Similar presentations:
Количественные измерения в химии. Количество вещества. Моль
1. 8 класс Количественные измерения в химии. Количество вещества. Моль
Покровская Наталия Васильевна,учитель химии ГОУ СОШ №939
г.Москва
5klass.net
2.
Ведьон
принесёт
тебе
ЗНАНИЯ!
3.
Тема урока:Количественные
измерения в химии.
Количество вещества.
Моль.
4.
Цель урока:Научиться
рассчитывать по
формулам массу
вещества, количество
вещества
5. Задачи урока:
• Образовательная: сформировать понятие околичестве вещества, единицах его
измерения, о взаимосвязи физико-химических
величин (массы, количества вещества и
числа молекул).
• Развивающая: развить умение решения задач
с использованием формул.
• Воспитательная: прививать нормы социальной
жизни, воспитывать умение работать в группе.
6.
Какие физические величиныможно использовать для
определения меры
веществ?
В каких единицах
измеряются эти физические
величины?
7.
Лкг
Л
М
8.
1 карат = 0,2 г1 баррель нефти
=158,988 л
9.
Порции10. Можно ли найти число частиц в порции вещества?
?11.
Мольот французского слова «moles»множество
1 Моль – это количество
вещества,
в котором содержится
23
6,02 ∙10 частиц
12.
Число всехпесчинок
в пустыне
Сахара
= 3 моль!!!
13.
14.
Число частицв одном моль вещества
называется
числом Авогадро (NА)
NА = 6,02
23
∙10 1/моль
15. Число Авогадро больше числа всех капель воды на Земле
Н2 О16. Количество вещества
Обозначение:ν (ню), или n
Единица измерения:
моль
17.
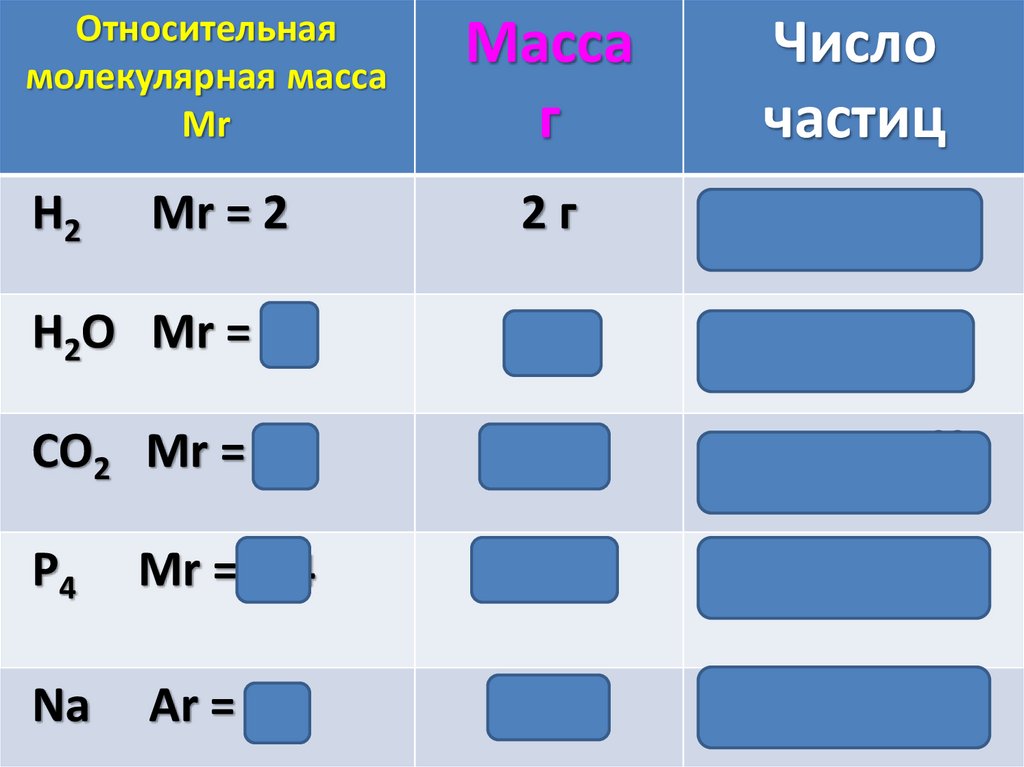
Относительнаямолекулярная масса
Mr
Масса
г
Число
частиц
2г
6,02 ∙1023
H2O Mr = 18
18 г
6,02 ∙1023
CO2 Mr = 44
44 г
6,02 ∙1023
P4
Mr =124
124 г
6,02 ∙1023
Na
Аr = 23
23 г
6,02 ∙1023
H2
Mr = 2
18.
1 моль вещества – 6,02∙1023частицСколько частиц содержат
3 моль вещества?
3∙
23
6,02∙10 =
23
18,06∙10
Сколько частиц содержат
0,5 моль вещества?
0,5 ∙
23
6,02∙10 =
23
3,01∙10
19.
В общем виде:N = ν ∙ NA
N – число частиц
ν – количество вещества
NA – число Авогадро
20.
Молярная масса (М) –это суммарная масса всех
частиц, входящих в 1 моль
вещества.
[ Mr = M ]
Mr(H2O)= 18
M(H2O)= 18 г/моль
21. Можно ли найти массу, зная количество вещества?
22.
ν = m/Mm=ν∙M
23.
Что тяжелее:1 моль атомов кислорода
или 1 моль атомов фосфора?
Почему?
M(O) = 16 г/моль
M(P) = 31 г/моль
24.
Задача.Найти массу 3 моль атомов серы
Дано
ν (S) = 3моль
M(S) = 32 г/моль
Найти m(S)
Решение
m=ν∙M
m = 3 ∙ 32 = 96 (г)
Ответ: m(S) = 96 г
25.
Равные массы, но разныеобъемы, потому что ....
m = V∙ ρ
26.
1 моль любого газа (н.у.)занимает объем 22,4 л
VM = 22,4л/моль
27.
ν = V/VmV = ν ∙ Vm
28.
m= ν ∙ MV=ν∙V
N = ν ∙ NA
m
Выучить!!!
29.
Сколько ложек сахарного пескавы кладете в чашку чая?
Рассчитайте:
1) какое количество сахарозы
вы выпиваете с чаем;
2) сколько молекул сахарозы (C12H22O11)
содержится в этом количестве, если
в 1 чайной ложке
примерно 5 г сахарозы.
30.
Цель достигнута?Спасибо за урок!
31.
Домашнее задание:по учебнику
§ 15 № 3, § 16


























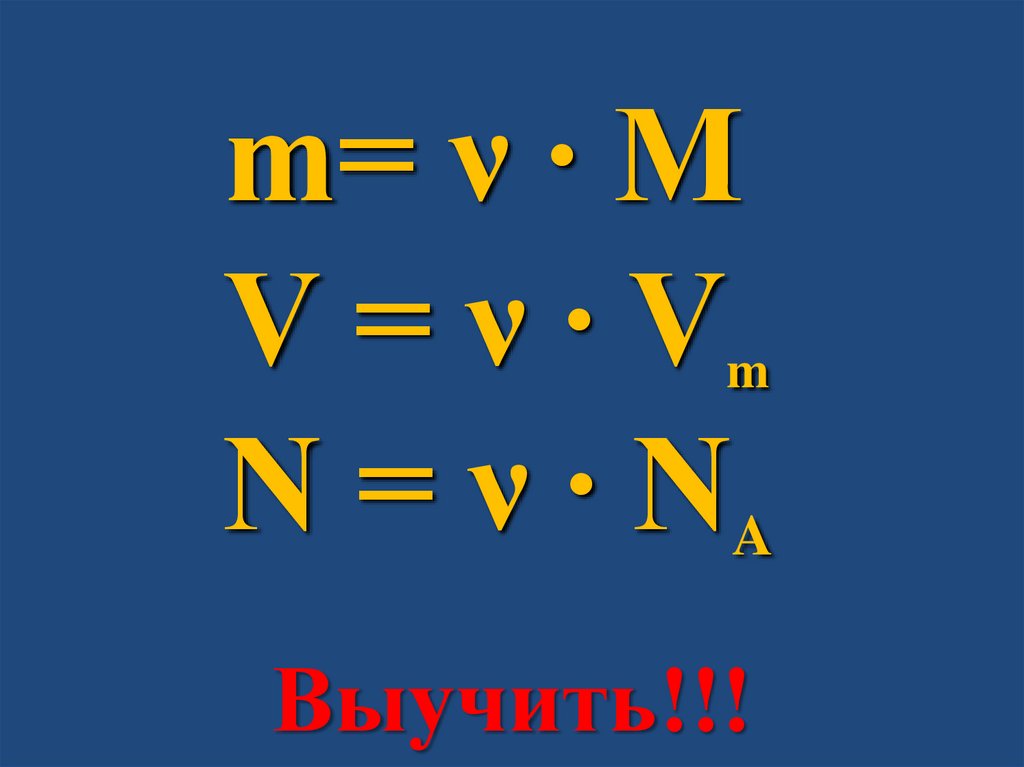



 chemistry
chemistry








