Similar presentations:
Основные понятия и законы химии
1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Занятие 12. Литература:
1. Коровин Н.В. Курс общей химии. 1990 г.2. Глинка Н.Л. Общая химия. 1983 г.
3. Ахметов Н.С. Общая и неорганическая
химия. 1988 г.
4. Глинка Н.Л. Задачи и упражнения по общей
химии 1983 г.
5. Смолова Л.М., Савельев Г.Г. Общая химия.
Учебное пособие. 2005 г.
6. Стась Н.Ф. Задачи, упражнения и вопросы по
общей химии. 2006 г.
3. Основные понятия
Химия часть естествознания, изучающаясвойства веществ и их превращения,
сопровождающиеся изменением состава и
структуры.
Химический элемент –это вид атомов с
одинаковым зарядом ядер, атом-это
наименьшая частица химического элемента,
сохраняющая все его химические свойства.
4.
Молекула - наименьшаячастица вещества, способная к
самостоятельному
существованию, обладающая
его основными химическими
свойствами и состоящая из
одинаковых или разных атомов.
5.
Моль (n) – количество веществасистемы, которое содержит столько
определенных структурных единиц
(молекул, атомов, ионов и т.д. ), сколько
атомов содержит в 0,012 кг углерода –12.
0,012 кг. углерода содержит - 6,02×1023
атомов углерода (NА постоянная
Авогадро).
6.
Массу одного моля вещества называютмолярной массой (М)
Отношение массы вещества (m) к его
количеству (n) представляет собой
молярную массу вещества:
m
M г / моль
n
7.
Относительной атомной массойэлемента (Аr) называют отношение
абсолютной массы атома к 1/12
части абсолютной массы атома
изотопа углерода 12С .
Аr показывает, во сколько раз
масса атома данного элемента
тяжелее 1/12 массы атома 12С .
8.
Относительной молекулярноймассой (Мr) вещества называется
масса его молекулы, выраженная в у.е.
Мr численно равна сумме атомных масс
всех атомов, входящих в состав
молекулы вещества. Она
подсчитывается по формуле вещества.
9. ПРИМЕР:
Относительная молекулярная массаводы будет слагаться из
атомных масс двух атомов водорода
атомной массы одного атома
кислорода
Тогда:
Mr(H2O )=2×1+16=18, выраженная в
углеродных единицах.
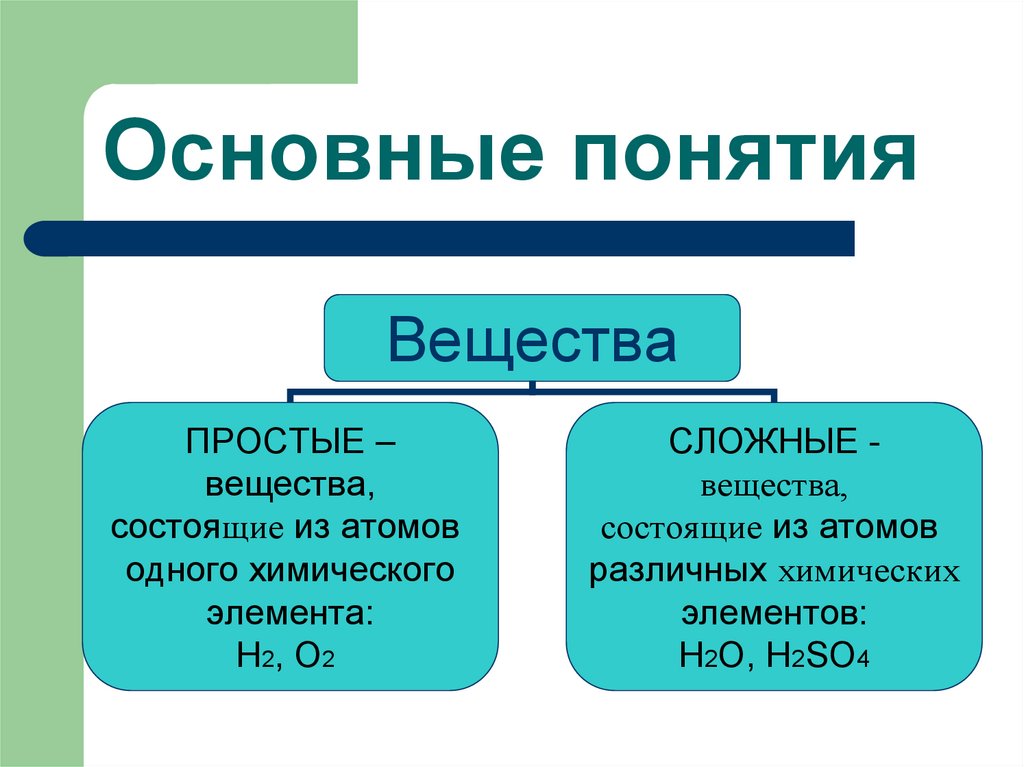
10. Основные понятия
ВеществаПРОСТЫЕ –
вещества,
состоящие из атомов
одного химического
элемента:
Н2, О2
СЛОЖНЫЕ вещества,
состоящие из атомов
различных химических
элементов:
H2O, H2SO4
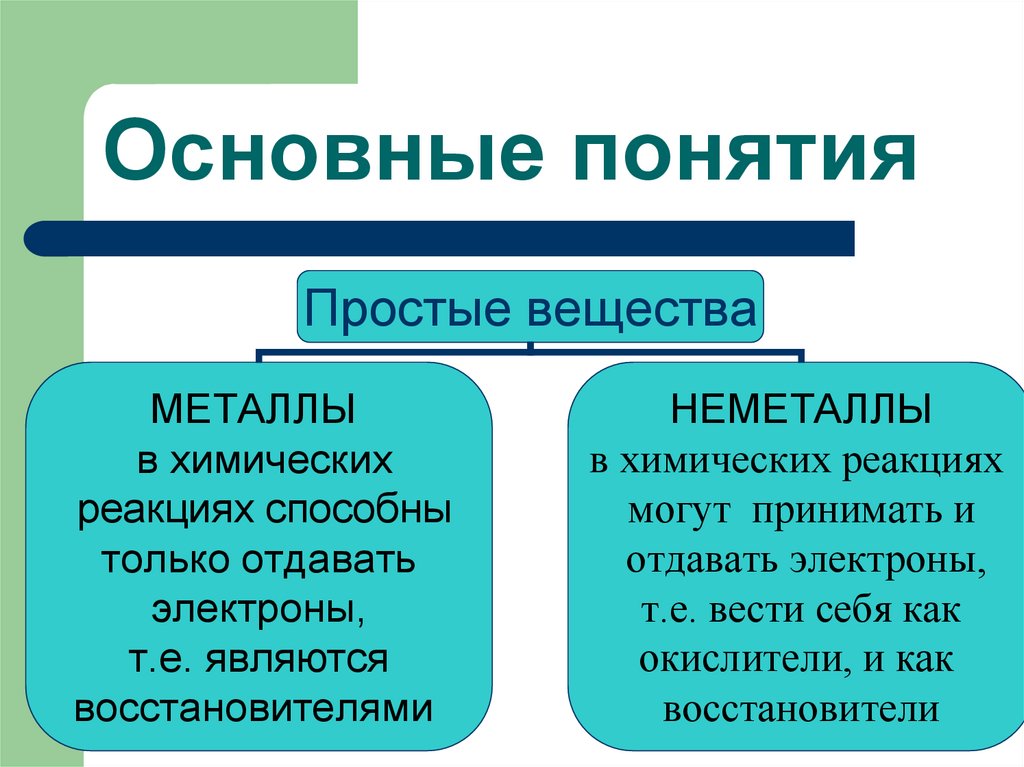
11. Основные понятия
Простые веществаМЕТАЛЛЫ
в химических
реакциях способны
только отдавать
электроны,
т.е. являются
восстановителями
НЕМЕТАЛЛЫ
в химических реакциях
могут принимать и
отдавать электроны,
т.е. вести себя как
окислители, и как
восстановители
12. ПРИМЕР:
в соединенияхатомы
металлов
имеют всегда
положительные
степени
окисления
2
Na S
2
Mg Cl2
13. ПРИМЕР:
Неметаллы вреакциях могут
принимать и
отдавать электроны
поэтому степени
окисления, могут
быть как
отрицательными, так
и положительными
H2S
2
4
H 2 S O3
6
H 2 S O4
14. Основные законы химии:
1. Закон сохранения массы(Ломоносов М.В. 1756-1759):
Масса веществ, вступающих
в реакцию, равна массе
веществ, образующихся в
результате реакции.
15. 2. Закон постоянства состава (Пруст 1801-1808):
Соотношения между массамиэлементов, входящих в состав
данного соединения,
постоянны и не зависят от
способа получения этого
соединения
16. ПРИМЕР:
CuSO4 5H 2OCuSO4 5H 2O
t
CH 4 O2 CO2 H 2O
NaOH HCl H 2O NaCl
17. Важно!
Данный закон - не абсолютен. Не всякоевещество имеет постоянный состав!
Например: FeS1,8…2 TiO1,8…2
Вещества меняющие свой состав
называются бертоллидами.
Вещества с постоянным составом
называются дальтонидами: Н2О; NaCI;
H2SO4
18. 3. Закон кратных отношений (Дальтон 1808 г)
Если два элемента образуют друг сдругом несколько химических
соединений, то массы одного из
элементов, приходящиеся в этих
соединениях на одну и ту же массу
другого, относятся между собой как
небольшие целые числа.
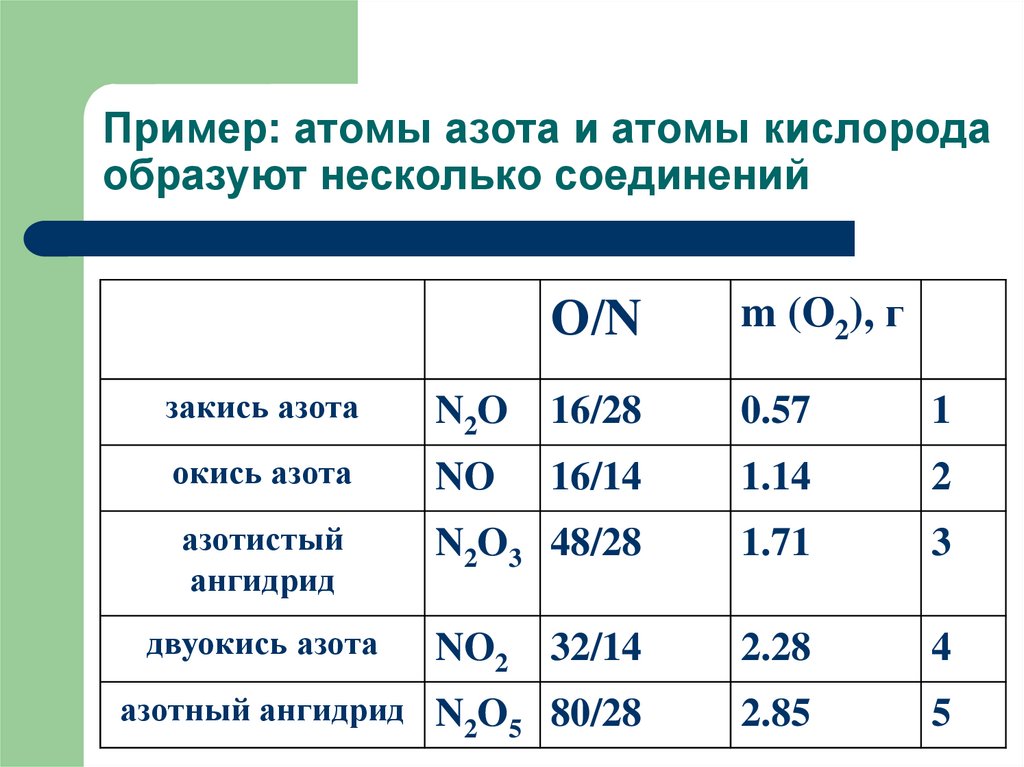
19. Пример: атомы азота и атомы кислорода образуют несколько соединений
О/Nm (O2), г
закись азота
N2O
16/28
0.57
1
окись азота
NO
16/14
1.14
2
азотистый
ангидрид
N2O3 48/28
1.71
3
NO2
32/14
2.28
4
азотный ангидрид N O 80/28
2 5
2.85
5
двуокись азота
20. 4. Эквивалент. Закон эквивалентов.
Эквивалент- реальная или условнаячастица вещества, которая в реакции
соединяется или замещается с
одним граммом водорода (атомом
или ионом) или восьмью граммами
кислорода
21.
- относительная масса такой частицыв а.е.м. называется эквивалентной
массой вещества
- масса одного моля таких частиц
выраженная в граммах, называется
молярной массой эквивалента
вещества и обозначается Мэ
22.
Расчет молярноймассы эквивалента
простого вещества
А А
Mэ
В Z
Встехиометрическая
валентность,
А-атомная масса
элемента,
Z-заряд или степень
окисления.
23. ПРИМЕР:
Определить эквивалентную массукислорода и водорода
O2
H2
16
M э (O)
2
1
M э (H )
1
24.
если условия нормальныеTo=273K и Р=101,3 кПа
или 0°С и Р=760 мм. рт. ст.
то в расчетных задачах используют
значения эквивалентных объемов
для кислорода Vэ=5,6 литра,
для водорода Vэ=11,2 литра.
25. Фактор эквивалентности
показывает какая частьмоля вступает во
взаимодействие с 1
молем водорода
26. ПРИМЕР:
HBrH2O
NH3
1 моль Н 2 моль Н
3 моль Н
1 моль
Br
f (Br)=1
1 моль О
1 моль N
f (O)=1/2
f (N)=1/3
27. Эквивалентные массы
Эквивалентная масса элемента = А×f(атомная масса × фактор
эквивалентности)
Эквивалентная масса вещества =М×f
(молярная масса × фактор
эквивалентности)
28. Эквивалентная масса кислоты:
Эквивалентная масса кислоты равнамолярной массе, деленной на число
атомов водорода (а в реакции число
замещенных атомов водорода)
М(кислоты)
M Э (кислоты) =
+
n×H
98
M Э (H 2SO 4 ) =
= 49 г/моль
2
29. Эквивалентная масса основания:
Эквивалентная масса основания равнамолярной массе основания, деленной
на число гидроксогрупп (а в реакции
число замещенных гидроксогрупп)
М(основания)
M Э (основания) =
n ×(OH )
90
M Э (Fe(OH)2 ) =
= 45 г/моль
2
30. Эквивалентная масса оксидов:
Эквивалентная масса оксида равнамолярной массе оксида деленной
на произведение числа атомов
элемента, образующих оксид, на
его степень окисления
М(оксида)
M Э (оксида) =
n×В
М(Cr2O 3 )
M Э (Cr2O 3 ) =
2× 3
31. Эквивалентная масса соли
Эквивалентная масса соли равнамолярной массе соли
деленной на произведение
числа атомов металла,
образующих соль, на его
степень окисления
32.
Эквивалентная массасложного бинарного
соединения равна сумме
эквивалентных масс
образующих его элементов
33. ПРИМЕР:
M Э (Al2O3 ) M Э (Al) M Э (O)27 16
M Э (Al2O3 ) 17 г / моль
3 2
или
M(Al2O3 ) 102
M Э (Al2O3 )
17 г / моль
2 3
6
34. Закон эквивалентов (Волластон, 1804 г.)
Массы реагирующих веществпрямопропорциональны их
эквивалентным массам
M Э1
m1
m2 M Э 2
35. ПРИМЕР:
0,304г магния вытеснили 0,0252 гводорода. Вычислите эквивалентную
массу магния.
Воспользуемся законом эквивалентов и
запишем: m(Mg)
M Э (Mg)
=
m(H 2 )
M Э (H 2 )
0.304
x
0.0252 1.008
x 12,16 г / моль
36. ГАЗОВЫЕ ЗАКОНЫ
Закон Авогадро (1811)В равных объемах различных
газов при одинаковых условиях
содержится равное число молекул
37.
Один моль газа при нормальных условиях(н.у.) занимает объем 22,4 л
Пример:
1 моль Н2 - 2 г/моль - 6,02×1023 молекул -22,4л
1 моль O2 - 32 г/моль - 6,02×1023 молекул -22,4 л
Нормальные условия:
To=273K и Р=101,3 кПа
или 0°С и Р=760 мм. рт. ст.
38.
Отношение массы данного газа к массетого же объема другого газа, взятого при
той же температуре и том же давлении,
называется относительной
плотностью первого газа по
второму:
m1 M 1
D
m2 M 2
39. ПРИМЕР:
масса 1 л СО2 равна 1,98 г, а масса 1лводорода при тех же условиях 0,09 г.
Плотность углекислого газа по водороду
составляет:
m(CO2 ) 1.98
DH 2 (CO2 )
22
m( H 2 ) 0.09
40.
Молярная масса газа равна егоплотности по отношению к другому газу
умноженной на молярную массу
второго газа:
M1 D M 2
41.
Часто молярную массу газовопределяют по водороду или по
воздуху:
M1 D M ( H 2 ) D 2
M1 D M (возд.) D 29
42. Пример
Плотность газа по воздуху равна1,52 определить молярную массу
газа.
Решение
M ( Н 2 ) D M (возд.) 1,52 29 45
43. Закон объемных отношений
Объемы вступающих в реакцию газовотносятся друг к другу и к объемам
образующихся газообразных продуктов
реакции как небольшие целые числа.
(Р=const, T=const.)
2H2 +
2
:
O2
1
=
:
2H2O(г)
2
44. Универсальная газовая постоянная
При нормальных условиях дляодного моля газа:
P0 V0
R const
T0
R –универсальная газовая
постоянная
45. Универсальная газовая постоянная
Численное значение газовой постояннойзависит от того, в каких единицах
выражается давление и объем:
мм. рт.ст. мл
R 62400
моль К
атм. л
R 0, 082
моль К
3
Дж
Па м
R 8,31
моль К моль К
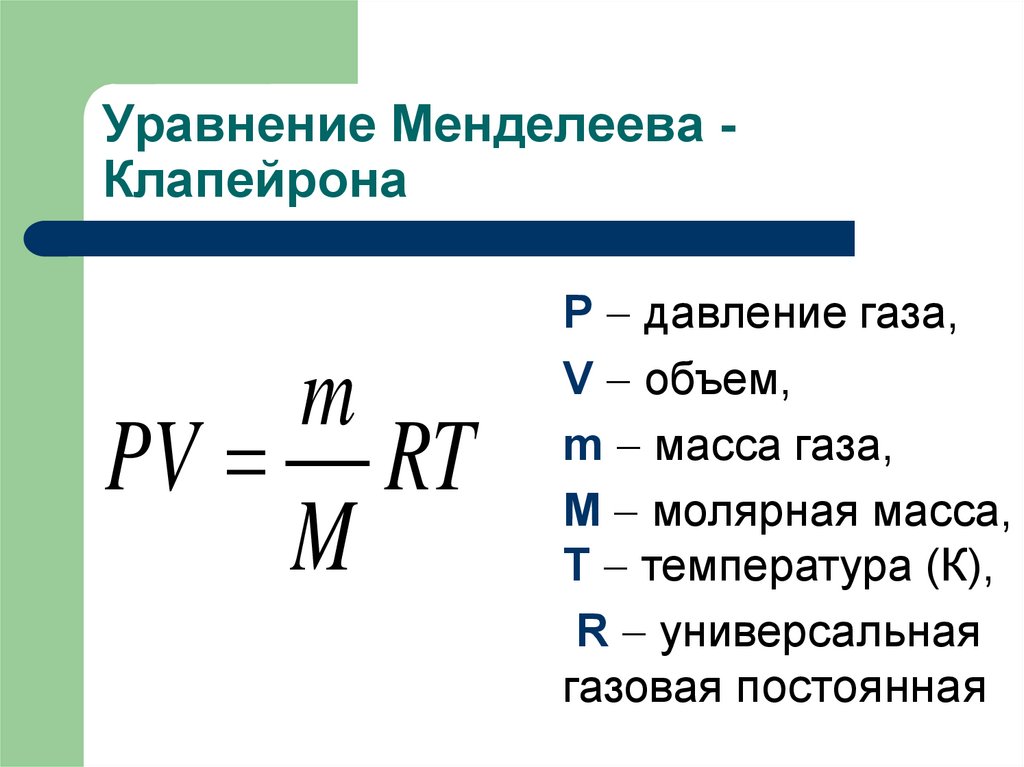
46. Уравнение Менделеева - Клапейрона
Уравнение Менделеева Клапейронаm
PV RT
M
Р давление газа,
V объем,
m масса газа,
М молярная масса,
Т температура (К),
R универсальная
газовая постоянная
47. ПРИМЕР:
Вычислить молярную массу газа если 500мл егопри температуре 37°С и давлении 750 мм.рт.ст.
весят 0,58 г.
m
PV
RT
Решение:
M
mRT
M
PV
0,58 62400 (273 37)
М
30 г / моль
750 500











































 chemistry
chemistry








