Similar presentations:
Основные стехиометрические законы химии. Лекция №2
1. Лекция №2
Основныестехиометрические
законы химии
2. рекомендуемая литература
• 1. Н.Л. Глинка. Общая химия.• 2. Н.С. Ахметов. Общая и неорганическая
химия.
• 3. Я.А. Угай. Общая и неорганическая химия.
• 4. Н.В. Коровин. Общая химия.
• 5. К. Хаускрофт, Э. Констебл. Современный
курс общей химии.
• 6. Д. Шрайвер, П. Эткинс. Неорганическая
химия.
• 7. Н. Гринвуд, А. Эрншо. Химия элементов
• 8. Неорганическая химия. Под ред.
Третьякова Ю.Д.
3.
Основы химии:1) атомно-молекулярное учение
2) стехиометрические законы
-
закон сохранения массы
закон сохранения энергии
закон эквивалентов
закон постоянства состава и свойств вещества
закон кратных отношений
3) газовые законы
-
закон Авогадро
законы Бойля - Мариотта и Гей-Люссака
уравнение Менделеева – Клапейрона
4) периодический закон Д.И. Менделеева
5) квантовая теория строения вещества
4. Основные стехиометрические законы химии
Стехиометрия – раздел химии, изучающийколичественные соотношения в химических
процессах. Основные законы стехиометрии
были открыты в XVIII – XIX веках и послужили
отправной точкой для создания современной
теории строения вещества.
5.
СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫАнтуан Лоран Лавуазье
Джеймс Прескотт Джоуль
Михаил Васильевич
Ломоносов
Юлиус Роберт Майер
Герман Людвиг
Фердинанд Гельмгольц
6.
СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫКлод-Луи
Бертолле
Джон Дальтон
Иеремия
Вениамин
Рихтер
Жозеф-Луи
Пруст
7. Закон сохранения массы
• Ломоносов (1756) – Лавуазье (1757)Масса веществ, вступивших в реакцию
равна массе веществ после реакции
8. Современная формулировка
1. Закон сохранения массы и энергии Ломоносова (1756) – Лавуазье (1757) – Эйнштейна (1905): в любой химической системе
общий запас ее энергии и масса во время химического процесса
остаются неизменными.
Закону соответствует несколько математических уравнений:
∑ mпр.р. = ∑ mисх. в-в;
Е = mc2;
∆Е = с2∆m,
где: ∑ mпр.р. и ∑ mисх. в-в - суммы масс продуктов реакции и
реагентов;
Е и ∆Е – общий запас энергии системы и ее изменение во время
химического процесса;
с – скорость света, соответствующая скорости излучения
энергии;
∆m – изменение массы химической системы, пропорциональное
количеству излучаемой энергии.
Закон точен, он не имеет исключений, а значит, является законом
природы.
9. 2. Закон постоянства состава . Ж.Пруста (1806г)
2.Закон постоянства состава .
Ж.Пруста (1806г)
Всякое чистое вещество независимо от способа его получения
всегда имеет постоянный качественный и количественный
состав.
Поскольку состав вещества зависит от номенклатуры входящих в
него атомов, то в честь автора атомистической теории Д. Дальтона
вещества постоянного состава стали называть дальтонидами или
стехиометрическими.
К дальтонидам относятся соединения с молекулярной структурой (Н2О,
СО2, NН3 и др.).
К. Бертолле в 1808г. установил, что в зависимости от способа
получения вещества его состав может изменяться в тех или иных
пределах. Позднее вещества переменного состава стали
именовать бертоллидами (Ti0,7О – TiО1,3). Такие соединения состоят
из атомов или ионов
10.
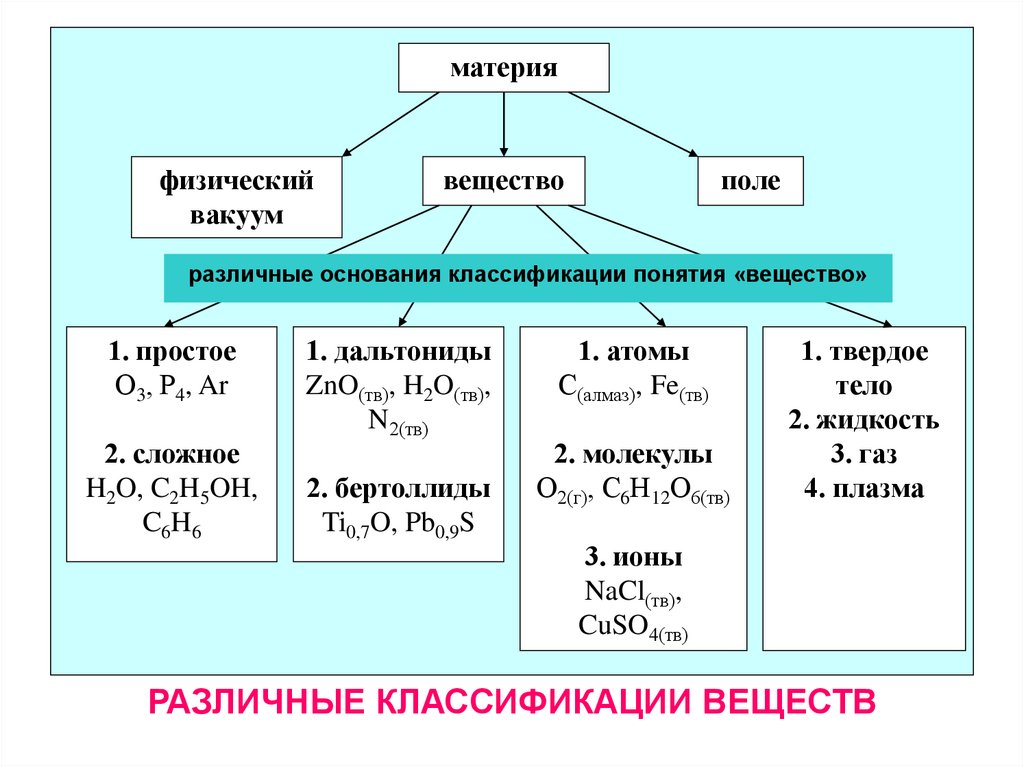
материяфизический
вакуум
вещество
поле
различные основания классификации понятия «вещество»
1. простое
О3, Р4, Ar
2. сложное
H2O, C2H5OH,
C6H6
1. дальтониды
ZnO(тв), H2O(тв),
N2(тв)
2. бертоллиды
Ti0,7O, Pb0,9S
1. атомы
С(алмаз), Fe(тв)
2. молекулы
О2(г), С6Н12О6(тв)
1. твердое
тело
2. жидкость
3. газ
4. плазма
3. ионы
NaCl(тв),
CuSO4(тв)
РАЗЛИЧНЫЕ КЛАССИФИКАЦИИ ВЕЩЕСТВ
11. Современная формулировка
• Химическое соединение,имеющеемолекулярное строение
независимо от способа
его получения
характеризуется
постоянным составом.
12. 3. Закон эквивалентов И. Рихтера (1792 - 1800):
3. Закон эквивалентовИ. Рихтера (1792 - 1800):
• Все вещества взаимодействуют между собой в
строго определенных количествах,
пропорциональных их эквивалентам.
Математическое выражение закона
эквивалентов выглядит следующим образом:
• m1 / m2 = Э1 / Э2 = nf1 / nf2 = М f1/ Мf2
,
где: m1 и m2 - физические массы, Э1 и
Э2 – эквиваленты, nf1 и nf2 – количества вещества
эквивалентов, Мf1 и Мf2 –молярные массы
эквивалентов взаимодействующих химических
объектов.
13. Примеры
Если же в процессе реакции
заместился лишь один ион водорода
• H2SO4 + NaOH = NaHSO4 + H2O , то
эквивалент серной кислоты будет равен ее
молекуле (ЭH2SO4 = H2SO4).
У хлорида титана величина
эквивалента может иметь четыре
различных
значения (ЭTiCl4 = TiCl4; Э
TiCl4 = ½TiCl4; ЭTiCl4 = ⅓TiCl4;
• ЭTiCl4 = ¼ TiCl4).
14. Эквивалент
• Таким образом, величина эквиваленталюбого химического вещества зависит
от условий химической реакции, в
которой это вещество участвует.
Понятие эквивалента химического
объекта без указания конкретного
химического процесса неприменимо.
15. Фактор эквивалентности
• Число, обозначающее долю реальнойчастицы, эквивалентную (равнозначную)
одному иону Н+ или одному электрону ē,
называют фактором эквивалентности (fэ).
• Следовательно,
• fэ (FeCl3) = 1; ½; ⅓.
fэ (НCl) = 1.
16. О-В реакции
• Для окислительно –• восстановительных реакций фактор
эквивалентности равен числу электронов, отданных
или принятых одной молекулой вещества в
окислительно-восстановительном процессе.
• Например, в реакции О2 + 4Н+ + 4ē = 2Н2О фактор
эквивалентности кислорода равно 4.
17. Количество вещества эквивалентов (nf)
Количество вещества эквивалентов (nf)или «моль эквивалентов» - количество вещества
химического объекта, содержащее 6,02·1023
эквивалентов этого вещества.
Например, из уравнений реакций
NaOH + Н3P04 = NaН2P04 + Н20
2NaOH + Н3P04 = Na2НP04 + 2Н20
3NaOH + Н3P04 = Na3P04 + 3Н20
следует, что nfэ (Н+) = 1моль соответствует
(эквивалентны) nf(NaOH)=1 моль; nf(Н3РО4)=⅓моль,
½моль, 1моль; nf (H2O)=1 моль.
18. Молярная масса эквивалента (Мf) -
Молярная массаэквивалента (Мf) • Молярная масса эквивалента (Мf) -
физическая масса одного моля эквивалента
вещества любого химического объекта.
Мf (сложн. в-ва) = M/∑z катионов
• Для О-В процессов:
• Мf (сложн. в-ва) = M/число электронов
• Современная формулировка: В
молекулярных соединениях
массы,составляющих их элементов относятся
между собой как эквиваленты
19. Закон кратных отношений Дж. Дальтона (1803г):
Закон кратных отношенийДж. Дальтона (1803г):
• если атомы двух химических элементов образуют между
собой несколько различных соединений, то на одну и ту же
массу атомов одного из них приходятся такие массы
атомов другого элемента, которые относятся между собой
как простые целые числа.
• Например, в оксидах азота NO, N2O3, NO2, N2O5, NO3
соотношения масс N:O равны 14:16; 14:24; 14:32; 14:40; 14:48.
Следовательно массовое отношение кислорода в этих оксидах,
связанное с постоянной массой азота в них равно
16:24:32:40:48 или (:8) 2:3:4:5:6.
• Именно на базе этого закона было введено понятие
относительной атомной массы и атомной единицы массы. Сам
Дальтон принял 1а.е.м. равной mа(Н), затем позже 1а.е.м. =
mа(О16)/16, теперь 1а.е.м. = mа(С12)/12.
20. Современная формулировка
• если атомы двух химических элементовобразуют между собой несколько
молекулярных соединений, то на
одну и ту же массу атомов одного из
них приходятся такие массы атомов
другого элемента, которые
относятся между собой как небольшие
целые числа.
21.
ГАЗОВЫЕ ЗАКОНЫЯн Баптист ван
Гельмонт
Роберт Бойль
Эдм Мариотт
Жозеф-Луи
Гей-Люссак
22.
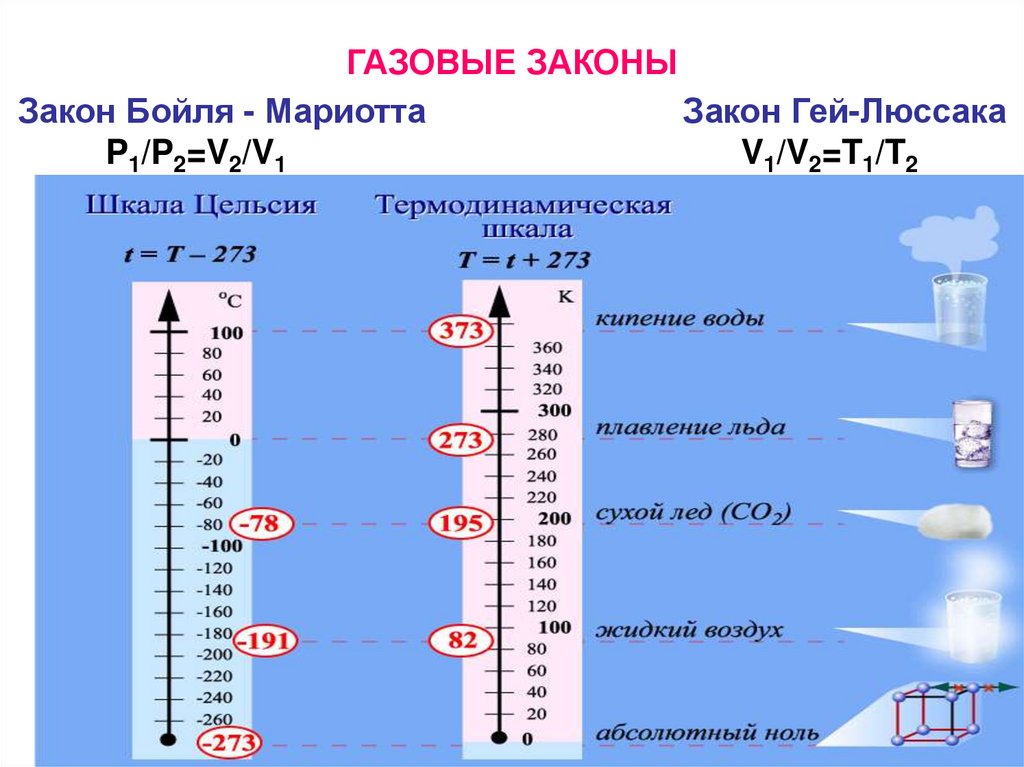
ГАЗОВЫЕ ЗАКОНЫЗакон Бойля - Мариотта
Закон Гей-Люссака
P1/P2=V2/V1
V1/V2=T1/T2
23.
ГАЗОВЫЕ ЗАКОНЫЗакон Бойля - Мариотта
Закон Гей-Люссака
P1/P2=V2/V1
V1/V2=T1/T2
P1V1/T1=P2V2/T2
Закон Авогадро
Молекулярную массу газа можно вычислить
несколькими способами.
1. При н.у. М=D·22,4, где D – плотность газа в г/л.
2. М=2·DH2 M=29·Dвозд, где DH2, Dвозд – относительная
плотность газа по водороду или воздуху. В расчете
молярной массы воздуха используется формула
Мср=М1φ1+М2φ2+…+Mnφn, где φ – объемная или
мольная доля компонента газовой смеси.
Уравнение Менделеева – Клапейрона
уравнение состояния идеального газа)
PV=nRT
Закон Дальтона
р=рa+pb+…
px=(nx/nΣ)·pΣ
24.
25. Закон простых объемных отношений Ж. Л. Гей-Люссака (1808):
Законпростых объемных отношений
Ж. Л. Гей-Люссака (1808):
• объемы вступающих в реакцию
газообразных веществ при
постоянных условиях относятся
между собой и к продуктам реакции
как небольшие целые числа.
• 2СО +О2=2СО2
• 2V
1V 2V
26. закон Авогадро (1811г):
• в равных объемах различных газовпри одинаковых условиях
содержится одинаковое число
молекул.
• Из закона вытекают два следствия:
• Следствие 1: Одинаковое число
молекул разных газов при одинаковых
условиях занимают одинаковый объем.
27. следствие1
• Для 6,02·1023 молекул этот объемоказался равным 22,4л при Т=273К и
Р=1,01·105 Па. Он был назван
молярным объемом любого газа при
нормальных условиях: Vm= 22,4
л/моль, или Vm= V/n (л/моль).
28. Следствие 2
• массы одинаковых объемов различных газов приодинаковых условиях есть величина постоянная и
называется относительной плотностью одного
газа по другому газу:
• D2=(m1/m2)р,т =M1/M2.
• D2 – относительная плотность газа 1 к газу 2 или
величина, показывающая во сколько раз один газ
легче или тяжелее другого газа, если они находятся
при одинаковых условиях.
29. Атомно-молекулярное учение
Вещество - это форма материи, обладающая массой покояи определенными физическими и химическими
свойствами. Химия изучает большей частью вещества,
организованные в атомы, молекулы, ионы и радикалы.
Молекула – частица, состоящая из двух или более атомов,
которая может самостоятельно существовать, это
наименьшая частица вещества, обладающая всеми его
химическими свойствами
Атом - наименьшая частица химического элемента,
обладающая всеми его свойствами. Атом - предел
химического разложения любого вещества.
Простое вещество (если оно не является одноатомным, как,
например, гелий, водород, сера) - разлагается на атомы
одного вида.
Сложное вещество - на атомы разных видов.
Химический элемент - это вид атомов с определенным
положительным зарядом ядра.
30. Стехиометрические законы
Закон сохранения массы - масса всех веществ,вступивших в химическую реакцию, равна массе всех
продуктов реакции. (Ломоносов М.В. 1748 г.)
2. Закон постоянства состава - любое определенное
химически чистое соединение независимо от способа его
получения состоит из одних и тех же химических
элементов, причем отношение их масс постоянны, а
относительные числа их атомов выражаются целыми
числами (Пруст Ж.Л., 1808г)
3. Закон кратных отношений – Если 2 элемента образуют
друг с другом несколько химических соединений, то
массы одного из элементов, приходящиеся в этих
соединениях на одну и ту же массу другого, относятся
между собой, как небольшие целые числа. (1803
2,66/1,33=2
Дж.Дальтон)
CO – угарный газ O:C=16/12=1,33
1.
31.
4. Закон простых объемных отношений - при равныхусловиях объемы вступающих в реакцию газов относятся
друг к другу и к объемам образующихся газообразных
продуктов как небольшие целые числа (Гей-Люссак, 1808г).
2H 2 O 2 2H 2 O
2V 1V 2V
5. Закон Авогадро - В равных объемах любых газов, взятых
при одинаковых условиях, содержится одинаковое число
молекул. (1811г)
Из закона Авогадро вытекают два следствия:
• Одинаковое число молекул любых газов при одинаковых
условиях занимают одинаковый объем.
• Относительная плотность одного газа по другому равна
отношению их молярных масс.
32.
Число Авогадро – число частиц в моле любого вещества;NA=6,02∙1023 моль–1.
Моль - единица измерения количества вещества в СИ.
Соответствует количеству вещества, содержащему столько
структурных единиц (атомов, молекул, ионов, электронов
или любых других частиц), сколько содержится атомов в
0,012 кг изотопа 12C
Молярный объем – объем моля любого газа при
нормальных условиях; равен 22,4 л∙моль–1.
Молярная масса (M) – масса одного моля вещества,
численно совпадающая с относительными массами атомов,
ионов, молекул, радикалов и других частиц, выраженных в
г∙моль–1.
6. Закон эквивалентов - в молекулярных соединениях
массы составляющих их элементов относятся между собой
как их эквиваленты. (Вещества взаимодействуют друг с
33.
Химический эквивалент – реальная или условнаячастица вещества, способная соединиться и заместить
1 моль атомов водорода в реакциях присоединения и
замещения или принять (отдать) 1 моль электронов в
окислительно-восстановительных реакциях.
Эквивалент вещества
Эквивалент элемента
Ээл
М эл
валентность
Экисл
HCl
ЭCl 34,45г / моль
ЭCl 1моль
М кисл
основность
Эосн
М осн
кислотность
H 2S
Эs 16г / моль
ЭS 1 / 2 моль
34. Атомные и молекулярные массы. Моль
Абсолютная масса – масса, выраженная в абсолютныхединицах массы (грамм, килограмм …)
Относительная масса – масса выраженная в атомных
единицах массы, а.е.м.
Атомная масса – масса атома.
Молекулярная масса – масса молекулы.
Для единицы измерения относительной
атомной/молекулярной массы используют 1/12 массы
изотопа углерода 12С.
































 chemistry
chemistry








