Similar presentations:
Осноы термодинамики
1. Основы термодинамики
_________Термодинамика – теория тепловых
процессов, в которой не учитывается
молекулярное строение тел.
2.
Внутренняя энергия• Определение:
Внутренняя энергия тела – это сумма
кинетической энергии хаотического
теплового движения частиц (атомов и молекул) тела и потенциальной энергии их
взаимодействия
• Обозначение:
• Единицы измерения:
U
[Дж]
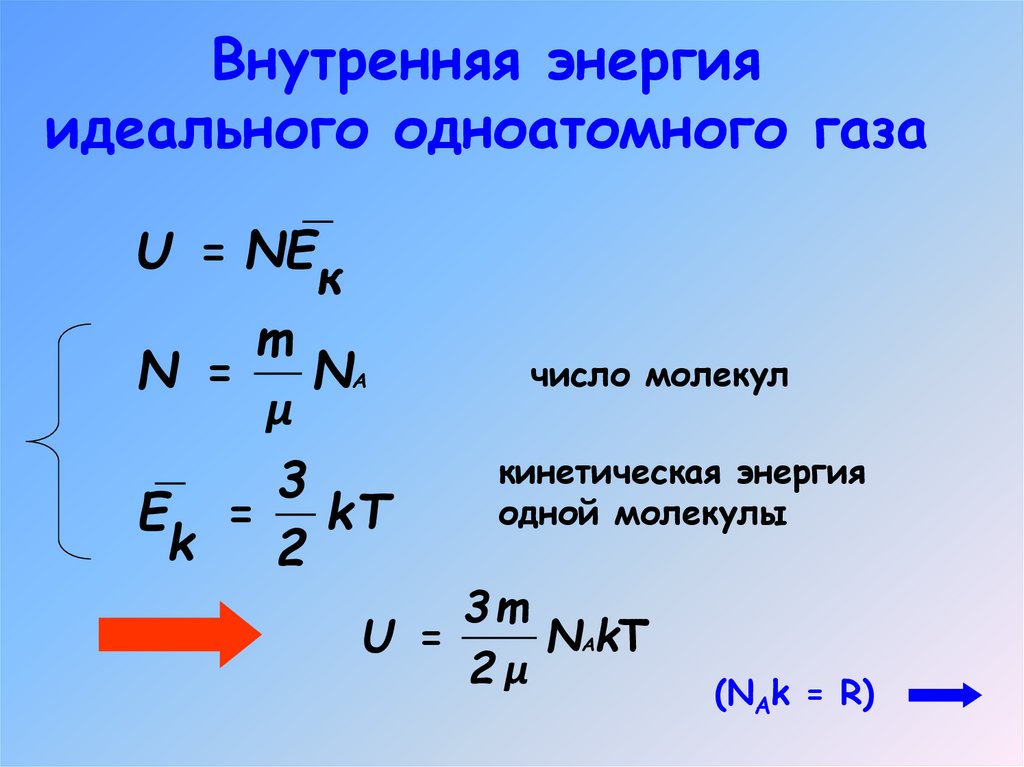
3. Внутренняя энергия
идеального одноатомного газаU = NE
к
m
N =
NА
μ
3
E = kT
k
2
число молекул
кинетическая энергия
одной молекулы
3m
U =
NАkT
2μ
(NAk = R)
4. Внутренняя энергия идеального одноатомного газа
3 mU =
RT
2 μ
Внутренняя энергия идеального одноатомного газа зависит лишь
от одного термодинамического параметра - температуры
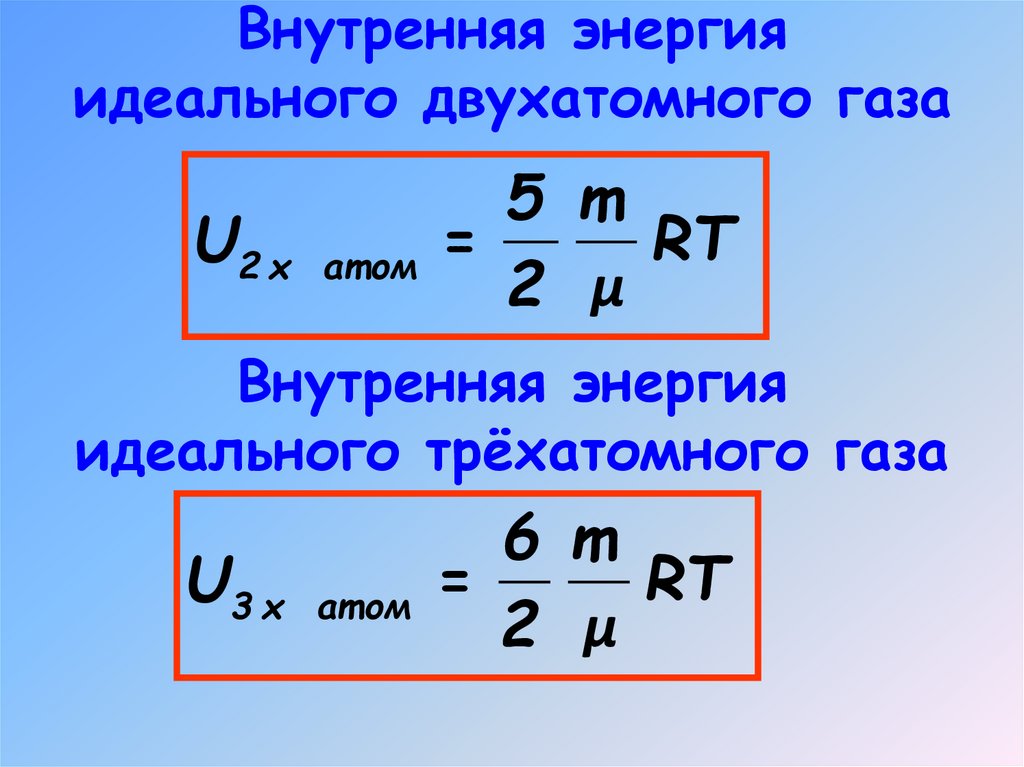
5. Внутренняя энергия идеального одноатомного газа
Внутренняя энергияидеального двухатомного газа
5 m
U2 х ат ом =
RT
2 μ
Внутренняя энергия
идеального трёхатомного газа
6 m
U3 х ат ом =
RT
2 μ
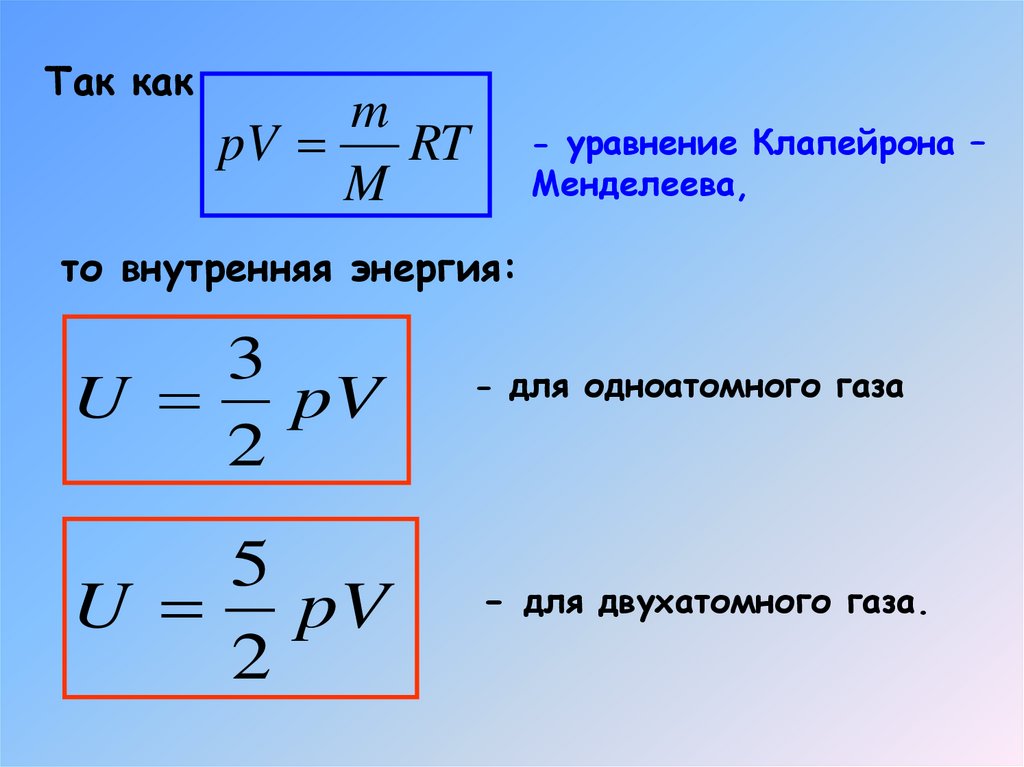
6. Внутренняя энергия идеального двухатомного газа
Так какm
pV
RT
M
- уравнение Клапейрона –
Менделеева,
то внутренняя энергия:
3
U pV
2
5
U pV
2
- для одноатомного газа
- для двухатомного газа.
7.
В общем виде:i m
i
U
RT pV
2M
2
где i – число степеней свободы молекул
газа (i = 3 для одноатомного газа и i = 5
для двухатомного газа), i = 6 для
трёхатомного газа),
8. В общем виде:
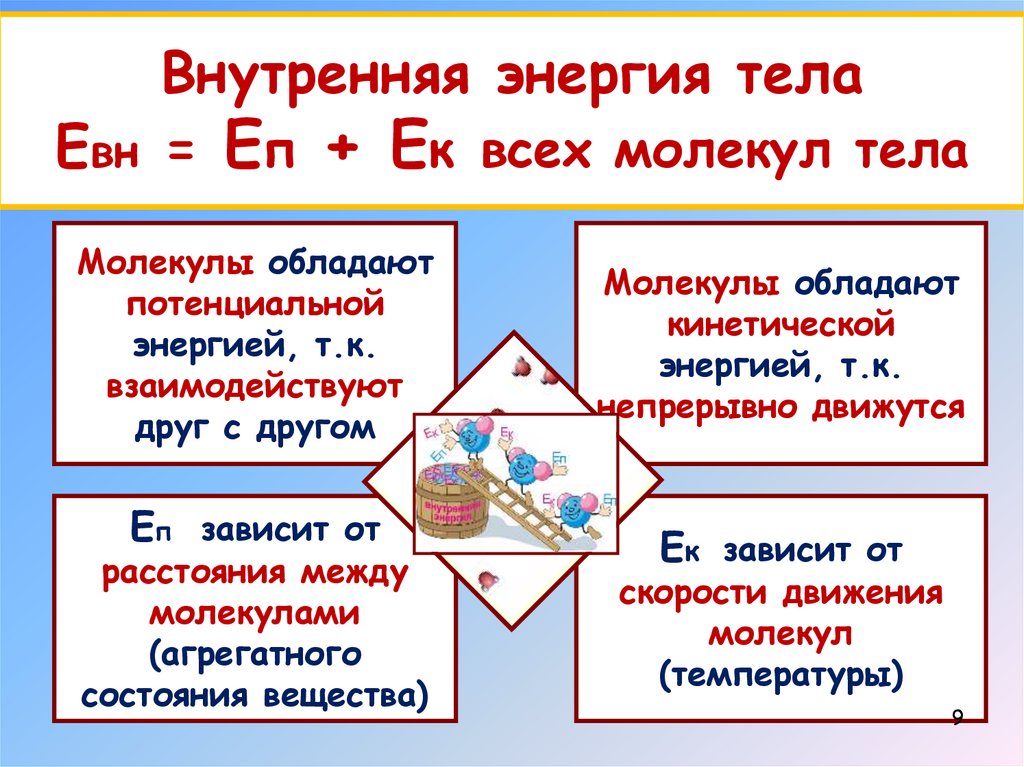
Внутренняя энергия телаЕвн = Еп + Ек всех молекул тела
Молекулы обладают
потенциальной
энергией, т.к.
взаимодействуют
друг с другом
Еп зависит от
расстояния между
молекулами
(агрегатного
состояния вещества)
Молекулы обладают
кинетической
энергией, т.к.
непрерывно движутся
Ек зависит от
скорости движения
молекул
(температуры)
9
9.
Процесс изменения внутренней энергии без совершенияработы над телом или самим
телом называется теплопередачей
10
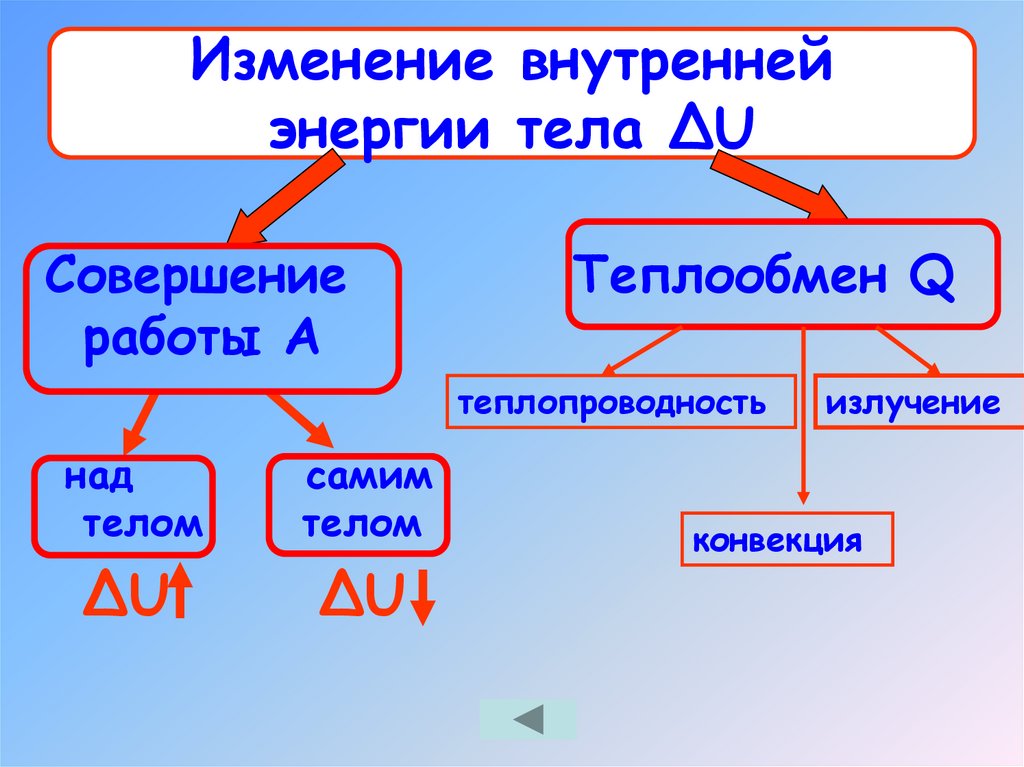
10.
Изменение внутреннейэнергии тела ΔU
Совершение
работы А
Теплообмен Q
теплопроводность
над
телом
самим
телом
ΔU
ΔU
излучение
конвекция
11. Изменение внутренней энергии тела ΔU
Работа газа при изобарном процессеГаз до расширения и после
Работа газа при
изобарном процессе
Это работа, которую выполняла сила,
с которой газ действовал на поршень
По третьему закону Ньютона, эта сила
по модулю равна силе, с которой
поршень действовал на газ, и
противоположна ей по направлению.
Обозначим силу, действовавшую на
газ:
12.
Работа в термодинамике• Работа газа:
A p(V2 V1 ) p V
• Работа внешних сил:
A A
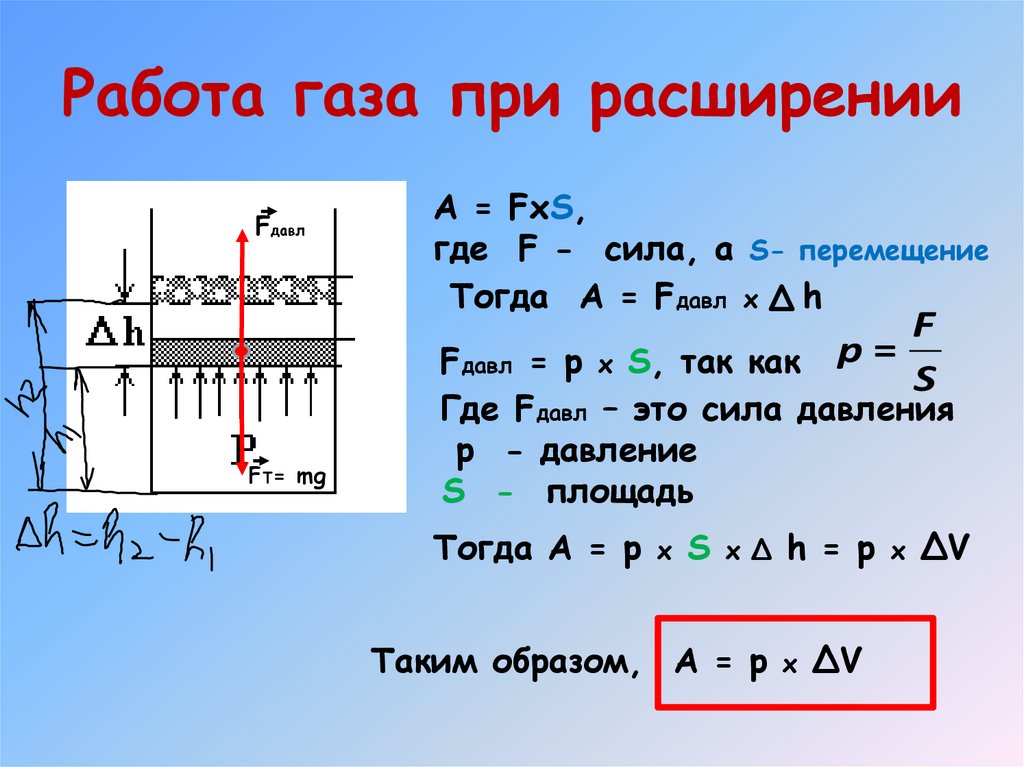
13. Работа в термодинамике
Работа газа при расширенииFдавл
A = FxS,
где F - сила, а S- перемещение
Тогда A = Fдавл x h
F
Fдавл = p x S, так как p =
S
FT= mg
Где Fдавл – это сила давления
p - давление
S - площадь
Тогда A = p x S x Δ h = p x ΔV
Таким образом, A = p x ΔV
14. Работа газа при расширении
Работа газа при изопроцессах• При изохорном процессе (V=const):
ΔV = 0 работа газом не
совершается:
P
A = p x ΔV , ΔV = 0
A 0
V
Изохорное нагревание
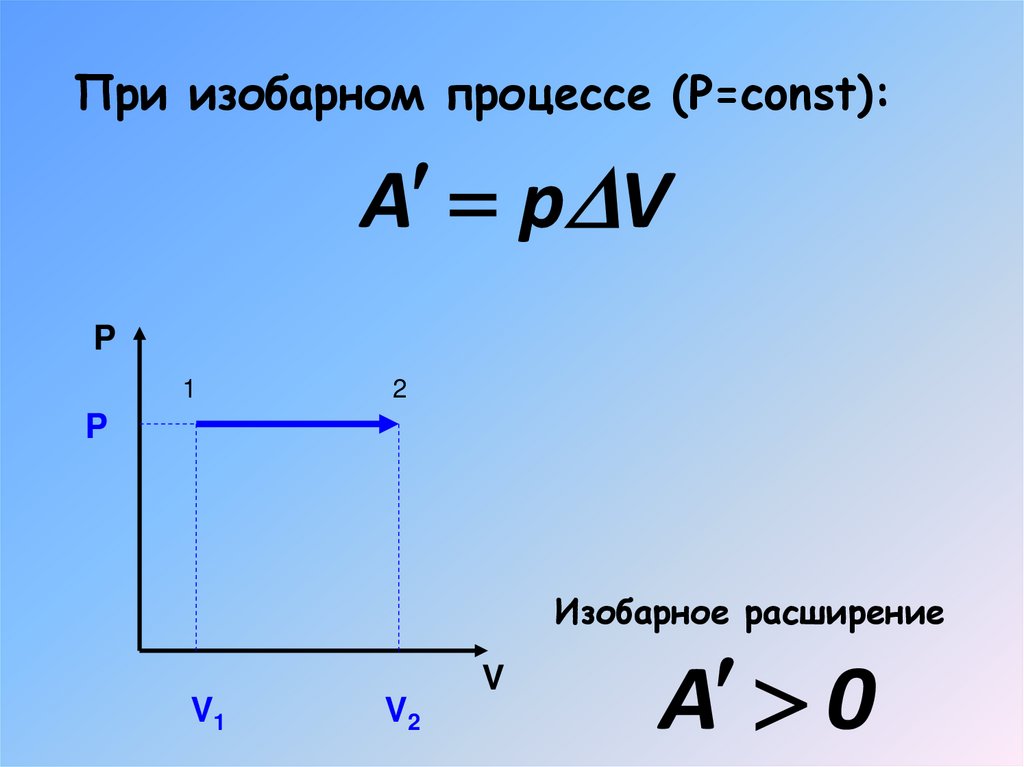
15. Работа газа при изопроцессах
При изобарном процессе (Р=const):A p V
P
1
2
P
Изобарное расширение
V
V1
V2
A 0
16. При изобарном процессе (Р=const):
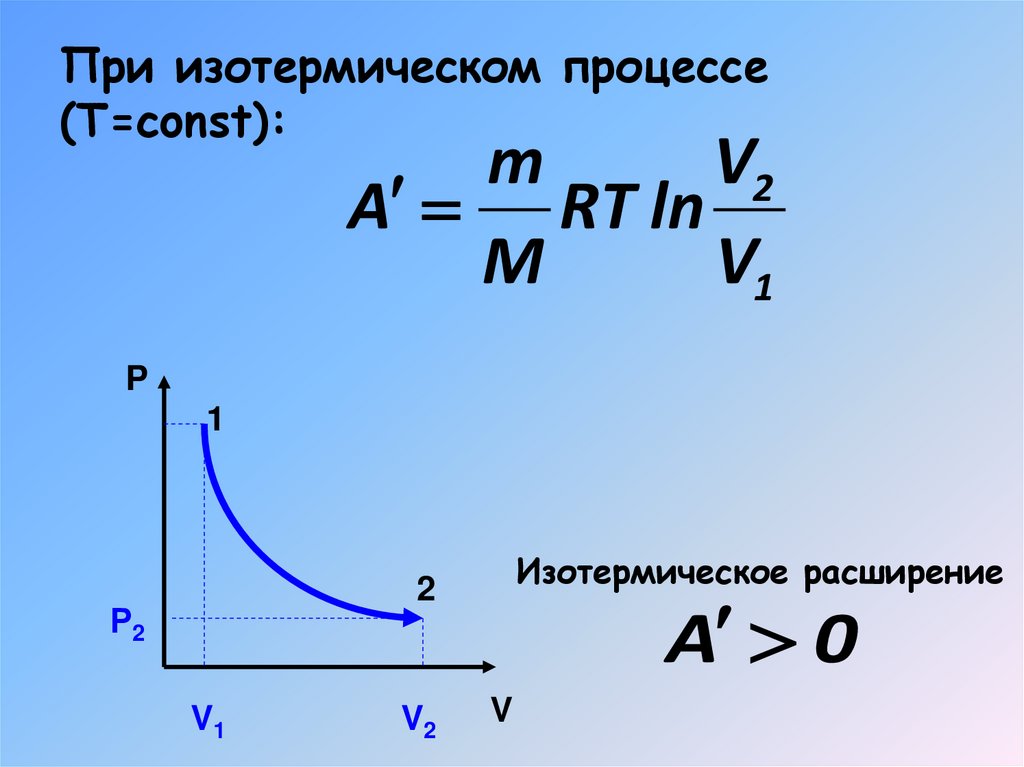
При изотермическом процессе(Т=const):
m
V2
A RT ln
M
V1
P
1
Изотермическое расширение
2
Р2
V1
V2
A 0
V
17. При изотермическом процессе (Т=const):
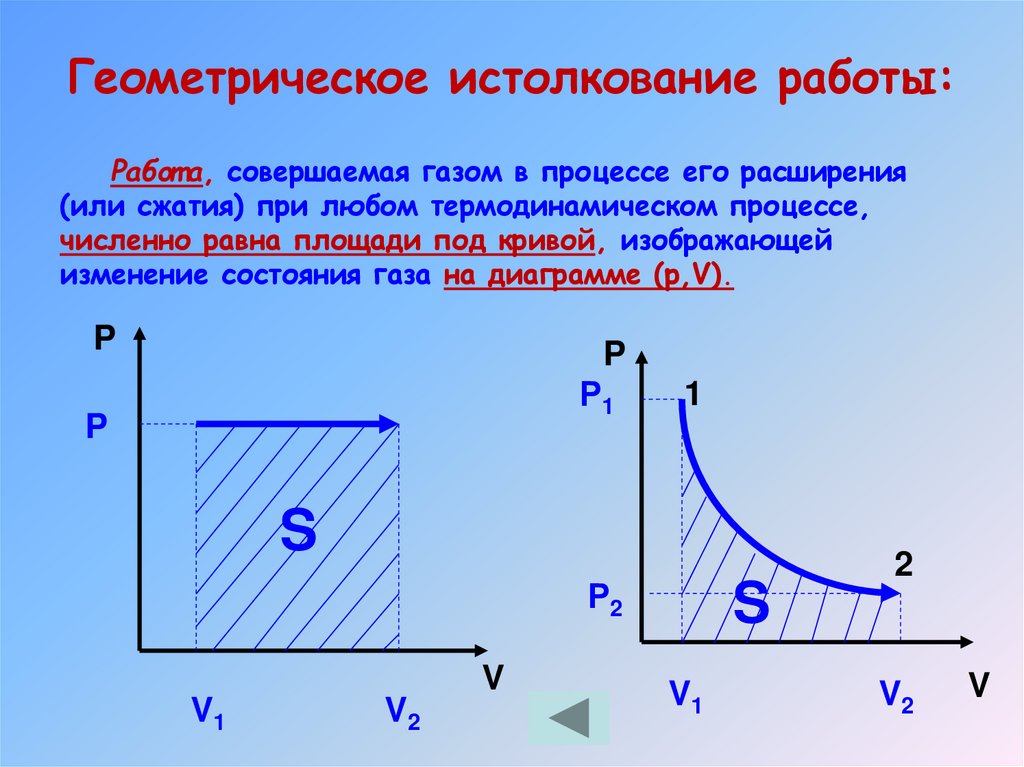
Геометрическое истолкование работы:Работ а, совершаемая газом в процессе его расширения
(или сжатия) при любом термодинамическом процессе,
численно равна площади под кривой, изображающей
изменение состояния газа на диаграмме (р,V).
P
P
Р1
P
1
S
Р2
V
V1
V2
S
V1
2
V2
V
18. Геометрическое истолкование работы:
Количество теплоты – часть внутреннейэнергии, которую тело получает или теряет при
теплопередаче
формула
Процесс
Нагревание или
охлаждение
Кипение или
конденсация
Q cm T
С – удельная теплоёмкость
вещества [ Дж/кг 0К], m –
масса [кг], ΔT – изменение
температуры [ 0K].
– удельная теплота
Q rm rпарообразования
[ Дж/кг ]
Плавление или
кристаллизация
Q m λ- удельная теплота
Сгорание
топлива
– удельная теплота сгорания
Q qm qтоплива
[ Дж/кг ]
плавления вещества [ Дж/кг ]
19. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
Анализ результатов опытов и наблюдений природныхявлений, выполненных к середине XIX века, привел
немецкого ученого Р. Майера, английского ученого
Д-Джоуля и немецкого ученого Г. Гельмгольца
к выводу о существовании закона сохранения энергии:
20.
Закон сохранения энергии: При любых взаимодействиях тел энергия не исчезает бесследно и не возникаетиз ничего. Энергия только передается от одного тела к
другому или превращается из одной формы в другую.
21.
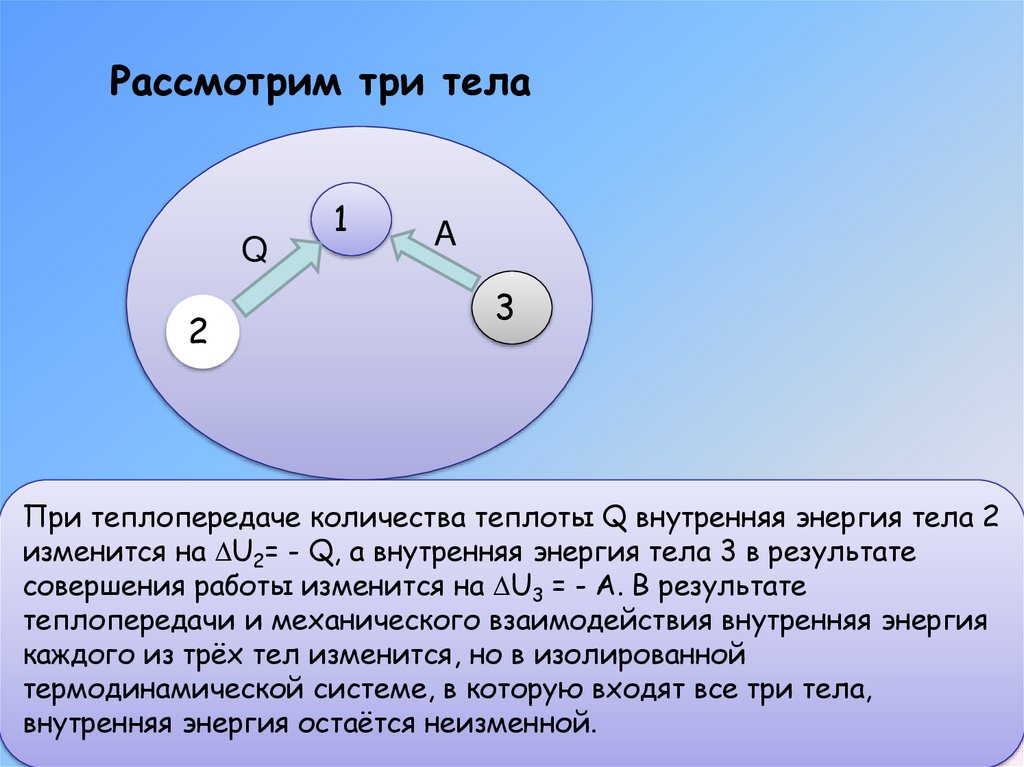
Рассмотрим три телаQ
2
1
A
3
При теплопередаче количества теплоты Q внутренняя энергия тела 2
изменится на U2= - Q, а внутренняя энергия тела 3 в результате
совершения работы изменится на U3 = - A. В результате
теплопередачи и механического взаимодействия внутренняя энергия
каждого из трёх тел изменится, но в изолированной
термодинамической системе, в которую входят все три тела,
внутренняя энергия остаётся неизменной.
22.
23.
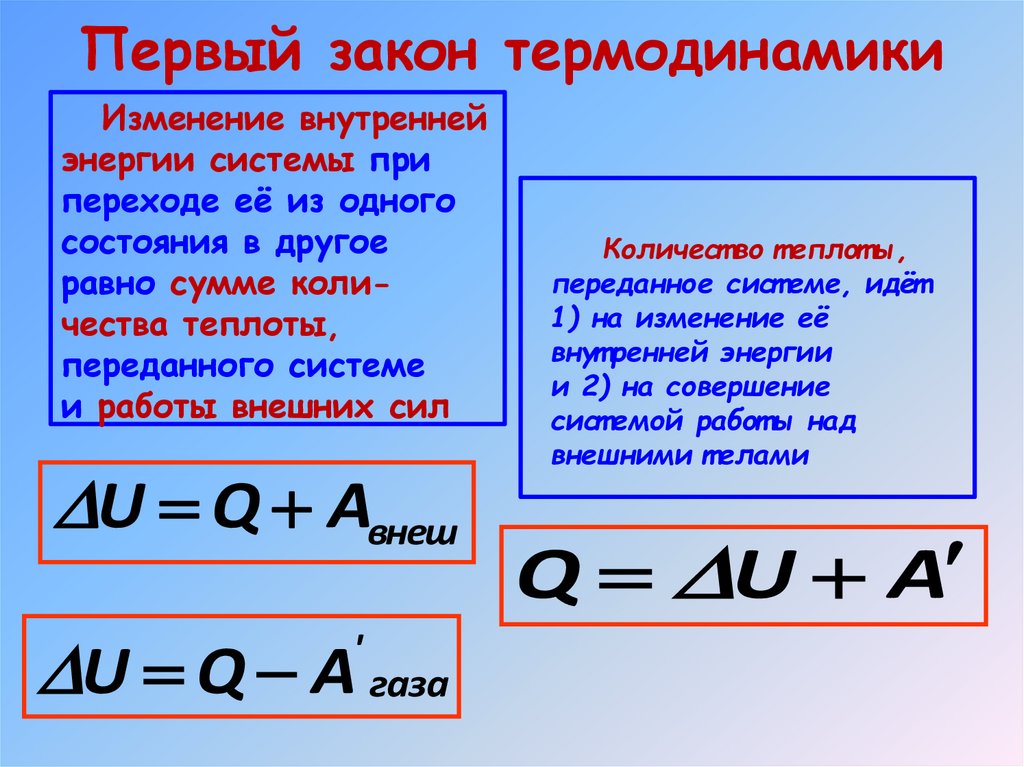
Первый закон термодинамикиИзменение внутренней
энергии системы при
переходе её из одного
состояния в другое
равно сумме количества теплоты,
переданного системе
и работы внешних сил
U Q Aвнеш
U Q A газа
'
Количест во т еплот ы,
переданное сист еме, идёт
1) на изменение её
внут ренней энергии
и 2) на совершение
сист емой работ ы над
внешними т елами
Q U A
24. Первый закон термодинамики
Применение первого законатермодинамики к различным
процессам
Процесс
Изохорный
Постоянный Первый закон
параметр
термодинамики
V = const
ΔU=Q; А=0
Изотермический Т = const
Q=A‘; ΔU=0
Изобарный
Р = const
Q=ΔU+A'
Адиабатный
Q = const
ΔU=-A'
25. Применение первого закона термодинамики к различным процессам
26.
27.
28.
•молярная масса воздуха M=0,029M=0,029 кг/моль;•универсальная газовая постоянная R=8,31R=8,31 Дж/(моль·К);
29.
30.
31.
Одним из главных следствийпервого закона
термодинамики является
невозможность построения
вечного двигателя.




















 physics
physics








