Similar presentations:
Основы термодинамики
1.
БПОУ ВО «Борисоглебскмедколледж»Тема занятия:
«Основы
термодинамики»
Преподаватель физики
Оболенская Н.С.
2.
3.
Внутренняя энергия (U)U Eп Ек
Еп –
суммарная потенциальная энергия взаимодействия
молекул
Ек –
суммарная кинетическая энергия движения молекул
Для идеального газа: Еп = 0, U=Eк
4.
Ек Е N3
Е kT
2
N N А
3
U Ек Е N kT N А
2
k NА R
3
3
3 m
U RT
RT pV
2
2
2M
-внутренняя
энергия
идеального
одноатомного
газа
5. В общем виде:
i mi
U
RT pV
2M
2
где i – число степеней свободы молекул газа
(i = 3 для одноатомного газа и i = 5 для
двухатомного газа)
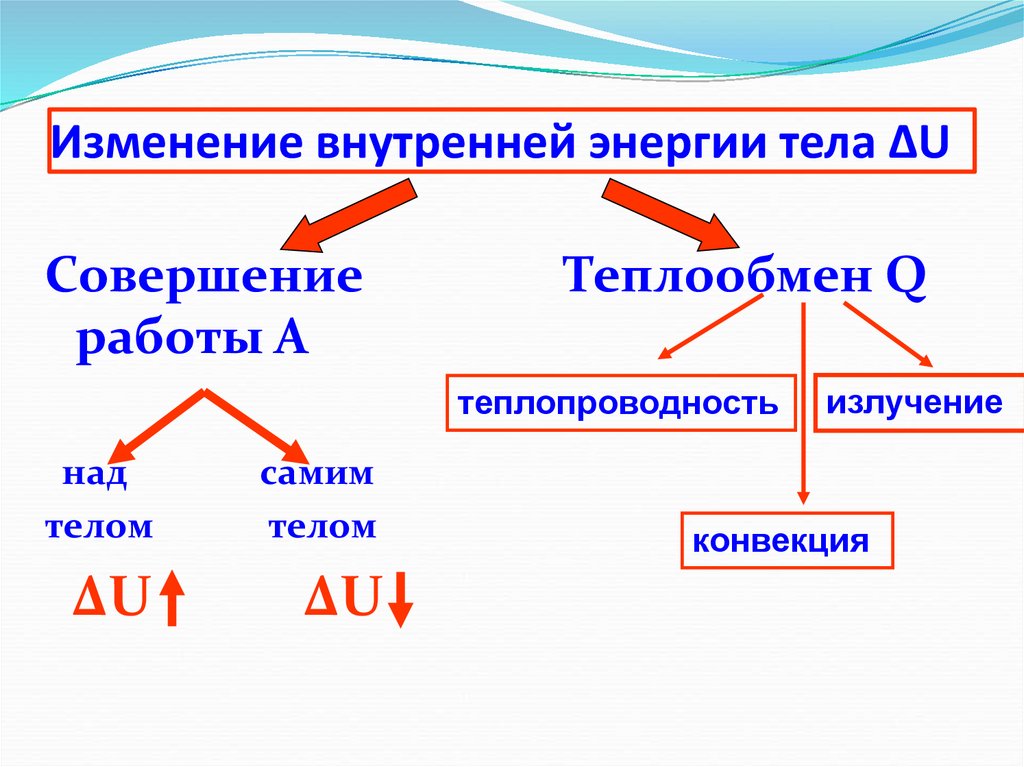
6. Изменение внутренней энергии тела ΔU
Совершениеработы А
Теплообмен Q
теплопроводность
над
телом
самим
телом
ΔU
ΔU
излучение
конвекция
7. Работа в термодинамике
Работа газа:A p(V2 V1) p V
Работа внешних сил:
A A
8. Работа газа в изопроцессах
При изохорном процессе (V=const):ΔV = 0 работа газом не совершается:
A 0
P
Изохорное
нагревание
V
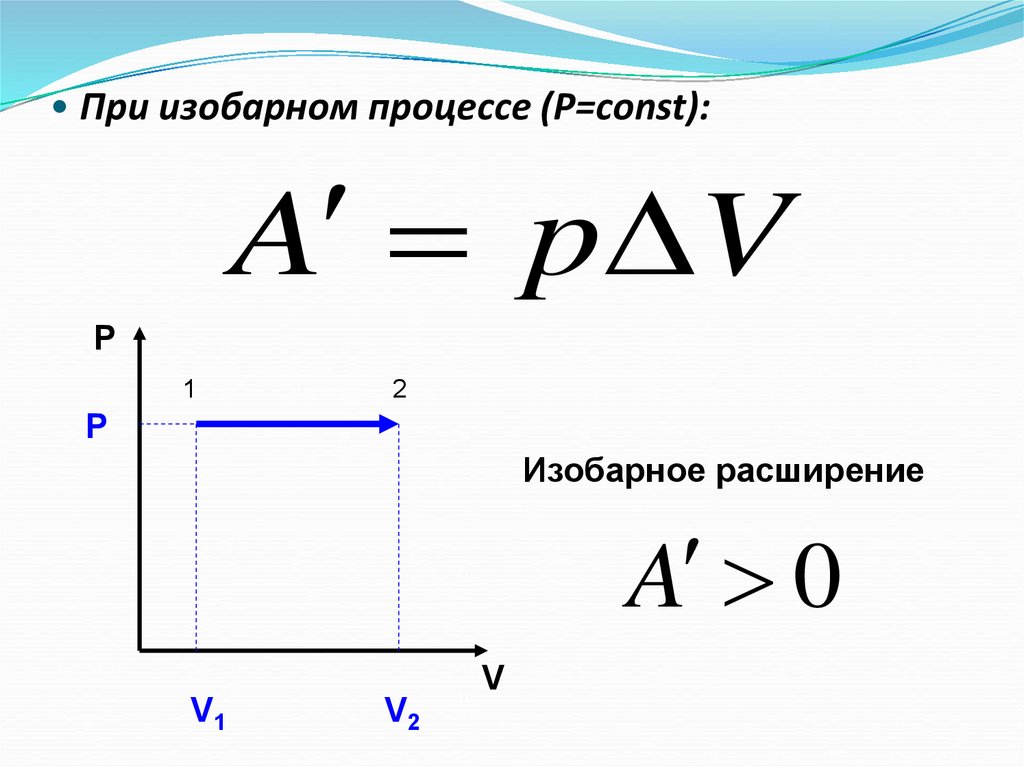
9. При изобарном процессе (Р=const):
• При изобарном процессе (Р=const):A p V
P
1
2
P
Изобарное расширение
A 0
V
V1
V2
10.
11.
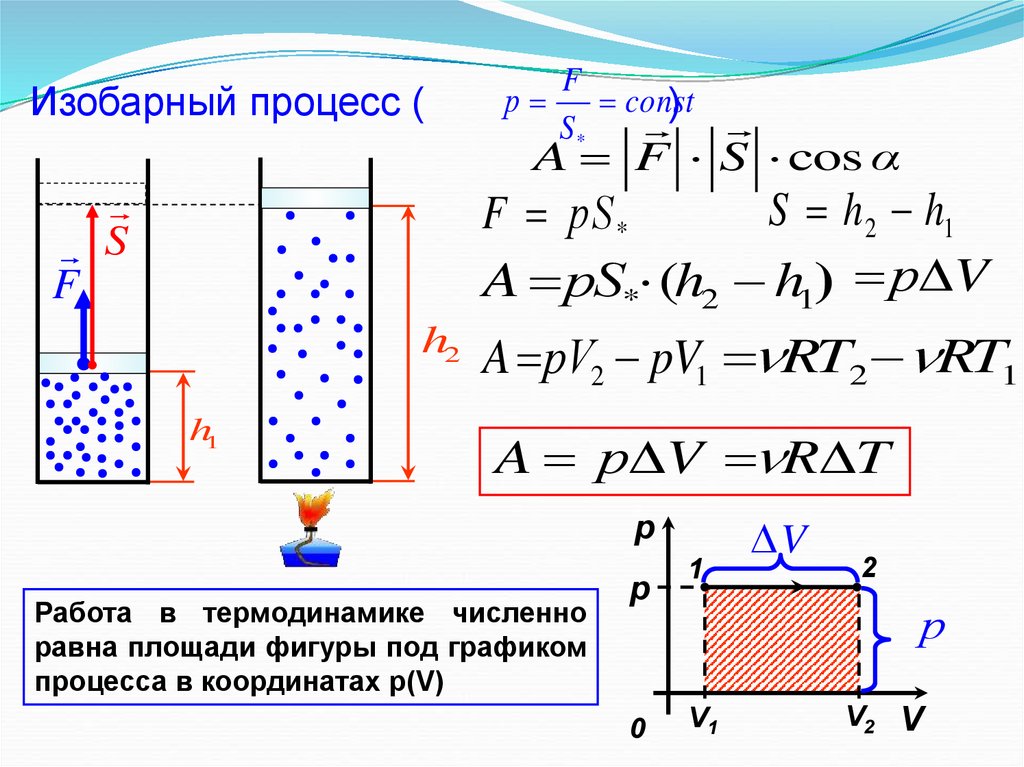
Изобарный процесс (р
F
const
)
S*
A F S cos α
S h 2 h1
F рS *
A рS* (h2 h1) р V
S
F
h2
h1
A рV2 pV1 RT2 RT1
A р V R T
p
Работа в термодинамике численно
равна площади фигуры под графиком
процесса в координатах р(V)
p
0
1
V
2
р
V1
V2 V
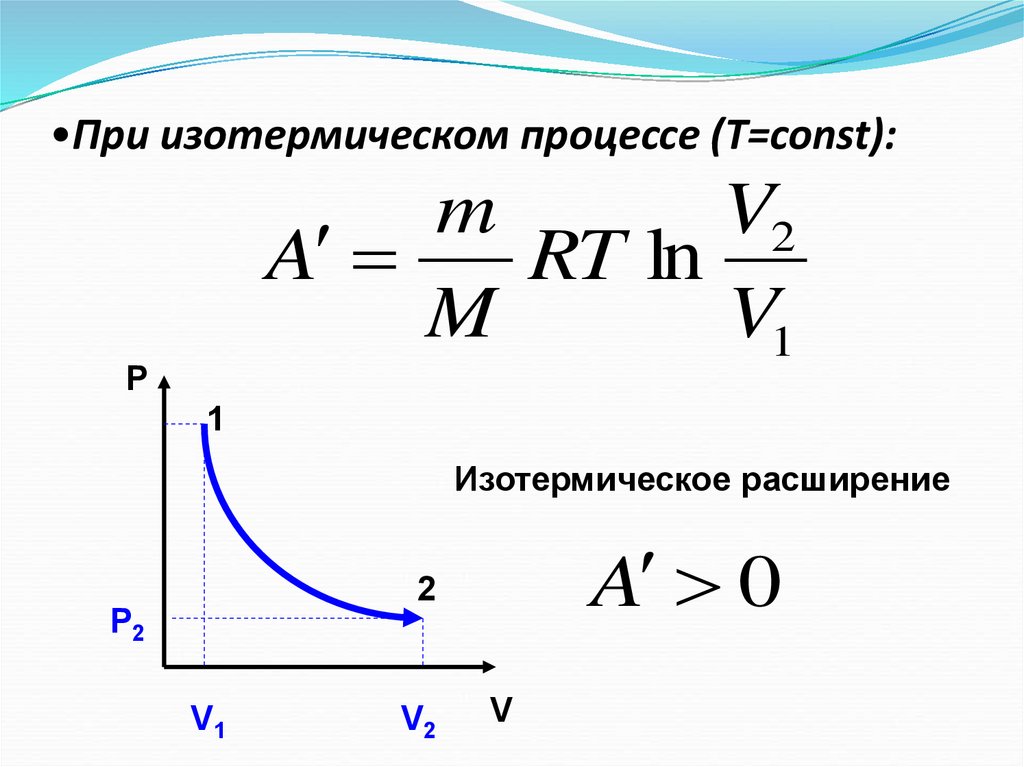
12. При изотермическом процессе (Т=const):
•При изотермическом процессе (Т=const):m
V2
A
RT ln
M
V1
P
1
Изотермическое расширение
A 0
2
Р2
V1
V2
V
13. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
ПроцессНагревание или
охлаждение
Формула
Q cm T
С – удельная теплоёмкость
вещества [ Дж/кг 0К],
m – масса [кг],
ΔT – изменение температуры [ 0K].
Кипение или
конденсация
Q rm
Плавление или
кристаллизация
удельная теплота плавления
Q m λвещества [ Дж/кг ]
Сгорание
топлива
Q qm
r – удельная теплота
парообразования [ Дж/кг ]
q – удельная теплота сгорания
топлива [ Дж/кг ]
14. Если в изолированной системе происходит теплообмен между несколькими телами, то
Q1 Q2 Q3 ... 0- уравнение
теплового баланса
15. Первый закон термодинамики
16. Первый закон термодинамики
Изменение внутренней энергии системы припереходе ее из одного состояния в другое
равно сумме работы внешних сил и количества
теплоты, переданного системе:
U Q A
Если А - работа внешних сил, а А' - работа газа, то
А = - А' (в соответствии с 3-м законом Ньютона).
Тогда:
Q U A
другая форма записи первого закона термодинамики
16
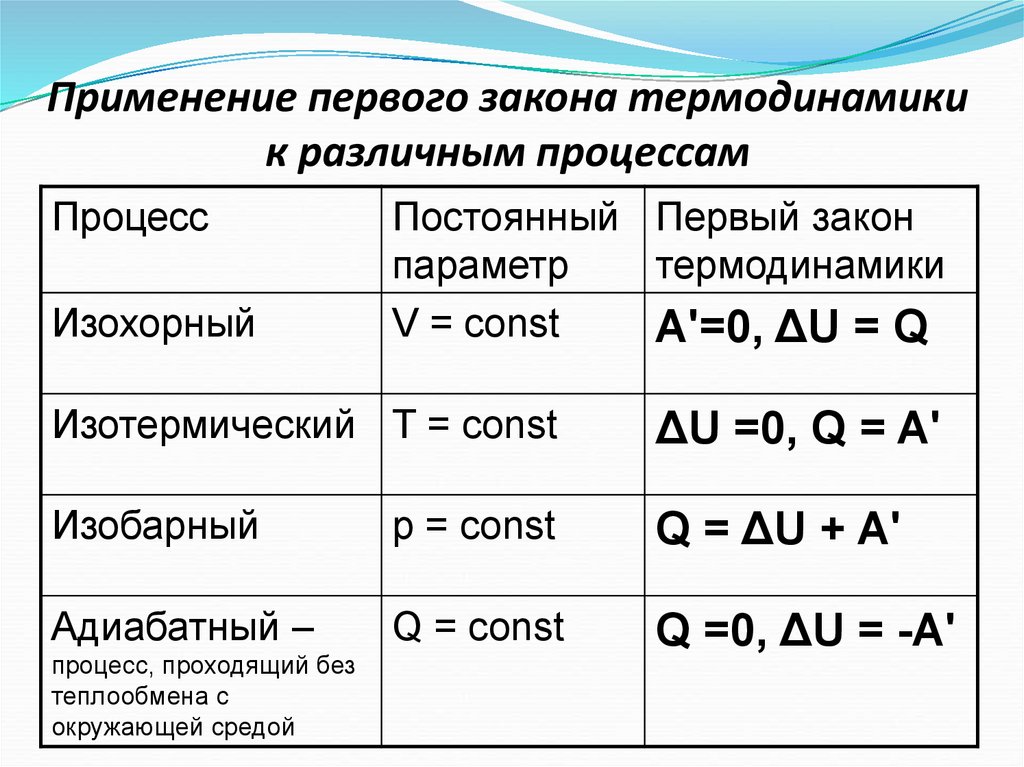
17. Применение первого закона термодинамики к различным процессам
ПроцессИзохорный
Постоянный Первый закон
параметр
термодинамики
V = const
A'=0, ΔU = Q
Изотермический Т = const
ΔU =0, Q = A'
Изобарный
p = const
Q = ΔU + A'
Адиабатный –
Q = const
Q =0, ΔU = -A'
процесс, проходящий без
теплообмена с
окружающей средой
18. Второй закон термодинамики
19. Формулировка закона: Невозможно перевести тепло от более холодной системы к более горячей при отсутствии других одновременных
изменений в обеих системах или вокружающих телах
20.
21. КПД тепловых двигателей
22.
Тепловые двигатели – этоустройства, превращающие
внутреннюю энергию топлива
в механическую работу
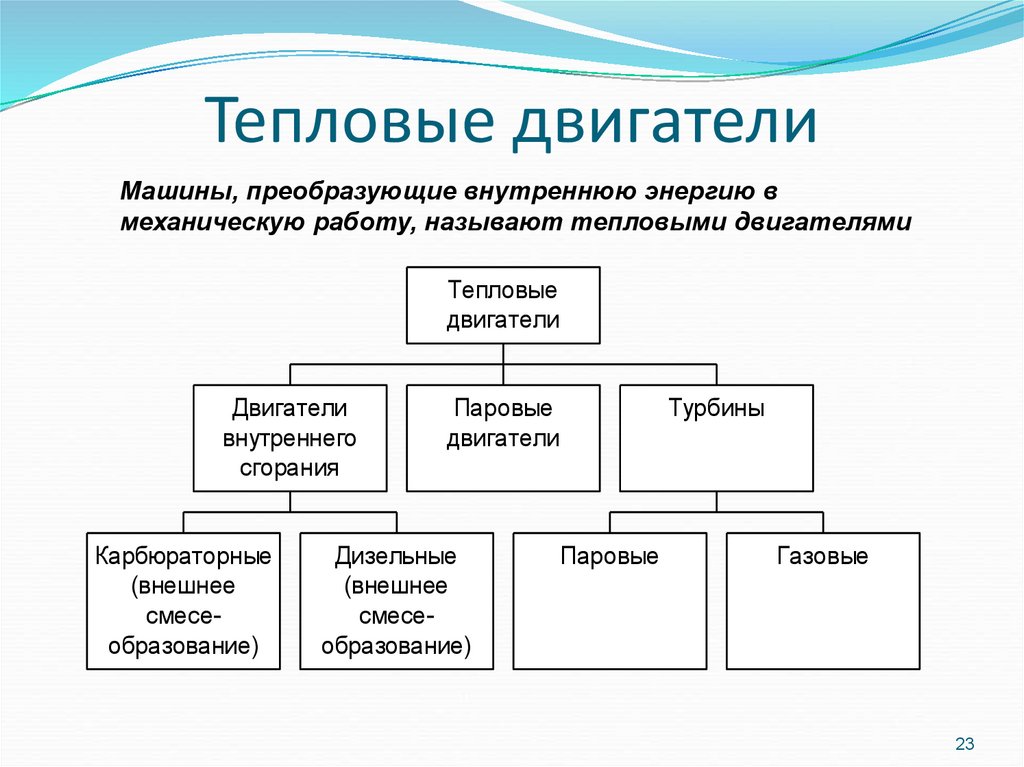
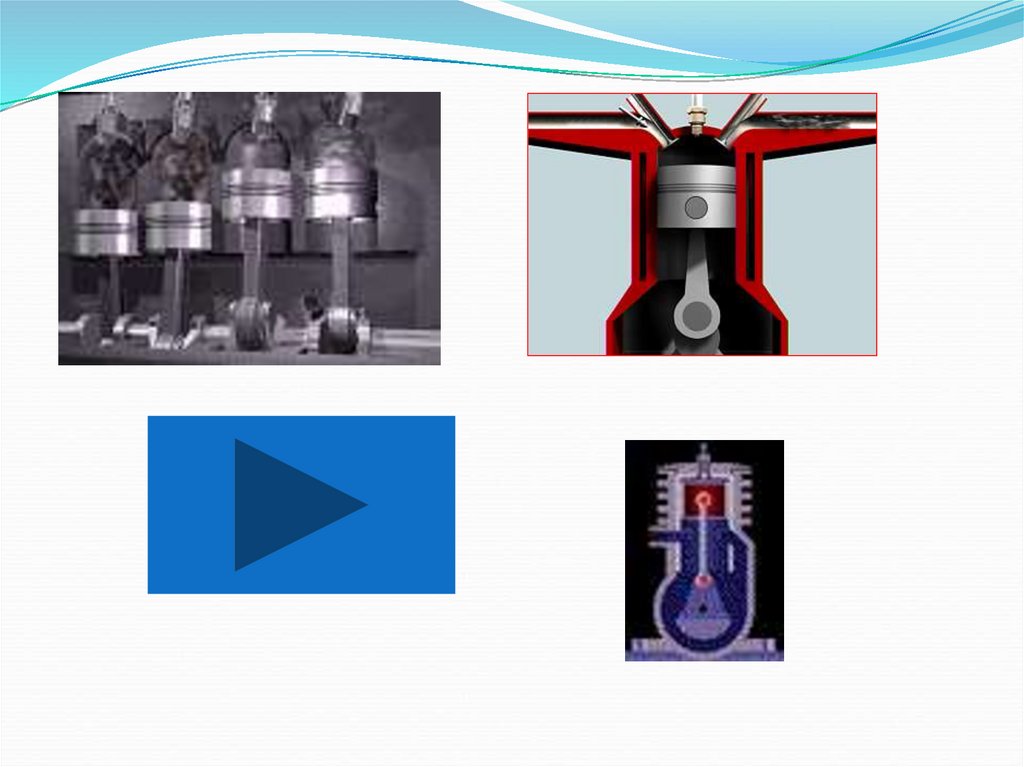
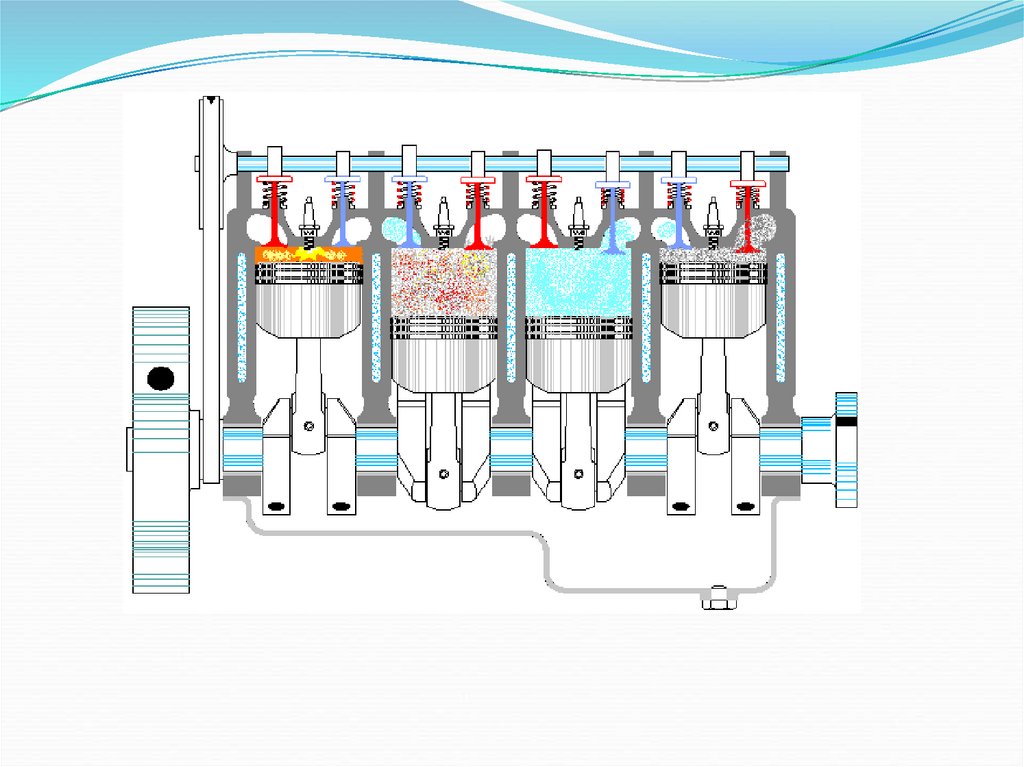
23. Тепловые двигатели
Машины, преобразующие внутреннюю энергию вмеханическую работу, называют тепловыми двигателями
Тепловые
двигатели
Двигатели
внутреннего
сгорания
Карбюраторные
(внешнее
смесеобразование)
Паровые
двигатели
Дизельные
(внешнее
смесеобразование)
Турбины
Паровые
Газовые
23
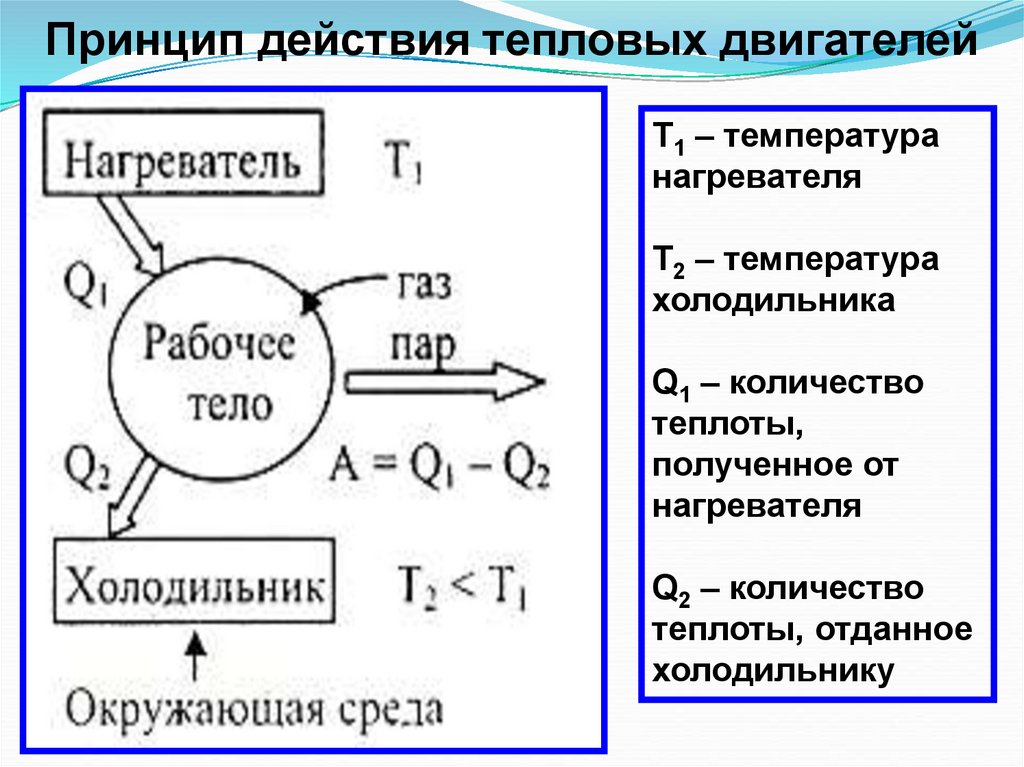
24.
Принцип действия тепловых двигателейТ1 – температура
нагревателя
Т2 – температура
холодильника
Q1 – количество
теплоты,
полученное от
нагревателя
Q2 – количество
теплоты, отданное
холодильнику
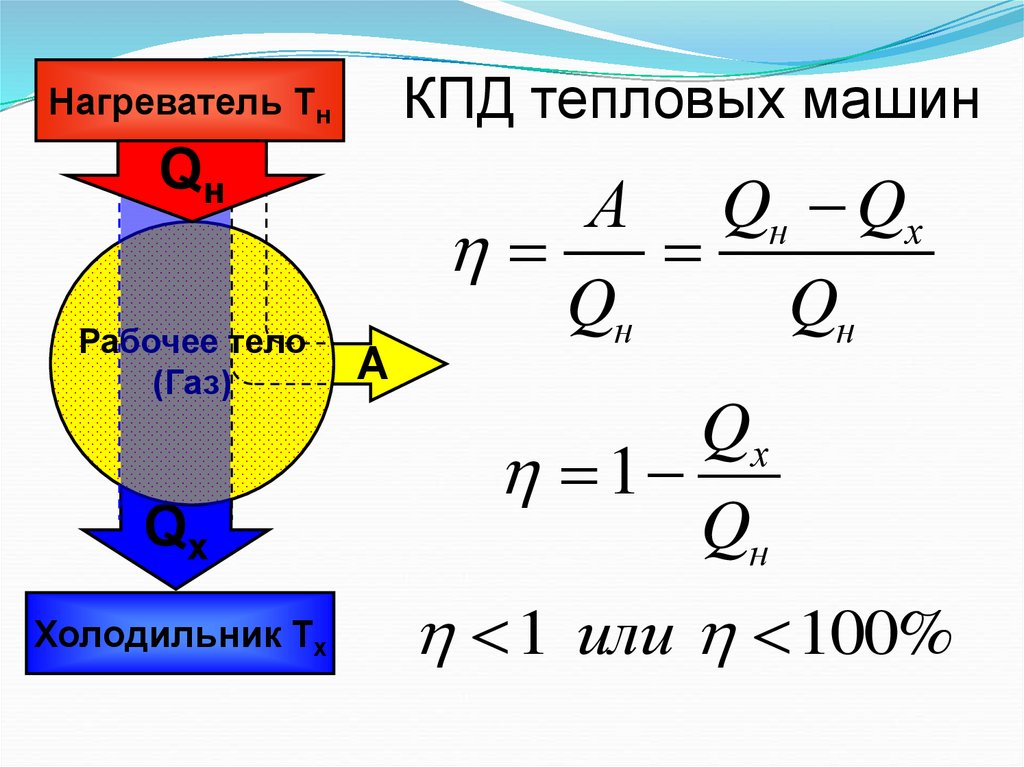
25.
Нагреватель ТнКПД тепловых машин
Qн
А Qн Qх
Qн
Qн
Рабочее тело
(Газ)
Qх
Холодильник Тх
А
Qх
1
Qн
1 или 100%
26.
Цикл Карно – самый эффективныйцикл, имеющий максимальный КПД
max
Т н Т х
Tн




















 physics
physics








