Similar presentations:
Основы технической термодинамики
1. Основы технической термодинамики
2.
_________Термодинамика – теория тепловых
процессов, в которой не учитывается
молекулярное строение тел.
3. Внутренняя энергия
• Определение:Внутренняя энергия тела – это сумма
кинетической энергии хаотического
теплового движения частиц (атомов и молекул) тела и потенциальной энергии их
взаимодействия
• Обозначение:
• Единицы измерения:
U
[Дж]
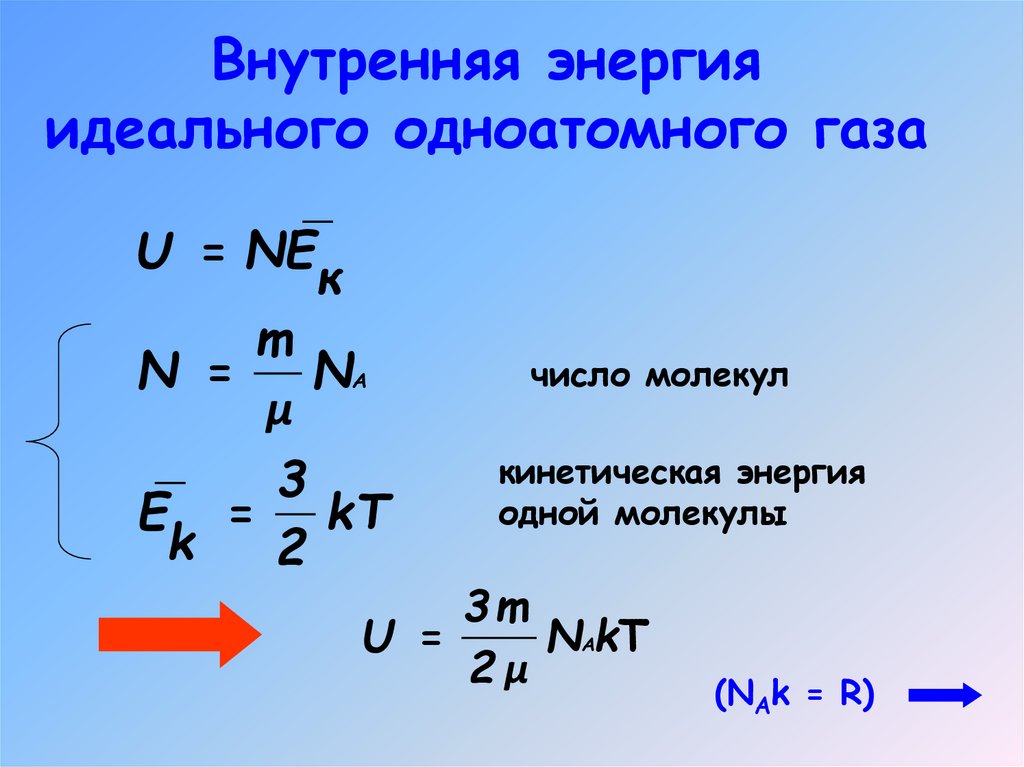
4. Внутренняя энергия идеального одноатомного газа
U = NEк
m
N =
NА
μ
3
E = kT
k
2
число молекул
кинетическая энергия
одной молекулы
3m
U =
NАkT
2μ
(NAk = R)
5. Внутренняя энергия идеального одноатомного газа
3 mU =
RT
2 μ
Внутренняя энергия идеального одноатомного газа зависит лишь
от одного термодинамического параметра - температуры
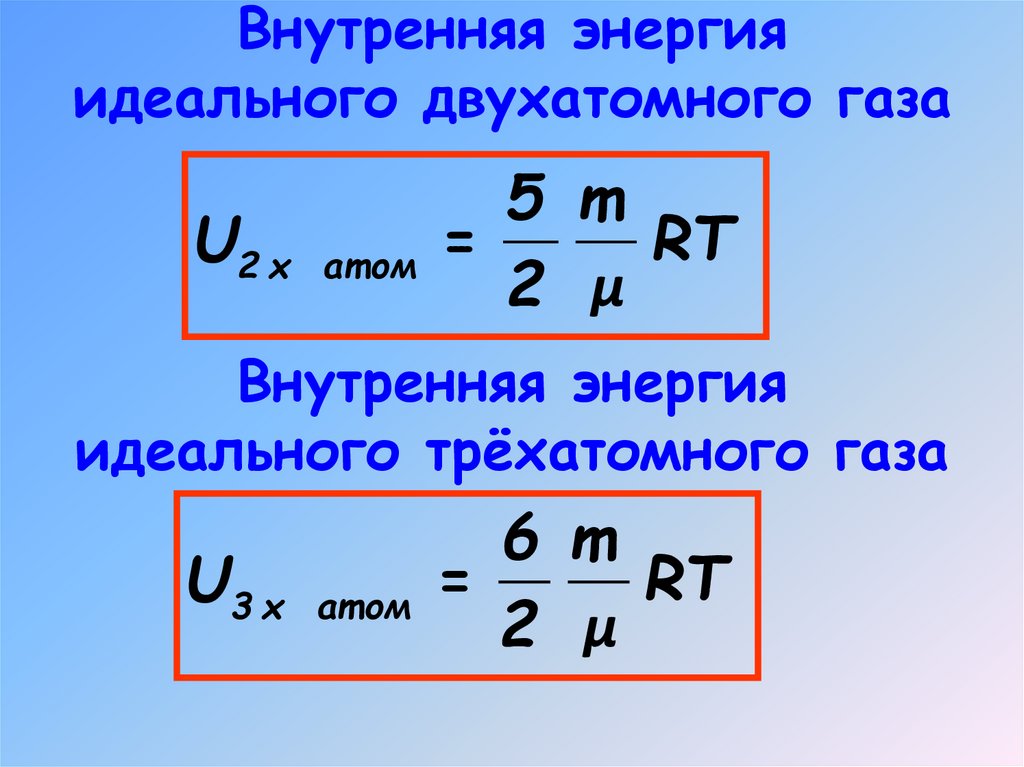
6. Внутренняя энергия идеального двухатомного газа
5 mU2 х ат ом =
RT
2 μ
Внутренняя энергия
идеального трёхатомного газа
6 m
U3 х ат ом =
RT
2 μ
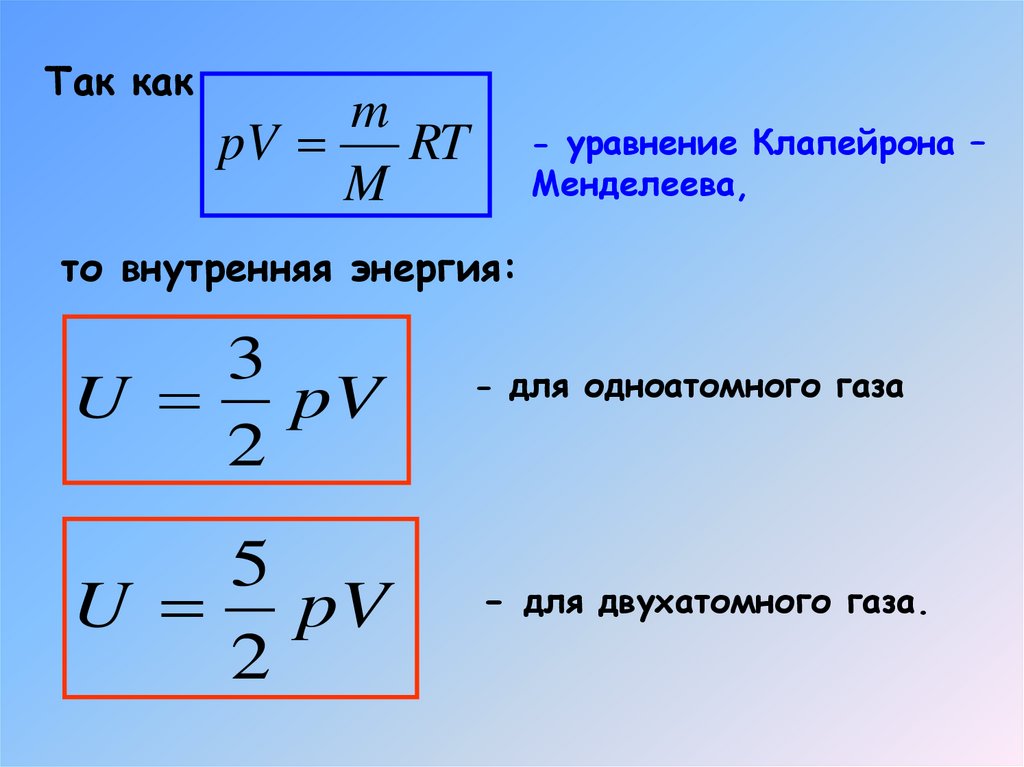
7.
Так какm
pV
RT
M
- уравнение Клапейрона –
Менделеева,
то внутренняя энергия:
3
U pV
2
5
U pV
2
- для одноатомного газа
- для двухатомного газа.
8. В общем виде:
i mi
U
RT pV
2M
2
где i – число степеней свободы молекул
газа (i = 3 для одноатомного газа и i = 5
для двухатомного газа), i = 6 для
трёхатомного газа),
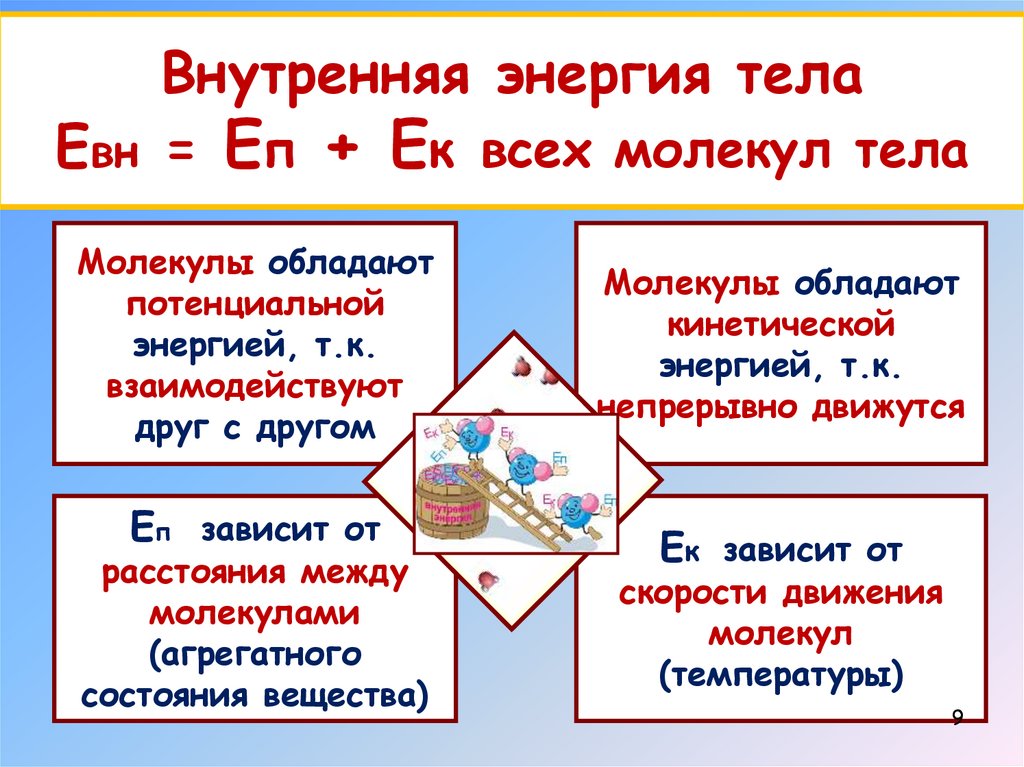
9.
Внутренняя энергия телаЕвн = Еп + Ек всех молекул тела
Молекулы обладают
потенциальной
энергией, т.к.
взаимодействуют
друг с другом
Еп зависит от
расстояния между
молекулами
(агрегатного
состояния вещества)
Молекулы обладают
кинетической
энергией, т.к.
непрерывно движутся
Ек зависит от
скорости движения
молекул
(температуры)
9
10.
Процесс изменения внутренней энергии без совершенияработы над телом или самим
телом называется теплопередачей
10
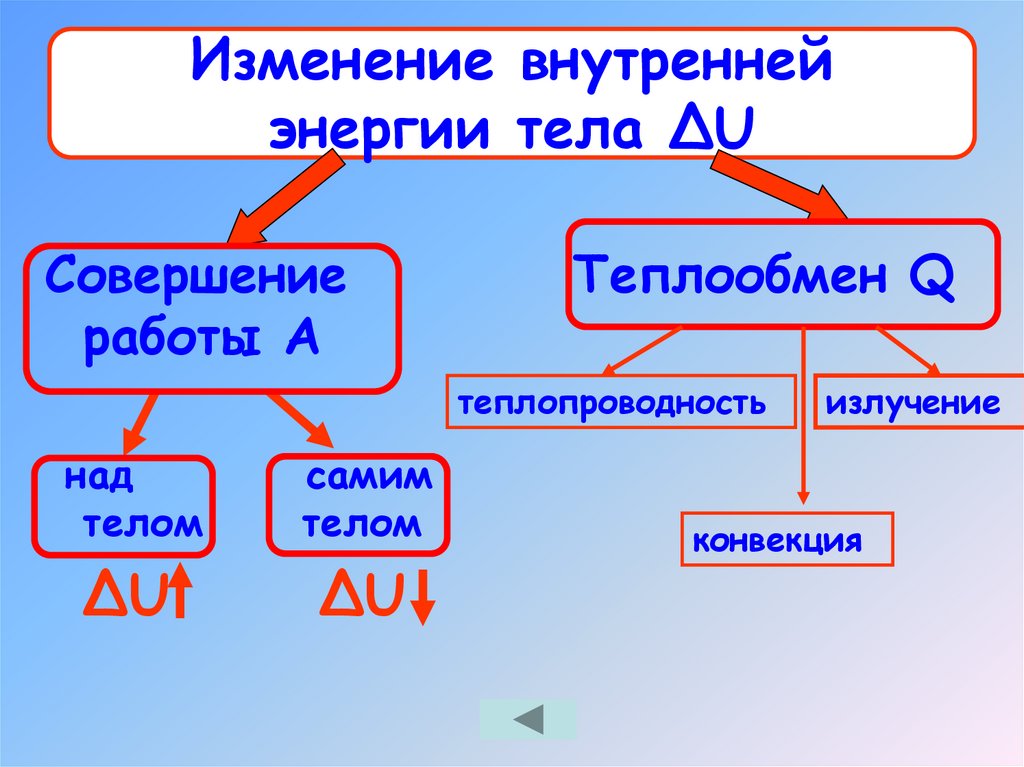
11. Изменение внутренней энергии тела ΔU
Совершениеработы А
Теплообмен Q
теплопроводность
над
телом
самим
телом
ΔU
ΔU
излучение
конвекция
12.
Работа газа при изобарном процессеГаз до расширения и после
Работа газа при
изобарном процессе
Это работа, которую выполняла сила,
с которой газ действовал на поршень
По третьему закону Ньютона, эта сила
по модулю равна силе, с которой
поршень действовал на газ, и
противоположна ей по направлению.
Обозначим силу, действовавшую на
газ:
13. Работа в термодинамике
• Работа газа:A p(V2 V1 ) p V
• Работа внешних сил:
A A
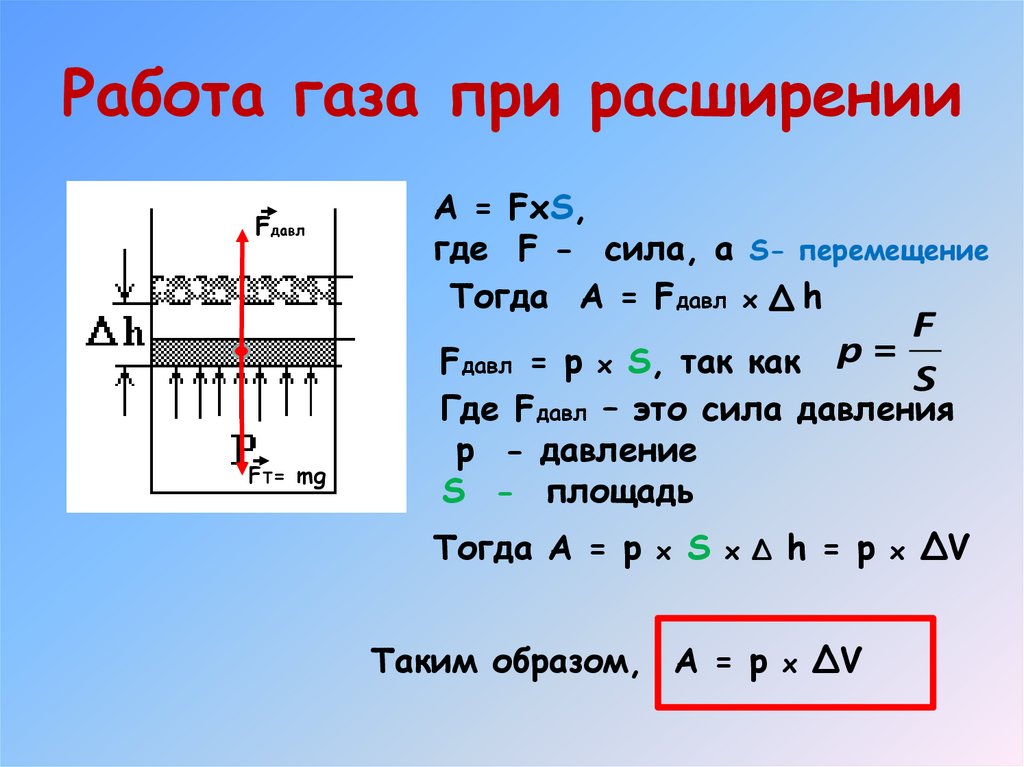
14. Работа газа при расширении
FдавлA = FxS,
где F - сила, а S- перемещение
Тогда A = Fдавл x h
F
Fдавл = p x S, так как p =
S
FT= mg
Где Fдавл – это сила давления
p - давление
S - площадь
Тогда A = p x S x Δ h = p x ΔV
Таким образом, A = p x ΔV
15. Работа газа при изопроцессах
• При изохорном процессе (V=const):ΔV = 0 работа газом не
совершается:
P
A = p x ΔV , ΔV = 0
A 0
V
Изохорное нагревание
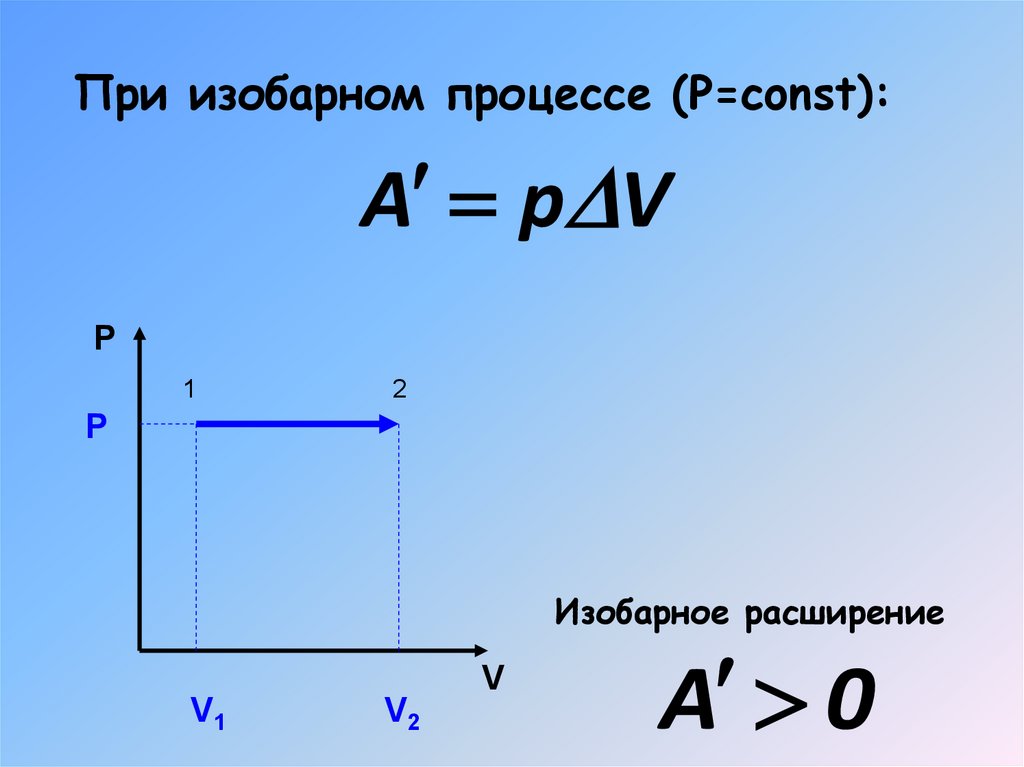
16. При изобарном процессе (Р=const):
A p VP
1
2
P
Изобарное расширение
V
V1
V2
A 0
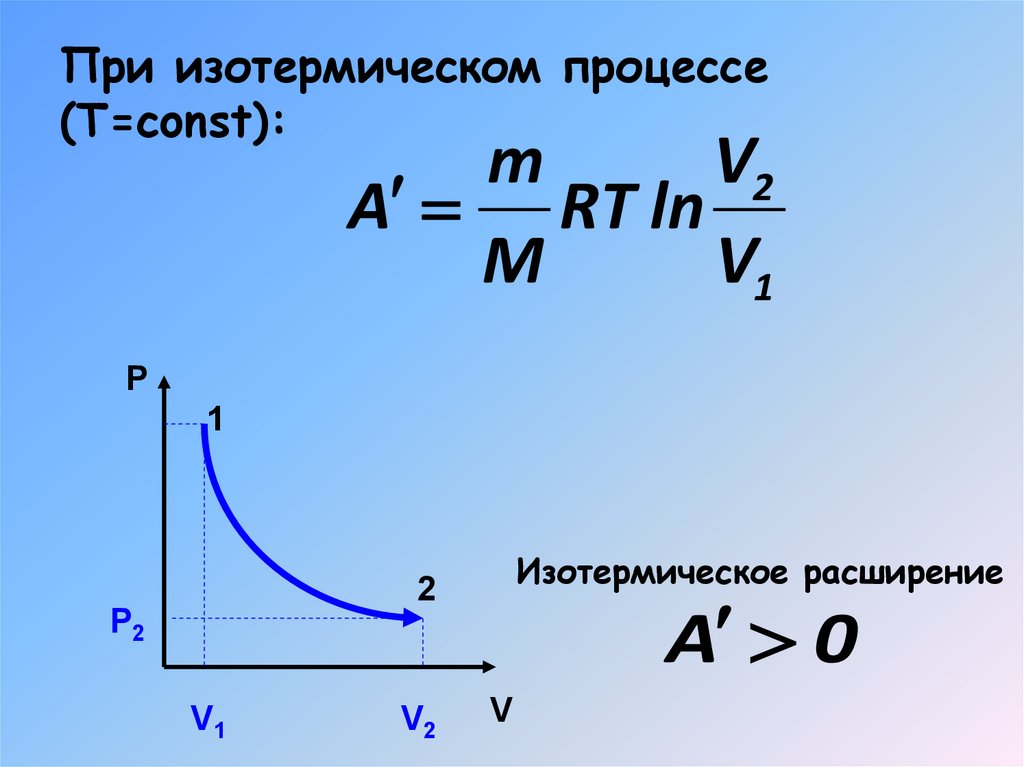
17. При изотермическом процессе (Т=const):
mV2
A RT ln
M
V1
P
1
Изотермическое расширение
2
Р2
V1
V2
A 0
V
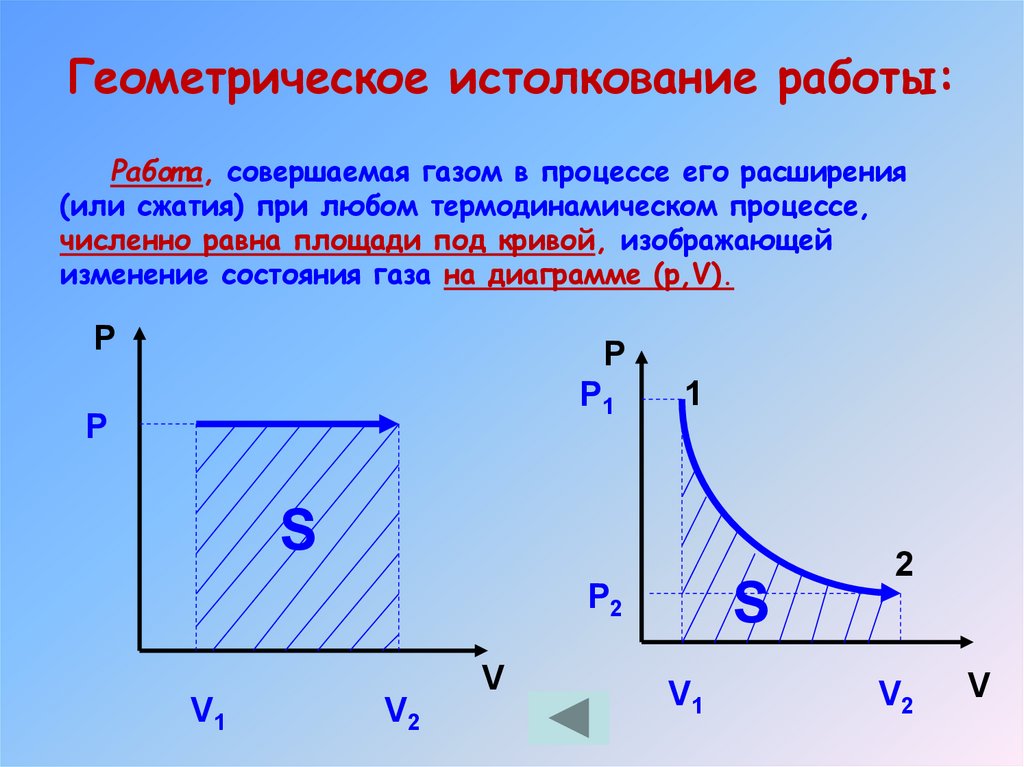
18. Геометрическое истолкование работы:
Работ а, совершаемая газом в процессе его расширения(или сжатия) при любом термодинамическом процессе,
численно равна площади под кривой, изображающей
изменение состояния газа на диаграмме (р,V).
P
P
Р1
P
1
S
Р2
V
V1
V2
S
V1
2
V2
V
19. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
формулаПроцесс
Нагревание или
охлаждение
Кипение или
конденсация
Плавление или
кристаллизация
Сгорание
топлива
Q cm T
Q rm
С – удельная теплоёмкость
вещества [ Дж/кг 0К], m –
масса [кг], ΔT – изменение
температуры [ 0K].
r – удельная теплота
парообразования [ Дж/кг ]
Q m λ- удельная теплота
плавления вещества [ Дж/кг ]
– удельная теплота сгорания
Q qm qтоплива
[ Дж/кг ]
20.
Анализ результатов опытов и наблюдений природныхявлений, выполненных к середине XIX века, привел
немецкого ученого Р. Майера, английского ученого
Д-Джоуля и немецкого ученого Г. Гельмгольца
к выводу о существовании закона сохранения энергии:
21.
Закон сохранения энергии: При любых взаимодействиях тел энергия не исчезает бесследно и не возникаетиз ничего. Энергия только передается от одного тела к
другому или превращается из одной формы в другую.
22.
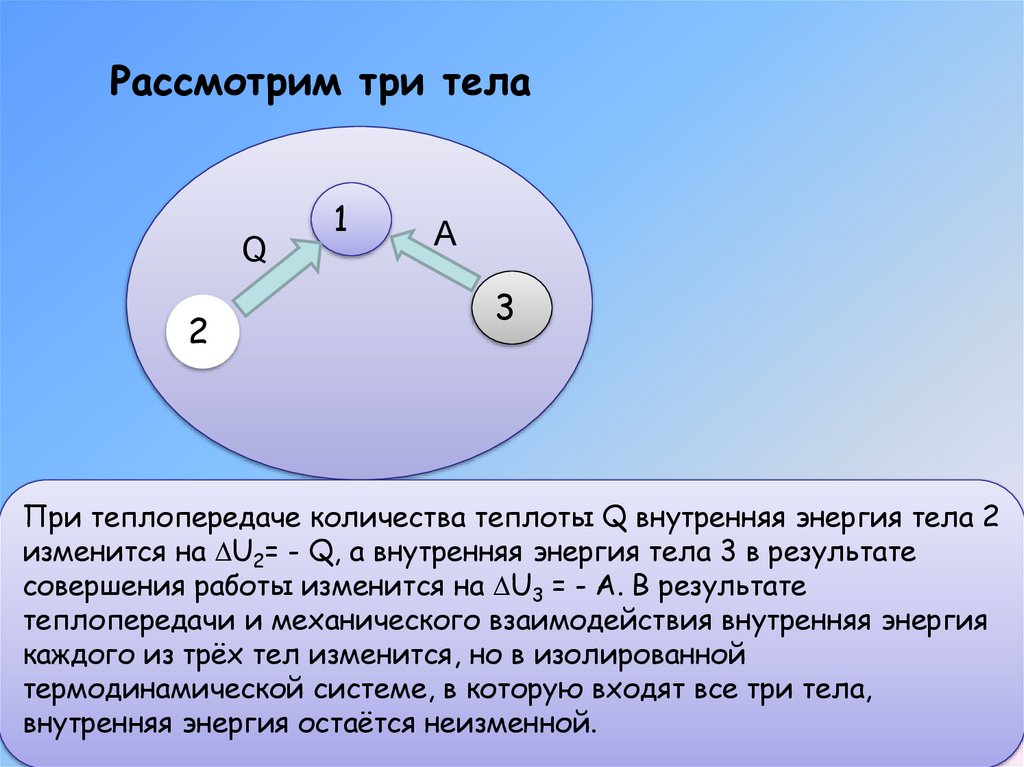
Рассмотрим три телаQ
2
1
A
3
При теплопередаче количества теплоты Q внутренняя энергия тела 2
изменится на U2= - Q, а внутренняя энергия тела 3 в результате
совершения работы изменится на U3 = - A. В результате
теплопередачи и механического взаимодействия внутренняя энергия
каждого из трёх тел изменится, но в изолированной
термодинамической системе, в которую входят все три тела,
внутренняя энергия остаётся неизменной.
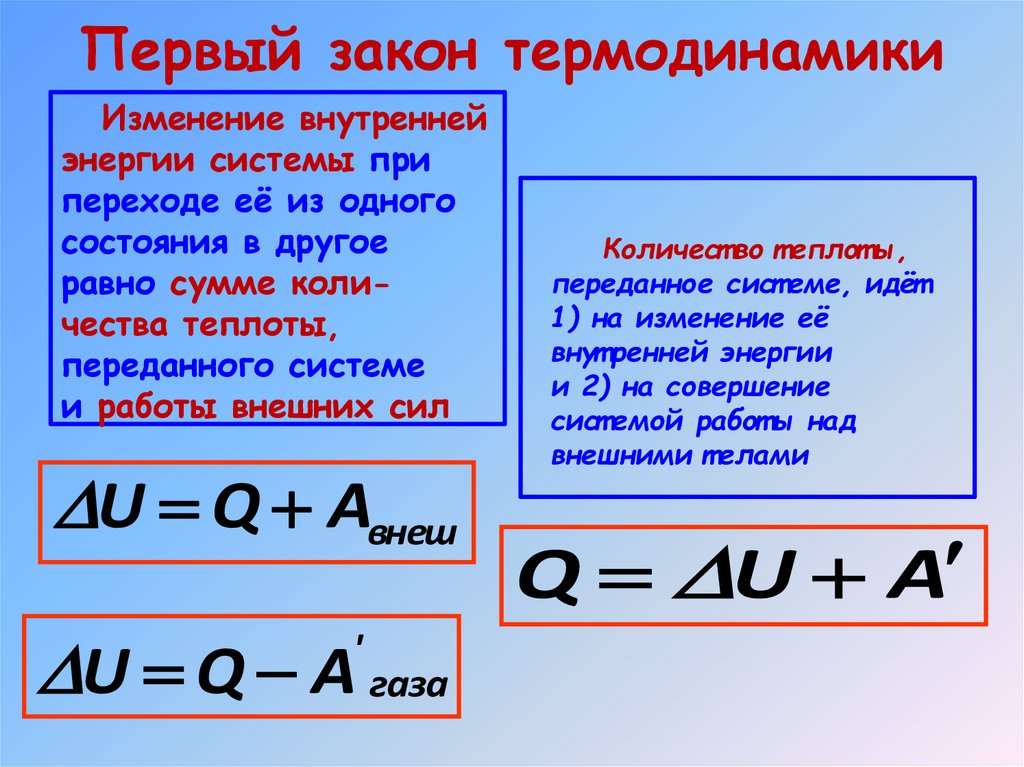
23. Первый закон термодинамики
Изменение внутреннейэнергии системы при
переходе её из одного
состояния в другое
равно сумме количества теплоты,
переданного системе
и работы внешних сил
U Q Aвнеш
U Q A газа
'
Количест во т еплот ы,
переданное сист еме, идёт
1) на изменение её
внут ренней энергии
и 2) на совершение
сист емой работ ы над
внешними т елами
Q U A
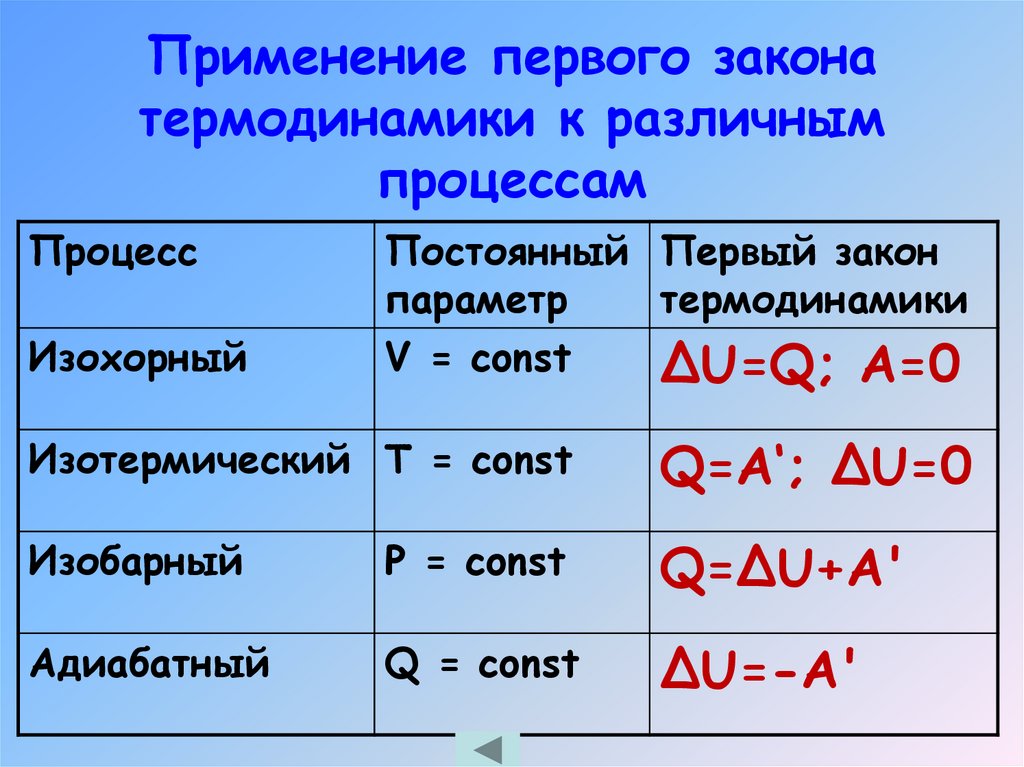
24. Применение первого закона термодинамики к различным процессам
ПроцессИзохорный
Постоянный Первый закон
параметр
термодинамики
V = const
ΔU=Q; А=0
Изотермический Т = const
Q=A‘; ΔU=0
Изобарный
Р = const
Q=ΔU+A'
Адиабатный
Q = const
ΔU=-A'
25.
Одним из главных следствийпервого закона
термодинамики является
невозможность построения
вечного двигателя.
26.
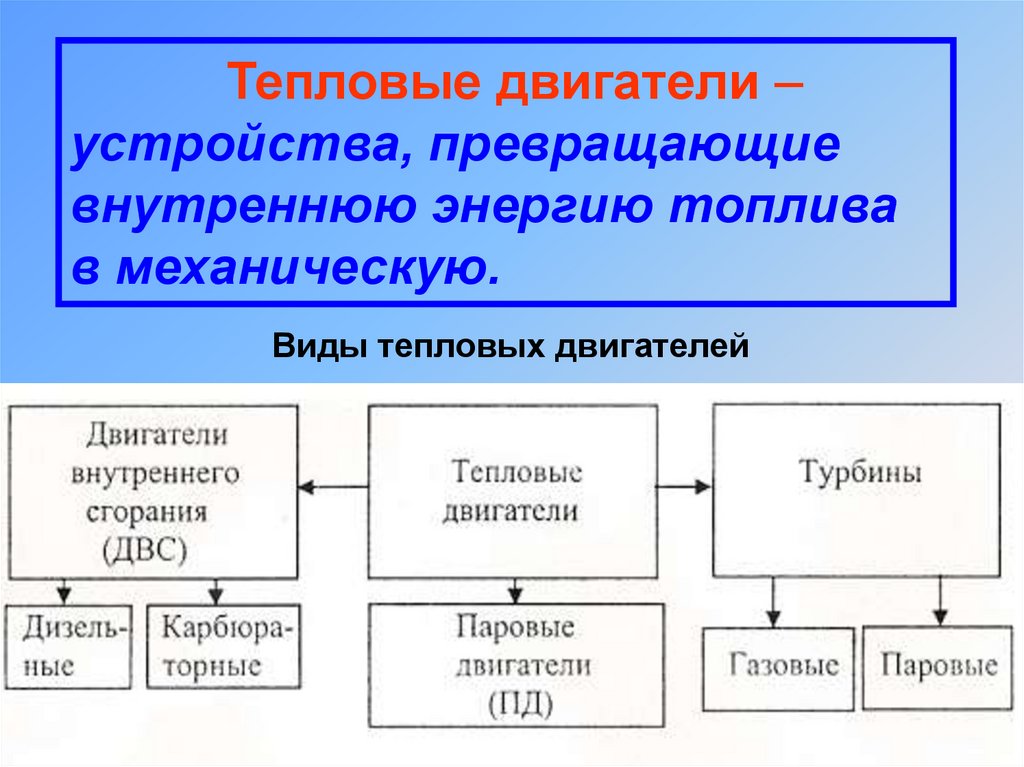
Тепловые двигатели –устройства, превращающие
внутреннюю энергию топлива
в механическую.
Виды тепловых двигателей
27.
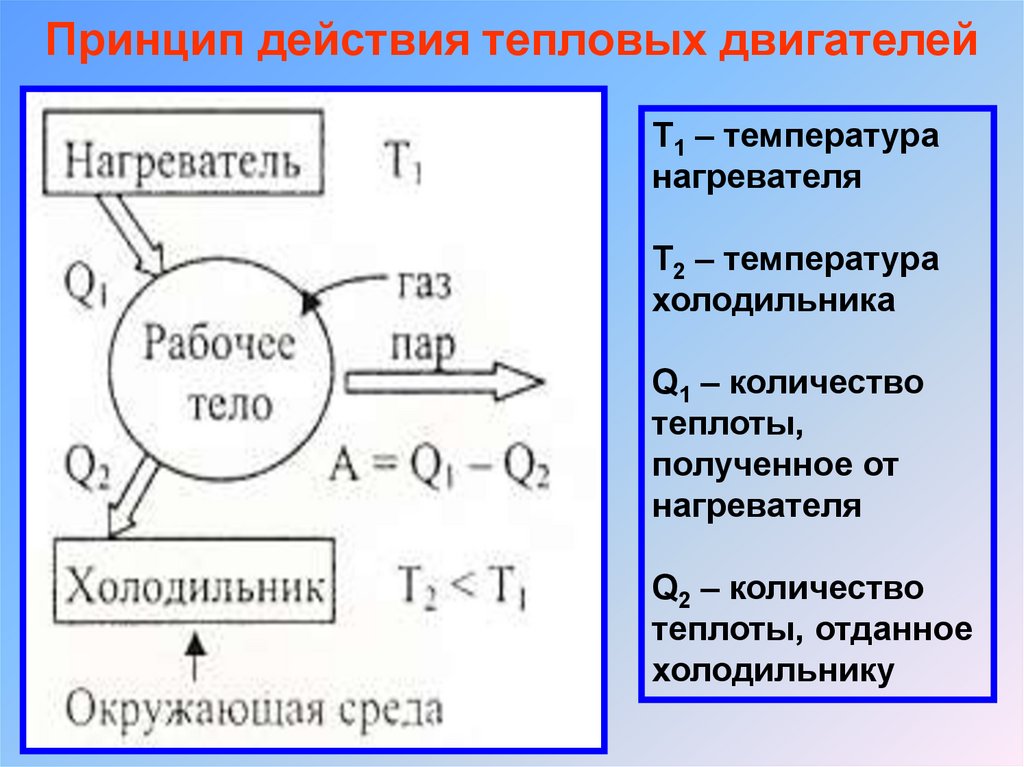
Принцип действия тепловых двигателейТ1 – температура
нагревателя
Т2 – температура
холодильника
Q1 – количество
теплоты,
полученное от
нагревателя
Q2 – количество
теплоты, отданное
холодильнику
28.
Коэффициент полезногодействия (КПД) теплового
двигателя –
отношение работы А’, совершаемой двигателем, к
количеству теплоты, полученному от
нагревателя:
А
Q1
29.
гдеА Q1 Q2 -работа, совершаемая
двигателем
тогда
Q1 Q2
1
При
Q1
1
Q2
Q1
КПД всегда меньше единицы, так
как у всех двигателей некоторое
количество теплоты
передаётся холодильнику
Т1 Т 2 0 двигатель не может работать
30.
Максимальное значение КПДтепловых двигателей (цикл Карно):
T1 T2
max
T1
31.
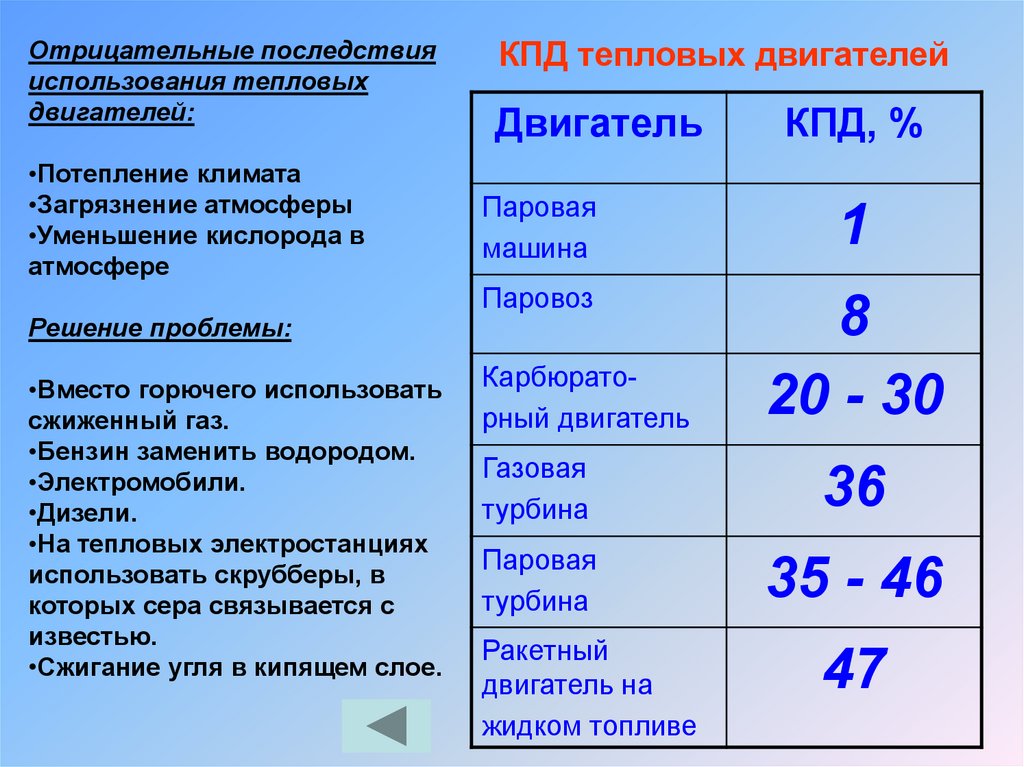
Отрицательные последствияиспользования тепловых
двигателей:
•Потепление климата
•Загрязнение атмосферы
•Уменьшение кислорода в
атмосфере
Решение проблемы:
•Вместо горючего использовать
сжиженный газ.
•Бензин заменить водородом.
•Электромобили.
•Дизели.
•На тепловых электростанциях
использовать скрубберы, в
которых сера связывается с
известью.
•Сжигание угля в кипящем слое.
КПД тепловых двигателей
Двигатель
КПД, %
Паровая
машина
1
Паровоз
8
20 - 30
Карбюраторный двигатель
Газовая
турбина
36
Паровая
турбина
35 - 46
Ракетный
двигатель на
жидком топливе
47
















 physics
physics








