Similar presentations:
вода
1.
СВОЙСТВА ВОДЫ2.
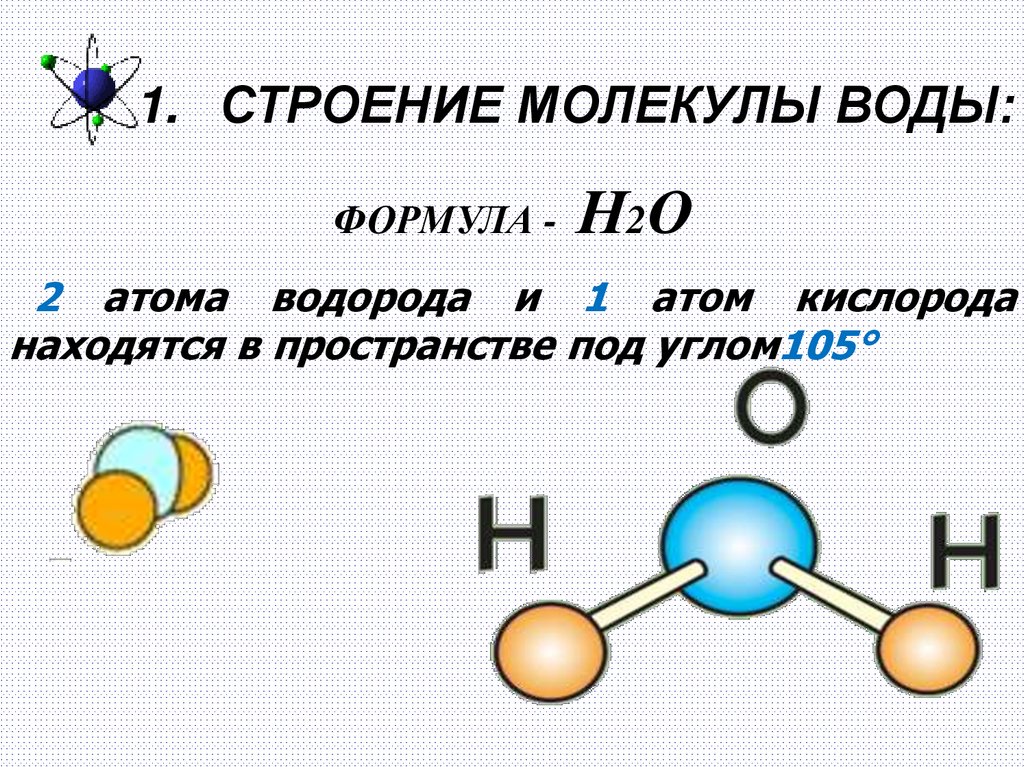
1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ:ФОРМУЛА - Н2О
2 атома водорода и 1 атом кислорода
находятся в пространстве под углом105°
3.
2. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ:ЖИДКОСТЬ - БЕЗ ЦВЕТА, ВКУСА И ЗАПАХА
СУЩЕСТВУЕТ В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
КИПИТ ПРИ 100°С
ЗАМЕРЗАЕТ (ПЛАВИТСЯ) ПРИ 0°С
ПЛОТНОСТЬ 1 Г/МЛ
ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЁМКОСТЬЮ
НЕ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК
ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ ПЛОТНОСТИ ВОДЫ
УНИВЕРСАЛЬНЫЙ РАСТВОРИТЕЛЬ
4.
3. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:
а) очень активные металлы при взаимодействии с
водой образуют гидроксид металла и водород:
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
5.
б) металлы средней активностивзаимодействуют с водой при нагревании,
образуя оксид металла и водород:
Zn + H2O = ZnO + H2
оксид цинка
3Fe + 4H2O = Fe3O4 + 4H2
железная окалина
в) малоактивные металлы с водой
не реагируют:
Cu + H2O =
6.
2. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ОКСИДАМИ:а) оксиды активных металлов при
взаимодействии с водой образуют гидроксиды:
CaO + H2O = Ca(OH)2
гидроксид кальция
K2O + H2O = 2 KOH
гидроксид калия
7. б) оксиды неметаллов при взаимодействии с водой образуют кислоты:
SO2 + H2O = H2SO3cернистая кислота
SO3 + H2O = H2SO4
серная кислота
8.
3. Разложение воды под действиемэлектрического тока (электролиз):
2H2O = 2H2 ↑ + O2 ↑






 chemistry
chemistry








