Similar presentations:
Вода округ нас. Физические и химические свойства воды
1.
8 классБозаджи Н.М.
учитель химии
высшей категории
2.
Воде была дана волшебная властьстать соком жизни на Земле.
Леонардо да Винчи
3.
В результате изучения темы, выбудете способны:
1.Описывать распространение
воды в природе.
2.Рассматривать воду как простое
вещество( состав, строение).
3.Описывать физические свойства воды.
4.Записывать уравнения хим.реакций,
демонстрирующих хим. свойства воды.
5.Рассматривать применение воды и её
значение
6.Осуществлять рефлексию
своей деятельности
4.
Вода в природеФизические
св-ва воды
Химические
св-ва воды
Круговорот воды
Применение и
значение воды
Рефлексия
5.
Большая часть поверхности Землипокрыта морями и океанами - 71%
Морская вода – 97% - 98%
Пресная вода – 2% - 3%
75% - ее сковано льдом, находится под
землей
Таким образом человек может пользоваться только
0,02% – 0,03%
всей воды на нашей планете.
6. 1.Вода́ (оксид водорода) —Н2O.
1.Вода́ (оксид водорода) —Н2O.• Mr (H2O)=18
• M (H2O)=18 г/моль
• Связь между атомами
водорода и
кислорода возникает
за счет общих
электронных пар –
ковалентная
полярная: H:O:H
7.
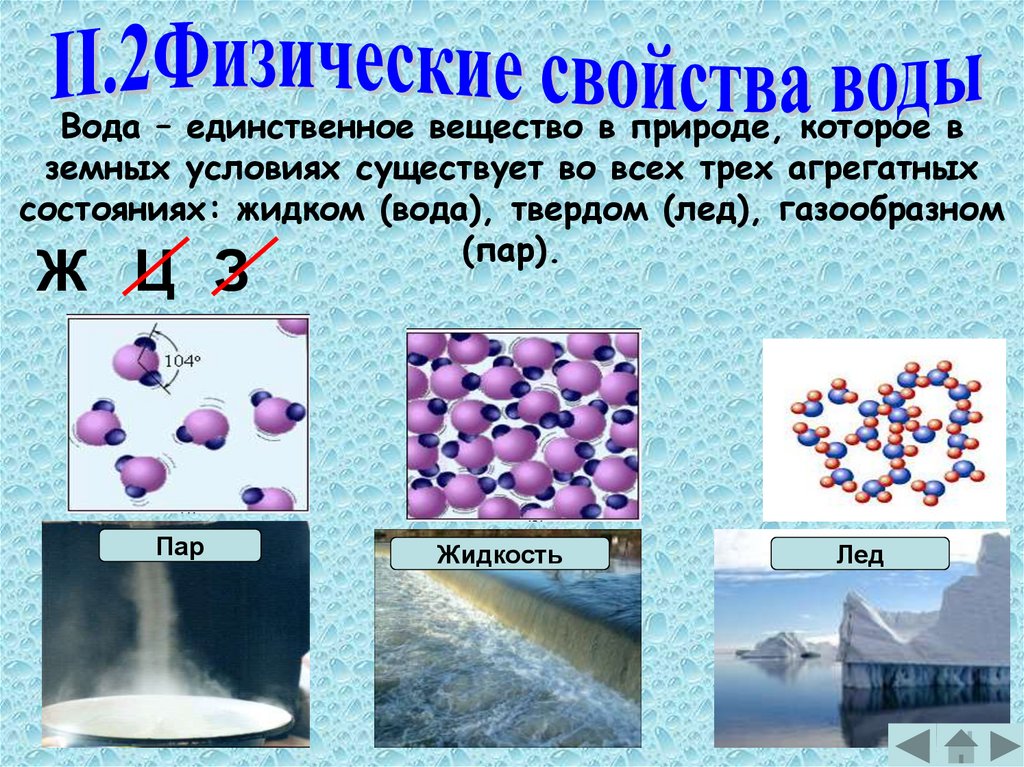
Вода – единственное вещество в природе, которое вземных условиях существует во всех трех агрегатных
состояниях: жидком (вода), твердом (лед), газообразном
(пар).
Ж Ц З
Пар
Жидкость
Лед
8.
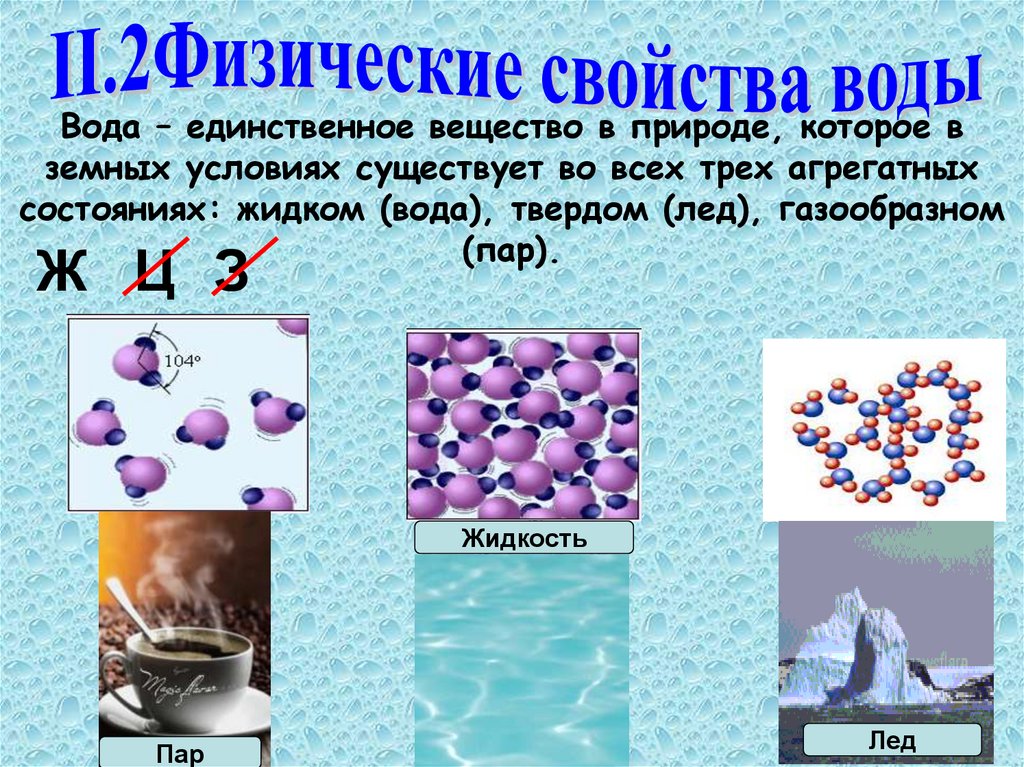
Вода – единственное вещество в природе, которое вземных условиях существует во всех трех агрегатных
состояниях: жидком (вода), твердом (лед), газообразном
(пар).
Ж Ц З
Жидкость
Пар
Лед
9.
Кровь человека на 90% состоит из водыМышцы на 75%
Кости на 28%
Стекловидное тело глаза на 99%
10.
Обезвоживание организмана 12 – 15 % приводит к
нарушению обмена веществ,
А потеря до 25 % воды –
к гибели организма
Без воды человек может
прожить 3 дня,
в то время, как без пищи
30 – 50 дней
11.
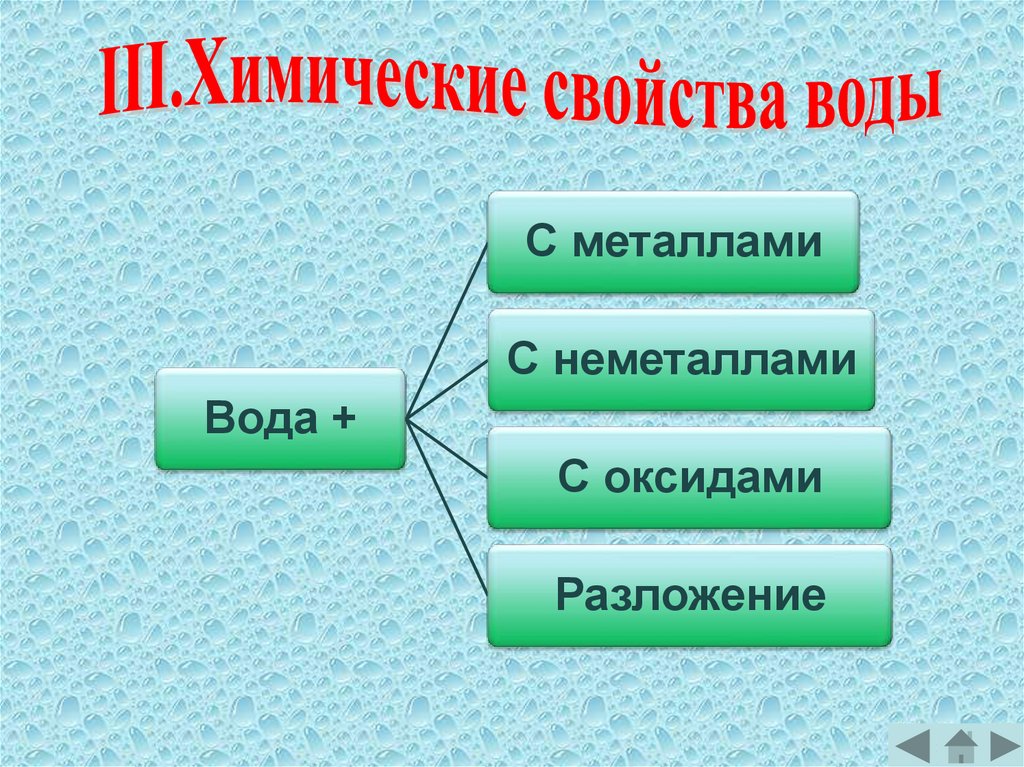
С металламиС неметаллами
Вода +
С оксидами
Разложение
12.
а) активные металлы (до Al) при взаимодействиис водой образуют Р.основание-( щелочь ) и H2:
2Na + 2H2O = 2NaOH + H2 ↑
гидроксид
натрия
2K + 2H2O = 2KOH + H2 ↑
гидроксид
калия
Ca + 2H2O = Ca(OH)2 + H2 ↑
гидроксид
кальция
13.
б) металлы средней активности (от Al до H )взаимодействуют с водой при нагревании,
образуя оксид металла и H2:
t0↑
Zn + H2O = ZnO + H2
t
оксид
0↑цинка
3Fe + 4H2O = Fe3O4 (FeO•Fe2O3) +4H2
железная
окалина
в) малоактивные металлы с водой
не реагируют:
Cu + H2O =
14.
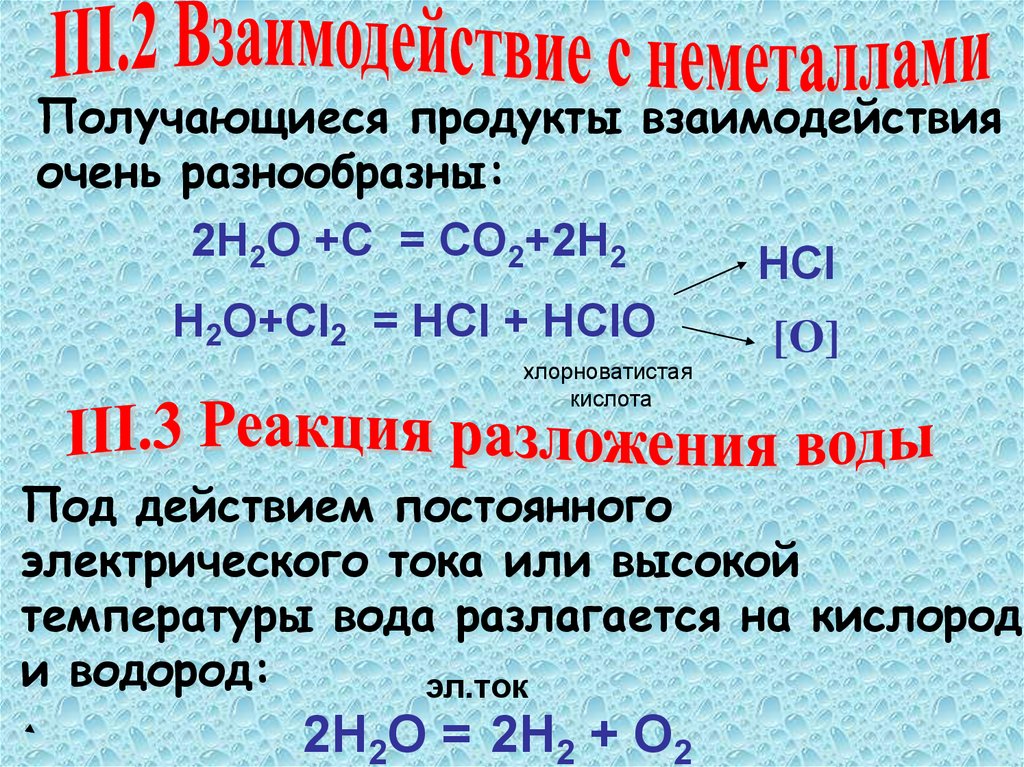
Получающиеся продукты взаимодействияочень разнообразны:
2H2О +C = CO2+2H2
HCl
H2О+Cl2 = HCl + HClO
[O]
хлорноватистая
кислота
Под действием постоянного
электрического тока или высокой
температуры вода разлагается на кислород
и водород:
эл.ток
2Н2О = 2Н2 + О2
15.
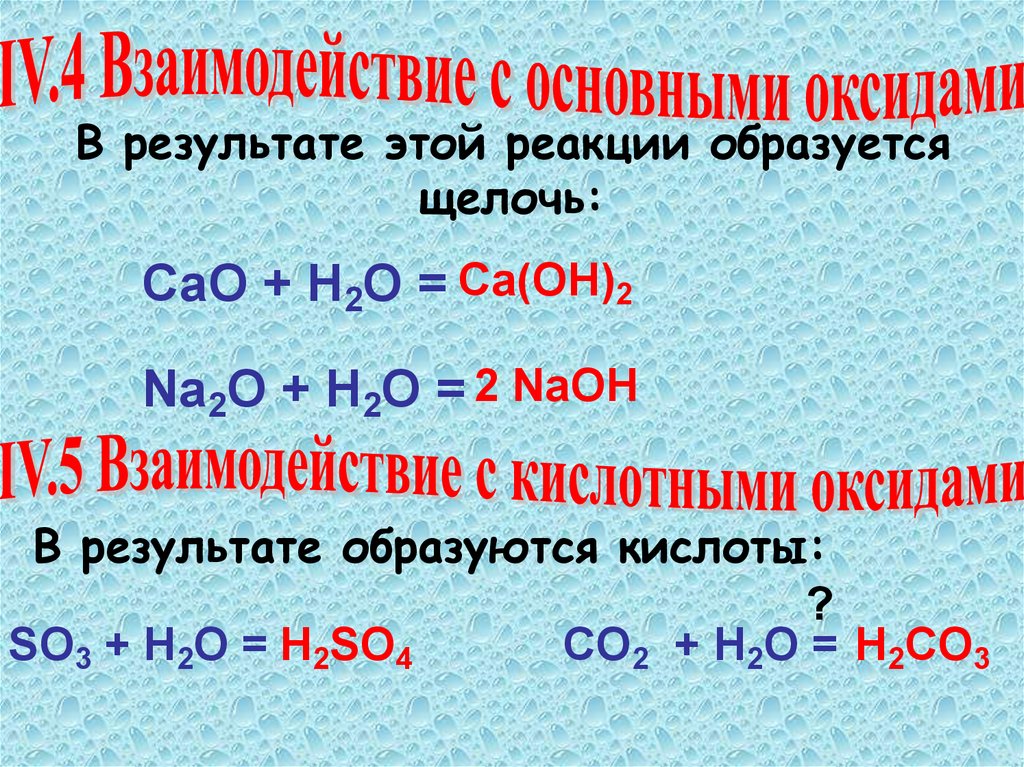
В результате этой реакции образуетсящелочь:
СаО + Н2О = Са(ОН)2
Na2O + H2O = 2 NaOH
В результате образуются кислоты:
?
SO3 + H2O = H2SO4
CO2 + H2O = H2CO3
16.
17.
Вода постоянноиспаряется с поверхности
наземных водоемов,
листьев растений Так
возникает водяной пар,
который, конденсируясь,
ставновится облаками.
Атмосферная вода
попадает на землю в
виде осадков.
Но не нужно думать, что круговорот – это
панацея от исчерпания доступных запасов
пресной воды. Все же он происходит медленно.
Берегите воду!
18.
+ Вопрос 1 + Вопрос 2 + Вопрос 3 + Вопрос 4 -Выберите
формулу
оксида,
ссводой
которым
Выберите
формулу
оксида,
которым
Агрегатное
состояние
воды
Наиболее
энергично
с
Формула
Между
Больше
молекулами
продукта
всего
примесей
реакции
воды
При
комнатной
температуре
водород
Только
при
нагревании
Наталья
Валерьевна
вода
Ушакова
взаимодействует
с образованием
Вид
связи
в
молекуле
воды
выделяется,
если
с
водой
реагирует
при
обычных
условиях
реагирует
оксида
содержится
образуется
серы
(IV)
всвязь
воде
с водой
реагирует
с водой
щелочи
кислоты
+ Вопрос 5 + Вопрос 6 + Вопрос 7 -
А
А
А
+ Вопрос 8 -
+ Вопрос 9 + Вопрос 10 -
ВВВ
В
оксид
водородная
водородная
дождевой
Кальций
кальций
фосфора
P
SiO
H22O
S25
(V)
жидкость
ковалентная
кальций
H
железо
речной
Na
SO
газообразное
2CO
2O
24
полярная
Б
Б
ГГГ
ковалентная
твердое
оксид
морской
магний
золото
BaO
CO
SOкалия
3
2
неполярная
оксид
оксид
родниковой
ионная
H
калий
ионная
CaO
SO
натрия
бария
возможны
2SO
3 3 все
19.
1.При обычных условиях вода можетреагировать с:
a)ZnO b) SiO2
c)Al
d) Na
2.При обычных условиях вода может
реагировать с
a)кальцием
b)оксидом алюминия
c) золотом
d)оксидом кремния(IV)
3.При обычных условиях вода не
может реагировать с:
a)Na2O
b)K
c) Fe2O3 d)SO3
4.Только при нагревании с водой реагирует:
a)оксид калия b)кальций
c)железо
d)натрий
20.
5.При растворении в воде основногооксида образуется:
а)кислота b)соль
c)снование d)кислотный оксид
6. Формула продукта реакции оксида серы(IV)
с водой:
a)H2S
b) H2SO4
c)H2S2O3
d)H2SO3
7.Вода при обычных условиях может
взаимодействовать со всеми в-вами группы:
a) кальций, оксид бария, оксид серы(VI)
b) калий, оксид алюминия, медь
c)оксид кремния(IV),водород, хлорид натрия
d)сера, алюминий, оксид фосфора(V).
21.
В жизни растенийи животных
В быту
человека
Для получения
оснований
Как растворитель в
отраслях народного
хозяйства
Вода
Вода
Для получения
кислот
В системах
охлаждения
Для получения
органических
веществ
Для получения
водорода
В паровых
двигателях
Для производства
минеральных
удобрений
22.
В жизни растенийи животных
Как растворитель в
отраслях народного
хозяйства
В быту
человека
Для получения
оснований
Для получения
органических
веществ
Для получения
водорода
Вода
Для получения
кислот
В системах
охлаждения
В паровых
двигателях
Для производства
минеральных
удобрений
23. Вода необходима всем живым организмам: растениям, животным и человеку. Без воды нет жизни. Вода – одно из самых главных
богатствЗемли.
24.
25. Пожалуй, ни одна проблема не вызывает сейчас у человечества такие оживленные дискуссии, как проблема загрязнения Мирового
океана. Последниедесятилетия знаменуются усилением антропогенных
воздействий на морские экосистемы в результате
загрязнения морей и океанов. Антропогенные
воздействия – это воздействие на природу в результате
деятельности человека.
26. Попадают ли отходы в океан? Оказывается, 75 г. твердых отходов в пересчете на одного человека попадают в океан, а в мире живет
более 7 миллиардов человек.27.
« Вода – у тебя нет ни цвета, ни вкуса, ни запаха,тебя невозможно описать, тобою наслаждаются, не
ведая, что ты такое.
Нельзя сказать, что ты необходима для жизни:
ты – сама жизнь!»
Антуан Сент – Экзюпери
28.
29.
WAY!Научно-фантастическое будущее
медленно, но верно пробирается в наши
дома. И вот вы ужу запросто можете
приобрести себе часы, которые
получают электроэнергию для своей
работы из обыкновенной воды.
Как же работают эти чудо -часы?
Внутри находится конвертер, который
«извлекает»электроны из молекул
жидкости, и работает как топливная
ячейка для часов. Расход воды очень
небольшой. Сообщается что одной
заправки резервуара хватит на
«несколько недель» бесперебойной
работы.
30.
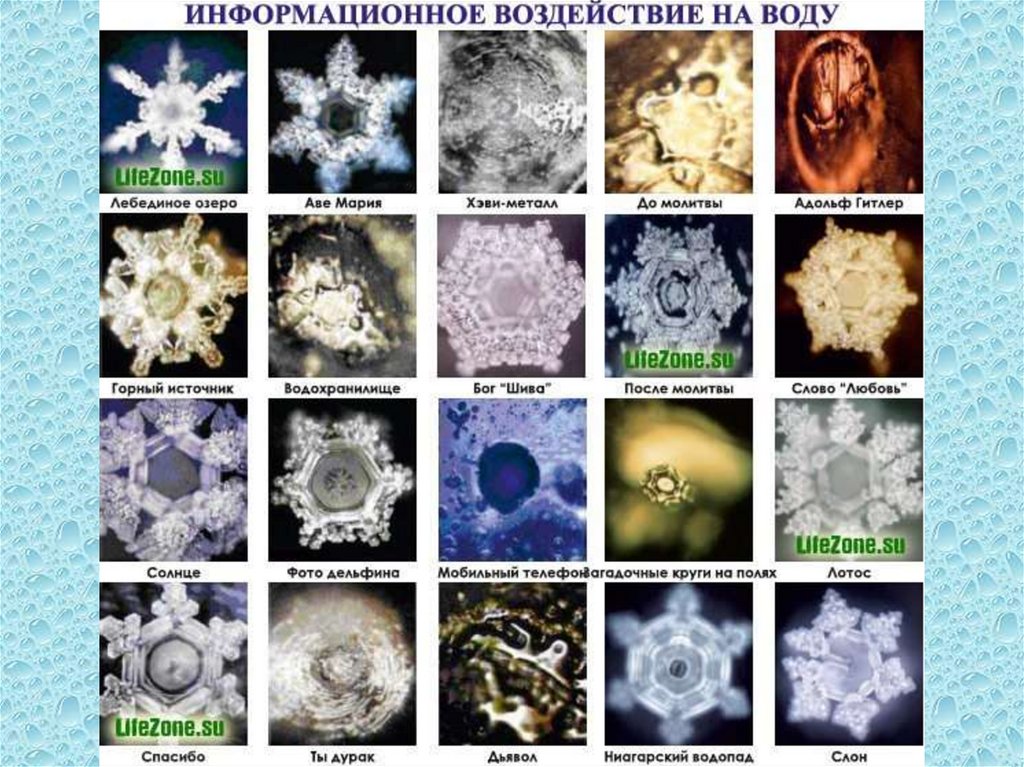
NB!Японский исследователь Масару Эмото (Masaru
Emoto) приводит удивительные доказательства
информационных свойств воды. За время работы он сделал
более 10000 фотографий, некоторые из них опубликованы в
его книгах «The Messages from Water» 1, 2 и «Water knows the
answer.» Доктор Эмото использовал Анализатор Магнитного
Резонанса (MRA) для нескольких функций, включая
качественный анализ воды. Он заметил, что никакие два
образца воды не образуют абсолютно похожих кристаллов, и
что форма кристаллов отражает свойства воды.
Гимн Москвы
Гимн России
Антарктический лед
31.
Ключевая водаТяжелый рок
Вода перед Крещением
Музыка Бетховена
Вода после Крещения
Родник в Тропарево
32.
33.
34.
35.
36.
Задание №1Закончите уравнения реакций,
расставьте коэффициенты:
а) Li2O + H2O →
б) Mg + H2O →
в) SO3 + H2O →
г) SiO2 + H2O →
37.
Задание №2Составьте уравнения реакций
взаимодействия с водой следующих
веществ:
а) натрий;
б) свинец; в) медь ;
г) литий;
д) железо; ж) серебро.
Запишите реакции, расставьте
коэффициенты, укажите названия
образующихся веществ.
38.
Задание №1Укажите физическое свойство воды:
1) голубой цвет 2) имеет приятный запах
3) температура кипения 100 °C
4) имеет вкус
Задание№2
С водой могут вступать в реакцию
оба вещества пары
1) H2, Na
2) CuO, Ca
3) CO2 , P2O5
4) N2 , Fe
39.
Задание№3В процессе взаимодействия двух веществ
образовались гидроксид натрия и водород.
Какие вещества вступили в реакцию?
1) оксид натрия и вода
2) натрий и вода
3) натрий и соляная кислота
4) оксид натрия и соляная кислота
40.
Задание№4Выберите формулу гидроксида, который
можно получить реакцией
соответствующего оксида с водой:
1) H2SiO3 2) Ba(OH)2 3) Cu(OH)2 4) AI(OH)3
Задание№5
Сумма коэффициентов в уравнениях
реакций воды с натрием и воды с оксидом
лития соответственно равна
1) 7 и 3 2) 6 и 3 3) 4 и 4 4) 7 и 4
41.
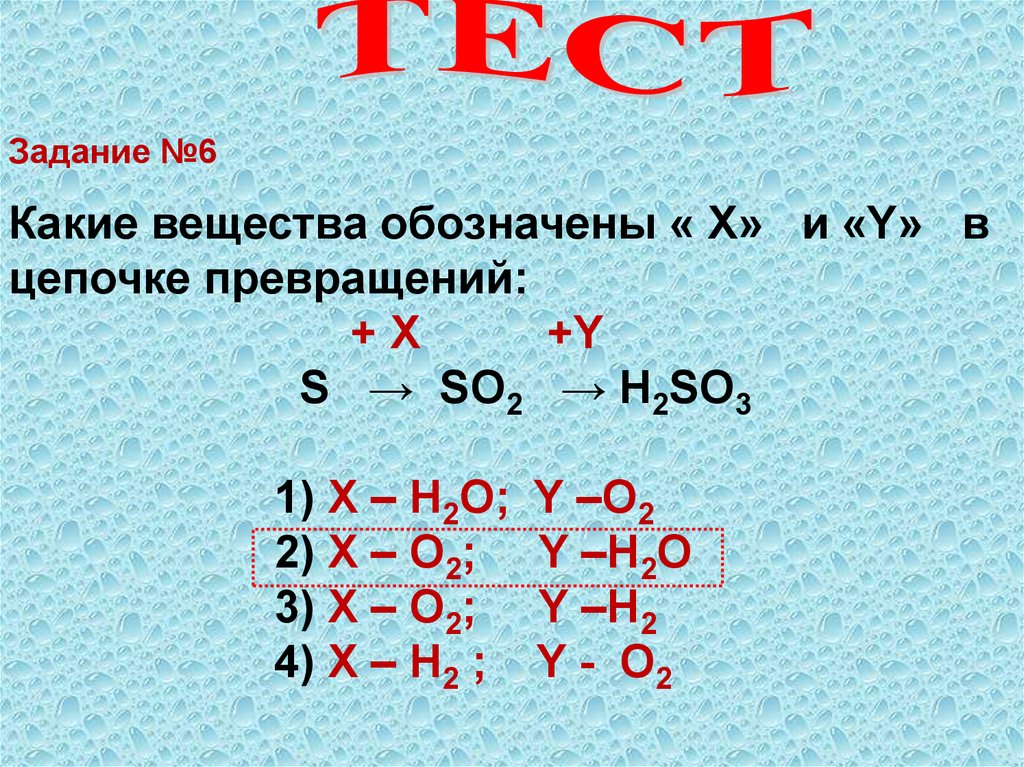
Задание№6Какие вещества обозначены « Х» и «Y» в
цепочке превращений:
+X
+Y
S → SO2 → H2SO3
1) X – H2O; Y –O2
2) X – O2; Y –H2O
3) X – O2; Y –H2
4) X – H2 ; Y - O2
42.
43.
Задание №1Укажите физическое свойство воды:
1) голубой цвет 2) имеет приятный запах
3) температура кипения 100 °C
4) имеет вкус
Задание№2
С водой могут вступать в реакцию
оба вещества пары
1) H2, Na
2) CuO, Ca
3) CO2 , P2O5
4) N2 , Fe
44.
Задание№3В процессе взаимодействия двух веществ
образовались гидроксид натрия и водород.
Какие вещества вступили в реакцию?
1) оксид натрия и вода
2) натрий и вода
3) натрий и соляная кислота
4) оксид натрия и соляная кислота
45.
Задание№4Выберите формулу гидроксида, который
можно получить реакцией
соответствующего оксида с водой без t0:
1) H2SiO3 2) Ba(OH)2 3) Cu(OH)2 4) AI(OH)3
Задание№5
Сумма коэффициентов в уравнениях
реакций воды с натрием и воды с оксидом
лития соответственно равна
1) 7 и 3 2) 6 и 3 3) 4 и 4 4) 7 и 4
46.
Задание №6Какие вещества обозначены « Х» и «Y» в
цепочке превращений:
+X
+Y
S → SO2 → H2SO3
1) X – H2O; Y –O2
2) X – O2; Y –H2O
3) X – O2; Y –H2
4) X – H2 ; Y - O2
47.
Самостоятельная работаЗадание№1
Напишите уравнения возможных реакций с
водой следующих веществ:
с водой реагируют те оксиды,
а) оксид азота (V) которым соответствуют
растворимые гидроксиды- щелочи:
б) кальций
например, оксид бария - гидроксид
в) оксид цинка
бария ( растворимое основание)
г) оксид натрия
оксид кремния (IV) не реагирует, т. к.
ему соответствует н/р кремниевая
д) медь
к-та
е) карбид кальция оксид алюминия не реагирует, т. к.
ему соответствует н/р основание
Назовите вещества и укажите в каждом
случае тип химической реакции.
48.
Самостоятельная работаЗадание№2
Запишите уравнения реакций, с помощью
которых можно осуществить следующие
превращения:
1) Ca --> CaO --> Ca(OH)2 --> CaCl2
2) H2O --> O2 --> P2O5 --> H3PO4 --> Na3PO4
3) Ba --> BaO --> Ba(OH)2 --> Ba(NO3)2
4) Fe(OH)3 --> H2O --> O2 --> SO2 --> H2SO3.
49.
Самостоятельная работаЗадание№3
Решите задачу:
1.Сколько граммов гидроксида натрия
образуется при взаимодействии 2,3 г
натрия с водой?
Ответ: 4 г
2.Какой объем кислорода (при н.у.)
выделится при разложении 0,5 моль воды
H2O?
Ответ: 5,6 л
50. Рефлексия
1.На уроке я работал…2.Своей работой на уроке я…
3.Урок для меня показался…
4.За урок я…
5.Мое настроение…
6.Материал урока мне был…
активно, доволен, коротким, не устал,
полезен, стало лучше, понятен, интересен,
легким.
51.
Домашнее заданиеРазобрать
конспект.
Повторить параграф: § 5.1-5.2
Выполнить задания:
упр. 7, стр.115;
упр.3,2* (раб. в группе) стр.118;












































 chemistry
chemistry








