Similar presentations:
Основания
1.
Общая характеристика оснований• В 1754 году французский
химик Г. Руэль (1703–
1770) ввёл термин
«основание», подразумевая,
что к соединениям данного
класса относится любое
вещество, которое способно
взаимодействовать с
кислотами, образуя соли
2.
• Основаниями называют сложные вещества,в состав которых входят металлические
химические элементы, соединённые с
одной или несколькими гидроксогруппами
(группами атомов −OH)
3.
Исходя из этого, общую химическуюформулу оснований можно изобразить
следующим образом:
• M(OH)n,
• где M — знак металлического химического
элемента,
• а n — индекс, численно совпадающий с
валентностью металла.
4.
• Название основания состоит из слова«гидроксид» и названия металлического
химического элемента в родительном падеже.
Если металлический элемент имеет
переменную валентность, то последняя
указывается римскими цифрами в скобках без
пробела сразу же после названия металла.
Пример:
• NaOH — гидроксид натрия,
• Fe(OH)2 — гидроксид железа(II),
• Fe(OH)3 — гидроксид железа(III).
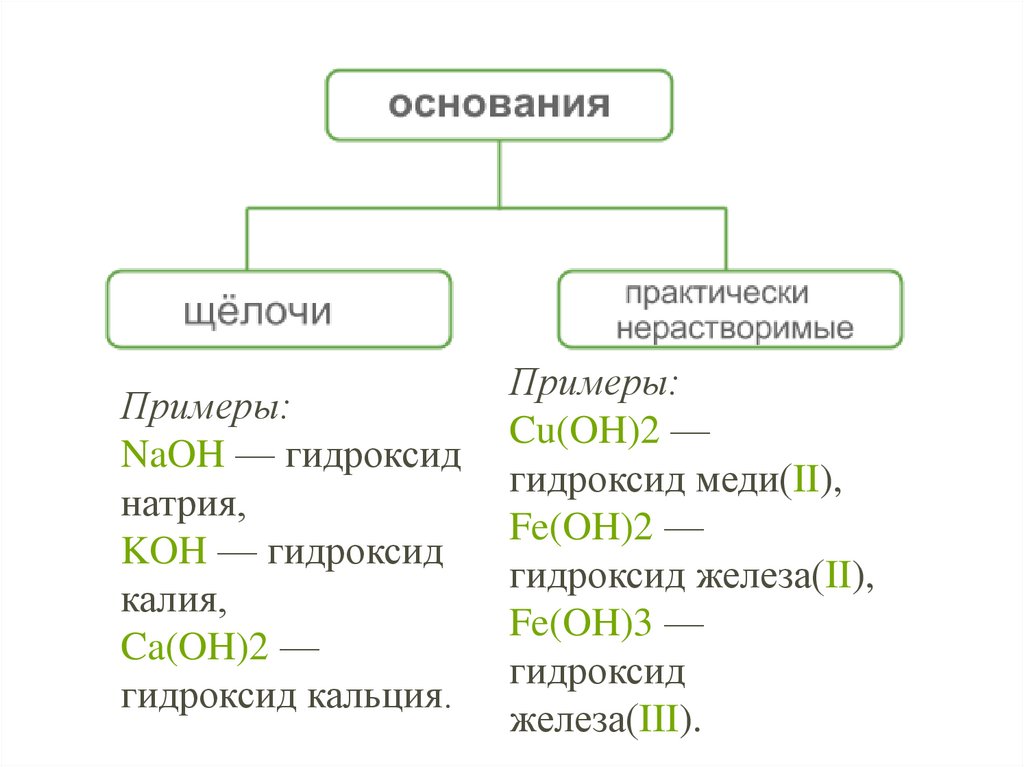
5.
Примеры:NaOH — гидроксид
натрия,
KOH — гидроксид
калия,
Ca(OH)2 —
гидроксид кальция.
Примеры:
Cu(OH)2 —
гидроксид меди(II),
Fe(OH)2 —
гидроксид железа(II),
Fe(OH)3 —
гидроксид
железа(III).
6.
Физические свойства оснований• При обычных условиях основания
(гидроксиды металлов) являются твёрдыми
кристаллическими веществами. Они
нелетучи и не имеют запаха
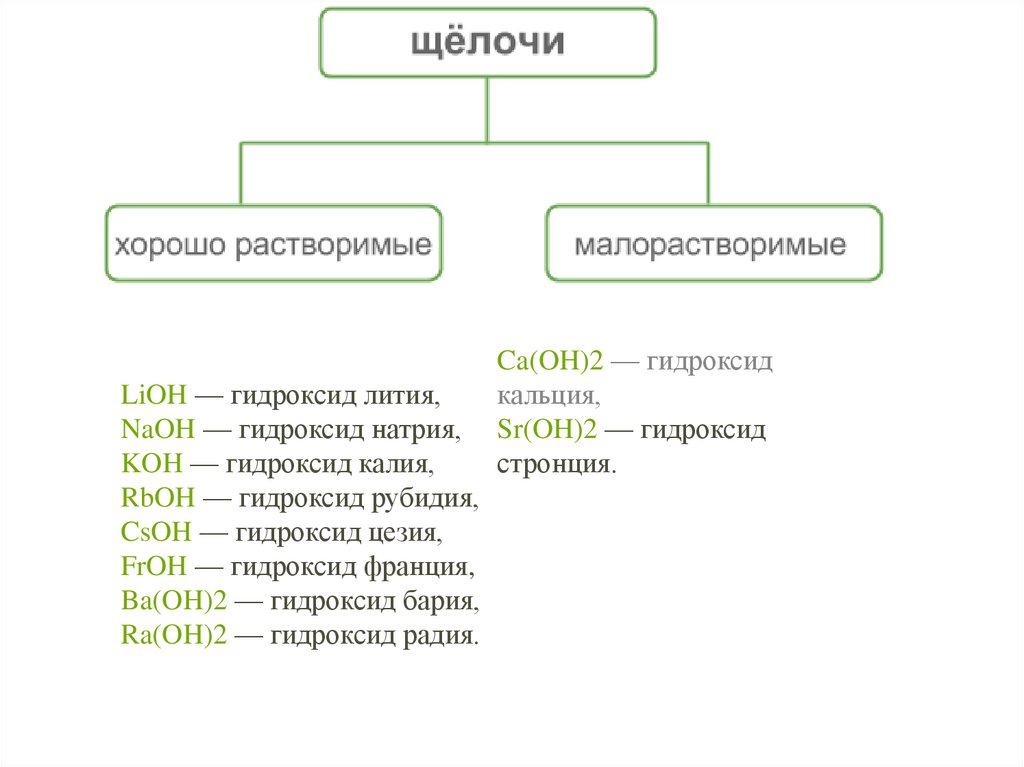
7.
LiOH — гидроксид лития,NaOH — гидроксид натрия,
KOH — гидроксид калия,
RbOH — гидроксид рубидия,
CsOH — гидроксид цезия,
FrOH — гидроксид франция,
Ba(OH)2 — гидроксид бария,
Ra(OH)2 — гидроксид радия.
Ca(OH)2 — гидроксид
кальция,
Sr(OH)2 — гидроксид
стронция.
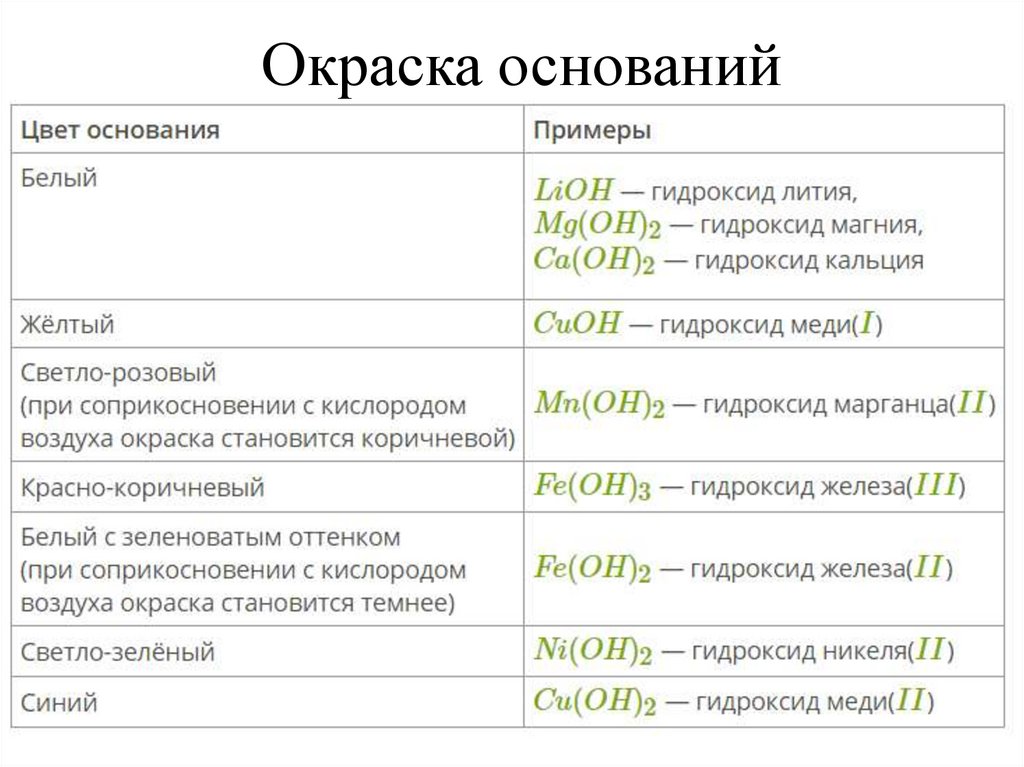
8.
Окраска оснований9.
Химические свойства оснований• 1. Кристаллы щелочей при растворении
в воде полностью диссоциируют
A) NaOH→Na+ +OH−
Б) Ca(OH)2→Ca2++2OH−
10.
Изменение окраски индикаторов врастворах щелочей
11.
12.
Щёлочи взаимодействуют скислотами, образуя соль и воду
• Реакции обмена между щелочами и
кислотами называют реакциями
нейтрализации
• NaOH+HCl→NaCl+H2O
• Ca(OH)2+2HNO3→Ca(NO3)2+2H2O
13.
Взаимодействие гидроксиданатрия с соляной кислотой
14.
Щёлочи взаимодействуют скислотными оксидами, образуя соль
и воду
• Ca(OH)2+CO2→CaCO3↓+H2O
• 6NaOH+P2O5→2Na3PO4+3H2O
15.
Щёлочи могут взаимодействовать срастворимыми в воде солями
• 2NaOH+CuSO4→Na2SO4+Cu(OH)2↓
• Ca(OH)2+Na2CO3→CaCO3↓+2NaOH
16.
Малорастворимые щёлочи принагревании разлагаются на оксид
металла и воду
• Ca(OH)2→t° CaO+H2O↑
17.
Общие химические свойстванерастворимых оснований
• Нерастворимые основания
взаимодействуют с кислотами, образуя соль
и воду
• Cu(OH)2+H2SO4→CuSO4+2H2O
• Fe(OH)3+3HCl→FeCl3+3H2O
18.
Взаимодействие гидроксидажелеза(III) с соляной кислотой
19.
Некоторые нерастворимые основания могутвзаимодействовать с некоторыми кислотными
оксидами, образуя соль и воду.
• Cu(OH)2+SO3→t° CuSO4+H2O.
20.
Нерастворимые основания принагревании разлагаются на оксид
металла и воду
• Cu(OH)2→t° CuO+H2O
• 2Fe(OH)3→t° Fe2O3+3H2O
21.
Разложение гидроксида меди(II)22.
• Техническое название гидроксидакальция — гашёная известь, или пушонка
• Взвесь (суспензия) гидроксида кальция в
воде называют известковым молоком
• прозрачный раствор этого вещества носит
название известковой воды.
• Гидроксид натрия – едкий
натр, каустическая сода
• Гидроксид калия – едкое кали
23.
• Щёлочи при попадании разъедают кожу ислизистые ткани.
• При обращении с ними особенно следует
беречь глаза, поскольку эти вещества
вызывают необратимое разрушение
зрительного нерва, следствием чего может
быть полная потеря зрения.
24.
• Если же щёлочь всё-таки попала наповерхность тела, поражённое место
нужно хорошенько прополоскать струёй
проточной воды,
• если попала в глаз — также непрерывно
промывать проточной водой не менее 35–
40 минут, а также обратиться за
медицинской помощью.
25.
Получение оснований• Щёлочи образуются при взаимодействии
щелочных и щелочноземельных металлов с
водой
• 2Na+2H2O→2NaOH+H2↑
• Ca+2H2O→Ca(OH)2+H2↑
26.
Взаимодействие натрия с водой27.
Щёлочи образуются при взаимодействии оксидовщелочных и щелочноземельных металлов с
водой. При этом протекает реакция соединения.
• Li2O+H2O→2LiOH
• CaO+H2O→Ca(OH)2
28.
В промышленности гидроксид натрия и калияполучают путём электролиза: пропускают
постоянный электрический ток через раствор
хлорида натрия или калия.
• 2NaCl+2H2O→электр. ток2NaOH+H2↑+Cl2↑
29.
• Чтобы получить нерастворимое основание,следует к раствору соли соответствующего
металла добавить раствор щёлочи
• CuCl2+2KOH→Cu(OH)2↓+2KCl
• FeCl3+3NaOH→Fe(OH)3↓+3NaCl





























 chemistry
chemistry