Similar presentations:
Гальванические элементы
1. Электрохимия
Гальванические элементы1
2. План лекции
• Общие понятия• Расчет ЭДС гальванических элементов
• Диффузионный потенциал
• Мембранный потенциал
• Потенциометрия
2
3. Гальванический элемент
• Устройство, состоящее из двухэлектродов, дающее возможность
получать электрический ток в результате
химической реакции
3
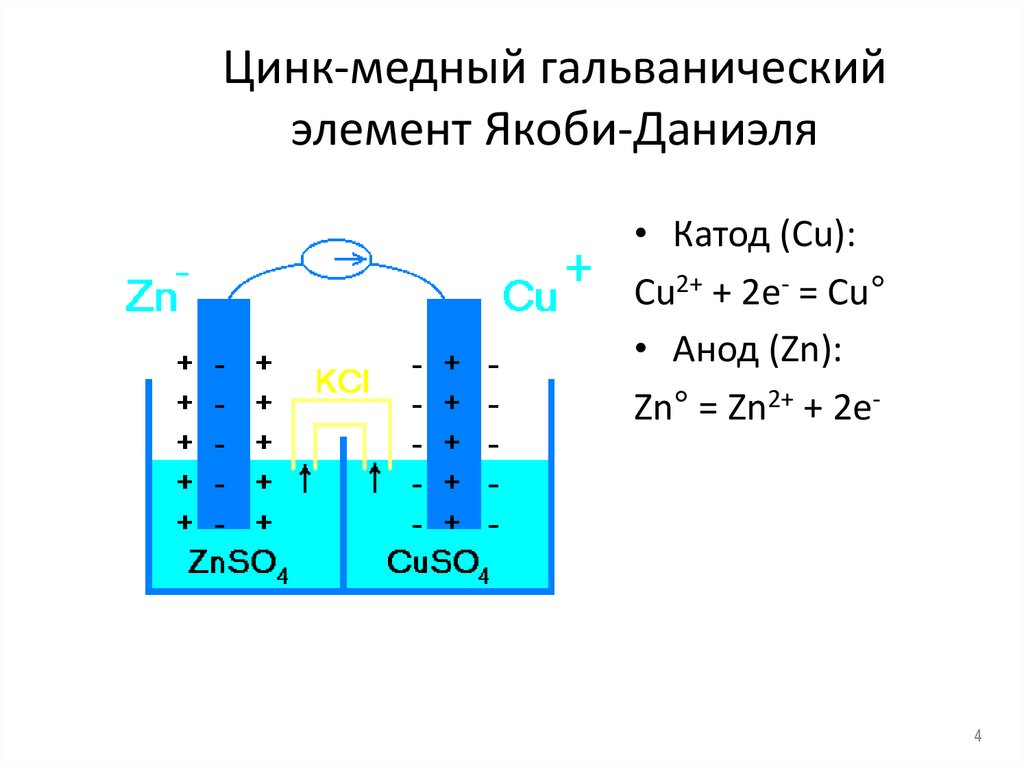
4. Цинк-медный гальванический элемент Якоби-Даниэля
• Катод (Сu):Cu2+ + 2e- = Cu°
• Анод (Zn):
Zn° = Zn2+ + 2e-
4
5. ЭДС гальванического элемента, составленного из двух металлов
• Из потенциала положительно заряженного электродавычитают потенциал отрицательно заряженного
электрода
ЭДС = Еcu - ЕZn
0,2T
Еcu = E°Cu + -------- lg a(Cu2+)
n
0,2T
ЕZn = E°Zn + -------- lg a(Zn2+)
n
0,2T
a(Cu2+)
ЭДС = E°Cu - E°Zn + ----------- lg ----------n
a(Zn2+)
5
6.
ЭДС зависит от:• Положения металлов в ряду напряжений
• Соотношения ионов взятых растворов
6
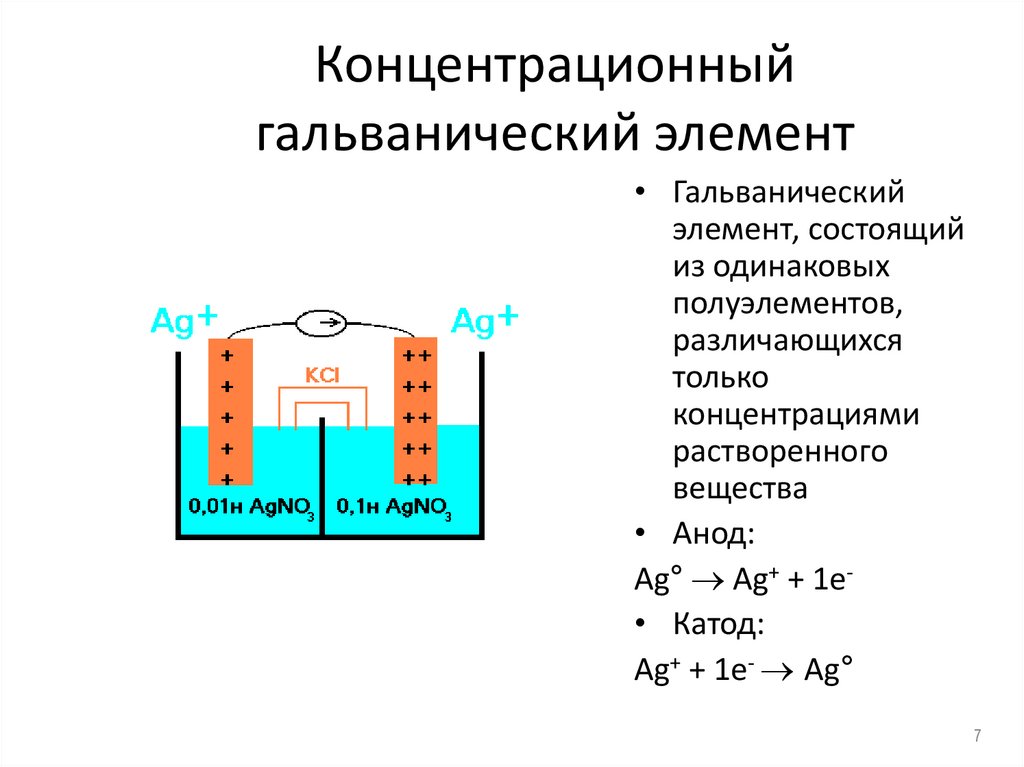
7. Концентрационный гальванический элемент
• Гальваническийэлемент, состоящий
из одинаковых
полуэлементов,
различающихся
только
концентрациями
растворенного
вещества
• Анод:
Ag° Ag+ + 1e• Катод:
Ag+ + 1e- Ag°
7
8. ЭДC концентрационного гальванического элемента
ЭДС = ЕAg1 – EAg20,2T
ЕAg1 = E°Ag1 + -------- lg a(Ag1)
n
0,2T
ЕAg2 = E°Ag2 + -------- lg a(Ag2)
n
0,2T
a(Ag1)
ЭДС = ----------- lg ----------n a(Ag2)
ЭДС элемента зависит от соотношения активностей ионов
и быстро падает во времени
8
9.
Измеряя ЭДС концентрационного элементаможно практически определить:
• Активность ионов
• Коэффициент активности ионов
• Неизвестную концентрацию раствора
а=f C
9
10. Пример
Цепь из двух водородных электродов: нормального –электрод сравнения и заполненного исследуемым
раствором с неизвестной концентрацией Н+ – электрод
определения
ЭДС = ЕН° – ЕНХ;
ЕН° = 0;
0,2Т
ЕНХ = ЕН° + ---------lg[H+]
n
0,2Т
ЭДС = 0 – 0 – ---------lg[H+];
ЭДС = 0,2Т рН
n
ЭДС
рН = ---------0,2Т
10
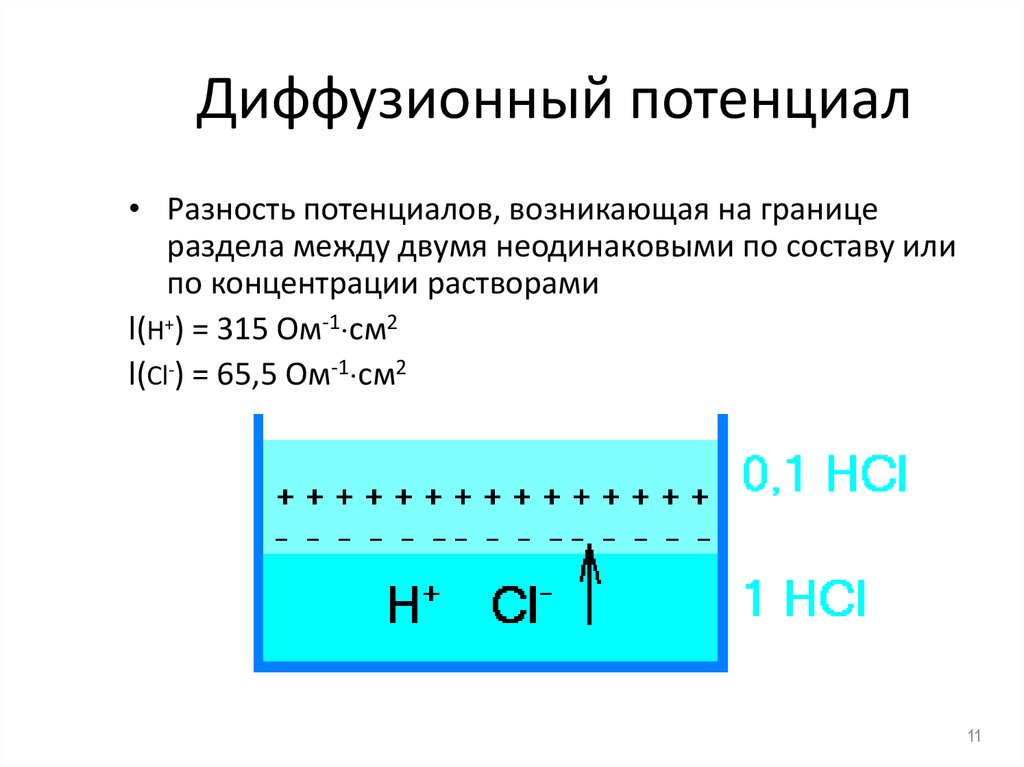
11. Диффузионный потенциал
• Разность потенциалов, возникающая на границераздела между двумя неодинаковыми по составу или
по концентрации растворами
l(H+) = 315 Ом-1 см2
l(Cl-) = 65,5 Ом-1 см2
11
12.
Диффузионный потенциал усредняет скоростидвижения ионов при сохранении скачка
потенциала на границе раздела растворов
разной концентрации
В результате движения ионов в
электролитическом мостике возникает
диффузионный потенциал, направленный
противоположно ЭДС гальванического
элемента
Его влияние устраняют, включая между
растворами электролитов насыщенный
раствор KCl или KNO3, так как подвижности
ионов примерно одинаковы:
l (K+) = 64,4 Ом-1 см2
l (Cl-) = 65,5 Ом-1 см2
12
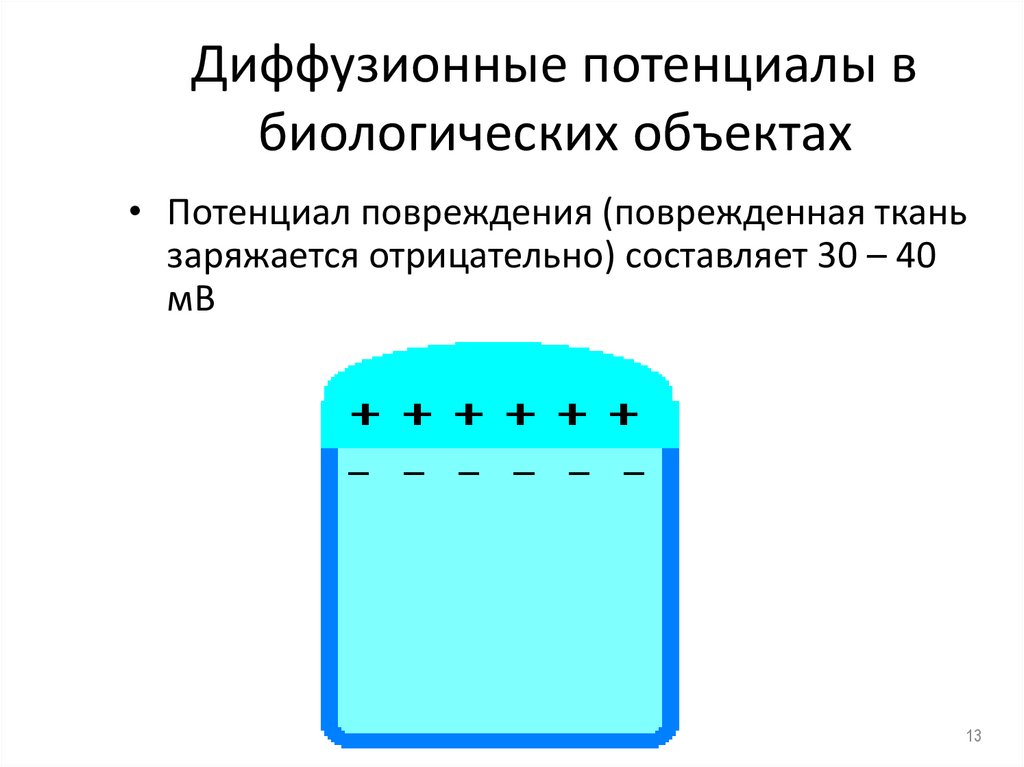
13. Диффузионные потенциалы в биологических объектах
• Потенциал повреждения (поврежденная тканьзаряжается отрицательно) составляет 30 – 40
мВ
13
14. Межфазовые потенциалы
Возникают:• На границе раздела между двумя
несмешивающимися жидкостями;
обусловлены неодинаковой
растворимостью в них веществ
• На поверхности макромолекул в
результате избирательного сродства
поверхности к различным ионам
14
15. Мембранный потенциал
• Потенциал, возникающий на мембране сизбирательной проницаемостью
(пропускающей только ионы одного
знака), разделяющей два раствора
различного состава
– СОО- : катионы
– NH3+ : анионы
15
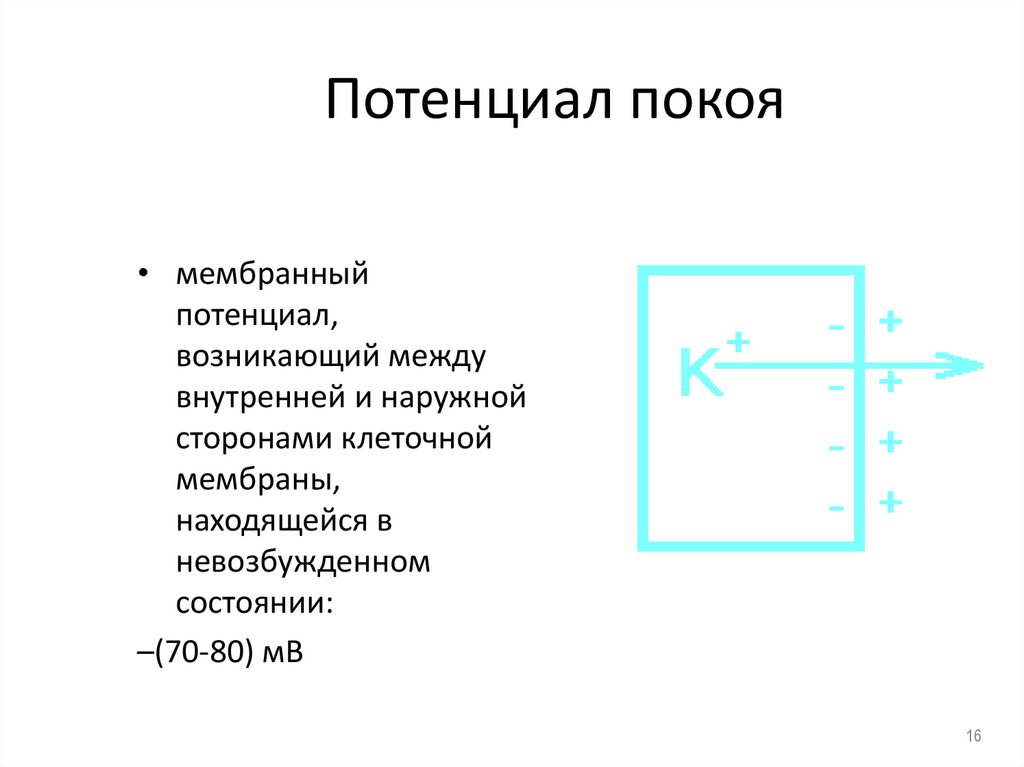
16. Потенциал покоя
• мембранныйпотенциал,
возникающий между
внутренней и наружной
сторонами клеточной
мембраны,
находящейся в
невозбужденном
состоянии:
–(70-80) мВ
16
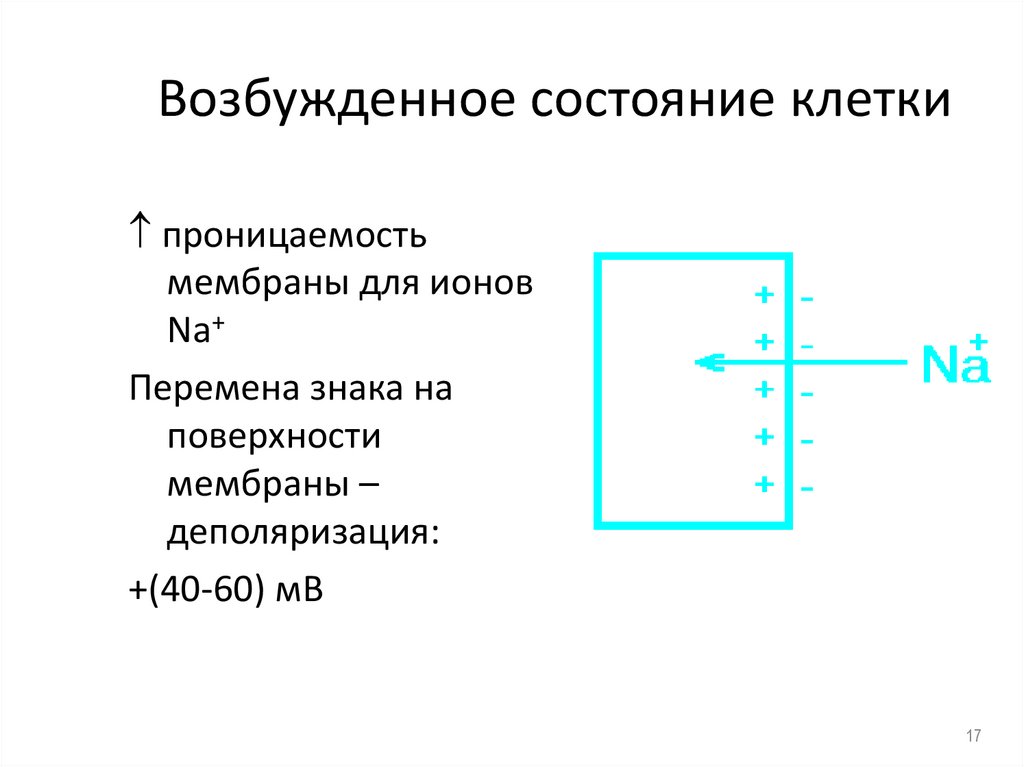
17. Возбужденное состояние клетки
проницаемостьмембраны для ионов
Na+
Перемена знака на
поверхности
мембраны –
деполяризация:
+(40-60) мВ
17
18. Потенциал действия
• Разность между потенциалом покоя и зарядоммембраны в возбужденном состоянии (амплитуда
колебания мембранного потенциала)
(120 – 140 мВ)
В результате активной работы К+ / Na+ насоса
наступает реполяризация – клетка возвращается в
состояние покоя
18
19. Потенциометрия
• Физико-химический метод анализа, воснове которого лежит измерение ЭДС
цепи, составленной из индикаторного
электрода и электрода сравнения
19
20. Методы потенциометрии
• Прямые – определение активности иконцентрации ионов или веществ в
растворе
• Косвенные – определение концентрации
неизвестного вещества при добавлении к
нему другого (потенциометрическое
титрование)
20
21. Прямая потенциометрия
• Электроды сравнения – электроды, потенциал которыхпрактически постоянен, легко воспроизводим и не
зависит от протекания побочных реакций
• Электроды определения – электроды, потенциал
которых зависит от активности (концентрации)
анализируемых ионов и практически не зависит от
содержания других ионов в растворе
Используют для измерения рН, концентрации
биологически активных ионов: H+, Na+, K+, NH4+, Ca2+,
NO3-, различных веществ в биологических средах
21
22. Индикаторные электроды
Мембранные: ионоселективные – способныопределять в растворе концентрацию одного
иона
– С твердыми мембранами
– Стеклянный
– С жидкими мембранами
Молекулярно-селективные – позволяют
определять концентрацию молекул вещества
(ферментные – мембрана содержит
определенный фермент)
22
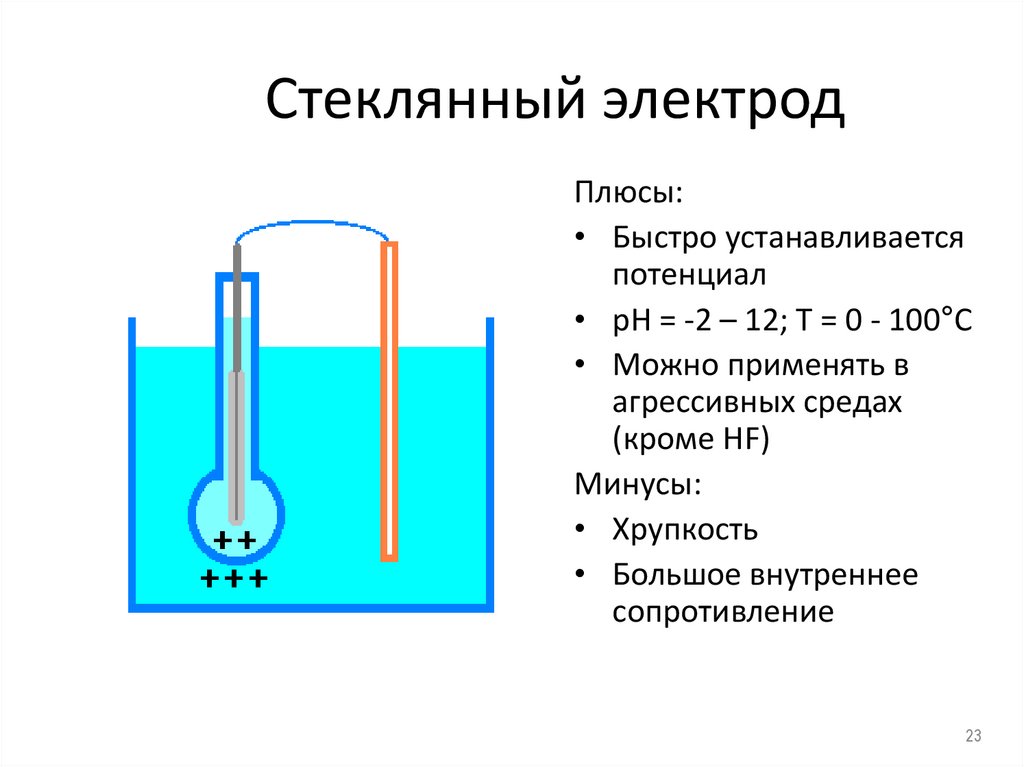
23. Стеклянный электрод
Плюсы:• Быстро устанавливается
потенциал
• рН = -2 – 12; Т = 0 - 100°С
• Можно применять в
агрессивных средах
(кроме HF)
Минусы:
• Хрупкость
• Большое внутреннее
сопротивление
23
24. Ионоселективные электроды
• Действие основано на возникновениимембранного потенциала на мембране с
избирательной чувствительностью к
данному иону
(калиевый, нитратный)
Ионоселективных электродов с четкой
выраженностью к определенным ионам
насчитывается более 20 (К+, Ca2+, Pb2+,
Cu2+, Cl-, NO3-, ClO4-, CNS-, S2-, CN-, F- и др.)
24
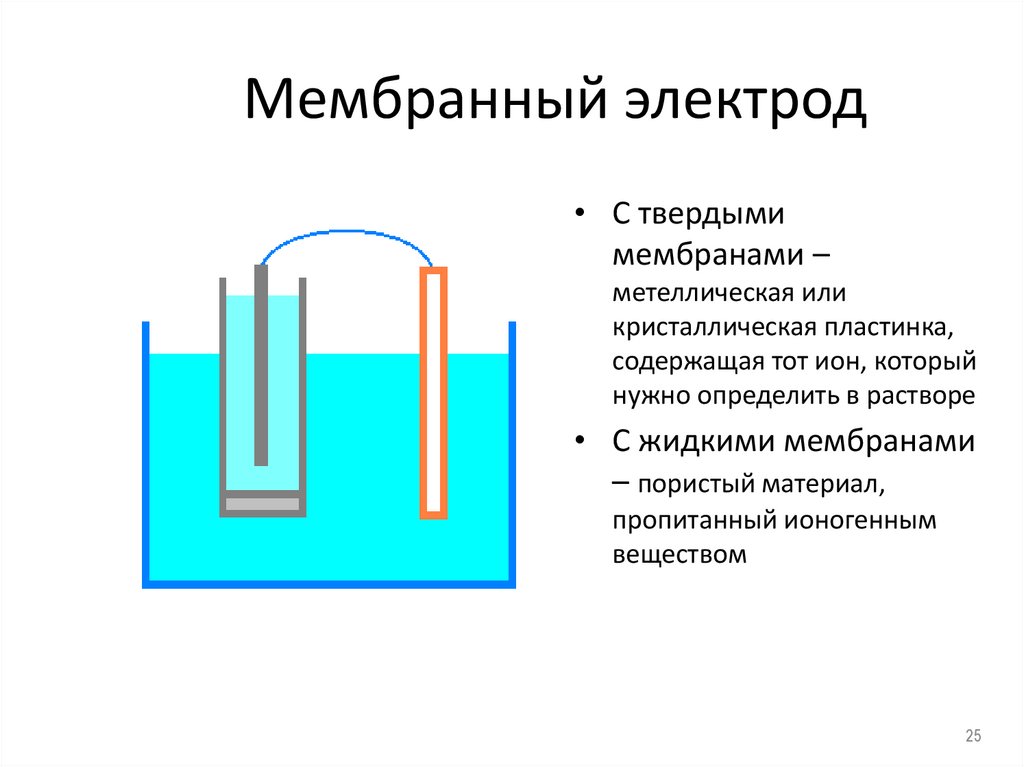
25. Мембранный электрод
• С твердымимембранами –
метеллическая или
кристаллическая пластинка,
содержащая тот ион, который
нужно определить в растворе
• С жидкими мембранами
– пористый материал,
пропитанный ионогенным
веществом
25
26. Ферментные электроды
• Мочевино-селективныйуреаза
СО(NH2)2
NH4+
• Пенициллино-селективный
пенициллиназа
пенициллиновая
кислота
Позволяют определять глюкозу, антибиотики,
витамины, гормоны, аминокислоты и другие
БАВ
Пенициллин
26
27. Косвенная потенциометрия (потенциометрическое титрование)
• График зависимостиЭДС цепи от объема
титранта
• График изменения
приращения
потенциала на
единицу
добавляемого
титранта
27
28. Значение потенциометрических методов исследования
• Определение концентрации веществ в мутныхи окрашенных растворах
• Определение концентрации нескольких
веществ в одной порции исследуемого
раствора
• Измерение рН среды (рН-метры, иономеры,
полярографы)
• Определение констант диссоциации слабых
кислот, аминокислот, белков, нуклеиновых
кислот
• Определение констант нестойкости
комплексных соединений
28




















 chemistry
chemistry








