Similar presentations:
Введение в электрохимические методы анализа (семинар 1)
1.
ВВЕДЕНИЕ ВЭЛЕКТРОХИМИЧЕСКИЕ
МЕТОДЫ АНАЛИЗА
1
2.
Электрохимические методы анализаЭкспрессность (быстрота); возможность анализа мутных и
окрашенных растворов, расплавов; широкий диапазон
концентраций (до нг)
Электрохимические реакции –
гетерогенные реакции переноса электронов
или ионов через границу раздела
электропроводящих фаз
Электрод
раствор электролита
2
3.
Электрохимические методы анализа(классификация)
Измеряемый
параметр
Условия
Название метода
Е (В,мВ)
потенциал
I~0
(во внеш.цепи)
E = f(а)
Потенциометрия
Прямая или потенциометрическое
титрование
Вольтамперометрия
I (A,мA)
сила тока
I = f(E)
(полярография)
Прямая или амперометрическое
титрование
Q, (Кл)
количество
электричества
E=const
или
I=const
Кулонометрия
Прямая или кулонометрическое
титрование
3
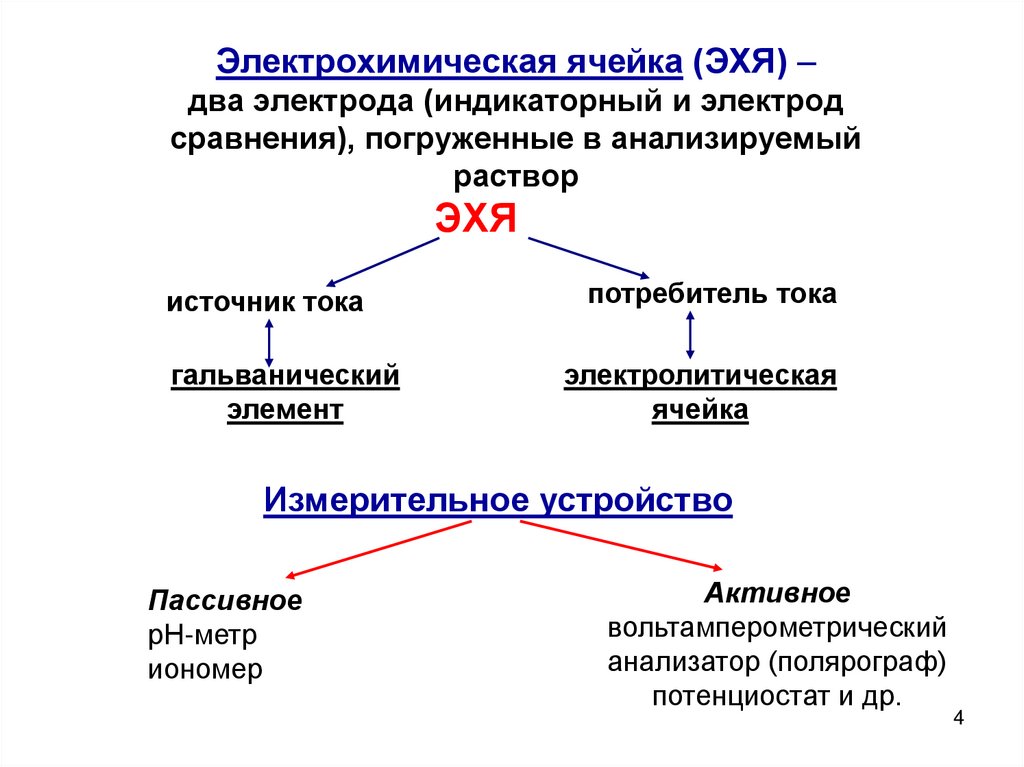
4.
Электрохимическая ячейка (ЭХЯ) –два электрода (индикаторный и электрод
сравнения), погруженные в анализируемый
раствор
ЭХЯ
источник тока
гальванический
элемент
потребитель тока
электролитическая
ячейка
Измерительное устройство
Пассивное
рН-метр
иономер
Активное
вольтамперометрический
анализатор (полярограф)
потенциостат и др.
4
5.
Индикаторный электрод – И.Э.наличие аналитического сигнала (А.С.),
интенсивность А.С.
Должен обратимо реагировать на изменение
концентрации (активности) определяемого компонента
Электрод сравнения – Э.Ср.
Точка отсчета А.С.
Требования к Э.Ср.:
должен иметь: - известный, постоянный потенциал,
- низкое сопротивление,
- низкий диффузионный потенциал
не должен: - зависеть от состава раствора,
- влиять на состав раствора
5
6.
Индикаторные электроды в потенциометрииИ.Э.
металлические
электронная
проводимость
мембранные
ионная
МЕТАЛЛИЧЕСКИЕ ЭЛЕКТРОДЫ
1.Активные (Ag, Cu, Cd…)
а) электроды первого рода
Ag+ + e = Ag0
E = E0 Ag+/Ag + 0,059 lg a Ag+
б) электроды второго рода
AgCl + e = Ag0 + Cl- E = E0 AgCl/Ag – 0,059 lg a Cl-
2.Инертные электроды (Pt, Au…)
Ox + ne = Red
E = E0Ox/Red + 0,059/n lg a Ox/a Red
6
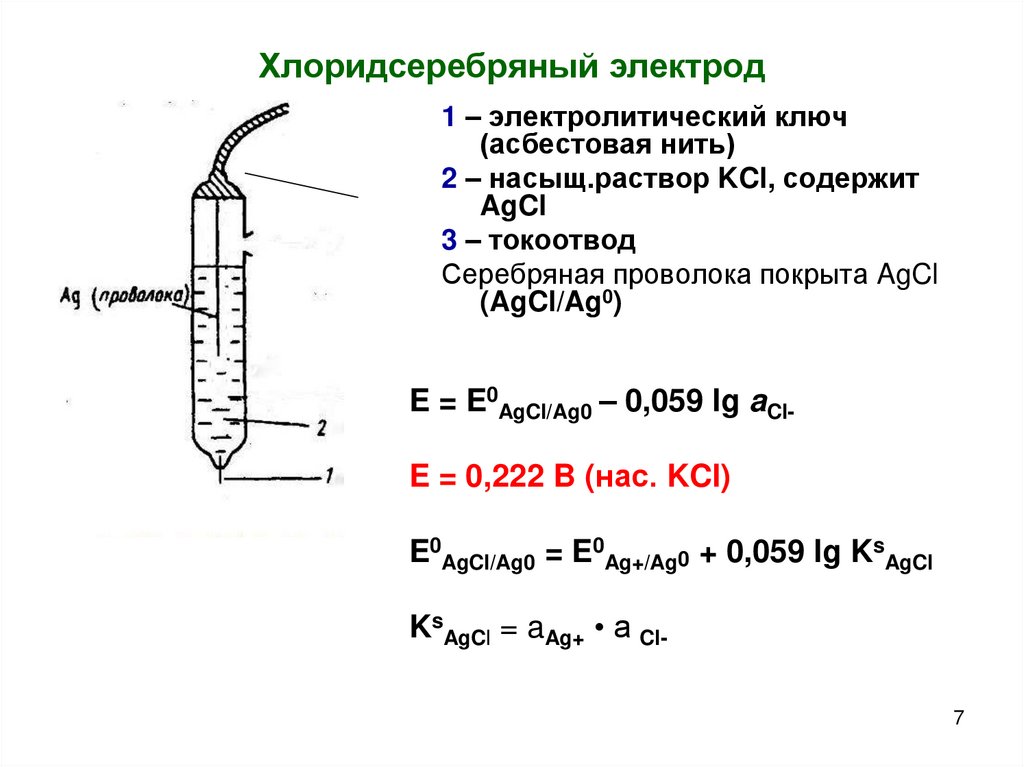
7.
Хлоридсеребряный электрод1 – электролитический ключ
(асбестовая нить)
2 – насыщ.раствор KCl, содержит
AgCl
3 – токоотвод
Серебряная проволока покрыта AgCl
(AgCl/Ag0)
E = E0AgCl/Ag0 – 0,059 lg aClE = 0,222 B (нас. KCl)
E0AgCl/Ag0 = E0Ag+/Ag0 + 0,059 lg KsAgCl
KsAgCl = aAg+ • a Cl7
8.
Ионометрия•Область прямой потенциометрии
•Индикаторный электрод – мембранный ионоселективный электрод
(ИСЭ)
ИСЭ – потенциометрические датчики (сенсоры) для определения
АКТИВНОСТИ некоторых ионов в присутствии других ионов –
отличают определенный ион от других.
СЕНСОР – селективный датчик химического состава, имеющий
малые размеры и работающий автономно.
МЕМБРАНА – слой, разделяющий два раствора с различной
концентрацией электролита, обладающий разной
проницаемостью для компонентов.
8
9.
Прямая потенциометрия с использованиемионоселективных электродов (ИСЭ)
Измерение разности потенциалов между двумя
электродами, погруженными в исследуемый раствор
E = f (aA) при I ≈ 0
̵
Ячейка работает в режиме гальванического элемента
̵
Измерительное устройство – потенциометры с
электронным усилителем сигнала и высоким входным
сопротивлением (до 1012 Ом)
pH-метры
иономеры
̵
̵
9
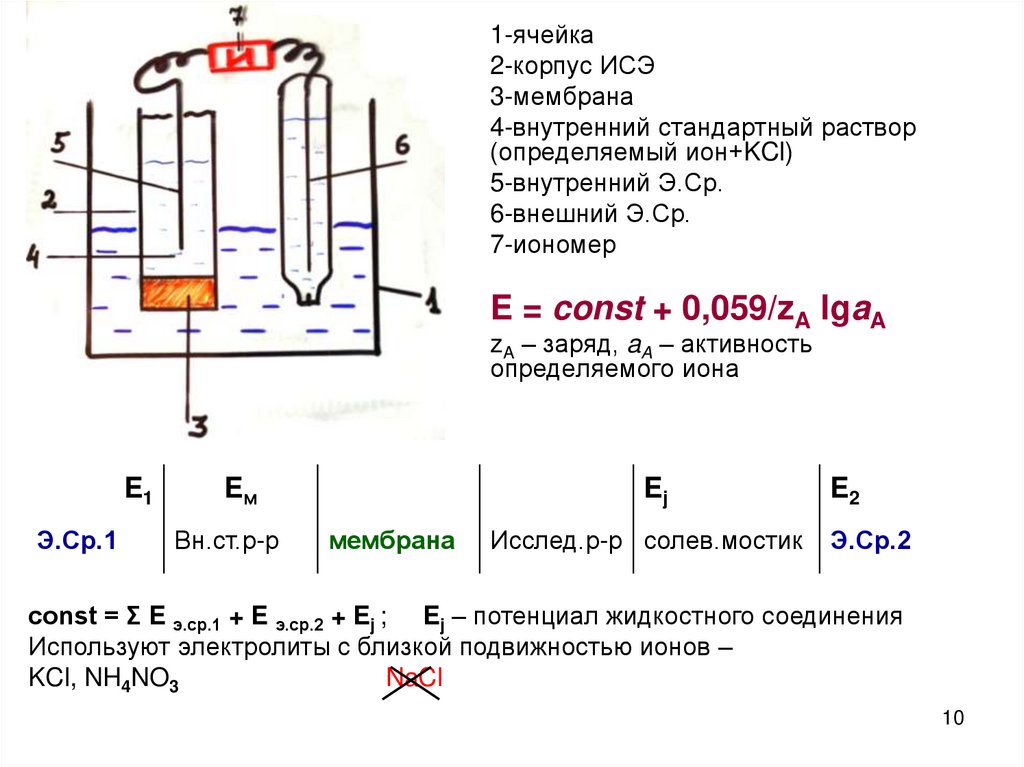
10.
1-ячейка2-корпус ИСЭ
3-мембрана
4-внутренний стандартный раствор
(определяемый ион+KCl)
5-внутренний Э.Ср.
6-внешний Э.Ср.
7-иономер
E = const + 0,059/zA lgaA
zA – заряд, aA – активность
определяемого иона
E1
Э.Ср.1
Eм
Вн.ст.р-р
Ej
мембрана
Исслед.р-р солев.мостик
E2
Э.Ср.2
const = Ʃ E э.ср.1 + E э.ср.2 + Ej ; Ej – потенциал жидкостного соединения
Используют электролиты с близкой подвижностью ионов –
KCl, NH4NO3
NaCl
10
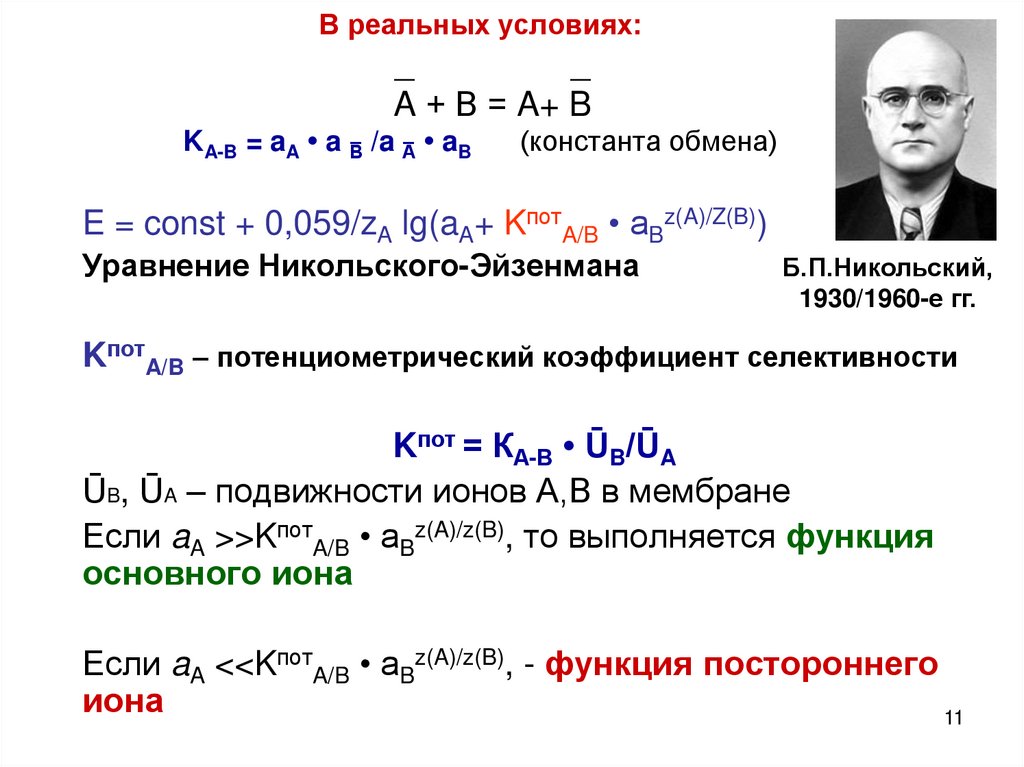
11.
В реальных условиях:_
_
A + В = A+ B
KA-B = aA • a B̅ /a A̅ • aB
(константа обмена)
E = const + 0,059/zA lg(aA+ KпотA/B • aBz(A)/Z(B))
Уравнение Никольского-Эйзенмана
Б.П.Никольский,
1930/1960-е гг.
KпотA/B – потенциометрический коэффициент селективности
Kпот = КА-В • ŪB/ŪA
ŪB, ŪA – подвижности ионов А,В в мембране
Если aA >>KпотA/B • aBz(A)/z(B), то выполняется функция
основного иона
Если aA <<KпотA/B • aBz(A)/z(B), - функция постороннего
иона
11
12.
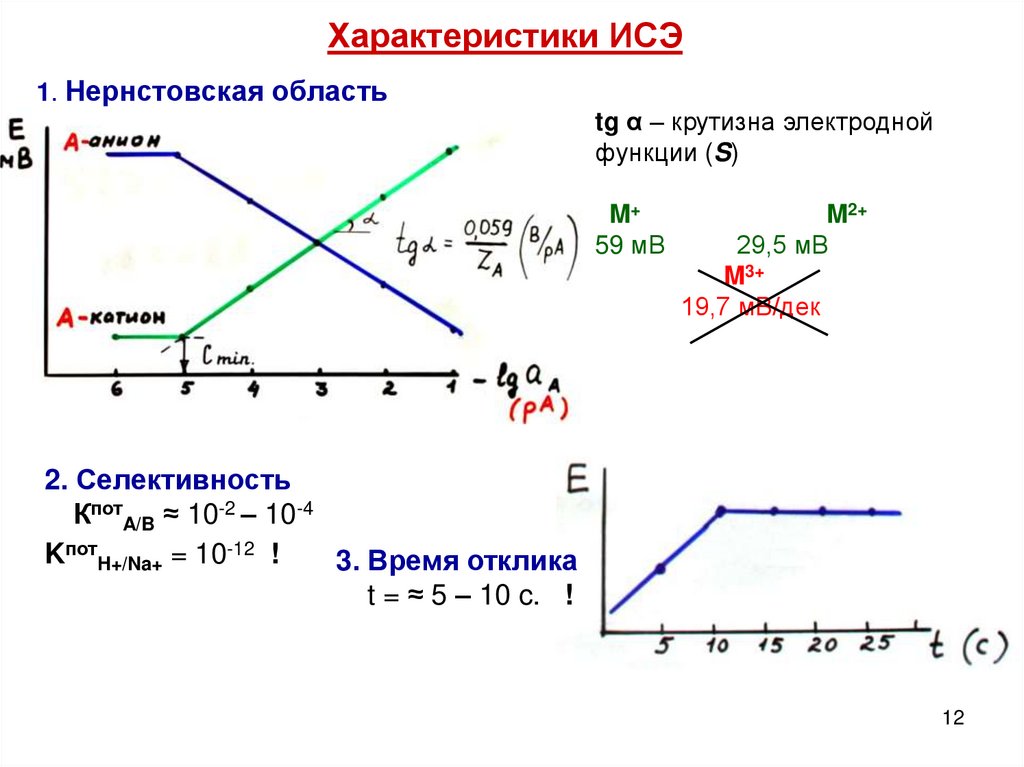
Характеристики ИСЭ1. Нернстовская область
tg α – крутизна электродной
функции (S)
M+
59 мВ
M2+
29,5 мВ
M3+
19,7 мВ/дек
2. Селективность
КпотA/B ≈ 10-2 – 10-4
KпотH+/Na+ = 10-12 !
3. Время отклика
t = ≈ 5 – 10 c. !
12
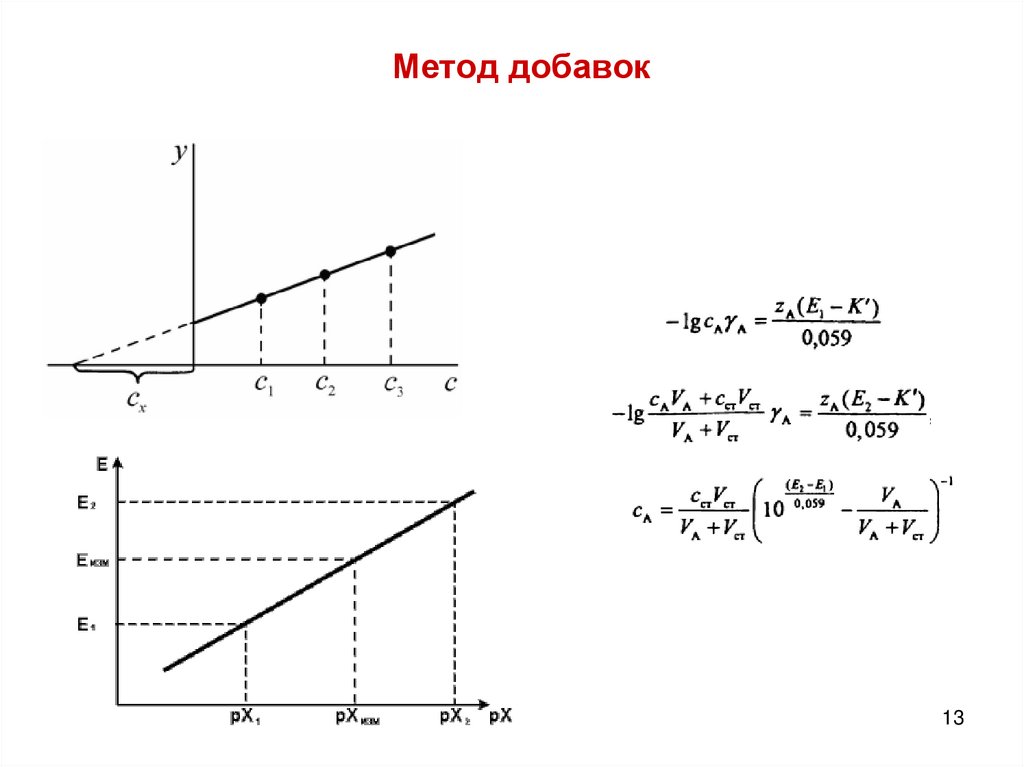
13.
Метод добавок13
14.
Задачи1. Рассчитайте потенциал медного электрода (отн. НКЭ) в растворе,
насыщенном CuA2 , содержащем 1.10-2 М NaA. Катодом или анодом является
этот электрод в ГЭ с НКЭ.
Ео (Сu2+/Cu0) = 0.337 В, Е НКЭ = 0,242 В, Кs = 1,7.10-16.
Решение:
CuA2 ↓ + 2e = Cu0 + 2АЕ= Ео (Сu2+/Cu0) + 0,059/2 lg [Сu2+] = Ео (Сu2+/Cu0) + 0,059/2 lg Кs / [А]2 = - 0,0102 В.
Это отн. СВЭ !
_______|___________|__________________|__________________
─ 0,0102
0 (СВЭ)
0,242 (НКЭ)
(отн. СВЭ)
Е (отн. НКЭ) = ─ 0, 0102 – 0,242= ─ 0,252 В.
ЭДС яч = Ек - Еа >0 (т.к. по условию это ГЭ) значит, медный электрод – анод:
ЭДС = 0,242 – (-0,0102) = 0,252 В.
В противном случае ЭДС = -0,0102 -0,242 = -0,252 В < 0 ! что противоречит условию.
14
15.
2. ЭДС гальванического элемента из НКЭ и Сd – анода в 0,01 М раствореХ- , насыщенном СdХ2 при 25 оС равна 0,971 В. Нарисуйте схему ячейки.
Рассчитайте Кs для СdХ2.
Ео (Сd2+/Cd0) = - 0.403 В , Е НКЭ = 0,242 В.
Решение
Cd | СdХ2 (нас.), Х- (0,010 М) | | НКЭ
ЭДС яч = Ек - Еа
Еа = Ек – Еяч = 0,242 – 0,971 = - 0,729 В
Еа = Ео (Сd2+/Cd0) + 0,059/2 lg Кs/ [Х] 2
-0,729 = -0,403 + 0,0295 lg Кs ─ 0,059lg 0,01
Кs = 8,89 × 10-16
15
16.
3. Потенциал нитрат-селективного электрода в 0,001 М KNO3 при 25 оС равен30 мВ, а в растворе, содержащем 0,001 М KNO3 и 0,01 М К2SO4 22 мв.
Вычислить К пот (NO3/ SO4 ), пренебрегая ионной силой раствора.
Решение:
Для первого раствора в отсутствие сопутствующих ионов:
Е = const - 59 lg 0.001= 30 мВ,
отсюда const = -147 мВ.
Знак «-»!
Для второго раствора:
Е = const - 59 lg ( [NO3] + К пот [SO4]1/2) = -147 - 59 lg (1.10-3 + К пот × 0,011/2) =
22 мВ.
К пот (NO3/ SO4 ) = 3,6 × 10-3
16
17.
4. К 25,0 мл пробы, анализируемой на содержание ионов меди, добавили0,50 мл стандартного раствора с концентрацией 0,1500 М нитрата меди. При
этом потенциал медь-селективного электрода при 30оС изменился от 190 мВ
до 205 мВ. Крутизна электродной функции данного электрода на 3 мВ ниже
теоретической. Каково содержание меди в исследуемом растворе? А.м.
(Cu)= 63,55.
Решение:
Используем для решения формулу для метода добавок, можно разбавление не
учитывать, т.к. соотношение объемов исследуемого раствора и добавки велико и
погрешность от разбавления мала.
Сх = Сs ∙ Vs / (Vx+Vs) ( 10 ΔE/S ─ Vx/(Vx+Vs))-1
где Vs – объем добавки; Vx – объем исследуемой пробы; Сs – концентрация добавки.
Крутизна электродной функции S= 30,0 – 3 = 27 мВ.
ΔЕ = 205 – 190 = 15 мВ
Изменения потенциала и изменение крутизны считаем всегда по модулю!
Сх = 0,15 ∙ 0,5 /25,5 ( 10 15/27 - 25/25,5) -1 = 1,125 × 10-3 М
m= C ∙ V ∙ А.м. = 1,125 × 10-3 ∙ 0,025 ∙ 63,55 = 1,78.10-3 г = 1,78 мг.
17
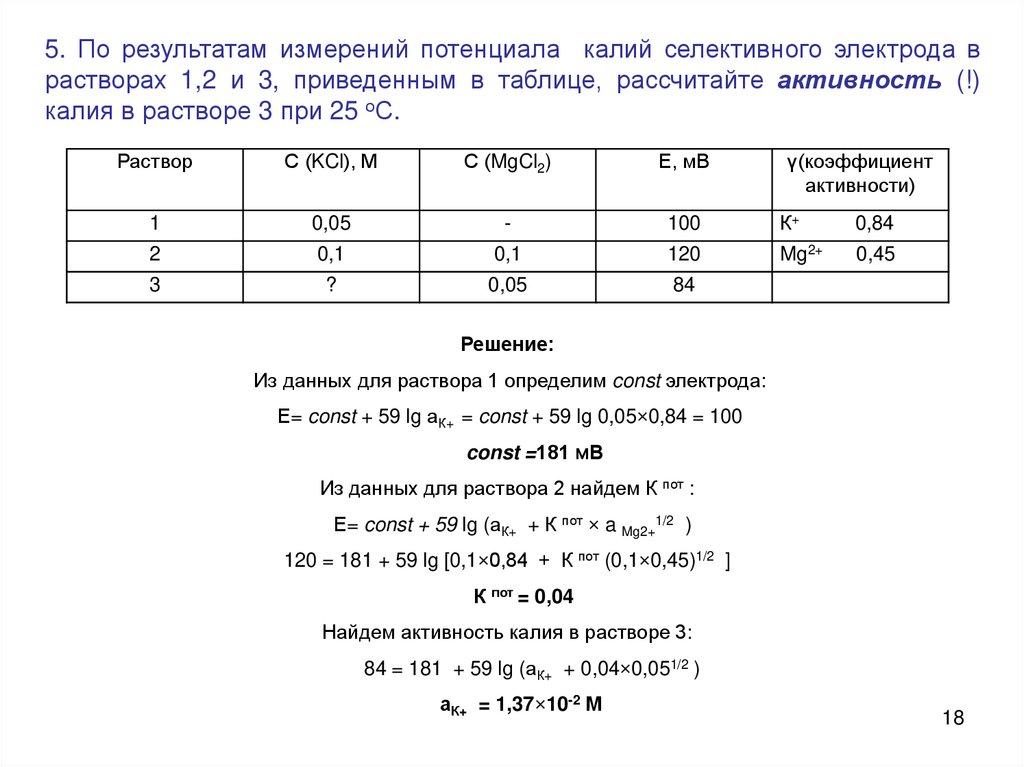
18.
5. По результатам измерений потенциала калий селективного электрода врастворах 1,2 и 3, приведенным в таблице, рассчитайте активность (!)
калия в растворе 3 при 25 оС.
Раствор
С (KCl), М
С (MgCl2)
Е, мВ
γ(коэффициент
активности)
1
0,05
-
100
К+
0,84
2
0,1
0,1
120
Mg2+
0,45
3
?
0,05
84
Решение:
Из данных для раствора 1 определим const электрода:
Е= const + 59 lg аК+ = const + 59 lg 0,05×0,84 = 100
const =181 мВ
Из данных для раствора 2 найдем К пот :
Е= const + 59 lg (аК+ + К пот × a Mg2+1/2 )
120 = 181 + 59 lg [0,1×0,84 + К пот (0,1×0,45)1/2 ]
К пот = 0,04
Найдем активность калия в растворе 3:
84 = 181 + 59 lg (аК+ + 0,04×0,051/2 )
аК+ = 1,37×10-2 М
18











 chemistry
chemistry








