Similar presentations:
Гальванические элементы
1. Электрохимия
Гальванические элементы1
2. План лекции
Общиепонятия
Расчет ЭДС гальванических
элементов
Диффузионный потенциал
Мембранный потенциал
Потенциометрия
2
3. Гальванический элемент
Устройство,состоящее из двух
электродов, дающее возможность
получать электрический ток в
результате химической реакции
3
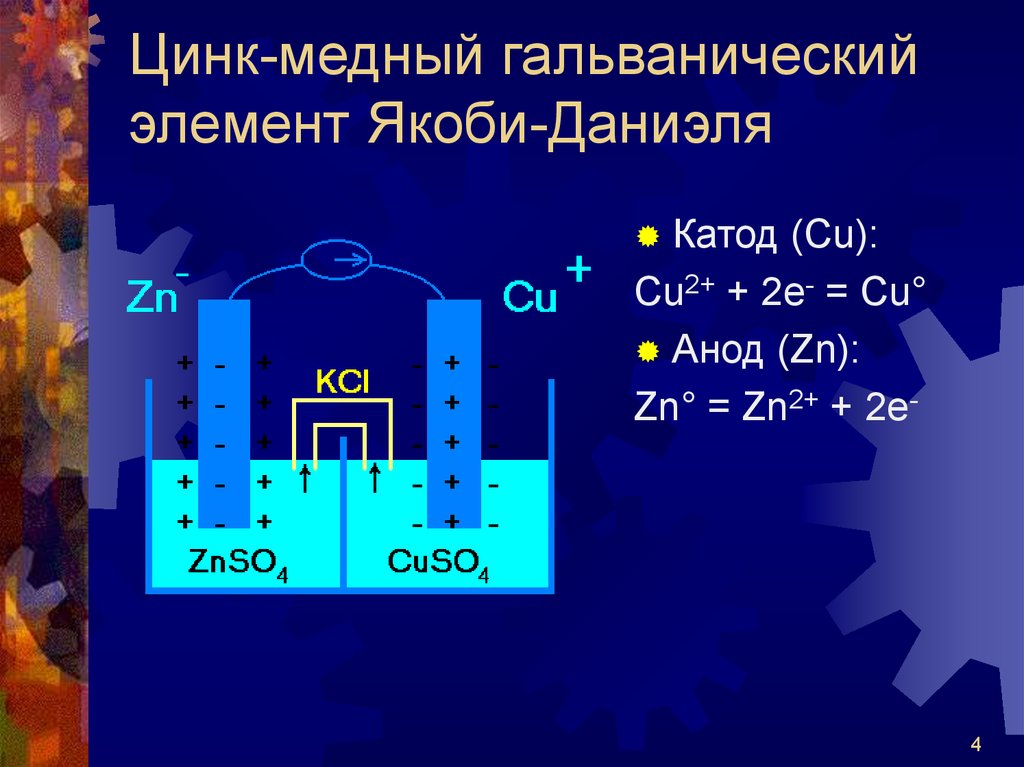
4. Цинк-медный гальванический элемент Якоби-Даниэля
Катод (Сu):Cu2+ + 2e- = Cu°
Анод (Zn):
Zn° = Zn2+ + 2e
4
5. ЭДС гальванического элемента, составленного из двух металлов
Из потенциала положительно заряженногоэлектрода вычитают потенциал отрицательно
заряженного электрода
ЭДС = Еcu - ЕZn
0,2T
Еcu = E°Cu + -------- lg a(Cu2+)
n
0,2T
ЕZn = E°Zn + -------- lg a(Zn2+)
n
0,2T
a(Cu2+)
ЭДС = E°Cu - E°Zn + ----------- lg ----------n
a(Zn2+)
5
6.
ЭДС зависит от:Положения металлов в ряду
напряжений
Соотношения ионов взятых
растворов
6
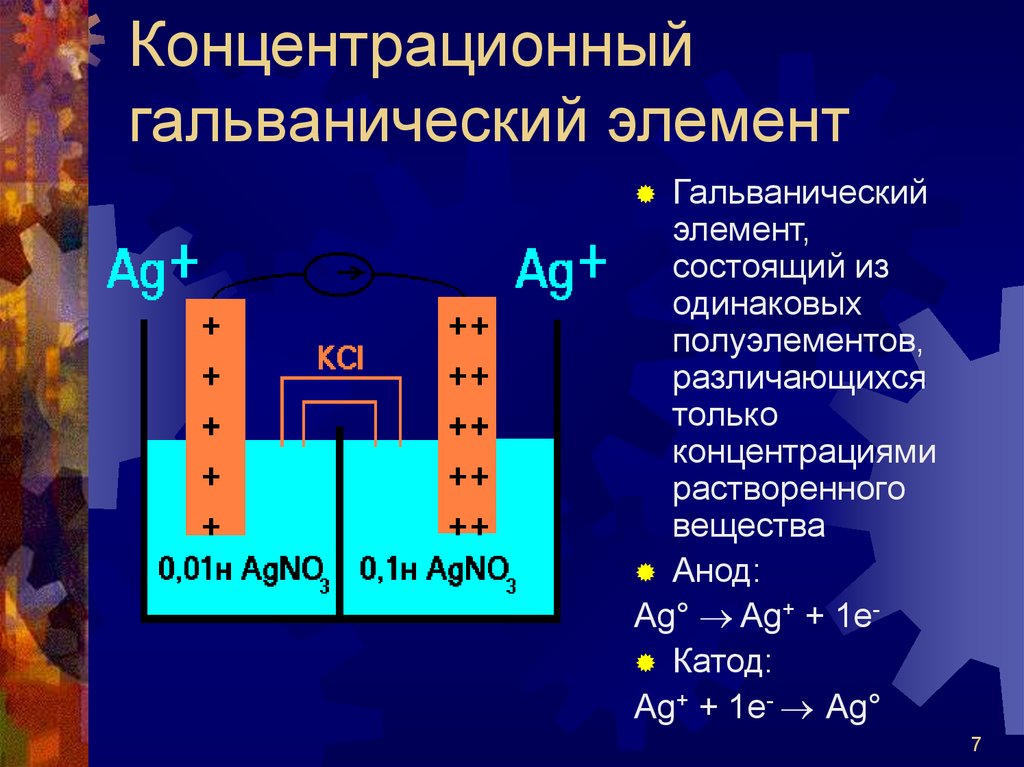
7. Концентрационный гальванический элемент
Гальваническийэлемент,
состоящий из
одинаковых
полуэлементов,
различающихся
только
концентрациями
растворенного
вещества
Анод:
Ag° Ag+ + 1e Катод:
Ag+ + 1e- Ag°
7
8. ЭДC концентрационного гальванического элемента
ЭДС = ЕAg1 – EAg20,2T
ЕAg1 = E°Ag1 + -------- lg a(Ag1)
n
0,2T
ЕAg2 = E°Ag2 + -------- lg a(Ag2)
n
0,2T
a(Ag1)
ЭДС = ----------- lg ----------n
a(Ag2)
ЭДС элемента зависит от соотношения активностей
ионов и быстро падает во времени
8
9.
Измеряя ЭДС концентрационногоэлемента можно практически
определить:
Активность ионов
Коэффициент активности ионов
Неизвестную концентрацию раствора
а=f C
9
10. Пример
Цепь из двух водородных электродов: нормального– электрод сравнения и заполненного
исследуемым раствором с неизвестной
концентрацией Н+ – электрод определения
ЭДС = ЕН° – ЕНХ;
ЕН° = 0;
0,2Т
ЕНХ = ЕН° + ---------lg[H+]
n
0,2Т
ЭДС = 0 – 0 – ---------lg[H+]; ЭДС = 0,2Т рН
n
ЭДС
рН = ---------0,2Т
10
11. Диффузионный потенциал
Разность потенциалов, возникающая на границераздела между двумя неодинаковыми по составу
или по концентрации растворами
l(H+) = 315 Ом-1 см2
l(Cl-) = 65,5 Ом-1 см2
11
12.
Диффузионный потенциал усредняетскорости движения ионов при сохранении
скачка потенциала на границе раздела
растворов разной концентрации
В результате движения ионов в
электролитическом мостике возникает
диффузионный потенциал, направленный
противоположно ЭДС гальванического
элемента
Его влияние устраняют, включая между
растворами электролитов насыщенный
раствор KCl или KNO3, так как
подвижности ионов примерно одинаковы:
l (K+) = 64,4 Ом-1 см2
l (Cl-) = 65,5 Ом-1 см2
12
13. Диффузионные потенциалы в биологических объектах
Потенциал повреждения (поврежденнаяткань заряжается отрицательно)
составляет 30 – 40 мВ
13
14. Межфазовые потенциалы
Возникают:На границе раздела между двумя
несмешивающимися жидкостями;
обусловлены неодинаковой
растворимостью в них веществ
На поверхности макромолекул в
результате избирательного сродства
поверхности к различным ионам
14
15. Мембранный потенциал
Потенциал,возникающий на
мембране с избирательной
проницаемостью (пропускающей
только ионы одного знака),
разделяющей два раствора
различного состава
– СОО- : катионы
– NH3+ : анионы
15
16. Потенциал покоя
мембранныйпотенциал,
возникающий между
внутренней и
наружной сторонами
клеточной мембраны,
находящейся в
невозбужденном
состоянии:
–(70-80) мВ
16
17. Возбужденное состояние клетки
проницаемостьмембраны для
ионов Na+
Перемена знака на
поверхности
мембраны –
деполяризация:
+(40-60) мВ
17
18. Потенциал действия
Разность между потенциалом покоя изарядом мембраны в возбужденном
состоянии (амплитуда колебания
мембранного потенциала)
(120 – 140 мВ)
В результате активной работы К+ / Na+ насоса
наступает реполяризация – клетка
возвращается в состояние покоя
18
19. Потенциометрия
Физико-химическийметод анализа, в
основе которого лежит измерение
ЭДС цепи, составленной из
индикаторного электрода и электрода
сравнения
19
20. Методы потенциометрии
Прямые– определение активности и
концентрации ионов или веществ в
растворе
Косвенные – определение
концентрации неизвестного вещества
при добавлении к нему другого
(потенциометрическое титрование)
20
21. Прямая потенциометрия
Электроды сравнения – электроды, потенциалкоторых практически постоянен, легко
воспроизводим и не зависит от протекания
побочных реакций
Электроды определения – электроды, потенциал
которых зависит от активности (концентрации)
анализируемых ионов и практически не зависит от
содержания других ионов в растворе
Используют для измерения рН, концентрации
биологически активных ионов: H+, Na+, K+, NH4+,
Ca2+, NO3-, различных веществ в биологических
средах
21
22. Индикаторные электроды
Мембранные: ионоселективные – способныопределять в растворе концентрацию
одного иона
С твердыми мембранами
Стеклянный
С жидкими мембранами
Молекулярно-селективные – позволяют
определять концентрацию молекул
вещества (ферментные – мембрана
содержит определенный фермент)
22
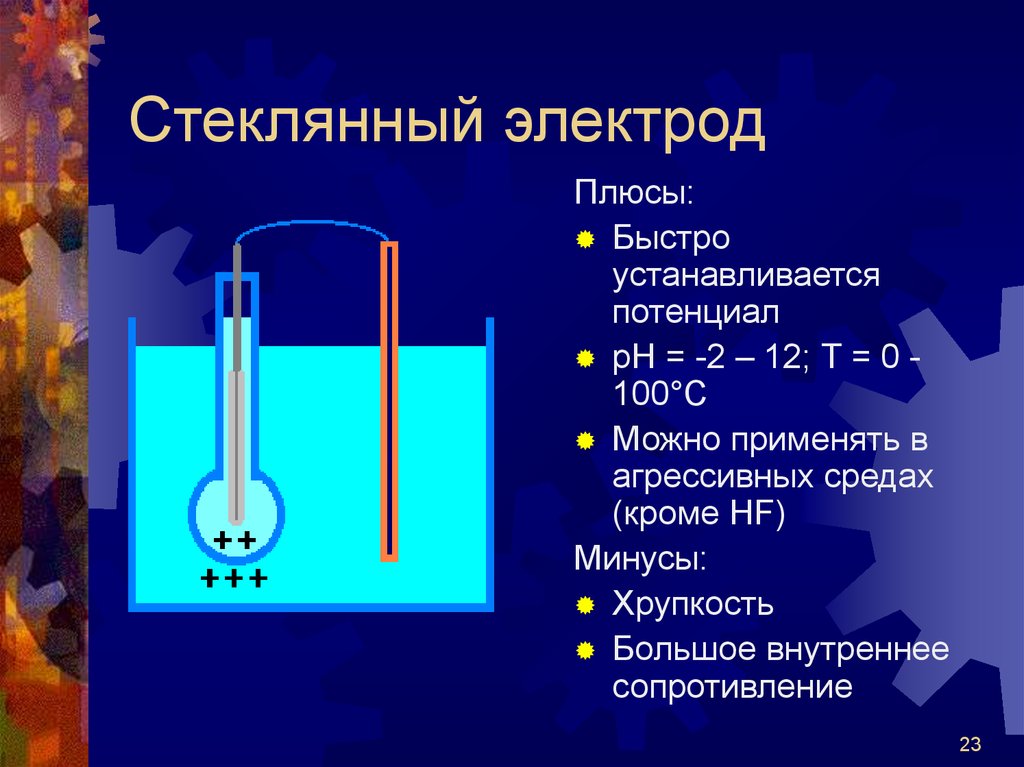
23. Стеклянный электрод
Плюсы:Быстро
устанавливается
потенциал
рН = -2 – 12; Т = 0 100°С
Можно применять в
агрессивных средах
(кроме HF)
Минусы:
Хрупкость
Большое внутреннее
сопротивление
23
24. Ионоселективные электроды
Действиеосновано на возникновении
мембранного потенциала на
мембране с избирательной
чувствительностью к данному иону
(калиевый, нитратный)
Ионоселективных электродов с четкой
выраженностью к определенным
ионам насчитывается более 20 (К+,
Ca2+, Pb2+, Cu2+, Cl-, NO3-, ClO4-, CNS-,
S2-, CN-, F- и др.)
24
25. Мембранный электрод
С твердымимембранами –
метеллическая или
кристаллическая
пластинка, содержащая тот
ион, который нужно
определить в растворе
С жидкими
мембранами –
пористый материал,
пропитанный ионогенным
веществом
25
26. Ферментные электроды
Мочевино-селективныйуреаза
СО(NH2)2
NH4+
Пенициллино-селективный
пенициллиназа
пенициллиновая
кислота
Позволяют определять глюкозу, антибиотики,
витамины, гормоны, аминокислоты и
другие БАВ
Пенициллин
26
27. Косвенная потенциометрия (потенциометрическое титрование)
Графикзависимости ЭДС
цепи от объема
титранта
График изменения
приращения
потенциала на
единицу
добавляемого
титранта
27
28. Значение потенциометрических методов исследования
Определение концентрации веществ вмутных и окрашенных растворах
Определение концентрации нескольких
веществ в одной порции исследуемого
раствора
Измерение рН среды (рН-метры,
иономеры, полярографы)
Определение констант диссоциации
слабых кислот, аминокислот, белков,
нуклеиновых кислот
Определение констант нестойкости
комплексных соединений
28

























 chemistry
chemistry electronics
electronics








