Similar presentations:
азот и фосфор
1. Азот, фосфор, строение их молекул, распространение в природе, способы получения, физические и химические свойства, применение.
Bochegova@23.12.2025
Азот, фосфор, строение их молекул,
распространение в природе,
способы получения, физические и
химические свойства, применение.
2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ПРОСТЫХ ВЕЩЕСТВ – АЗОТА И ФОСФОРА
Bochegova@23.12.2025
3.
Bochegova@23.12.2025
1. Азот и фосфор- элементы V группы, главной подгруппы.
2. Заряд ядра атома N равен +7 , атома P - +15,
3. На последнем энергетическом уровне атомов азота и фосфора
находится по 5 электронов. Электронная конфигурация
валентного уровня - ns2np3.
4. Радиус атома азота меньше радиуса атома фосфора.
5. От азота к фосфору уменьшаются неметалличность,
электроотрицательность, окислительная способность, а
восстановительная способность возрастает.
6. До устойчивого состояния атомы этих элементов могут
присоединять по 3 электрона или отдавать по 5 электронов.
Отсюда для азота и фосфора характерна высшая степень
окисления +5 , низшая степень окисления -3.
7. Формулы высших оксидов: оксид азота (V) N2О5 ,
оксид фосфора (V) Р2О5 . Высшие оксиды и гидроксиды азота и
фосфора имеют кислотный характер.
8. Азот образует летучее водородное соединение NH3 аммиак,
фосфор – РН3 фосфин.
4.
Bochegova@23.12.2025
В 1787 г. А.Лавуазье установил, что
«жизненный» и «удушливый» газы,
входящие в состав воздуха, это простые
вещества.
Он предложил название «азот».
«азот» -«безжизненный»
(греч. «а» – отрицание, «зоэ» –
жизнь)
«фосфор» -«светоносец»
(греч. «фос» – свет и «феро» –
несу)
1772 г. – открытие азота
Д.Резерфорд, сжигая фосфор и другие
вещества в стеклянном колоколе,
показал, что остающийся газ не
поддерживает дыхания и горения.
Д.Резерфорд назвал его «удушливым
воздухом».
Фосфор открыт
гамбургским
алхимиком
Хеннингом
Брандом в 1669 г.
5.
Bochegova@Строение и физические свойства простых
веществ – азота и фосфора
Химические свойства азота и фосфора
Получение азота и фосфора
Применение азота и фосфора
Контроль знаний
23.12.2025
6.
Bochegova@азот
ковалентная неполярная связь,
молекулярная кристаллическая
решетка
бесцветный газ
без запаха
малорастворим в Н2О
Tкип.= -1960C
Tпл. =-2100С
Не ядовит, не
поддерживает
дыхания, не горюч.
23.12.2025
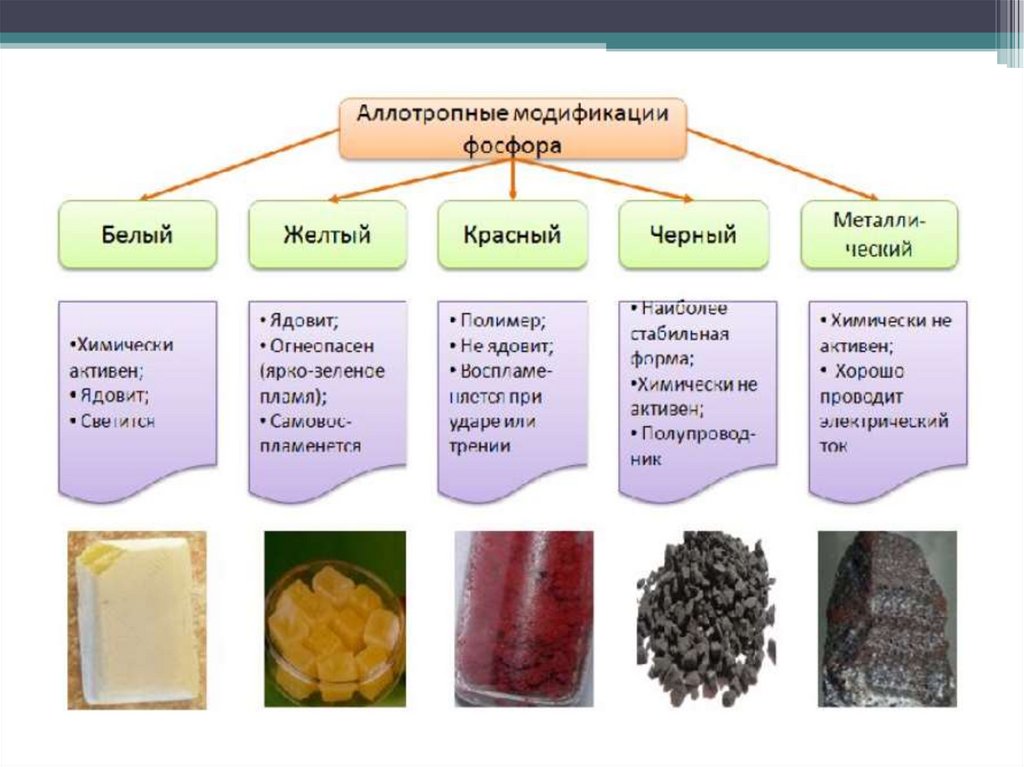
фосфор
Аллотропные модификации
БЕЛЫЙ ФОСФОР
КРАСНЫЙ ФОСФОР
7.
Bochegova@23.12.2025
воскообразное вещество бледножелтого цвета
чесночный запах
растворим в сероуглероде, не
растворим в Н2О
ядовит!
Р4
светится в темноте!
ковалентная неполярная связь,
Т воспламенения = +400С
молекулярная кристаллическая
решетка
Tпл. =+44 °С
8.
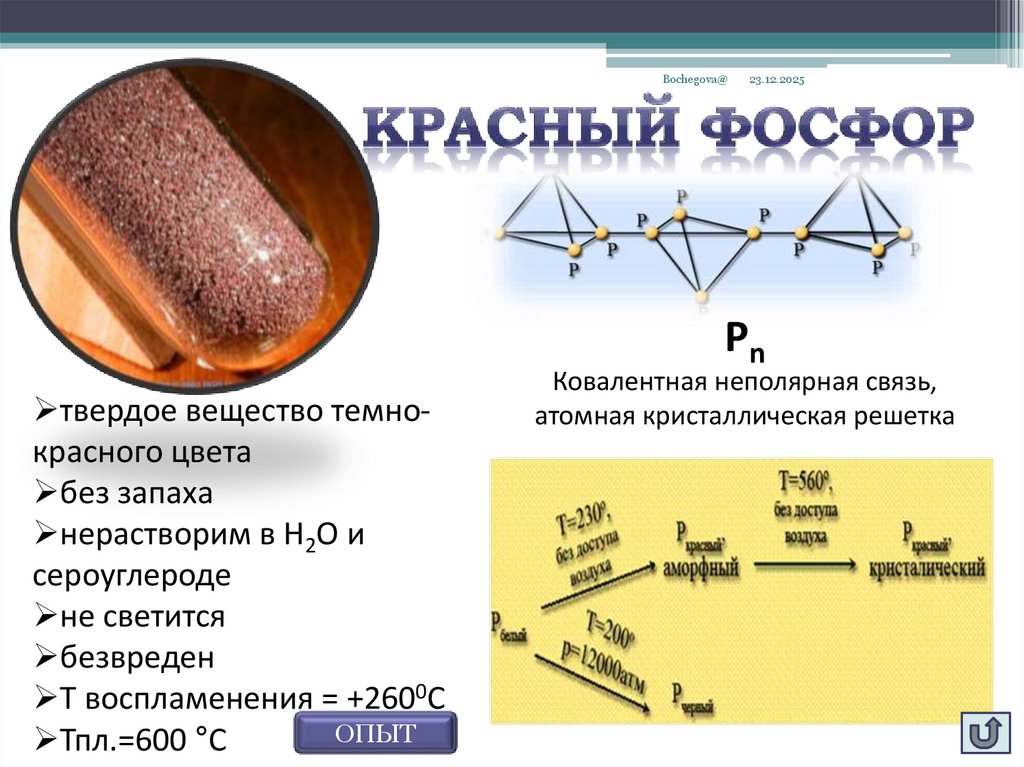
Bochegova@23.12.2025
Рn
твердое вещество темнокрасного цвета
без запаха
нерастворим в Н2О и
сероуглероде
не светится
безвреден
Т воспламенения = +2600С
ОПЫТ
Тпл.=600 °С
Ковалентная неполярная связь,
атомная кристаллическая решетка
9.
Bochegova@23.12.2025
10. Просмотрите фрагмент. Прокомментируйте его с химической точки зрения.
Bochegova@Просмотрите фрагмент. Прокомментируйте
его с химической точки зрения.
23.12.2025
«Да! Это была собака, огромная черная, как
смоль. Но такой собаки еще никто из нас,
смертных, не видывал. Из ее отверстой пасти
вырывалось пламя, глаза метали искры, по
морде и загривку переливался мерцающий
огонь. Ни в чьем воспаленном мозгу не
Могло возникнуть видение более страшное,
более омерзительное, чем это адское
существо, выскочившее на нас из тумана...
….Я дотронулся до этой светящейся головы и,
отняв руку, увидел, что мои пальцы тоже
засветились в темноте.
-Фосфор- сказал я".
Артур Конан-Дойл.
"Собака Баскервилей"
11.
Bochegova@23.12.2025
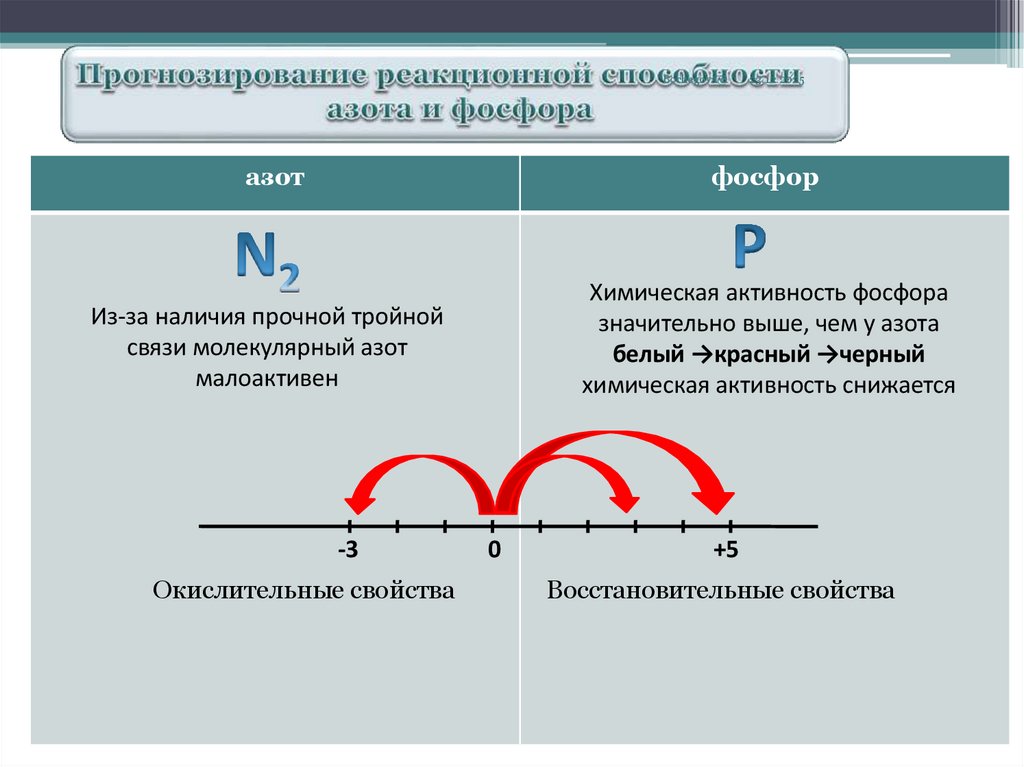
азот
фосфор
Из-за наличия прочной тройной
связи молекулярный азот
малоактивен
Химическая активность фосфора
значительно выше, чем у азота
белый →красный →черный
химическая активность снижается
-3
Окислительные свойства
0
+5
Восстановительные свойства
12.
Bochegova@азот
23.12.2025
фосфор
Взаимодействие с металлами
При обычных условиях реагирует только с
литием, образуются
- нитриды:
6е
0
+1
0
-3
0
6 Li + N2= 2 Li3N
6е
0
нитрид лития
0 toC +2
Фосфор реагирует с металлами с образованием
фосфидов: 3 е-
-3
3Са + N2 = Ca 3 N 2
0
o
3 Н2+ N2
-3 +1
2 NH3
аммиак
+2
-3
6е
0
o
0 tc
3 Ca +2P = Са 3 Р 2
фосфид кальция
Взаимодействие с водородом
0 p, t , Fe
-3
3 Li + P =фосфид
Li3Pлития
нитрид кальция
6е
0 toc +1
Н2 + Р =
13.
Bochegova@23.12.2025
Взаимодействие с кислородом
Только под действием электрического
разряда азот реагирует с O2:
4е
0
0 3000oC
N2 + О 2
в-тель
ок-тель
+2 -2
2 NO
оксид азота (II)
Фосфор легко окисляется
кислородом:
20 е
0
0 toc
+5
-2
4 Р + 5О2= 2 P2 О5
в-тель
ок-тель
oксид фосфора (V)
Взаимодействие с галогенами, серой
10 еАзот непосредственно не
взаимодействует
с галогенами и серой
0
0 toc
+5 -1
2 Р + 5Сl2 = 2РCl 5
хлорид фосфора (V)
14. Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль
Bochegova@23.12.2025
Реакция окисления фосфора
происходит при поджигании
спичек, в качестве окислителя
выступает бертолетова соль
0
+5
-1
+5
P + KClO3 = KCl + P2O5
+5
ок-тель Cl + 6e =
0
в-тель P - 5e =
-1
Cl ∙55 восстановление
+5
∙6
окисление
3
6
P
15.
Bochegova@23.12.2025
Сырье: апатиты или
фосфориты, кокс, песок
Процесс: восстановление
фосфата кальция коксом в
электропечи при температуре
1500°С.
• Сырье: воздух
• Процесс: перегонка сжиженного
воздуха
• Первым отгоняется азот так
сжижается при более низкой
температуре, чем кислород:
• tкипN2 = - 1960С
• tкипО2 = - 1830С
фосфорит
Са3(РО4)2 + 5С + 3SiO2 =2P + 5CO +3CaSiO3
кокс
песок
шлак
16.
Bochegova@В медицине для быстрого
замораживания и
хранения тканей и
различных органов, в
криотерапии
Пищевая добавка E941,
как газовая среда для
упаковки и хранения,
хладагент
В пожаротушении.
Создание инертной среды
при перекачке горючих
жидкостей, разливке
стали, накачка шин.
Синтез аммиака, азотных
удобрений, взрывчатых
веществ
23.12.2025
17.
Bochegova@Красный и белый
фосфор используют при
получении
йодистоводородной и
бромистоводородной,
фосфорной кислот.
Белый фосфор используют в
военном деле для
зажигательных бомб, а также
для дымообразующих
снарядов, шашек и гранат,
дающих дымовые завесы.
Красный фосфор
применяют в
спичечном
производстве.
Фосфид цинка Zn3Р2
применяют для борьбы с
грызунами.
23.12.2025
18.
Bochegova@ВОПРОС 1
ВОПРОС 2
ВОПРОС 3
23.12.2025
Верны
следующие
суждения
офосфоре?
фосфоре?
Верны
лили
следующие
суждения
о свойствах
азота?
Верны
ли
следующие
суждения
о
Тремя
Электронная
Азот
ВБелый
твердом
общими
проявляет
конфигурация
состоянии
электронными
свойства
А.
фосфор
ядовит
и дает P O
А.
Азот
является
более
слабым
восстановителем,
А.
Фосфор
горит
на
воздухе
с
образованием
Азот
Число
Фосфор
Фосфор
проявляет
нейтронов
не
реагирует
проявляет
степень
в
атоме
с
степень
веществом,
окисления
фосфора
2 5
Химическая активность аллотропных
форм
чем
фосфор
труднозаживающие
ожоги
внешнего
кристаллическая
парами
восстановителя
энергетического
образована
решетка
связь
белого
уровня
в
Б. При
взаимодействии
фосфора
с металлами
фосфора
увеличивается
в
ряду
окисления
формула
-3
в
соединении
равно
+5
которого:
в
соединении
Б.
является
окислителем в
реакциивс
Б.Азот
Фосфор
– необходимый
элемент
образуются
атома
вмолекуле
фосфора
реакции
азота
фосфиды
с
водородом
организме
человека
ВОПРОС 4
ВОПРОС 5
А
белый→
Б
2только
5 А
верно
верно
кислородом
KClO
только
АА
верно
атомная
2s
НNО
РН
только
Р
15
2p
3
43 3
красный→черный
ВОПРОС 6
черный→
2К
1 ББ
верно
водородом
только
верно
молекулярная
2s
N
Р
N
только
31
О
2p
22 2 33
красный→белый
ВОПРОС 7
ВОПРОС 8
ВОПРОС 9
ВОПРОС 10
ВОПРОС 11
ВОПРОС 12
В
верны
оба
красный→
2H
3
верны
верныионная
литием
оба
оба
суждения
суждения
H
3s
HNO
O
16
РО
3p
2
3 2 24
белый→черный
суждения
Г
оба
суждения
оба
красный
суждения
2РО
3→
магнием
Сl
металлическая
H
2s
NН
H
46
2p
23 3
3→
2
черный
белый
неверный
неверны
неверны
19. Домашнее задание
Bochegova@23.12.2025
Домашнее задание
• §15,16,21
• Задача: Вычислите массу фосфора,
образующегося из 1 кг фосфата
кальция, содержащего 5% примесей.
• Стр.52, №2
• Стр. 70 №2,4,5
20. Использованные ресурсы
Bochegova@23.12.2025
• Периодическая система
http://theodoregray.com/PeriodicTableDisplay/Elements/015/index.s9.html
• История открытия аллотропных модификаций фосфора В. А. Красицкий . Журнал
«Химия и химики» №6, 2010
• Единая коллекция цифровых образовательных ресурсов http://schoolcollection.edu.ru/catalog/
1.Белый фосфор (N 125289) Иллюстрация
2.Красный фосфор (N 125287) Иллюстрация
3.Сравнение температур воспламенения белого и красного фосфора (N 54483)
Видеофрагмент
4.Превращение красного фосфора в белый (N 54480) Видеофрагмент
5.Получение фосфида кальция (N 54904) Видеофрагмент
• ФЦИОР http://fcior.edu.ru/
Физические и химические свойства азота mmlab.chemistry.418i
• Анимация: схема электропечи для получения фосфора. CD «Библиотека наглядных
электронных пособий. Химия.» ООО «Кирилл и Мефодий», 2006