Similar presentations:
История открытия фосфора
1.
ФосфорI. История открытия фосфора
II. Фосфор – химический элемент
1. Положение фосфора в периодической системе
химических элементов. Строение атома.
2. Сравнение строения атома азота и фосфора.
3. Нахождение в природе.
III. Фосфор – простое вещество
1. Аллотропные модификации фосфора.
2. Получение фосфора.
3. Химические свойства.
4. Применение фосфора
IV. Тест
2.
Фосфор был открыт немецким алхимиком X. Брэндом в1669 г.
Позже А. Лавуазье доказал, что фосфор
самостоятельный химический элемент. Ж. Пруст и М.
Клапорт установили его широкое распространение в
земной коре, в основном в виде фосфата кальция.
3.
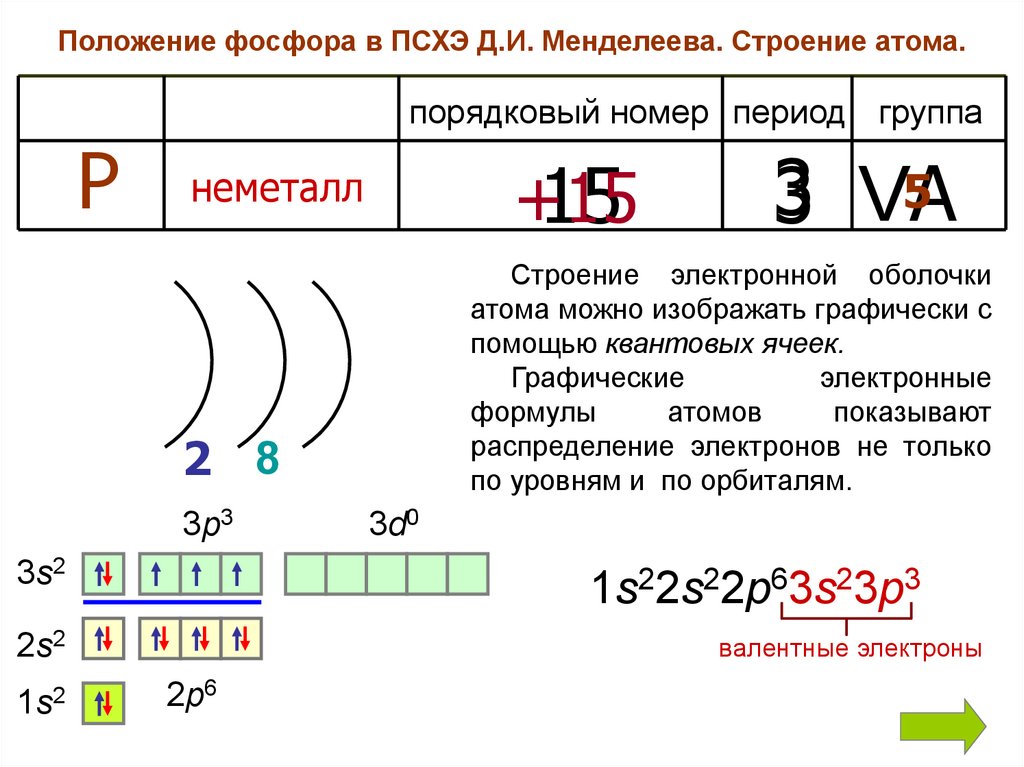
Положение фосфора в ПСХЭ Д.И. Менделеева. Строение атома.порядковый номер период группа
Р
+15
15
неметалл
Строение электронной оболочки
атома можно изображать графически с
помощью квантовых ячеек.
Графические
электронные
формулы
атомов
показывают
распределение электронов не только
по уровням и по орбиталям.
2 8
3p3
3s2
3d0
1s22s22p63s23p3
2s2
1s2
5
3 VA
валентные электроны
2p6
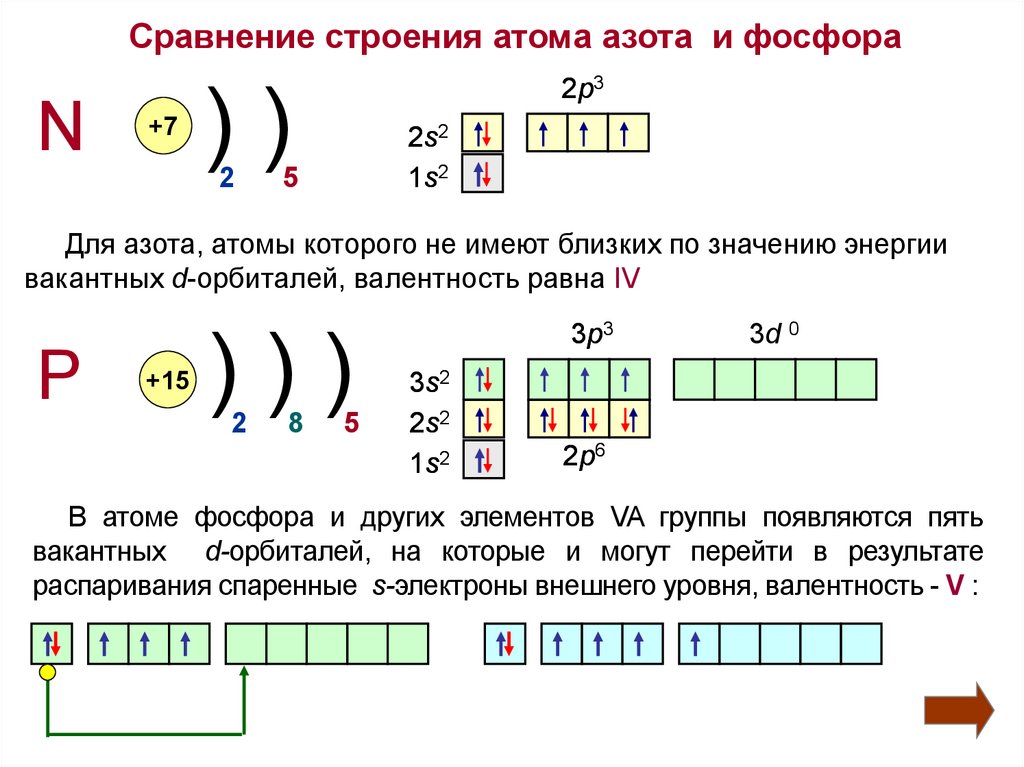
4.
Сравнение строения атома азота и фосфораN
+7
2p3
))
2
2s2
1s2
5
Для азота, атомы которого не имеют близких по значению энергии
вакантных d-орбиталей, валентность равна IV
P
+15
)))
2
8
5
3p3
3s2
2s2
1s2
3d 0
2p6
В атоме фосфора и других элементов VA группы появляются пять
вакантных d-орбиталей, на которые и могут перейти в результате
распаривания спаренные s-электроны внешнего уровня, валентность - V :
5.
Нахождение в природеСодержание фосфора в земной коре составляет 0,093%.
В природе фосфор встречается только в виде соединений, главным
образом апатитов, фосфоритов.
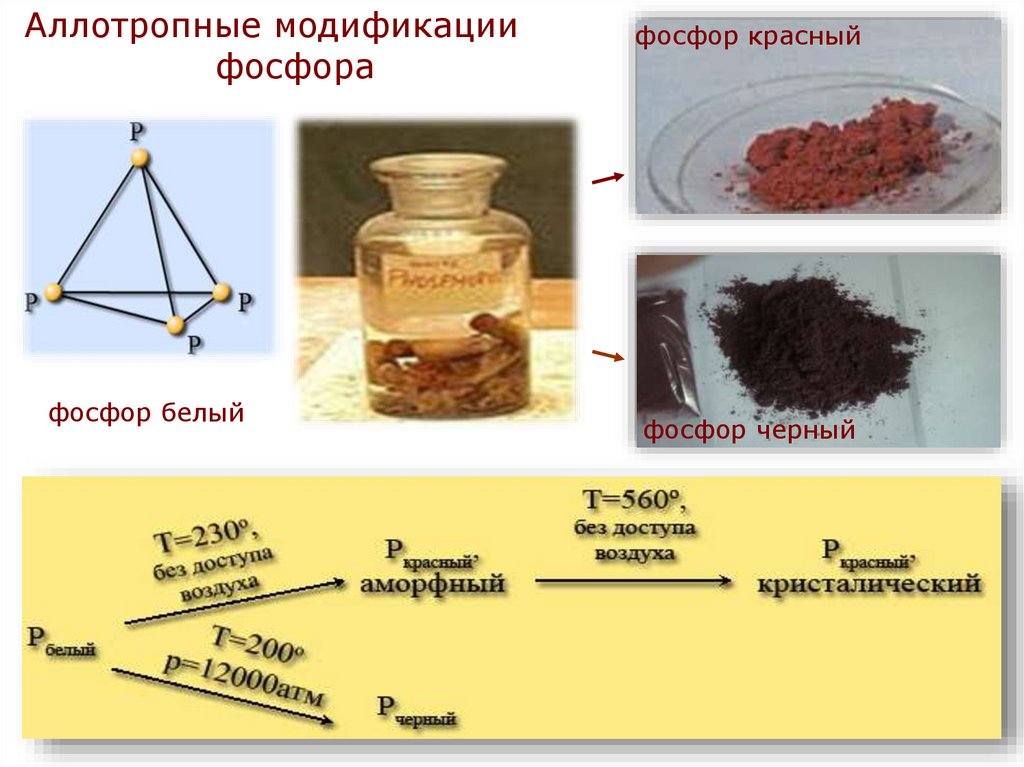
6.
Аллотропные модификациифосфора
фосфор белый
фосфор красный
фосфор черный
7.
• Белый фосфор - твердое кристаллическоевещество, плотность его 1,82 г/см3. На воздухе
самовоспламеняется, в темноте светится.
Получают
быстрым
охлаждением
паров
фосфора. Очень ядовит.
• Красный фосфор - порошок темно-красного
цвета, плотность его 2,2 г/см3. Получают
длительным нагреванием белого фосфора без
доступа воздуха при температуре 250-300°С. По
своим свойствам отличается от белого, не
ядовит.
• Черный фосфор - твердое вещество, плотность
его 2,7 г/см3. Образуется при нагревании белого
фосфора при температуре 200 °С под высоким
давлением. Используется в производстве
спичек, снарядов и т. д.
8.
Превращение красного фосфора9.
Свечение белого фосфора10.
Получение фосфораСвободный фосфор получают из природных фосфатов,
прокаливая их с коксом и песком:
Ca3(PO4)2 +3SiO2 +5C = 2P +3CaSiO3 +5CO
11.
Химические свойства фосфоравосстановитель
P0
окислитель
P + O2 (S, Cl2)
P + Ме
P+5 (P+3)
P–3
I. Взаимодействие фосфора с неметаллами
1) с кислородом
2) с серой
3) с хлором
II. Взаимодействие фосфора с металлами
III. Взаимодействие фосфора со сложными веществами
12.
I. Взаимодействие фосфора с неметалламиВзаимодействие фосфора с кислородом
Составьте уравнения реакций взаимодействия фосфора
кислородом, серой, хлором. Назовите окислитель и восстановитель.
4P0 + 5 O20 = 2 P2+5O5–2
P0 –5e → P+5
O20 + 4e → 2O–2
5 4
4 5
Опыт №1
Опыт №2
Р0 – восстановитель, процесс окисления;
О20 – окислитель, процесс восстановления
При окислении фосфора в недостатке кислорода образуется
4P0 +3O20 =2P2+5O3–2
с
Р2О3
13.
Горение красного фосфора14.
Горение белого фосфора15.
Так же, как с кислородом, фосфор реагирует и сдругим халькогеном – серой:
4 P0 + 3 S0 = 2 P2+3S3–2
P0 – 3e → P+3
S0 + 2e → S–2
3 2
2 3
Р0 – восстановитель, процесс окисления;
S0 – окислитель, процесс восстановления
4 P0 + 5 S0 = 2 P2+5S3–2
P0 – 5e → P+3
S0 + 2e → S–2
5 2
2 5
Р0 – восстановитель, процесс окисления;
S0 – окислитель, процесс восстановления
16.
При пропускании хлора через трубку с красным фосфором вприемнике собирается бесцветная жидкость – хлорид фосфора (III). В
избытке хлора фосфор сгорает бледно-зеленым пламенем с
образованием хлорида фосфора (V), которые при охлаждении
конденсируются в светло-желтые кристаллы.
2 P0 + 3 Cl20 = 2 P+3Cl3–1
P0 –3e → P+3
Cl20 + 2e → 2Cl–1
3 2
2 3
Р0 – восстановитель, процесс окисления;
Cl20 – окислитель, процесс восстановления
2 P0 + 5 Cl20 = 2 P+5Cl5–1
P0 –5e → P+5
Cl20 + 2e → 2Cl–1
5 2
2 5
Р0 – восстановитель, процесс окисления;
Cl20 – окислитель, процесс восстановления
Опыт
17.
Горение фосфора в хлоре18.
III. Взаимодействие фосфора с металламиВзаимодействие фосфора с кальцием
Опыт
Составьте уравнение реакции взаимодействия фосфора с
кальцием, назовите окислитель и восстановитель.
2 P0 + 3 Ca0 = Ca3+2P2–3
P0 + 3e → P–3
Ca0 — 2e → Ca+2
3 2
2 3
Р0 – окислитель, процесс восстановления;
Cа0 – восстановитель, процесс окисления.
19.
Получение фосфида кальция20.
Фосфиды энергично разлагаются водой с выделениемфосфина. Фосфин очень ядовитый газ с чесночным запахом.
Ca3P2 + 6H2O = 3Ca(OH)2 + ↑2PH3
21.
III. Взаимодействие фосфора со сложными веществами:1. С концентрированными кислотами (азотной и серной);
2. Раствором щелочи;
3. Хлоратом калия.
1. Концентрированные азотная и серная кислоты окисляют фосфор
до фосфорной кислоты:
P + 5HNO3 = H3PO4 + 5NO2 + H2O
опыт
2P + 5H2SO4= 2H3PO4 + 5SO2 + 2H2O
2. Фосфор, особенно легко белый, вступает в реакцию с горячим
раствором щелочи:
4P + 3NaOH + 3H2O = PH3 +
гипофосфит
3NaH2PO2 натрия
3. В роли окислителя фосфора может быть бертолетова соль (хлорат
калия):
6P + 5KClO3 = 5KCl + 3P2O5
опыт
22.
Взаимодействие безводной азотной кислоты с фосфором23.
24.
Применение фосфора1
Белый фосфор применяется для получения красного фосфора
2
Фосфор применяется для получения фосфорных кислот и их
производных.
3
Основная область применения красного фосфора – производство
спичек
4
Фосфор применяется как раскислитель и компонент некоторых
металлических сплавов
5
Производство лекарственных
препаратов
6
Средства борьбы с вредителями
сельского хозяйства
7
Производство моющих средств
8
Органический синтез
9
Р2О5 как осушитель газов и
жидкостей
25.
1. В каком из перечисленных соединений степень окисления фосфора +3 ВА) Р2О5;
Б) NaPO3;
В) PCl3
2. В какой из приведенных пар оба вещества взаимодействуют с фосфором:
А) кальций и соляная кислота; Б) натрий и хлор; В) кислород и соляная кислота.
Б
3. Составьте уравнение реакции фосфора с кальцием. Коэффициент перед
формулой окислителя:
А) 2;
Б) 3);
В) 1.
А
4. Как хранят красный фосфор в лаборатории:
А) под слоем воды;
Б) под слоем керосина;
В) в обычных условиях.
В
5. Фосфор образует простое вещество с молекулярной кристаллической решеткой,
в узлах которой находятся молекулы Р4. какой цвет имеет такой фосфор:
Б
А) красный;
Б) желтый;
В) зеленый.
6. Степень окисления фосфора увеличивается в ряду:
А) PH3, P2O3, H3PO4;
Б) Na3PO4, P2O5, HPO3; В) Ca3P2, PH3, NaPO3
А
7. Какое из утверждений неверно: «Атом фосфора по сравнению с атомом азота
имеет»:
В
А) больший радиус;
Б) больший заряд ядра;
В) более ярко выраженные неметаллические свойства.






















 chemistry
chemistry








