Similar presentations:
семинар о-в 1 весна 2025 испр
1.
СЕМИНАР 6РЕАКЦИИ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ
ВКОЛИЧЕСТВЕННОМ АНАЛИЗЕ
2.
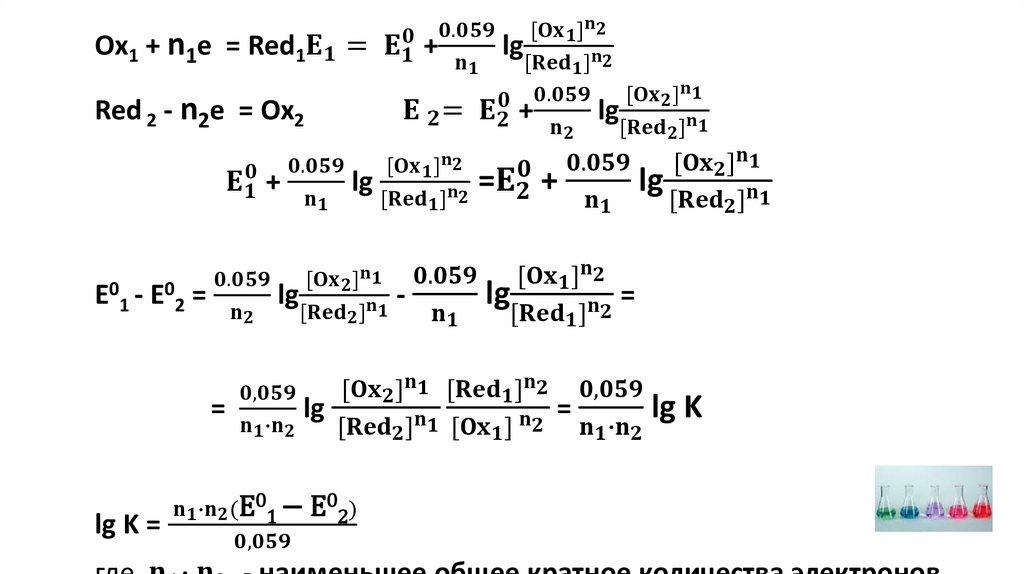
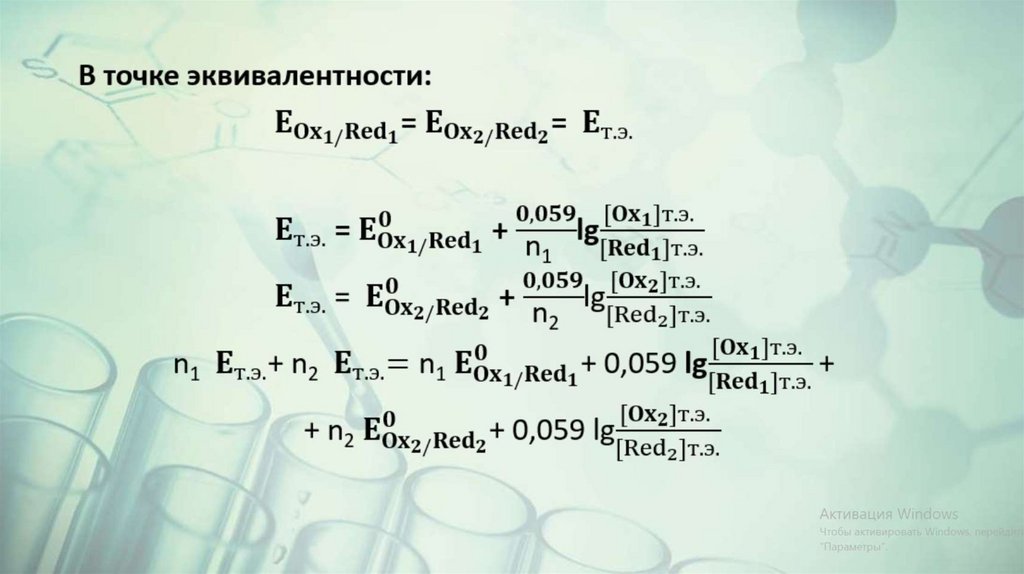
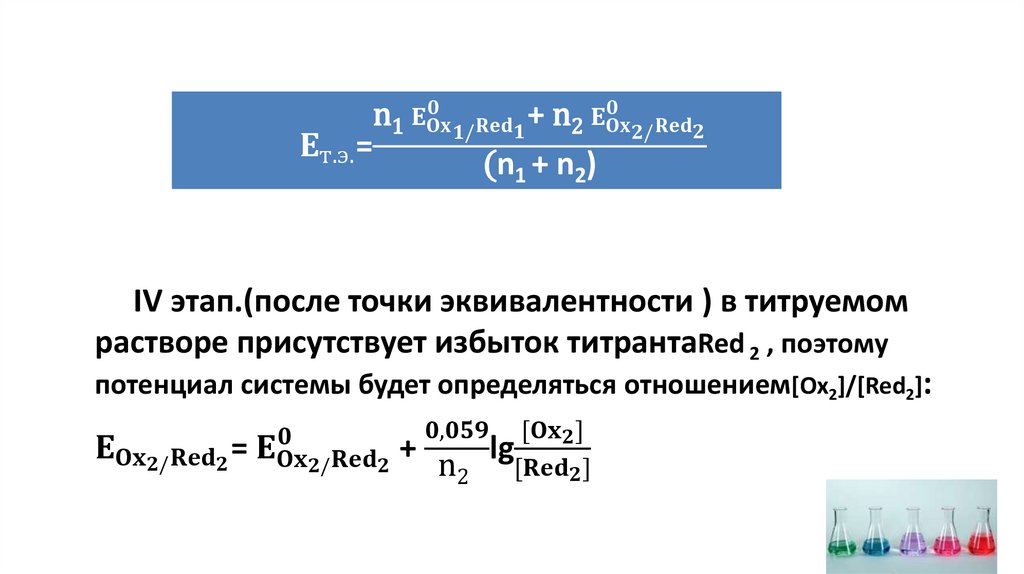
n2Ox1 + n1Red 2 = n2Red 1 + n1Ox2Ox1 + n1e = Red1
Red 2 - n2e = Ox2
Ox1/ Red 1-окислительно-восстановительная пара;
Ox2/ Red 2 - окислительно-восстановительная пара;
Реакция, показывающая изменения, происходящие с
каждым участником реакции, называется полуреакцией.
3.
Возможность протекания окислительно-восстановительной реакцииопределяется химической активностью пары, которая количественно
характеризуется
величиной
стандартного
окислительновосстановительного потенциала Е0Оx/Red
Стандартный окислительно-восстановительный потенциал – это
потенциал
окислительно-восстановительной
пары,
измеренный
относительно стандартного водородного электрода при t0= 250C и ɑOx =
ɑRed = 1 моль/л.
Чем
больше
значение
стандартного
окислительновосстановительного потенциала, тем сильнее выражены
окислительные свойства пары.
4.
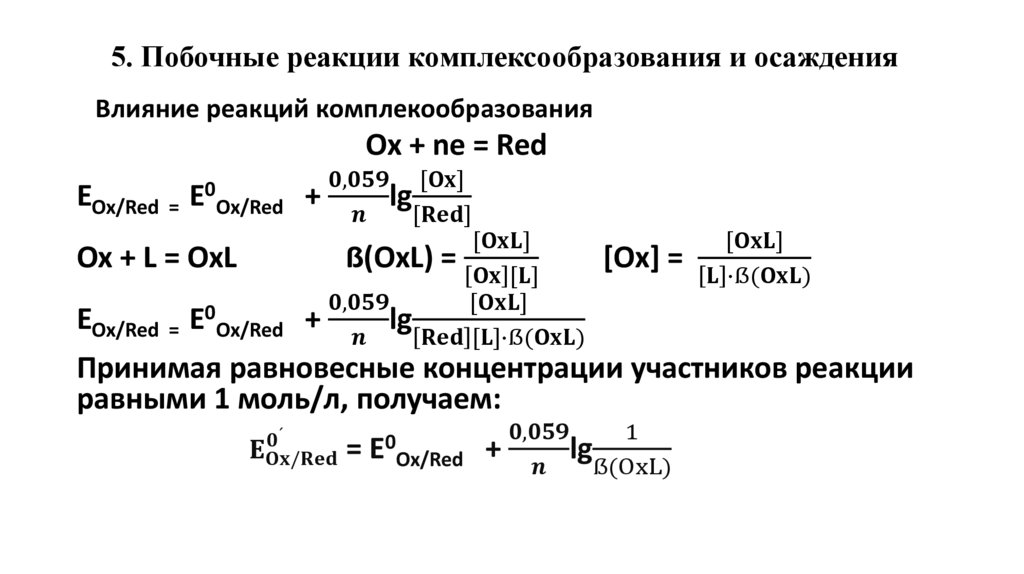
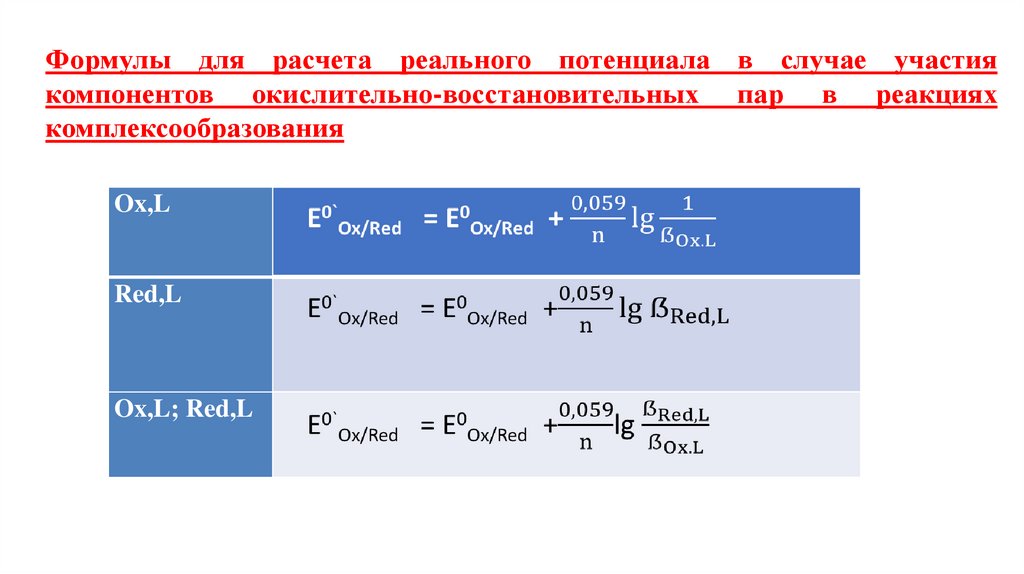
Уравнение НернстаEOx/Red = E0Ox/Red































 chemistry
chemistry








