Similar presentations:
НЕМЕТАЛЛЫ-24 (2)
1.
НЕМЕТАЛЛЫ2.
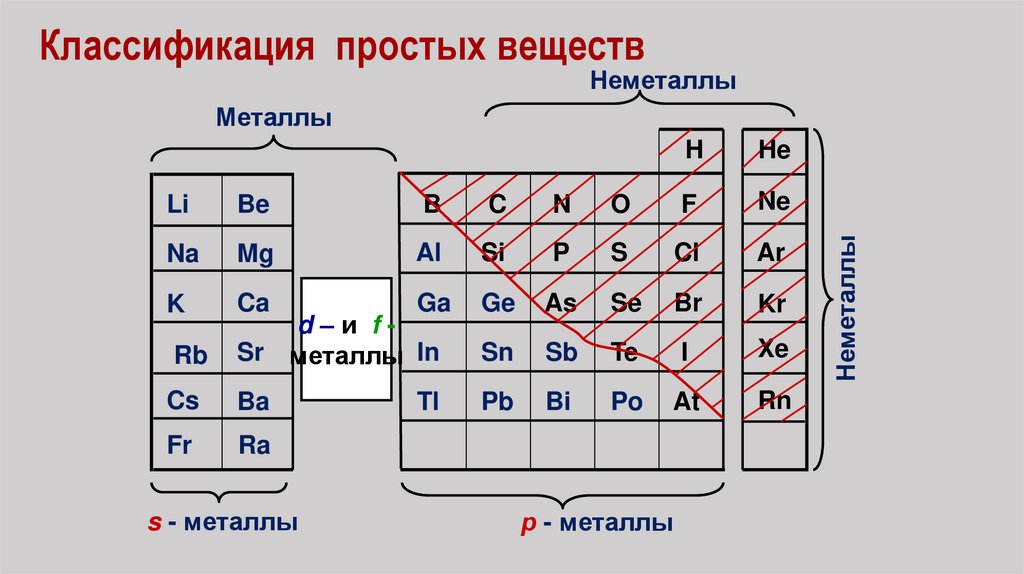
Классификация простых веществНеметаллы
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Ga
Ge
As
Se
Br
Kr
Sn
Sb
Te
I
Xe
Pb
Bi
Po
At
Rn
Rb
d–и fSr металлы In
Cs
Ba
Fr
Ra
s - металлы
Tl
р - металлы
Неметаллы
Металлы
3.
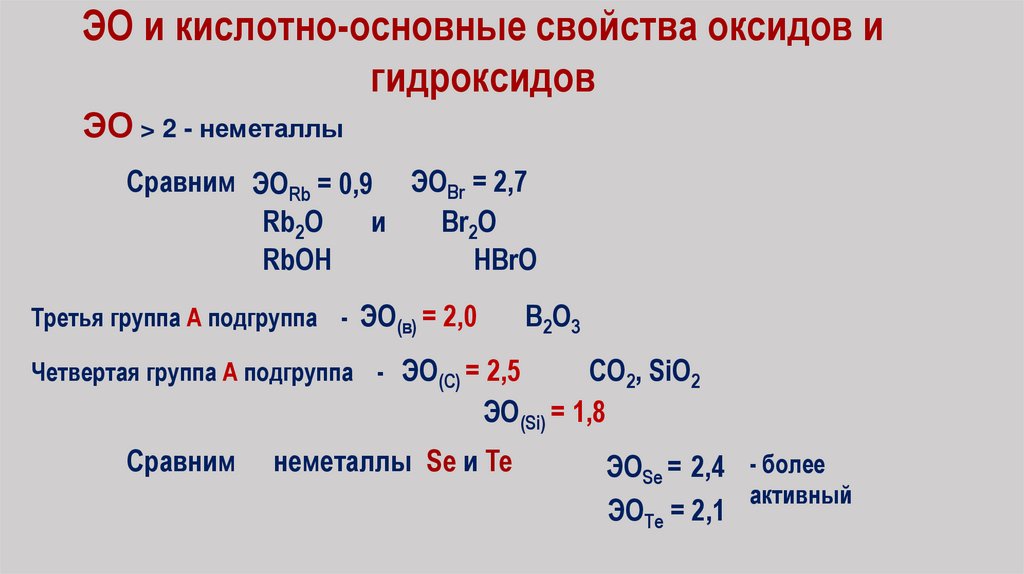
ЭО и кислотно-основные свойства оксидов игидроксидов
ЭО > 2 - неметаллы
Сравним ЭОRb = 0,9 ЭОBr = 2,7
Rb2O
и
Br2O
RbOH
HBrO
Третья группа А подгруппа - ЭО(в) = 2,0
В2О3
Четвертая группа А подгруппа - ЭО(С) = 2,5
СО2, SiO2
ЭО(Si) = 1,8
Сравним
неметаллы Se и Te
ЭОSe = 2,4 - более
активный
ЭОТе = 2,1
4.
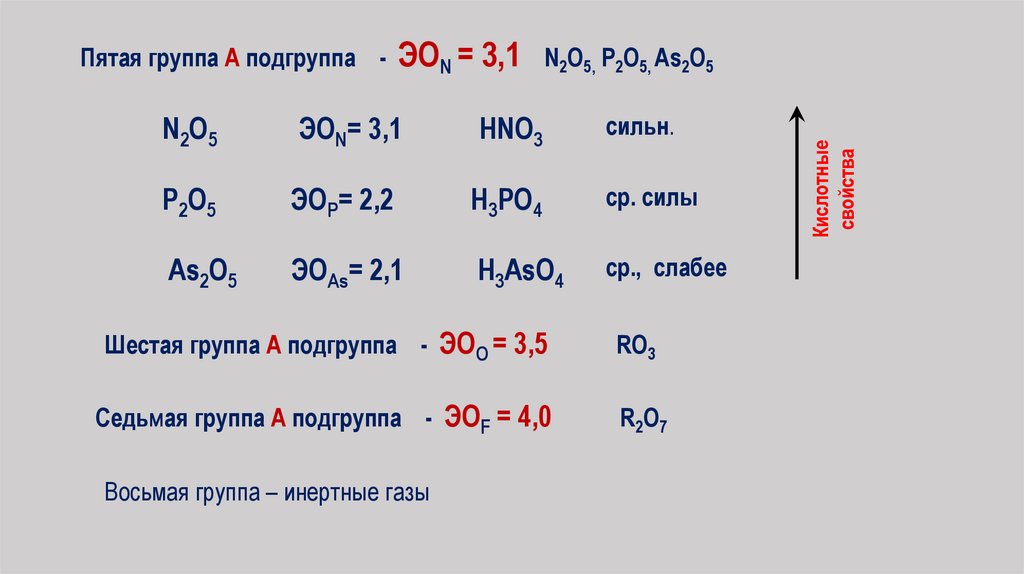
N2O5ЭОN= 3,1
HNO3
cильн.
P2O5
ЭОР= 2,2
H3PO4
ср. силы
As2O5
ЭОAs= 2,1
H3AsO4
ср., слабее
Шестая группа А подгруппа - ЭОО = 3,5
RО3
Седьмая группа А подгруппа - ЭОF = 4,0
R2О7
Восьмая группа – инертные газы
Кислотные
свойства
Пятая группа А подгруппа - ЭОN = 3,1 N2О5, P2O5, As2O5
5.
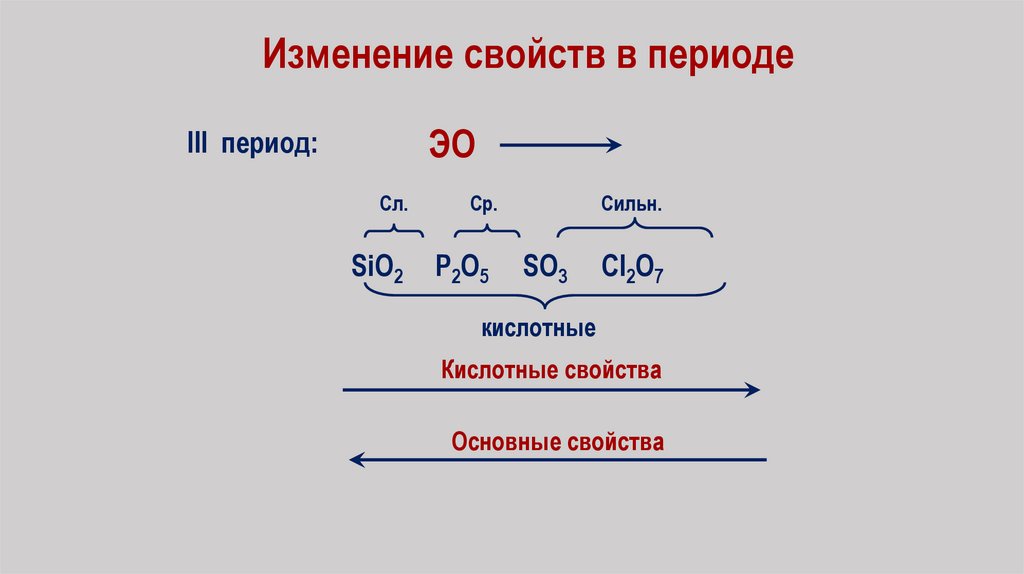
Изменение свойств в периодеЭО
III период:
Сл.
Ср.
SiO2
P2O5
Сильн.
SO3
Cl2O7
кислотные
Кислотные свойства
Основные свойства
6.
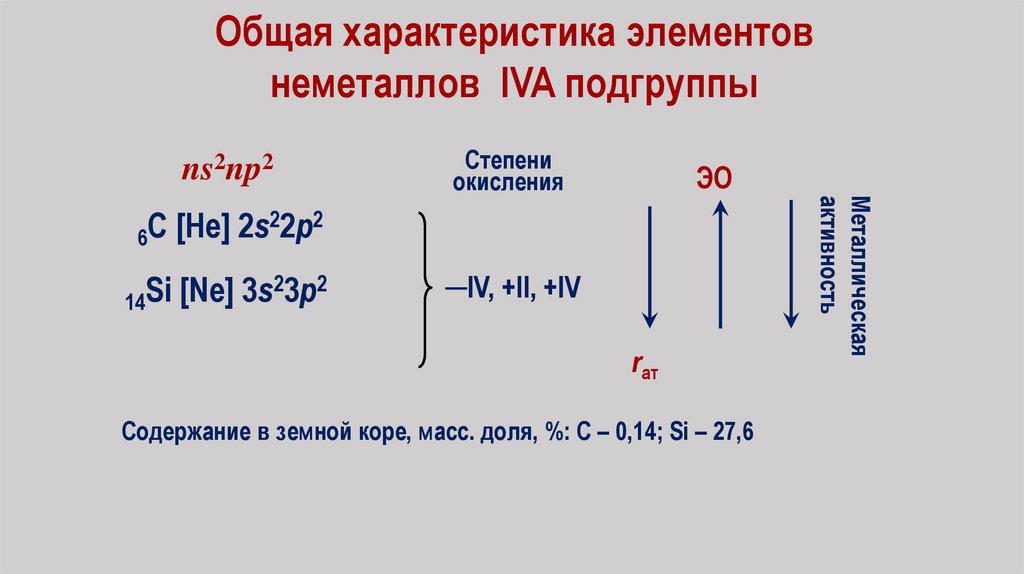
Общая характеристика элементовнеметаллов IVA подгруппы
ns2np2
Степени
окисления
ЭО
23p2
Si
[Ne]
3s
14
─IV, +II, +IV
rат
Содержание в земной коре, масс. доля, %: С – 0,14; Si – 27,6
Металлическая
активность
22p2
С
[He]
2s
6
7. Историческая справка: углерод
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора надпрокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном
нагревании сгорает без остатка, было известно давно. Ещё в 1751 году германский император Франц I согласился
дать алмаз и рубин для опытов по сжиганию. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с
примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье
поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что
алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом
периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 году Потт обнаружил
отсутствие в графите какой-либо примеси свинца. Шееле исследовал графит (1779) и счёл его особым минеральным
углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона. Двадцать лет спустя
Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту. В XVII—
XIX веках в русской химической и специализированной литературе иногда применялся термин «углетвор»;
с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карбо(н) «уголь».
8.
Основные минералы углерода, кремниякальцит
исландский шпат
CaCO3
магнезит
горный хрусталь
MgCO3
SiO2
9. Историческая справка: кремний
В 1823 году Берцелиус впервые смог приготовить кремний и охарактеризовать его в чистом виде.Существование кремния было предсказано им в 1810 году. Впервые в чистом виде кремний был
выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Позже, в 1823 году Берцелиус выделил аморфный кремний путём восстановления фторида
кремния SiF4 калием, очистил продукт до коричневого порошка путём многократной промывки и
подробно
описал
его
химические
свойства.
Новому
элементу
было
дано
название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году
российским химиком Германом Ивановичем Гессом.
10.
Основные минералы углерода, кремния11.
Способы полученияРазложение углеводородов: СН4 → С + Н2
Восстановление:
Применение
SiO2 + C → Si + CO2
SiO2 + Al → Si + Al2O3
C
- сырье для энергетики
- восстановитель в доменном процессе
- органический синтез
Si
- строительная промышленность (силикаты)
- полупроводниковые материалы
- твердые и жаропрочные композиции (карборунд)
12.
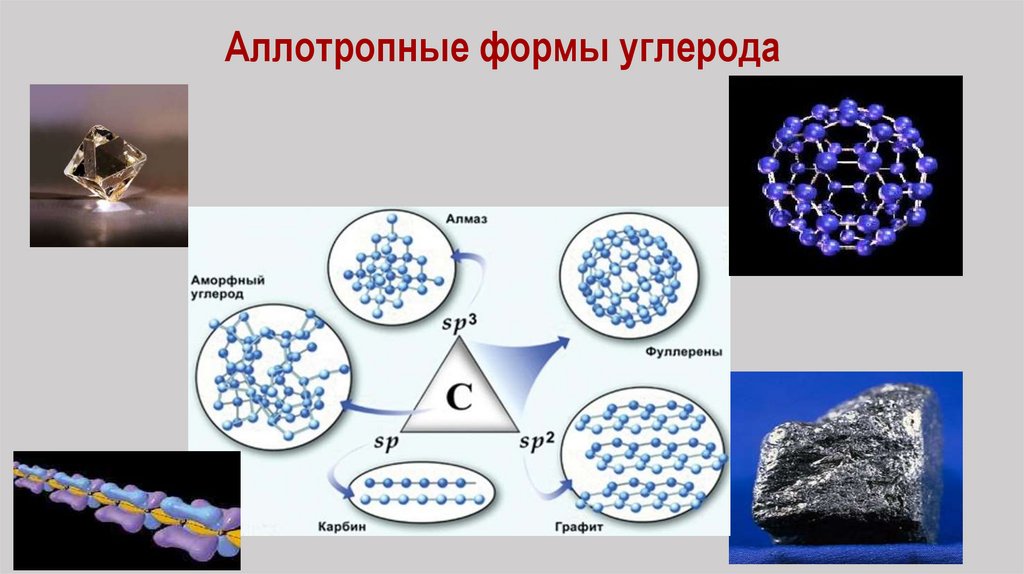
Аллотропные формы углерода13.
Аллотропные формы кремнияАморфный
кремний
Кристаллический кремний
14.
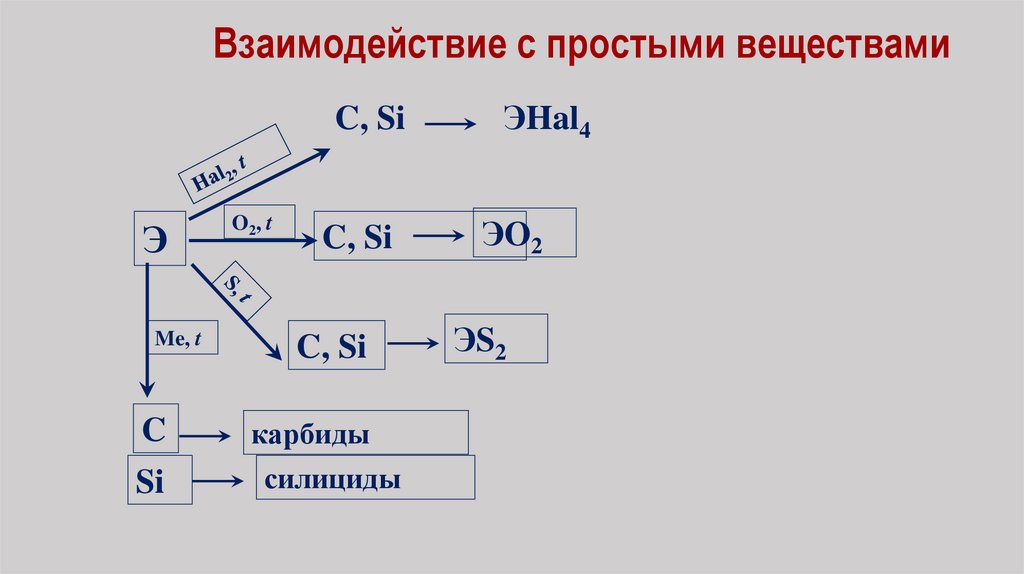
Взаимодействие с простыми веществамиЭ
Me, t
O2 , t
C, Si
ЭHal4
C, Si
ЭO2
C, Si
C
карбиды
Si
силициды
ЭS2
15.
Соединения с водородомCnH2n+2
CnH2n
CnH2n-2 и др.
SinH2n+2
алканы
алкены
алкины, диены
силаны
n = 1-9
n = 1-…
Все ЭН4 - газы
СН4 химически инертен, остальные имеют высокую
реакционную способность.
SiH4 + O2 → SiO2 + H2O - самовоспламеняется на
воздухе
SiH4 + H2O
SiO2 + H2↑
- разлагаются
водой
16.
Оксиды Э(IV)Восстановительные свойства проявляются:
ЭО
CO
у СО – при высокой температуре;
SiO
несолеобразующие
ЭО2
CO2
SiO2
слабокислотные
у SiO – в щелочной среде.
17.
Гидроксиды Э(IV)Угольная кислота и её соли
H2CO3 H2SiO3
Слабые кислоты
H2O + CO2 ⇆ H2CO3
H2CO3 ⇆ H+ + HCO3-
K1 = 4,3·10-7
HCO3- ⇆ H+ + CO32-
К2 = 5,6·10-11
Карбонаты плохо растворимы в воде (за исключением
карбонатов щелочных металлов).
Гидрокарбонаты – растворимы в воде.
Гидролиз солей:
2CO3 + H2O ⇆ HCO3 + OH
18.
Соли угольной кислотыNa2CO3
- сода, углекислая сода
NaHCO3
- питьевая сода
K2CO3
- поташ
CaCO3 - в природе: мел, мрамор, известняк
Временная (карбонатная) жесткость воды:
CaCO3 + CO2+ H2O ⇄ Ca(HCO3)2
Устранение:
t
Ca(HCO3)2 → CaCO3 + H2O + CO2
кипячение
ионный обмен
19.
Кремниевая кислота и её солиxSiO2 · yH2O – поликремниевые кислоты
x = 1, y = 1
H2SiO3 – метакремниевая кислота
x = 1, y = 2
H4SiO4 – ортокремниевая кислота
Соли – силикаты – не растворимы в воде ( за
исключением силикатов щелочных металлов).
Обыкновенное стекло – Na2O · CaO · 6SiO2
Жидкое стекло – водный раствор Na4SiO4
20.
Общая характеристика неметаллов VA подгруппыСтепени
окисления
ns2np3
22p3
N
[He]
2s
7
-III(-II,-I), I, II, III, IV, V
23p3
P
[Ne]
3s
15
-III, (I), III, V
104s24p3
As
[Ar]
3d
33
N2
ЭО
P
- III, III, V
rат
As
21. Историческая справка: азот
В 1772 году Генри Кавендиш провёл опыт: он многократно пропускал воздух над раскалённым углём, затемобрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым воздухом. Сегодня
ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем поглощался
щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот,
но не сумел понять, что это новое простое вещество (химический элемент), и описал его как мефитический воздух
(от англ. mephitic — «вредный»). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли. Джозеф Пристли
в это же время в серии экспериментов связывал кислород воздуха и удалял полученный углекислый газ, то есть также
получал азот, однако, также неверно истолковал полученные результаты — он решил, что выделил флогистированный
(то есть насыщенный флогистоном) воздух.
Шведский химик Карл Шееле летом 1772 года получил азот по методу Кавендиша и исследовал его в течение пяти
лет, затем опубликовал результаты своих исследований. В этой публикации Шееле первым описал атмосферный
воздух как смесь отдельных газов: «огненного воздуха» (кислорода) и «грязного воздуха» (азота). Таким образом,
точно установить первооткрывателя азота не представляется возможным.
22. Историческая справка: фосфор
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пыталсяотыскать философский камень. Он сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая
золотистым цветом, может содержать золото или нечто нужное для его добычи. После нескольких часов интенсивных
кипячений смеси белого песка и выпаренной мочи получились крупицы белого воскоподобного вещества, которое
очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество сначала «холодным огнём», а
затем phosphorus mirabilis (лат. «чудотворный носитель света»).
Открытие фосфора Брандом стало первым открытием химического элемента со времён античности, но существуют
данные, что фосфор умели получать ещё арабские алхимики в XII в. Несколько позже фосфор был получен другим
немецким химиком — Иоганном Кункелем. Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем,
описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и
опубликованной в 1693 году. Более усовершенствованный способ получения фосфора был опубликован в 1743
году Андреасом Маргграфом, а чуть позже Лавуазье доказал достоверное отношение фосфора к простым
веществам.Красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
23. Историческая справка: мышьяк
В 1649 году Лауриот Фабр Кусин — алхимик и фармацевт описал химические свойства и методы получениямышьяка. Кусин обнаружил, что мышьяк является элементом санскрита, который встречается в различных
растениях и минералах. Сульфиды мышьяка As2S3 и As4S4, так называемые аурипигмент («арсеник») и реальгар,
были знакомы римлянам и грекам. Эти вещества ядовиты. Мышьяк является одним из элементов, встречающихся
в природе в свободном виде. Его можно сравнительно легко выделить из соединений. Поэтому история не знает,
кто впервые получил в свободном состоянии элементарный мышьяк. Многие приписывают роль
первооткрывателя алхимику Альберту Великому. В трудах Парацельса также описано получение мышьяка в
результате реакции арсеника с яичной скорлупой. Многие историки науки предполагают, что металлический
мышьяк был получен значительно раньше, но он считался разновидностью самородной ртути.
24.
Аллотропные модификации фосфора25.
фосфоритCa3(PO4)2
арсенопирит
аурипигмент
FeAsS
As2S3
апатит
3Ca3(PO4)2 · CaX2 (X = F, Cl, OH)
26.
ЭН3NH3
аммиак
Э2О3
AsH3
фосфин
арсин
преобладают
кислотные свва
N2O3
P2O3
As2O3
амфотерные
кислотные
HNO2
PH3
H3PO3
Э2О5
N2O5
P2O5
As2O5
HNO3
H3PO4
H3AsO4
Окислительные свойства
H3AsO3
Кислотные свойства
Восстановительные свойства
Кислотные свойства
27.
Химические свойства азотаN2 + 3H2 ⇄ 2NH3 (промышленный
способ получения аммиака)
P = 30 MПа, Т = 500 ºС,
катализатор – губчатое железо
N2
O2, t
NO
нитриды
Li3N (tкомн.)
Mg3N2 (800 oC)
BN, AlN, TiN, TaN - тугоплавкие, коррозионностойкие материалы
28.
Лабораторный способ получения:t
NH4Cl + Ca(OH)2 → NH3↑ + CaCl2 + H2O
Химические свойства аммиака
Реакции присоединения:
NH3 + HCl = NH4Cl
NH3
Реакции замещения:
+K, t
-H2
KNH2
амид
калия
+ K, t
-H2
K2NH
имид
калия
+K, t
-H2
K3N
нитрид
калия
29.
Реакции окисления:t
NH3 + O2 → N2 + H2O
Pt
NH3 + O2 → NO + H2O
ОВР:
NH3 + KMnO4 → N2 + MnO2 + KOH + H2O
30.
Кислородные соединения азотагазы
N2O
NO
N2 O 3
несолеобразующие
Тв., белый
NO2
N2O5
кислотные
Кислотные свойства
Окислительные свойства
N2O – «веселящий» газ (наркоз)
31.
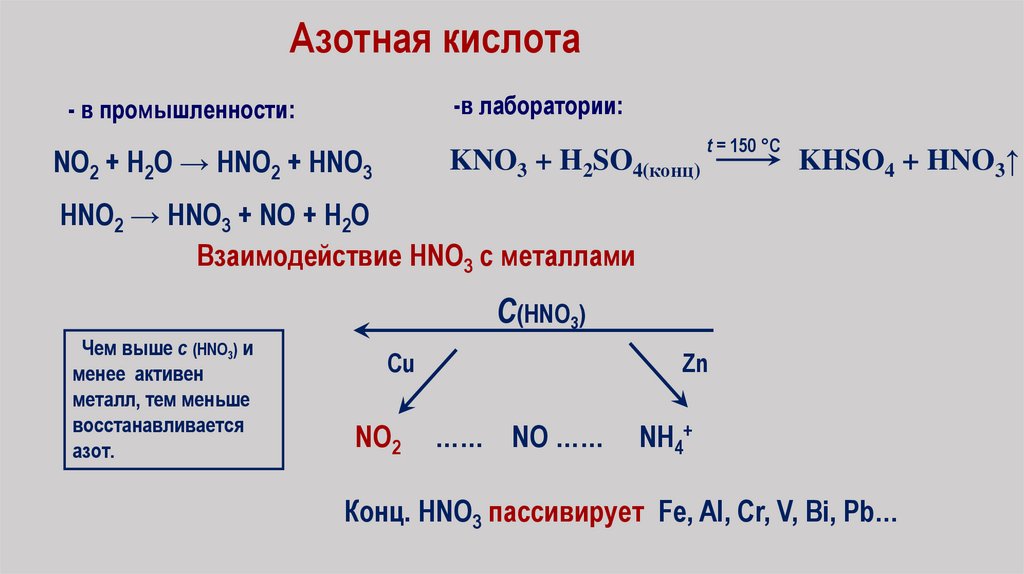
Азотная кислота-в лаборатории:
- в промышленности:
NO2 + H2O → HNO2 + HNO3
KNO3 + H2SO4(конц)
t = 150 °C
KHSO4 + HNO3↑
HNO2 → HNO3 + NO + H2O
Взаимодействие HNO3 c металлами
С(HNO3)
Чем выше c (HNO3) и
менее активен
металл, тем меньше
восстанавливается
азот.
Cu
NO2
Zn
…… NO ……
NH4+
Конц. HNO3 пассивирует Fe, Al, Cr, V, Bi, Pb…
32.
HNO3 не растворяет Au, Pt, Ru, Ir, Os, Ta…Царская водка:
HNO3 + HCl = 1:3
HNO3 + 3HCl = NOCl + 2Cl + 2H2O
хлорид
нитрозила NOCl = NO↑ + Cl
Au + HNO3 + HCl → H[AuCl4] + NO + H2O
Pt + HNO3 + HCl → H2[PtCl6 ] + NO + H2O
Взаимодействие HNO3 с неметаллами
HNO3 + S → H2SO4 + NO
HNO3 + C → CO2↑ + NO2↑ + H2O
HNO3 + P + H2O → H3PO4 + NO
33.
Соли азотной кислотыНитраты всех металлов растворимы в воде
t, °C
c(NH4NO3), г /100 г H2O
20
192
80
580
Окислительная активность нитратов
проявляется в расплавах:
t
Fe2O3 + KNO3 + KOH → K2FeO4 + KNO2 + H2O
t
KNO3 + S → SO2 + KNO2
t
KNO3 + C → CO2 + KNO2
Черный порох:
75% KNO3, 15%
C,
10% S
34.
Нитраты разлагаются при t > 200 - 300 ºCa) металл стоит в ряду напряжений левее Mg:
NaNO3 → NaNO2 + O2↑
б) металл стоит в ряду напряжений от Mg до Cu:
Pb(NO3)2 → PbO + NO2↑ + O2↑
Cu(NO3)2 → CuO + NO2↑ + O2↑
в) металл стоит в ряду напряжений правее Cu:
AgNO3 → Ag + NO2↑ + O2↑
35.
NH4NO3 → N2O↑ + H2O↑(t = 250 ºC)
(t > 500 ºC)
NH4NO3 → N2↑ + O2↑ + H2O,
ΔΗº = -237 кДж
Тривиальные названия нитратов:
взрыв
Калийная (индийская) селитра
- KNO3
Натриевая (чилийская) селитра
- NaNO3
Аммонийная селитра
- NH4NO3
Известковая (норвежская) селитра
- Ca(NO3)2
Бариевая селитра
- Ba(NO3)2
Ляпис
- AgNO3
36.
Азотистая кислота HNO2Получение:
0 C
Ba(NO2)2 + H2SO4 → BaSO4↓ + 2HNO2
N2O3 + H2O = 2HNO2
(Кд ~ 5 ·10-4)
MeNO2 – нитриты; хорошо растворимы
в воде (кроме AgNO2), ядовиты.
В ОВР – двойственная природа:
1) NaNO2 + KI + H2SO4 → NO + I2 + …
Ок-ль
2) NaNO2 + KMnO4+ H2SO4 → MnSO4 + NaNO3+ …
Восст-ль
37.
3) Реакции диспропорционирования:3HNO2 ⇆ HNO3 + 2NO + H2O
Термическое разложение нитритов:
t
- щелочных металлов:
- других металлов:
- благородных металлов:
- аммония:
LiNO2 → Li2O + NO + O2
t
Cd(NO2)2 → CdO + NO + NO2
t
AgNO2 → Ag + NO2
t
NH4NO2 → N2 + H2O
38.
Фосфор – «светоносный»Получение:
1200 ºC
Ca3(PO4)2 + C + SiO2 → CaSiO3 + P↑ + CO
Применение:
- производство спичек, боеприпасов;
- AlP, GaP, InP - полупроводниковые материалы.
Белый фосфор применялся американцами в Ираке при атаке
Фаллуджи для освещения местности и постановки дымовых
завес.
39.
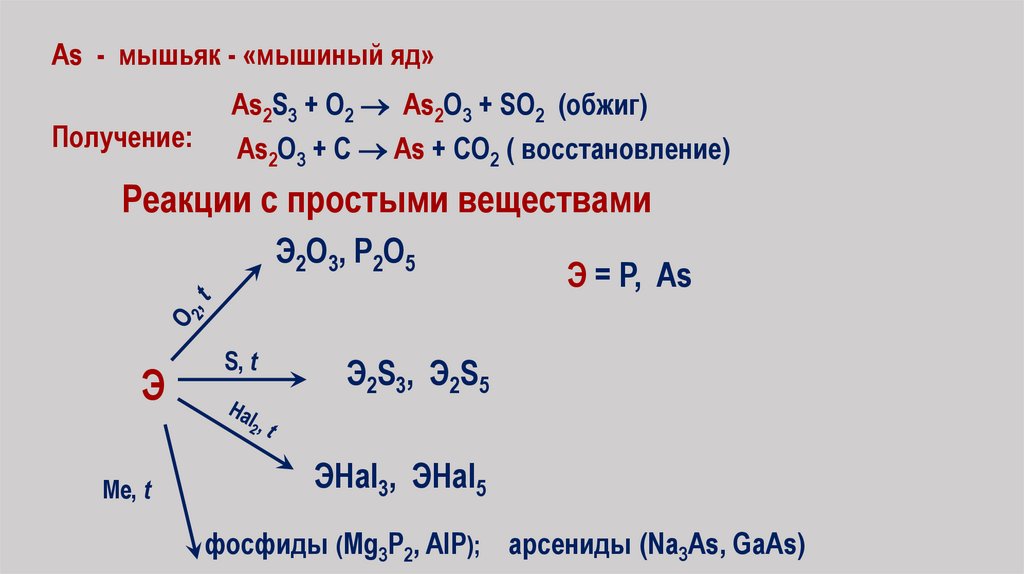
As - мышьяк - «мышиный яд»Получение:
As2S3 + O2 As2O3 + SO2 (обжиг)
As2O3 + C As + CO2 ( восстановление)
Реакции с простыми веществами
Э2О3, Р2О5
Э
Me, t
S, t
Э = P, As
Э2S3, Э2S5
ЭHal3, ЭHal5
фосфиды (Mg3P2, AlP); арсениды (Na3As, GaAs)
40.
Реакции с кислотами и щелочамиH2SO4(разб., конц.)
HNO3(разб) HCl
P+
HNO3(конц)
NaOH(изб)
H2 O
H3PO4 + NO
кипячение
PH3 + NaH2PO2
гипофосфит
натрия
Э = As
Э+
H2SO4(разб)
H2SO4(конц)
H3AsO3
41.
Э = AsHNO3(разб.)
H3AsO4 + NO + H2O
As + HNO3(конц.)
H3AsO4 + NO2 + H2O
As + NaOH
Na3AsO3 + H2↑
42.
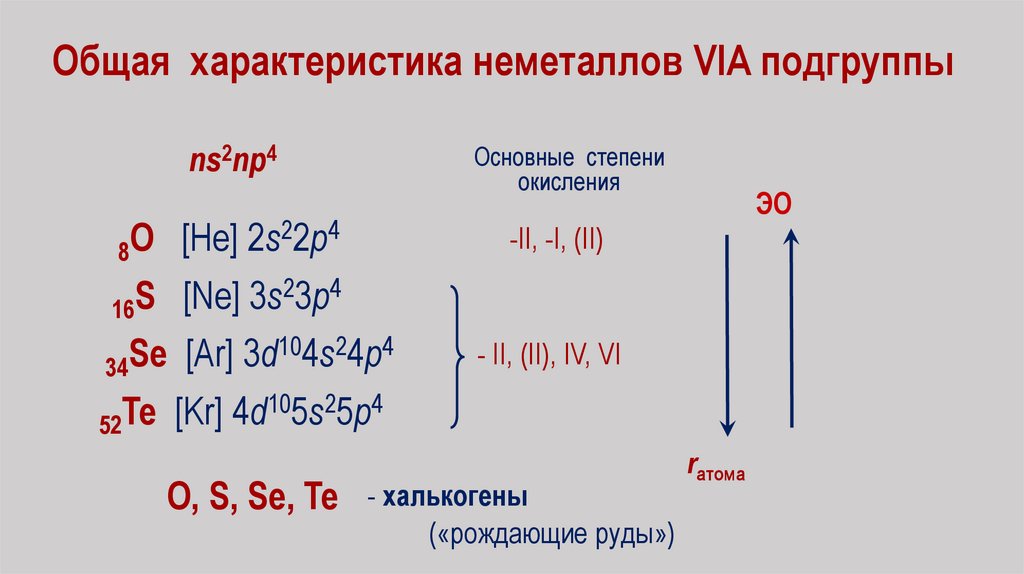
Общая характеристика неметаллов VIA подгруппыns2np4
Основные степени
окисления
22p4
O
[He]
2s
8
23p4
S
[Ne]
3s
16
104s24p4
Se
[Ar]
3d
34
105s25p4
Te
[Kr]
4d
52
О, S, Se, Te
ЭО
-II, -I, (II)
- II, (II), IV, VI
- халькогены
(«рождающие руды»)
rатома
43. Историческая справка: кислород
Английский химик Джозеф Пристли открыл химический элемент с атомным номером 8 — кислород 1 августа 1774года. Он получил этот важный химический элемент путём разложения оксида ртути в герметично закрытом сосуде,
направляя на это соединение солнечные лучи с помощью мощной линзы. Пристли первоначально не понял, что открыл
новое простое вещество. О своём открытии учёный сообщил выдающемуся французскому химику Антуану Лавуазье. В
1775 году Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих
веществах.
Несколькими годами ранее (в 1771 году) кислород также получил шведский химик Карл Шееле. Он
прокаливал селитру с серной кислотой и затем разлагал образующийся оксид азота. Шееле назвал этот газ «огненным
воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что эта книга была опубликована
позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также
сообщил о своём опыте Лавуазье. Лавуазье провёл опыт по сжиганию различных веществ, опубликовав результаты по
изменению веса сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право
утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного
вещества увеличивается, что опровергает теорию флогистона.
44. Историческая справка: сера
Точное время открытия серы не установлено, но этот элемент использовался до нашей эры. Сераиспользовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением
сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе
различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие
выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Простое вещество сера — это светло-жёлтый порошкообразный неметалл, относится к халькогенам. Слово «сера»
заимствовано из старославянского «сѣра» — «сера, смола», вообще «горючее вещество, жир». Латинское sulpureus,
sulphurous впервые использовал древнеримский поэт Квинт Энний. Большие скопления самородной серы (с
содержанием
>25
%)
редки,
они
встречаются
в
местах
вулканической
активности,
им
сопутствуют
сернистые фумаролы и сернистые воды.
Французский химик Антуан Лоран Лавуазье первым охарактеризовал серу как химический элемент. Он обнаружил
выделение газа при сжигании веществ. Как мы теперь знаем, это был сернистый газ. Позже Лавуазье изучил свойства и
природу химического элемента, породившего газ.
45. Историческая справка: теллур
Впервые этот элемент был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором ФранцемЙозефом
Мюллером
(впоследствии
бароном
фон
Райхенштейном)
на
территории
Австро-Венгрии.
В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства. Название «теллур»
произошло от латинского tellus, род. падеж telluris — «Земля». Простое вещество теллур — хрупкий,
малотоксичный редкий полуметалл (иногда его также относят к неметаллам) серебристо-белого цвета. Относится
к халькогенам. По химическим свойствам схож с селеном. Теллур гораздо более распространён во Вселенной в
целом, чем на Земле. Его чрезвычайная редкость в земной коре, сравнимая с редкостью платины, отчасти объясняется
образованием летучего гидрида, из-за которого теллур улетучился в космос в виде газа во время горячей фазы
формирования Земли.
46. Историческая справка: селен
Йёнс Якоб Берцелиус открыл химический элемент селен в 1817 году. Простое вещество селен —это
хрупкий,
блестящий
на
изломе
неметалл
серого
цвета
(данный
цвет
обусловлен
устойчивой аллотропной модификацией, неустойчивые аллотропные модификации придают селену
различные оттенки красного цвета). Название происходит от греч. σελήνη — Луна. Элемент назван так в
связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в
честь Земли).
47.
Аллотропные модификациикислорода
серы
ромбическая
моноклинная
пластическая
48.
Нахождение серы в природеСульфатная руда
Гипс CaSO4 · 2H2O
Самородная сера
Сульфидная руда CuFeS2
Халькопирит (медный колчедан)
49.
Основные способы получения кислородаВ промышленности – ректификацией (разделением) жидкого воздуха.
В лаборатории: KMnO K MnO + MnO + O
4
2
4
2
2
KClO3 KCl + O2 (катализатор - MnO2)
KNO3 KNO2 + O2
серы
FeS + H2SO4 + O2 → S↓ + Fe2(SO4)3 + H2O
Внутри кратера вулкана Иджен (о. Ява, Индонезия).
Расплавленная сера из трещин вулкана конденсируется,
приобретая при охлаждении желтый цвет.
50.
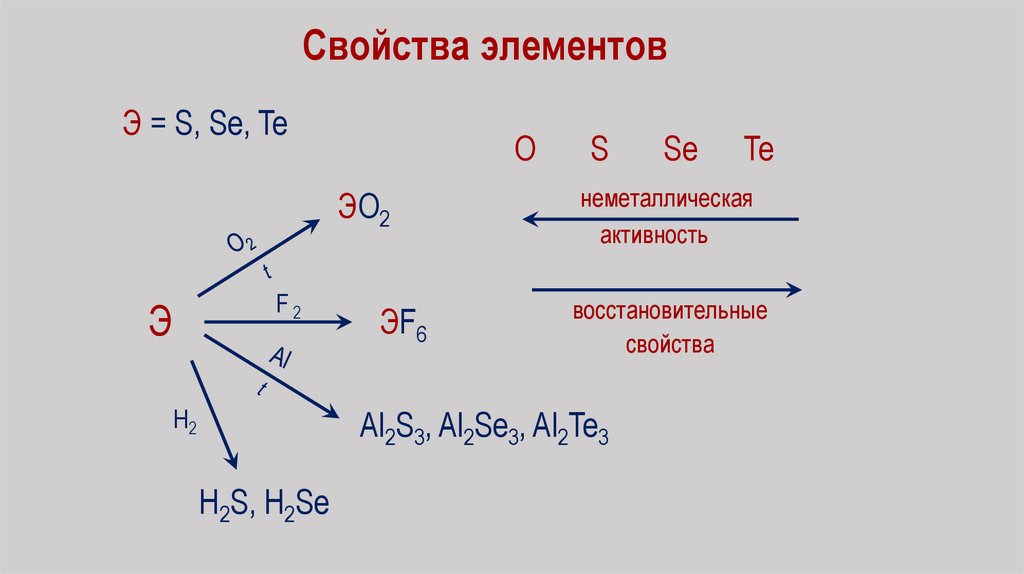
Свойства элементовЭ = S, Se, Te
О
ЭО2
F2
Э
Н2
ЭF6
S
Te
неметаллическая
активность
восстановительные
свойства
Al2S3, Al2Se3, Al2Te3
H2S, H2Se
Se
51.
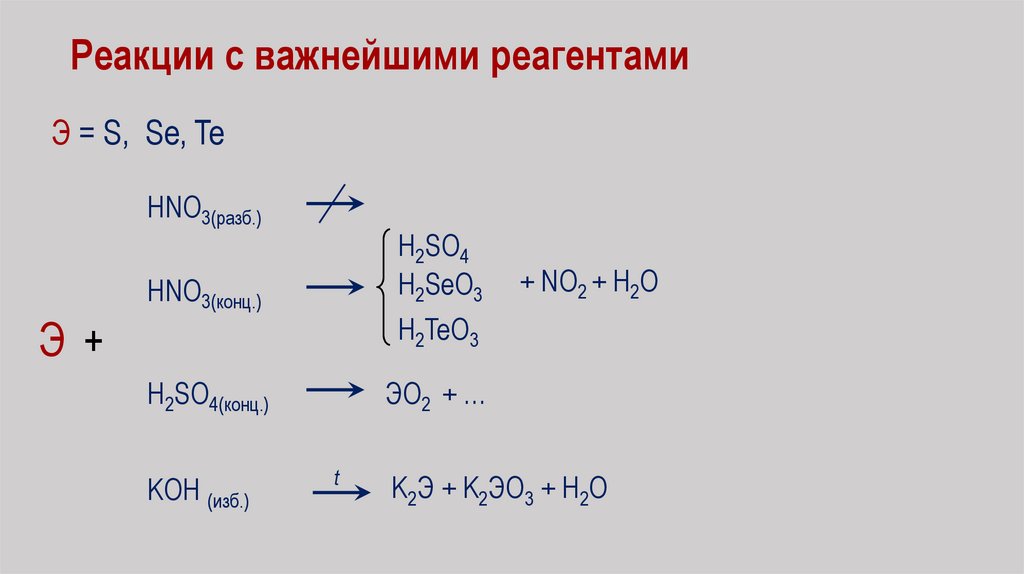
Реакции с важнейшими реагентамиЭ = S, Se, Te
HNO3(разб.)
Э+
HNO3(конц.)
H2SO4
H2SeO3
H2SO4(конц.)
ЭO2 + …
KOH (изб.)
+ NО2 + Н2О
H2TeO3
t
K2Э + K2ЭO3 + H2O
52.
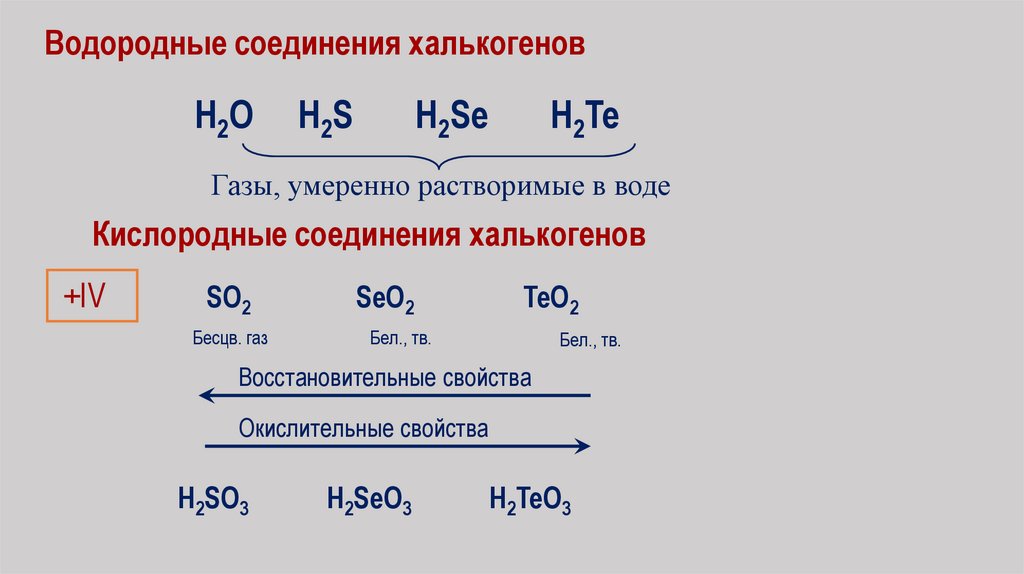
Водородные соединения халькогеновH2O
H2S
H2Se
H2Te
Газы, умеренно растворимые в воде
Кислородные соединения халькогенов
+IV
SO2
Бесцв. газ
SeO2
TeO2
Бел., тв.
Бел., тв.
Восстановительные свойства
Окислительные свойства
H2SO3
H2SeO3
H2TeO3
53.
H2SПолучение:
Химические
свойства
t
H2 + S ⇆ H2S
FeS + HCl → H2S + FeCl2
пирротин
SO2 + H2O
H2S + O2
S + H2O
H2S ⇆ H+ + HS-
К1 ~10-8
HS- ⇆H+ + S2-
K2 ~ 10-14
В водных
растворах:
Na2S + H2O + CO2 = Na2CO3 + H2S↑
54.
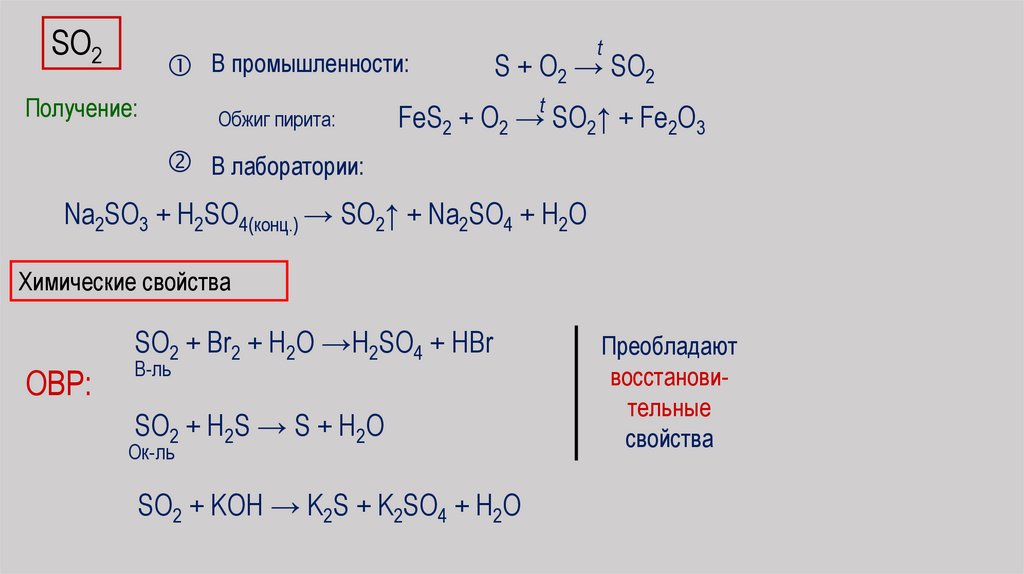
SO2В промышленности:
Получение:
Обжиг пирита:
t
S + O2 → SO2
t
FeS2 + O2 → SO2↑ + Fe2O3
В лаборатории:
Na2SO3 + H2SO4(конц.) → SO2↑ + Na2SO4 + H2O
Химические свойства
ОВР:
SO2 + Br2 + H2O →H2SO4 + HBr
В-ль
SO2 + H2S → S + H2O
Ок-ль
SO2 + KOH → K2S + K2SO4 + H2O
Преобладают
восстановительные
свойства
55.
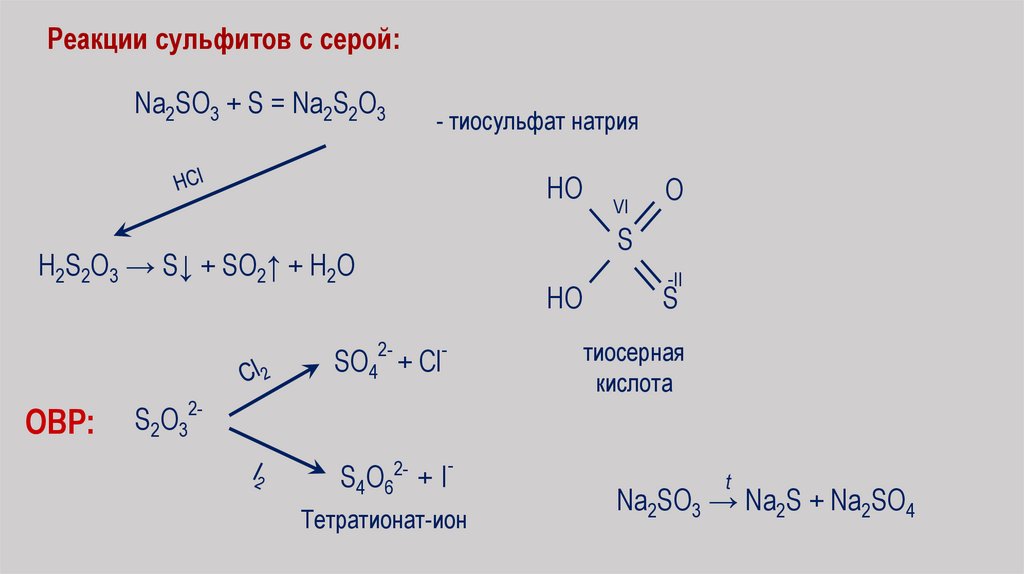
Реакции сульфитов с серой:Na2SO3 + S = Na2S2O3
- тиосульфат натрия
HO
H2S2O3 → S↓ + SO2↑ + H2O
2SO4 + Cl
ОВР:
S2O322S4O6 + I
Тетратионат-ион
VI
O
S
HO
-II
S
тиосерная
кислота
t
Na2SO3 → Na2S + Na2SO4
56.
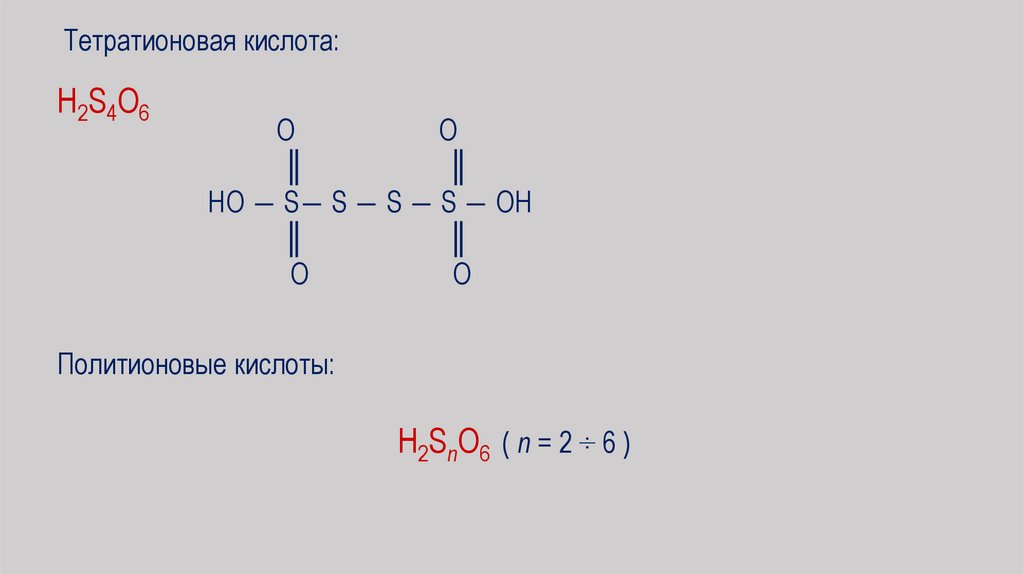
Тетратионовая кислота:H2S4O6
O
O
║
║
HO ― S― S ― S ― S ― OH
║
║
O
O
Политионовые кислоты:
H2SnO6 ( n = 2 ÷ 6 )
57.
+VISO3
бесцв. ж-ть,
t > 17 °C
SeO3
TeO3
бел., тв.
желт., тв.
Кислотные свойства
H2SO4
H2SeO4
бесцв. ж-ть
бел., тв.
H6TeO6 (H2TeO4)
бел., тв.
Окислительная активность
58.
SO3Получение:
V2O5
SO2 + O2 → SO3
H2SO4
Мировое производство H2SO4 – около 200 млн. т в год.
98% р-р H2SO4: ρ = 1,84 г/см3, tкип = 338 ºС
тяжелая маслянистая жидкость без
запаха и цвета
59.
H2SO4(конц.):C12H22O11
сахароза
а) дегидратирующий агент:
H2SO4(конц.)
– 11H2O
12С
б) сильный окислитель:
H2SO4(конц.) + C → CO2 + SO2↑ + H2O
H2SO4(конц.) + Ag → Ag2SO4 + SO2↑+ H2O
H2SO4(конц., хол.) + Fe → пассивация
H2SO4(разб.) + Fe → FeSO4 + H2↑
60.
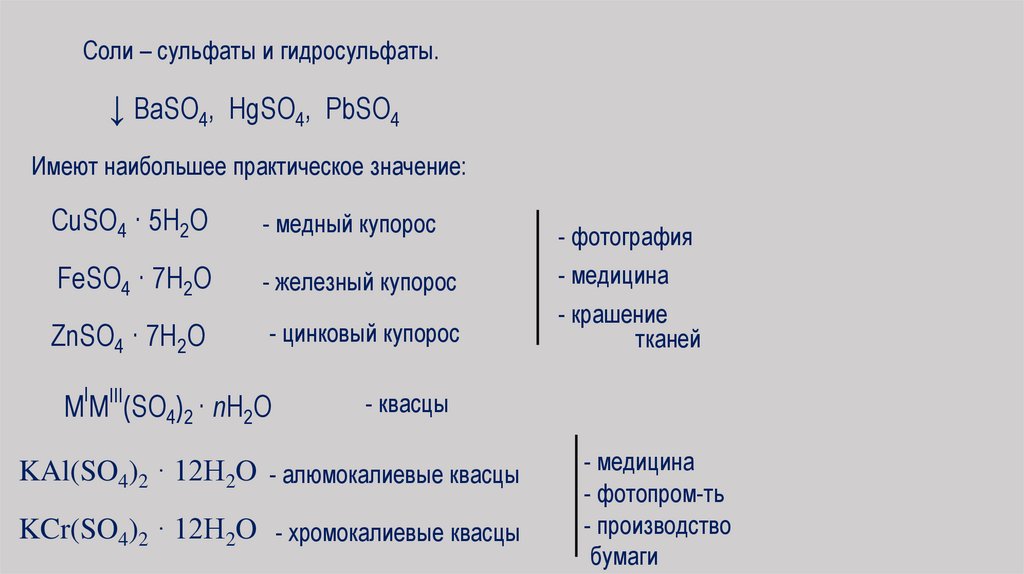
Соли – сульфаты и гидросульфаты.↓ BaSO4, HgSO4, PbSO4
Имеют наибольшее практическое значение:
CuSO4 · 5H2O
- медный купорос
- фотография
FeSO4 · 7H2O
- железный купорос
- медицина
ZnSO4 · 7H2O
- цинковый купорос
- крашение
тканей
I
M MIII(SO4)2 · nH2O
- квасцы
KAl(SO4)2 · 12H2O - алюмокалиевые квасцы
KCr(SO4)2 · 12H2O - хромокалиевые квасцы
- медицина
- фотопром-ть
- производство
бумаги
61.
tCuSO4 → CuO + SO2↑+ O2↑
t
2KHSO4 → K2S2O7 + H2O
пиросульфат калия
H2SO4 · SO3 ≡
n=1
H2S2O7 – пиросерная кислота
O
║
O
║
HO − S − O − S − OH
O
║
O
║
H2SO4 · nSO3 – полисерные кислоты
62.
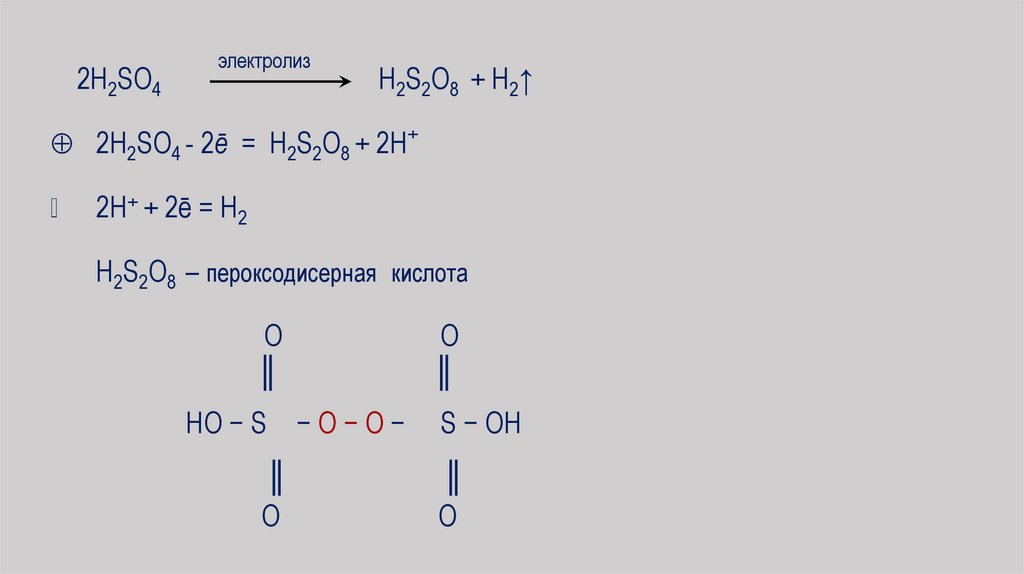
2H2SO4электролиз
H2S2O8 + H2↑
2H2SO4 - 2ē = H2S2O8 + 2H+
2H+ + 2ē = H2
H2S2O8 – пероксодисерная кислота
HO − S − O − O −
O
║
S − OH
O
║
O
║
O
║
63.
H2S2O8 и её соли – пероксодисульфаты –сильнейшие окислители
S2O82- + Cr3+ + H2O → Cr2O72- + SO42- + H+
H2S2O8 + H2O → H2SO4 + H2O2
64.
Общая характеристика неметаллов VIIA подгруппы«Галогены» в переводе с греческого означает «рождающие соли»
Элемент
Электронная формула
9F
1s22s22p5
17Cl
[Ne]3s23p5
35Br
[Ar]3d104s24p5
53I
[Kr]4d105s25p5
85At
[Xe]4f145d106s26p5
Степени
окисления
-I
- I, I, III, V, VII, (IV,VI)
- I, I, III, V, VII
65. Историческая справка: фтор
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор».В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он
выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Дэви изучил
растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в
свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого
водорода, содержащего примесь кислого фторида калия KHF2.
Название «фтор» (от др.-греч. φθόριος — разрушительный), предложенное Андре Ампером в 1816 году,
употребляется в русском, греческом и некоторых других языках. Во многих же других странах приняты названия,
производные от старинных названий минерала флюорита CaF2, (лат. fluere — течь): например, тот же Ампер в
письме Дэви от 6 августа 1812 предложил слово fluorine.
66. Историческая справка: хлор
Хлор (от др.-греч. χλωρός — «изжелта-зелёный», от лат. Chlorum). Хлор был получен в 1774 г. шведскимхимиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной
кислотой в своём трактате о пиролюзите: 4HCl+MnO2→MnCl2+Cl2↑+2H2O Шееле отметил запах хлора, схожий с
запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие
свойства. Бертолле и Лавуазье в рамках кислородной теории кислот обосновали, что новое вещество должно быть
оксидом гипотетического элемента мурия. Однако попытки его выделения оставались безуспешными вплоть до работ Г.
Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор, доказав элементарную природу
последнего. В 1811 г. Дэви предложил для нового элемента название «хлорин» (chlorine). Спустя год Ж. ГейЛюссак «сократил» французское название до хлора (chlore), хотя в английском языке оно осталось прежним. В том же
1811 г. немецкий физик Иоганн Швейгер предложил для хлора название «галоген» (дословно солерод), однако
впоследствии этот термин закрепился за всей 17-й (VIIA) группой элементов, в которую входит и хлор. В 1826 году
атомная
масса
хлора
была
с
высокой
точностью
определена
Берцелиусом (отличается от современных данных не более чем на 0,1 %).
шведским
химиком
Йёнсом
Якобом
67. Историческая справка: бром
Бром был независимо открыт двумя химиками: Карлом Якобом Лёвихом в 1825 году, и Антуаном Жеромом Баларом в1826 году. Балар заметил бурое окрашивание при прибавлении хлорной воды к маточному раствору бассейнов, в
которых из рассолов кристаллизовалась поваренная соль. Долгое время наполняя такие бассейны свежей морской
водой, собирая поваренную соль и не сливая остатков, в них накапливают бромиды, которые содержатся в морской
воде в незначительных количествах и не кристаллизуются с солью, потому что не достигают насыщения. Балар дал
открытому элементу название «мурид», но по предложению проверявшей его открытие комиссии Парижской Академии
наук (Воклен, Тенар, Гей-Люссак) изменил его на закрепившееся «бром» от греческого «бромос» — «вонь». В России
бром под именем «вромий» стал известен в 1827 году после доклада профессора А. Иовского на публичном заседании
в Московском Университете. В том же году в журнале «Указатель открытий по физике, химии, естественной истории и
технологии» оповестил об открытии брома профессор Н. П. Щеглов.
68. Историческая справка: йод
Ио́д (от греч. ἰώδης — «фиалковый (фиолетовый)») Простое вещество иод (при нормальных условиях) —это
кристаллы
(формула
—
I2)
чёрно-серого
цвета
с
фиолетовым
металлическим
блеском,
проявляющие неметаллические свойства и издающие характерный запах. Легко образует фиолетовые пары,
обладающие резким запахом. Элементарный иод высокотоксичен. Иод был открыт в 1811 году Куртуа. При
кипячении серной кислоты с рассолом золы морских водорослей он наблюдал выделение фиолетового пара, при
охлаждении превращающегося в тёмные кристаллы с ярким блеском.
Элементная природа иода установлена в 1811—1813 годах Л. Ж. Гей-Люссаком (а чуть позже — и Х. Дэви). ГейЛюссак получил также многие производные (HI, HIO3, I2O5, ICl и др.).
69.
CaF2ФЛЮОРИТ
Кридит
Ca3Al2F8(OH)2(SO4)∙2H2O
Апатит
Ca5(PO4)3F, Cl Фосфорит
Галит (NaCl)
Сильвин (KCl)
70.
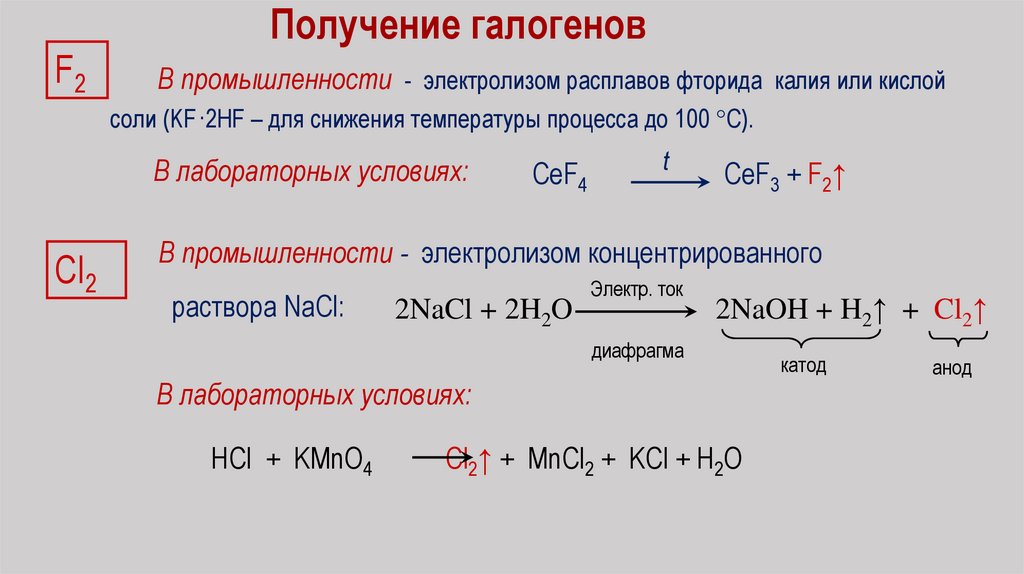
F2Получение галогенов
В промышленности - электролизом расплавов фторида калия или кислой
соли (KF·2HF – для снижения температуры процесса до 100 С).
В лабораторных условиях:
Сl2
CeF4
t
CeF3 + F2↑
В промышленности - электролизом концентрированного
раствора NaCl:
2NaCl + 2H2O
Электр. ток
2NaOH + H2↑ + Cl2↑
диафрагма
В лабораторных условиях:
HCl + KMnO4
Cl2↑ + MnCl2 + KCl + H2O
катод
анод
71.
Br2 и I2В промышленности - извлечением из морских и
буровых вод (I2 – из морских водорослей)
2MBr
2MI
+ Cl2
pH = 3,5
Br2 + 2MCl
I2 + 2MCl
В лаборатории:
KI + MnO2 + H2SO4 → I2 + MnSO4 + K2SO4 + H2O
72.
Физические свойства галогеновжидкость
коричневого цвета
хлор легко сжижается
(tкип = –34 C)
тёмно-фиолетовые
кристаллы
кристаллы газ
73.
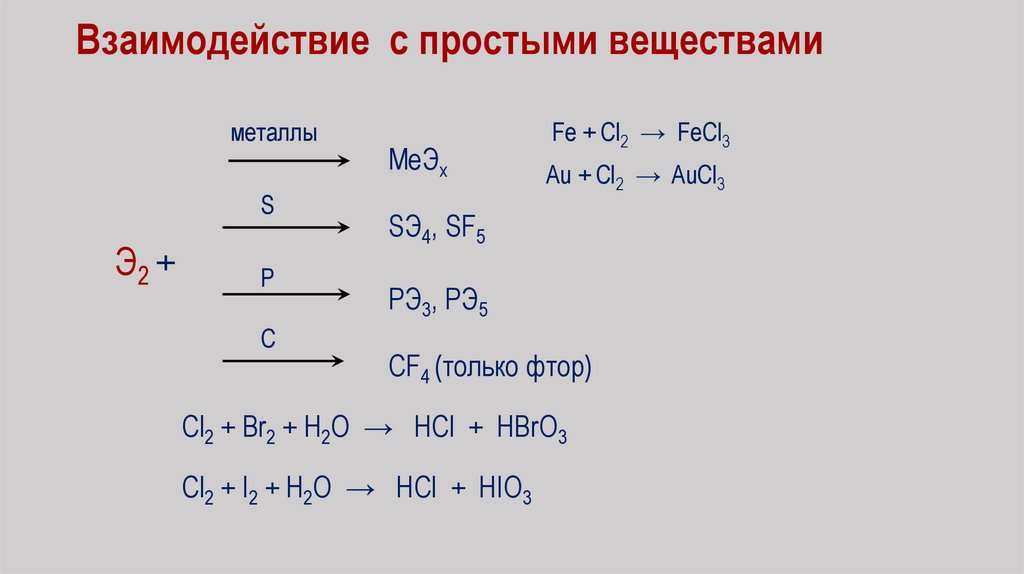
Взаимодействие с простыми веществамиметаллы
S
Э2 +
Р
С
MeЭх
Fe + Cl2 → FeCl3
Au + Cl2 → AuCl3
SЭ4, SF5
PЭ3, РЭ5
CF4 (только фтор)
Cl2 + Br2 + H2O → HCl + HBrO3
Cl2 + I2 + H2O → HCl + HIO3
74.
Окислительная способность Cl2, Br2, I2 ниже, чем F20
-I
+I
Cl2 + H2O ⇄ HCl + HClO (Br2 , I2)
-I
0
Br2 + KOH
+I
KBr + KBrO + H2O
-I
+V
KBr + KBrO3 + H2O
I2 + HNO3 (конц.) → HIO3 + NO2 + H2O
Cl2 (Br2) + HNO3 (конц.) →
(Cl2, I2)
75.
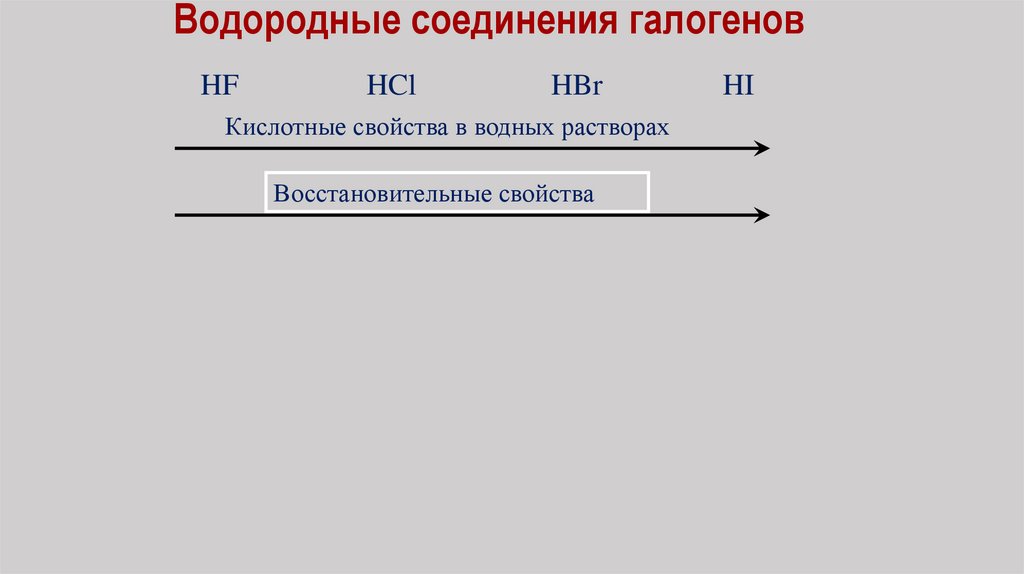
Водородные соединения галогеновHF
HCl
HBr
Кислотные свойства в водных растворах
Восстановительные свойства
HI
76.
Свойства и получение фтороводородаCaF2 + H2SO4(конц.) = 2HF + CaSO4
плавиковый
шпат
HF(г) + SiO2 SiF4 + 2H2O
HF(ж) + SiO2 H2[SiF6 ] + H2O
кремнефтористая кислота
HF нельзя хранить в стеклянной посуде!
77.
HFВ водных растворах молекулы ассоциированы
(водородные связи!) - H2F2, H3F3
HF ⇆ H+ + F ̶
Kд = 7 ∙ 10-4
Фтороводородная кислота может образовывать
кислые соли:
F ̶ + HF ⇆ HF2 ̶
2HF + KOH
KHF2 + H2O
Большинство фторидов малорастворимы в воде.
Растворимые фториды: NaF, KF, AlF3, AgF, SnF2
Все соли очень ядовиты!
78.
Основной способ промышленногополучения:
H2 + Cl2
hν
2HCl
Раствор HCl в воде – соляная кислота
Ме + HCl
НСl конц:
ωHCl ~ 37%
ρ = 1,19 г/см3
МеClх + Н2
Большинство хлоридов хорошо растворимы в воде
Малорастворимые соли: AgCl, CuCl, PbCl2, Hg2Cl2
79.
Восстановительные свойства галогеноводородовHF - не проявляет восстановительных свойств
-I
0
HCl(конц.) + K2Cr2O7 → Cl2 + CrCl3 + KCl + H2O
восстановитель
HCl + H2SO4(конц.)
IV
HBr + H2SO4(конц.) → Br2 + SO2 + H2O
-II
HI + H2SO4(конц.) → I2 + H2S + H2O
80.
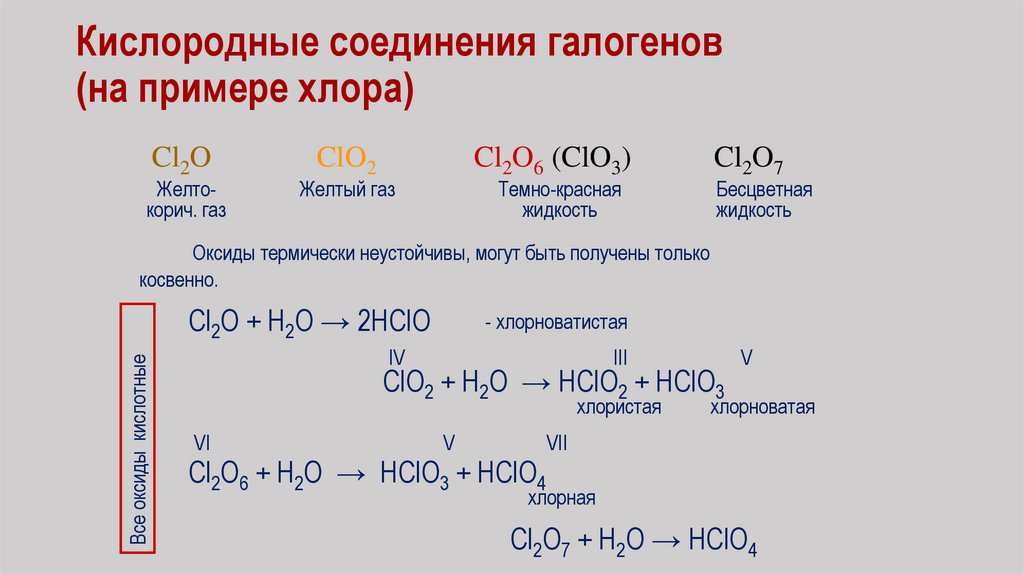
Кислородные соединения галогенов(на примере хлора)
Cl2O
Желтокорич. газ
ClO2
Cl2O6 (ClO3)
Желтый газ
Темно-красная
жидкость
Cl2O7
Бесцветная
жидкость
Оксиды термически неустойчивы, могут быть получены только
косвенно.
Все оксиды кислотные
Cl2O + H2O → 2HClO
- хлорноватистая
IV
III
ClO2 + H2O → HClO2 + HClO3
хлористая
VI
V
V
хлорноватая
VII
Cl2O6 + H2O → HClO3 + HClO4
хлорная
Cl2O7 + H2O → HClO4
81.
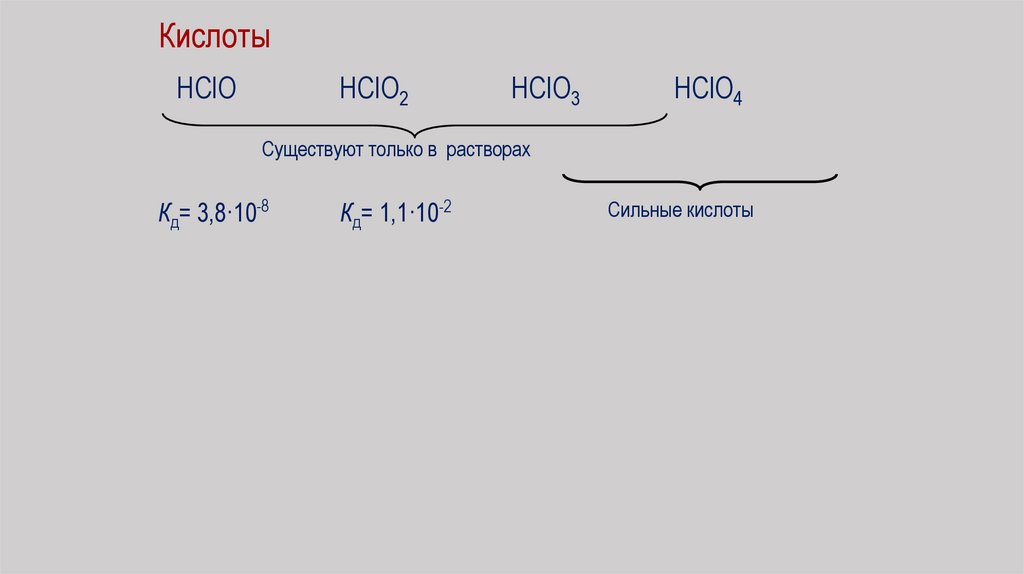
КислотыHClO
HClO2
HClO3
HClO4
Существуют только в растворах
Кд= 3,8·10-8
Кд= 1,1·10-2
Сильные кислоты
82.
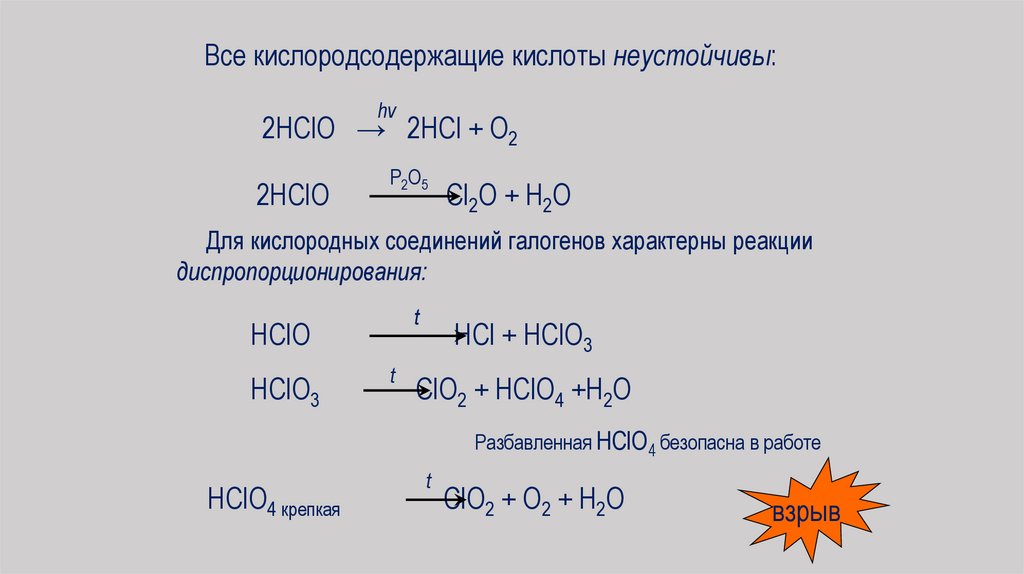
Все кислородсодержащие кислоты неустойчивы:hν
2HClO → 2HCl + O2
2HClO
P2O5
Cl2O + H2O
Для кислородных соединений галогенов характерны реакции
диспропорционирования:
t
HClO
HClO3
t
HCl + HClO3
ClO2 + HClO4 +H2O
Разбавленная HClO4 безопасна в работе
HClO4 крепкая
t
ClO2 + O2 + H2O
взрыв
83.
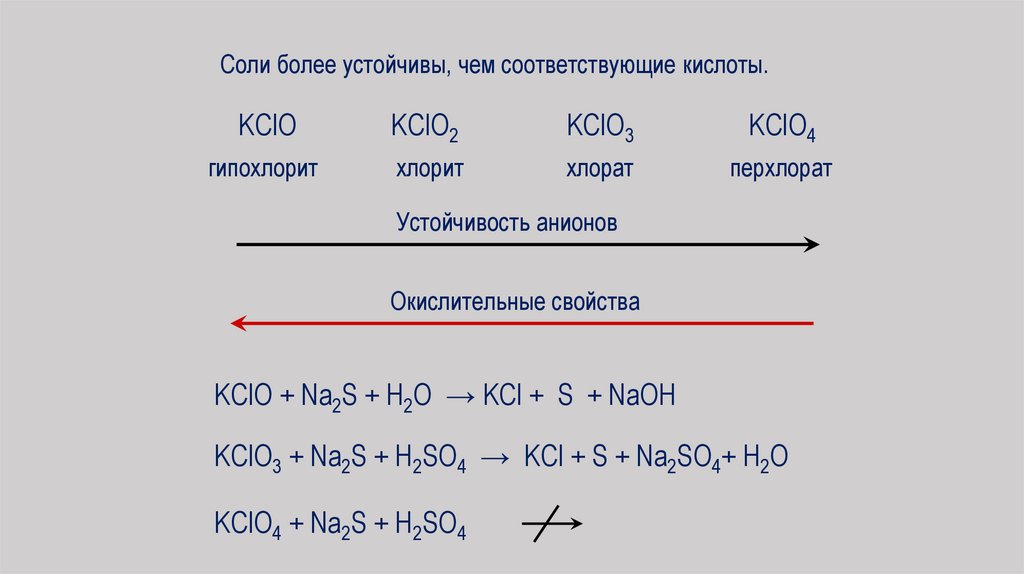
Соли более устойчивы, чем соответствующие кислоты.KClO
KClO2
KClO3
KClO4
гипохлорит
хлорит
хлорат
перхлорат
Устойчивость анионов
Окислительные свойства
KClO + Na2S + H2O → KCl + S + NaOH
KClO3 + Na2S + H2SO4 → KCl + S + Na2SO4+ H2O
KClO4 + Na2S + H2SO4
84.
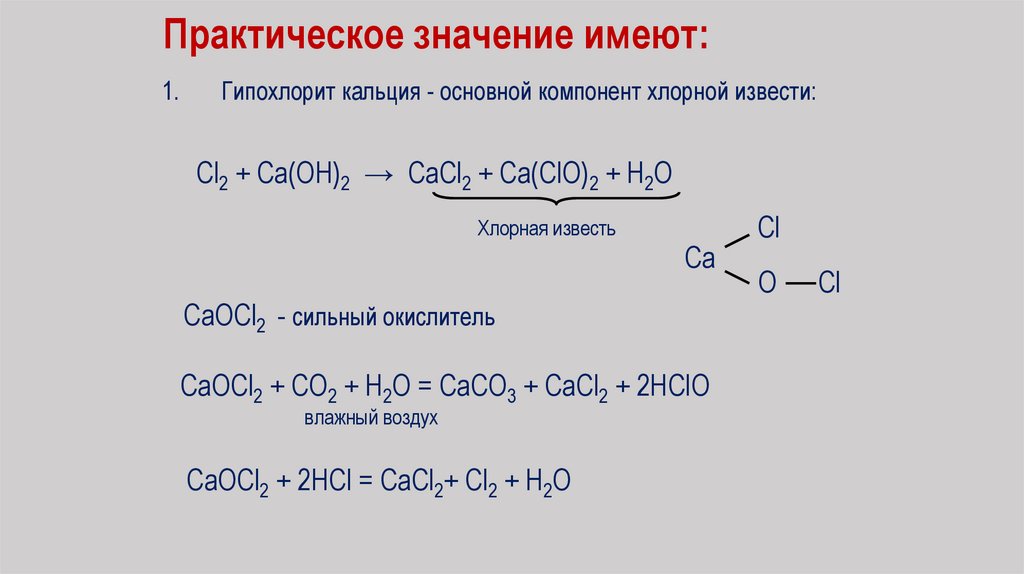
Практическое значение имеют:1.
Гипохлорит кальция - основной компонент хлорной извести:
Cl2 + Ca(OH)2 → CaCl2 + Ca(ClO)2 + H2O
Хлорная известь
Ca
CaOCl2 - сильный окислитель
CaOCl2 + CO2 + H2O = CaCO3 + CaCl2 + 2HClO
влажный воздух
CaOCl2 + 2HCl = CaCl2+ Cl2 + H2O
Cl
O
Cl
85.
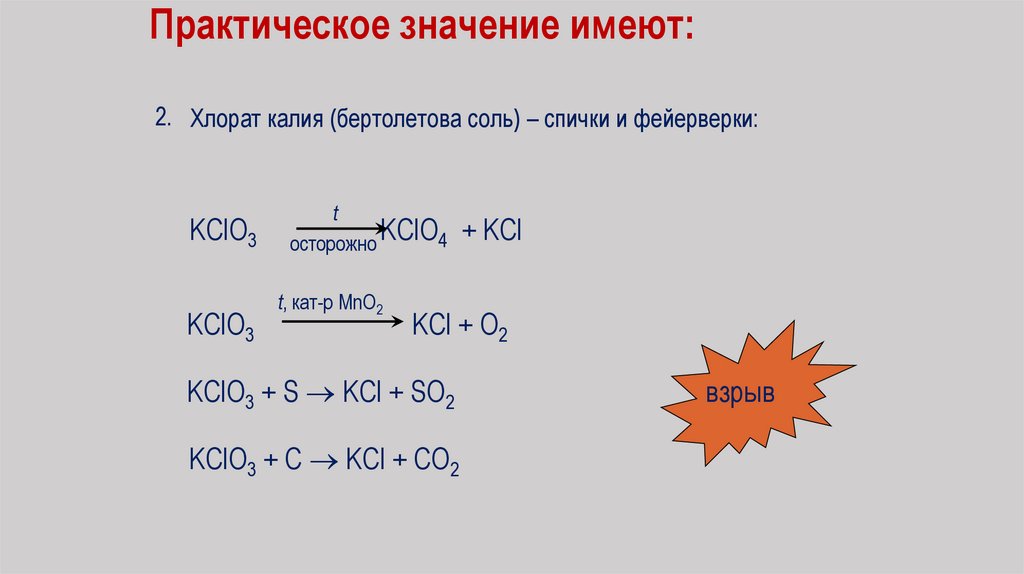
Практическое значение имеют:2. Хлорат калия (бертолетова соль) – спички и фейерверки:
KClO3
KClO3
t
KClO4 + KCl
осторожно
t, кат-р MnO2
KCl + O2
KClO3 + S KCl + SO2
KClO3 + C KCl + CO2
взрыв
86.
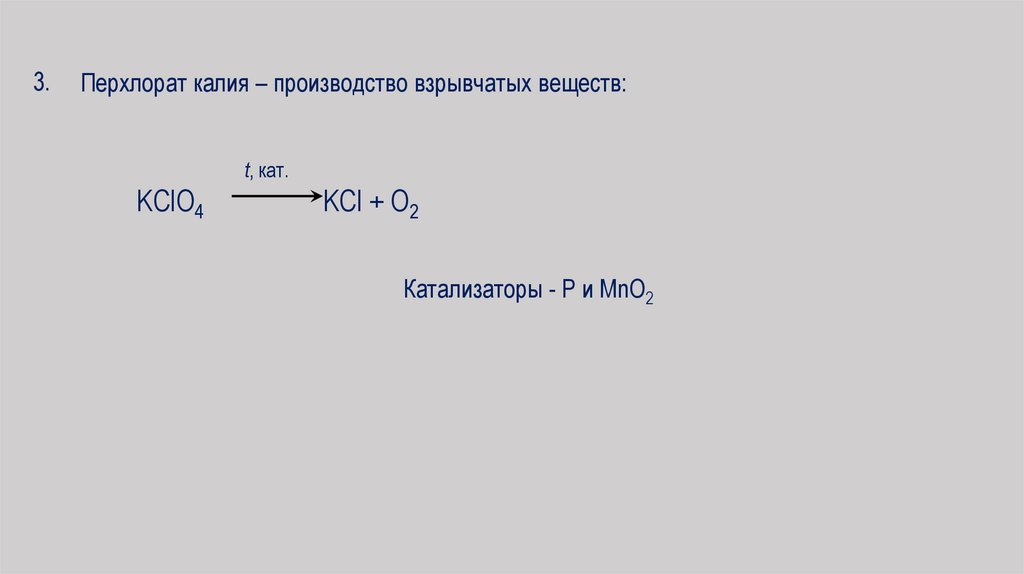
3.Перхлорат калия – производство взрывчатых веществ:
t, кат.
KClO4
KCl + O2
Катализаторы - Р и MnO2































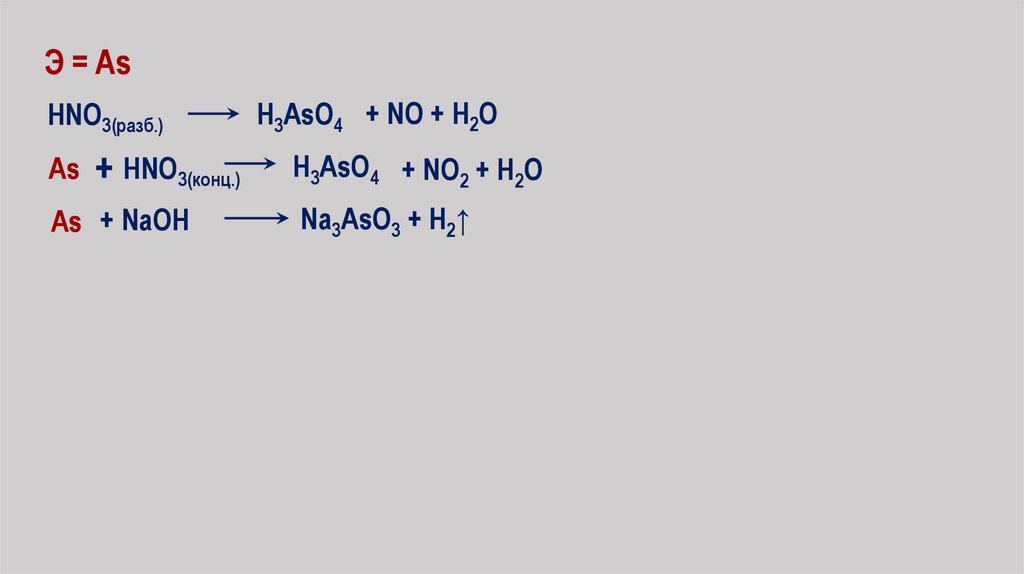


























 chemistry
chemistry








