Similar presentations:
D-элементы: хром, молибден, вольфрам
1.
ХИМИЯ d-ЭЛЕМЕНТОВ.Хром, молибден, вольфрам
Лекция № 13
2.
Особенности химии d-элементов:- все d-элементы являются металлами, но менее активными,
чем s-металлы, металлы часто склонны к пассивации;
- d-элементы (кроме 3 и 12 (Zn, Cd) групп) проявляют в
соединениях несколько степеней окисления;
- для
d-элементов
особенно
свойственно
комплексообразование;
- cоединения d-элементов часто бывают окрашенными
(кроме d0 и d10).
3.
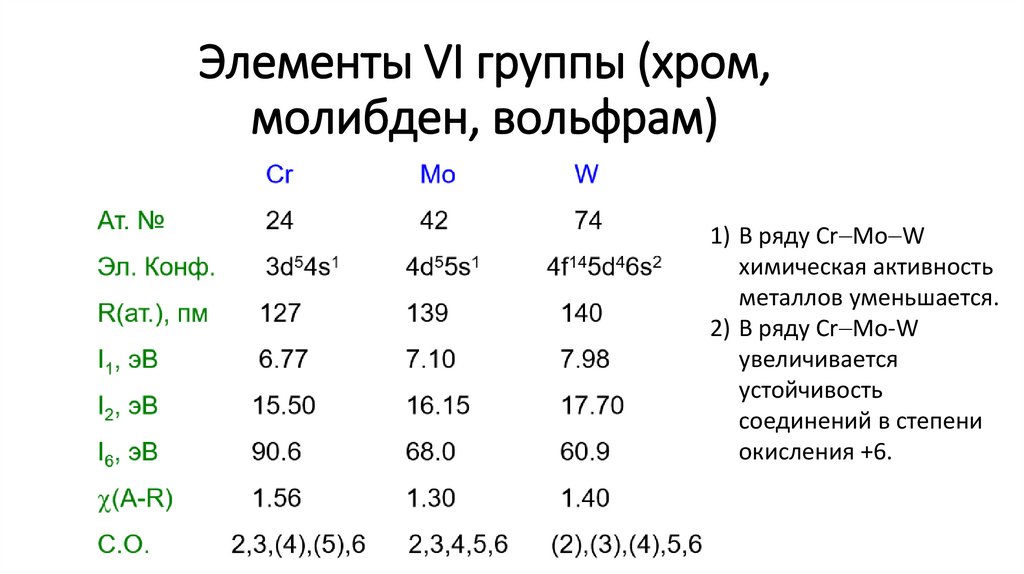
Элементы VI группы (хром,молибден, вольфрам)
1) В ряду Cr Mo W
химическая активность
металлов уменьшается.
2) В ряду Cr Mo-W
увеличивается
устойчивость
соединений в степени
окисления +6.
4.
Свойства металлов VI группыМеталлы склонны
к пассивации.
5.
Хром• [Ar] 3d54s1.
Характерные степени окисления +2, +3, +6.
• Наиболее характерна степень окисления +3.
• Хром – металл, склонный к пассивации (пассивируется H2SO4 конц,
HNO3конц и царской водкой при комнатной температуре).
• Растворяется в кислотах-неокислителях и разбавленных растворах
кислот-окислителей. Неустойчив в присутствии хлорид-ионов:
Cr + 2 HCl CrCl2 + H2 (без доступа воздуха)
4 Cr + 3 O2 + 12 HCl 4 CrCl3 + 6 H2O (в атмосфере воздуха)
10 Cr + 36 HNO3разб 10 Cr(NO3)3 + 3 N2 + 18 H2O.
• При сильном нагревании пассивация может быть снята:
t
2 Cr + 6 H2SO4конц
Cr2(SO4)3 + 3 SO2 + 6 H2O.
• Устойчив к действию растворов щелочей.
6.
Химические свойства хрома (продолжение)• Может быть окислен в щелочном плаве:
C
K2CrO4 + 3 KNO2 + H2O.
Cr + 3 KNO3 + 2 KOH 450
• Окисляется кислородом при нагревании:
C
4 Cr + 3 O2 400
2 Cr2O3.
• Окисляется парами воды при сильном нагревании:
C
2 Cr + 3 H2O 900
Cr2O3 + 3 H2.
• Окисляется галогенами:
- 1200 C 2 CrCl .
2 Cr + 3 Cl2 1100
3
• При нагревании может реагировать со многими неметаллами:
7.
Получение хрома• Минералы хрома:
Хромит
(хромистый
железняк)
FeO·Cr2O3
Крокоит
PbCrO4
• Получение феррохрома (60 % Cr, ~5 % C, ~8 % Si):
t
• FeCr2O4 + 4C
Fe + 2Cr + 4 CO.
феррохром
8.
Получение хромаt
4 FeCr2O4 + 7 O2 + 8 Na2CO3
8 Na2CrO4 + 2 Fe2O3 + 8 CO2
• 2 Na2CrO4 + 2 H2SO4 + 2 KCl K2Cr2O7 + 2 NaHSO4 + 2NaCl + H2O
t
K2CO3 + Cr2O3 + CO
• K2Cr2O7 + 2C
t
2 Cr + Al2O3 (в шихту добавляют
• Алюмотермия 2 Al + Cr2O3
бихромат для инициирования реакции, известняк для связывания
кремнезема).
Чистый хром получают гидрометаллургическим методом:
2Cr2(SO4)3 + 6 H2O –электролиз 4 Cr + 3 O2 + 6 H2SO4.
9.
Соединения Cr(0). Карбонильные комплексы хрома[Cr(CO)6] – бесцветное летучее соединение молекулярного
строения. Получение прямым синтезом из хрома и CO
невозможно, т.к. хром покрыт плотной оксидной пленкой.
Получение:
CrCl3 + 6 CO + Al (p, 140 C) [Cr(CO)6] + AlCl3.
Свойства:
1. Разложение при нагревании:
[Cr(CO)6] (200 C) Cr + 6 CO.
2. Окисление:
4 [Cr(CO)6] + 15 O2 (t) 2 Cr2O3 + 24 CO2
[Cr(CO)6] + 18 HNO3 Cr(NO3)3 + 15 NO2 + 6 CO2 + 9 H2O.
3. Восстановление до отрицательных степеней окисления
хрома:
[Cr(CO)6] + 2 Na(Hg) (THF) Na2[Cr 2(CO)5] + CO
2 [Cr(CO)6] + 2 Na[BH4] (NH3ж) Na2[Cr2(CO)10] + B2H6 + H2 +2 CO.
4. Реакция с раствором щелочей. Образование гидридного
комплекса:
[Cr(CO)6] + KOH K[Cr(CO)5H] + CO2.
10.
Нитрозил хрома. Металлорганическиекомплексы хрома
[Cr(CO)6] + 4 NO [Cr(NO)4] + 6 CO.
NO – трехэлектронный донор (NO+). Фрагмент M N O линейный.
Дибензолхром:
CrCl3 + 2 C6H6 + Al Cr(C6H6)2 + AlCl3
(везде – CrCl3 безводный! Cr2O3 + 3 C + 3 Cl2 (t) 2 CrCl3 + 3 CO)
Хромоцен:
CrCl2 + 2 Nacp Cr(cp)2 + 2 NaCl.
11.
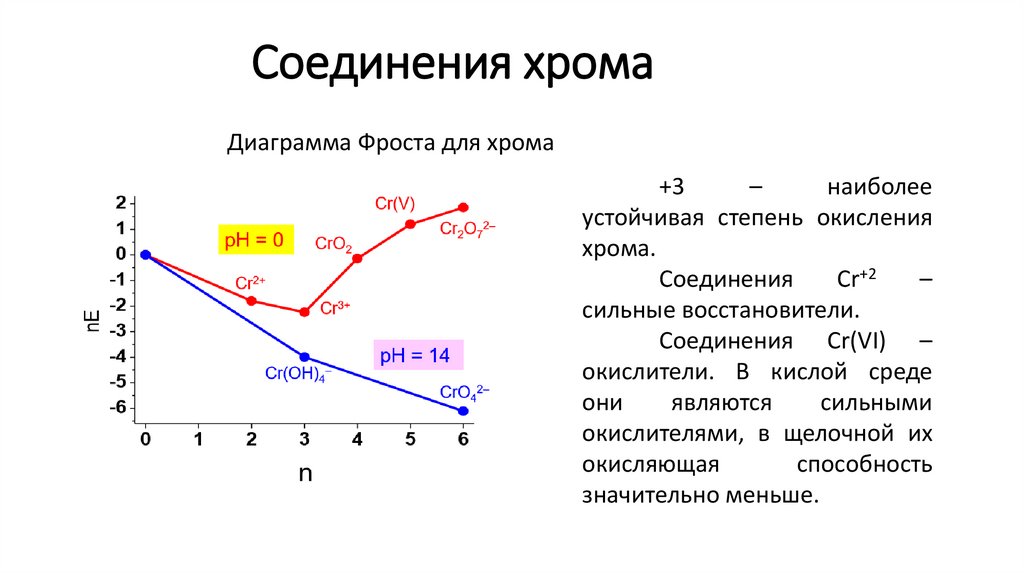
Соединения хромаДиаграмма Фроста для хрома
+3
–
наиболее
устойчивая степень окисления
хрома.
Соединения
Cr+2
–
сильные восстановители.
Соединения Cr(VI) –
окислители. В кислой среде
они
являются
сильными
окислителями, в щелочной их
окисляющая
способность
значительно меньше.
12.
Соединения Cr(II)• Сильные восстановители
Получение в растворе:
Cr2(SO4)3 + Zn –(H+) 2 CrSO4 + ZnSO4
Неполное восстановление Cr3+ можно провести и
электрохимически.
Соединения Cr(II) имеют только основный характер:
CrCl2 + 2 NaOH –(без доступа воздуха) Cr(OH)2 (желтый) + 2 NaCl
t
Cr(OH)2
(без доступа воздуха) CrO (черный) + H2O
Cr(OH)2 + H2SO4 (p-p) (без доступа воздуха) CrSO4 (небесноголубой) + 2 H2O.
13.
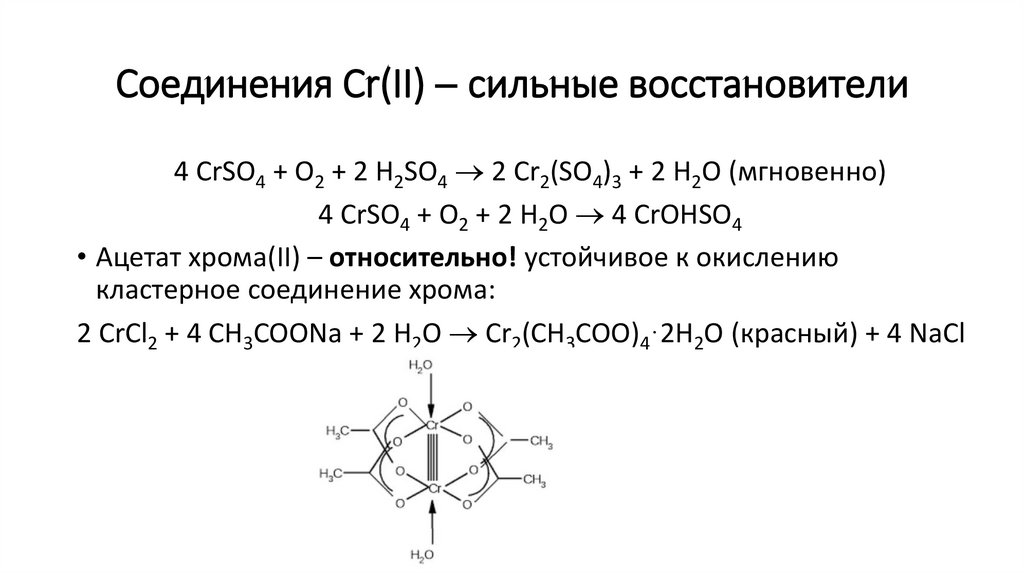
Соединения Cr(II) сильные восстановители4 CrSO4 + O2 + 2 H2SO4 2 Cr2(SO4)3 + 2 H2O (мгновенно)
4 CrSO4 + O2 + 2 H2O 4 CrOHSO4
• Ацетат хрома(II) – относительно! устойчивое к окислению
кластерное соединение хрома:
2 CrCl2 + 4 CH3COONa + 2 H2O Cr2(CH3COO)4·2H2O (красный) + 4 NaCl
14.
Соединения Cr(III)• В октаэдрическом кристаллическом поле электронная
конфигурация (t2g)3(eg)0. Устойчивые, кинетически инертные
комплексы.
• [Cr(H2O)6]3+ - фиолетовый (как Cr(NO3)3, Cr(ClO4)3).
• В результате анации (anion penetration) происходит внедрение
ряда анионов во внутреннюю координационную сферу хрома, и
окраска меняется на зеленую. Поэтому сульфат и хлорид Cr(III)
зеленые:
[Cr(H2O)6]3+ + Cl [Cr(H2O)5Cl]2+ + Cl .
15.
Оксид хрома (III)• Твердый, химически инертный, структура корунда tпл = 2275 С
• Практически не реагирует с водными растворами
кислот и щелочей:
Cr2O3 + H2SO4 (р-р)
Cr2O3 + KOH(р-р)
Обычный способ переведения в раствор – окисление до Cr(VI) (щелочной плав):
Cr2O3 + 3 KNO3 + 4 KOH –(t) 2 K2CrO4 + 3 KNO2 + 2 H2O.
Получение солей Cr(III):
- сплавление с пиросульфатами Cr2O3 + 3 K2S2O7 –(t) Cr2(SO4)3 + 3 K2SO4;
- восстановительное хлорирование Cr2O3 + 3 C + 3 Cl2 –(t) 2 CrCl3 + 3 CO;
- Cr2O3 + 3 CCl4 –(t) 2 CrCl3 + 3 COCl2.
Амфотерный характер оксида хрома (III):
Cr2O3 + K2CO3 –(t) 2 KCrO2 + CO2.
16.
Гидроксидхрома
(III)
Cr2O3·xH2O
• Получение
Cr2(SO4)3 + 6 NH3·H20 (р-р) 2 Cr(OH)3 + 3 (NH4)2SO4
Осадок Cr(OH)3 подвержен «старению» Cr(OH)3 CrO(OH) + H2O
Амфотерность CrO(OH) (pKa = 16, pKb = 10):
Cr(OH)3 + KOH + 2 H2O K[Cr(H2O)2(OH)4]
2 Cr(OH)3 + 3 H2SO4 Cr2(SO4)3 + 6 H2O
K[Cr(H2O)2(OH)4] + CO2 Cr(OH)3 + KHCO3 + 2 H2O.
17.
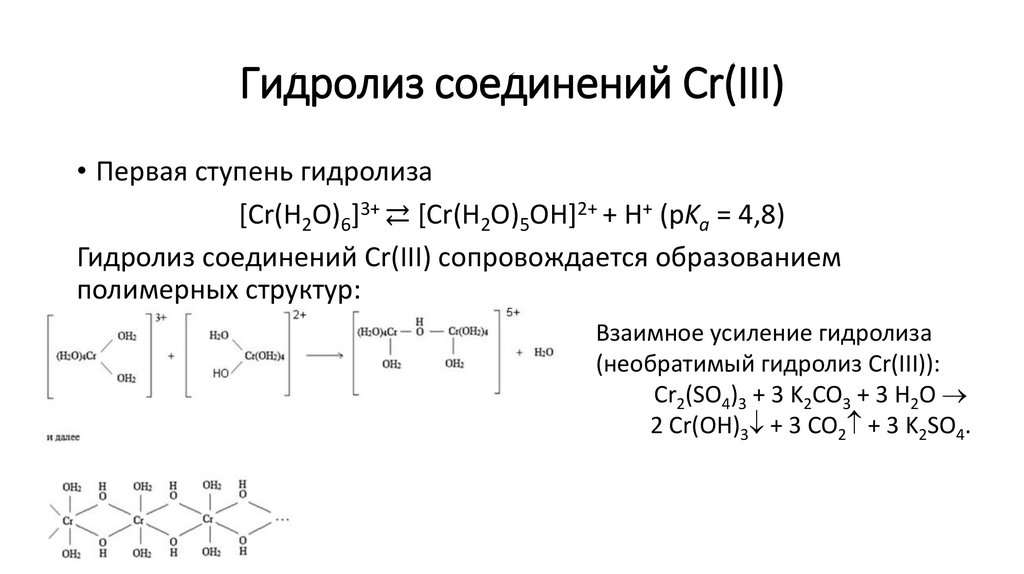
Гидролиз соединений Cr(III)• Первая ступень гидролиза
[Cr(H2O)6]3+ ⇄ [Cr(H2O)5OH]2+ + H+ (pKa = 4,8)
Гидролиз соединений Cr(III) сопровождается образованием
полимерных структур:
Взаимное усиление гидролиза
(необратимый гидролиз Cr(III)):
Cr2(SO4)3 + 3 K2CO3 + 3 H2O
2 Cr(OH)3 + 3 CO2 + 3 K2SO4.
18.
Окислительно-восстановительные реакциисоединений Cr(III) в растворах
• Cr(III) – самое устойчивое в окислительно-восстановительном отношении
состояние хрома.
Окисление легче провести в щелочном растворе (окислителями щелочной
среды Br2, Cl2, H2O2), образуются хроматы:
2 Cr(OH)3 + 3 Br2 + 10 KOH 2 K2CrO4 + 6 KBr + 8 H2O.
Но окисление возможно в нейтральной и даже в кислой среде, нужно лишь
найти подходящий окислитель. В кислой среде образуются бихромат-ионы:
Cr2(SO4)3 + 3 (NH4)2S2O8 + 7 H2O (H+) H2Cr2O7 + 6 NH4HSO4 + 3 H2SO4.
Восстановление до Cr(II) возможно при действии сильных восстановителей
2CrCl3 + Zn –(H+, pH=2) CrCl2 + ZnCl2.
19.
Координационные соединения Cr(III)• Устойчивы, кинетически инертны.
• Чем больше о (10 Dq), тем устойчивее
комплекс:
[CrCl2(H2O)4]Cl + 6 KCN K3[Cr(CN)6] + 3 KCl
+ 4 H2O.
(цианид-ион – лиганд сильного поля,
Образует более устойчивые комплексы).
20.
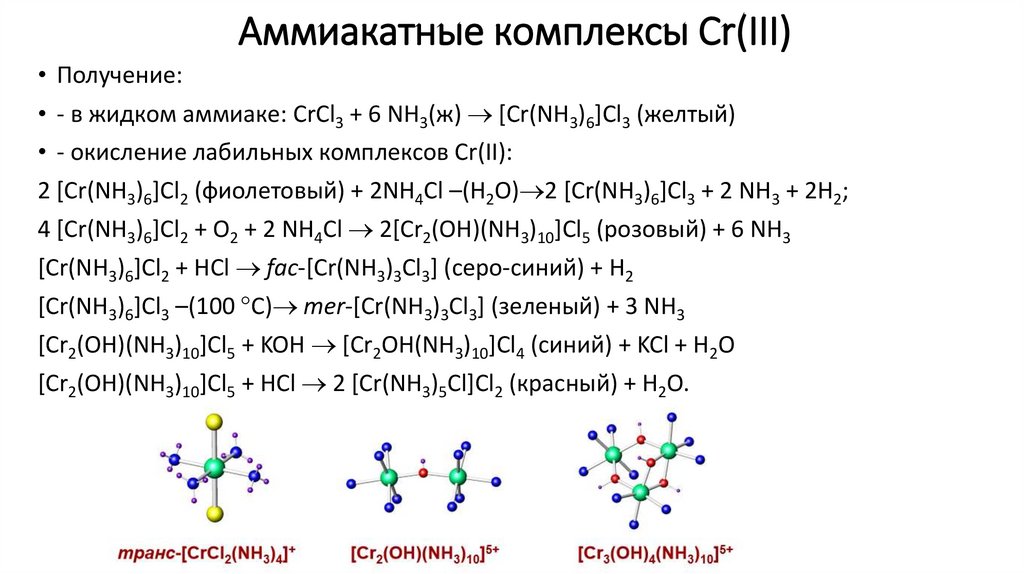
Аммиакатные комплексы Cr(III)• Получение:
• - в жидком аммиаке: CrCl3 + 6 NH3(ж) [Cr(NH3)6]Cl3 (желтый)
• - окисление лабильных комплексов Cr(II):
2 [Cr(NH3)6]Cl2 (фиолетовый) + 2NH4Cl –(H2O) 2 [Cr(NH3)6]Cl3 + 2 NH3 + 2H2;
4 [Cr(NH3)6]Cl2 + O2 + 2 NH4Cl 2[Cr2(OH)(NH3)10]Cl5 (розовый) + 6 NH3
[Cr(NH3)6]Cl2 + HCl fac-[Cr(NH3)3Cl3] (серо-синий) + H2
[Cr(NH3)6]Cl3 –(100 C) mer-[Cr(NH3)3Cl3] (зеленый) + 3 NH3
[Cr2(OH)(NH3)10]Cl5 + KOH [Cr2OH(NH3)10]Cl4 (синий) + KCl + H2O
[Cr2(OH)(NH3)10]Cl5 + HCl 2 [Cr(NH3)5Cl]Cl2 (красный) + H2O.
21.
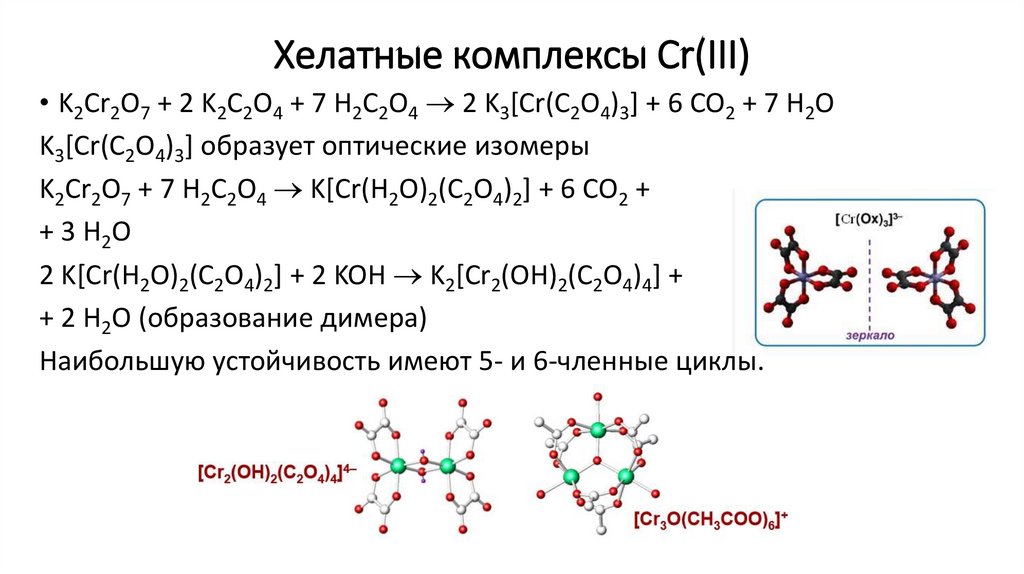
Хелатные комплексы Cr(III)• K2Cr2O7 + 2 K2C2O4 + 7 H2C2O4 2 K3[Cr(C2O4)3] + 6 CO2 + 7 H2O
K3[Cr(C2O4)3] образует оптические изомеры
K2Cr2O7 + 7 H2C2O4 K[Cr(H2O)2(C2O4)2] + 6 CO2 +
+ 3 H2O
2 K[Cr(H2O)2(C2O4)2] + 2 KOH K2[Cr2(OH)2(C2O4)4] +
+ 2 H2O (образование димера)
Наибольшую устойчивость имеют 5- и 6-членные циклы.
22.
Соединения Cr(VI). Оксид хрома (VI)• Фиолетово-красные кристаллы, tпл = 197 С, tразл = 205 С
2 CrO3 –(t) 2 CrO2 + O2.
Ангидрид хромовых кислот:
CrO3 + H2O хромовые кислоты
CrO3 + 2 KOH(изб) K2CrO4 + H2O
Сильный окислитель:
4 CrO3 + C2H5OH 2 Cr2O3 + 2 CO2 + 3 H2O (спирт загорается)
Получение: K2Cr2O7(нас) + H2SO4(конц) 2 CrO3 + 2 KHSO4 + H2O.
23.
Хромовые кислоты. Хроматы• Хромовая кислота H2CrO4 – сильная кислота (pKa1 = -0,61; pKa2 =6,49)
Поликонденсация хромовой кислоты HCrO4- ⇄ Cr2O72- + H2O
Поликонденсация хроматов (всегда к.ч. Cr(VI) = 4!):
BaCl2 + K2CrO4 BaCrO4 (желтый) +
2 KCl
2 BaCl2 + K2Cr2O7 + H2O 2 BaCrO4 +
2KCl + 2 HCl.
24.
Окислительное действие соединений Cr(VI)• Сильные окислители в кислой среде, крайне слабые – в щелочной:
6 (NH4)2[Fe(SO4)2] + K2Cr2O7 + 7 H2SO4 3 Fe2(SO4)3 + Cr2(SO4)3 + 6 (NH4)2SO4 +
K2SO4 + 7 H2O
K2Cr2O7 (кр) + 14 HCl (конц) 2 CrCl3 + 3 Cl2 + 7 H2O + 2 KCl
3 (NH4)2S + 8 K2CrO4 + 8 KOH + 20 H2O 8 K3[Cr(OH)6] + 3 (NH4)2SO4.
При нагревании разлагаются по типу внутримолекулярного окислениявосстановления:
(NH4)2Cr2O7 –(t) N2 + Cr2O3 + 4 H2O
4 K2Cr2O7 –(t) 4 K2CrO4 + 2 Cr2O3 + 3 O2.
25.
Хлорпроизводные Cr(VI)• K2Cr2O7 + 2 HCl –(холодный раствор) 2 KCrO3Cl + H2O
(хлорхромат калия)
• K2Cr2O7 (кр) + 6 HCl (г) –(t) 2 CrO2Cl2 + 3 H2O + 2 KCl (хлористый
хромил)
• СгO2Сl2 + 2Н2O Н2СгO4 + 2 НСl.
26.
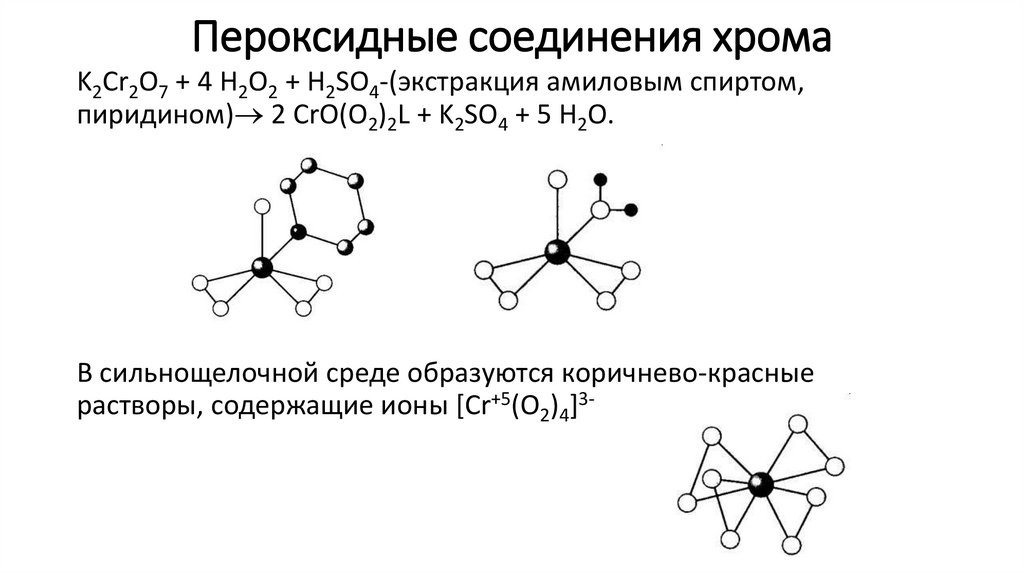
Пероксидные соединения хромаK2Cr2O7 + 4 H2O2 + H2SO4-(экстракция амиловым спиртом,
пиридином) 2 CrO(O2)2L + K2SO4 + 5 H2O.
В сильнощелочной среде образуются коричнево-красные
растворы, содержащие ионы [Cr+5(O2)4]3-
27.
Молибден и вольфрам• Химически менее активны, чем хром.
• Степень окисления +6 становится устойчивой и преобладает в соединениях.
• Не растворяются в растворах кислот-неокислителей
• Могут быть растворены в окислительной среде (окислятся до +6):
W + 2 HNO3 + 4 HF H2[WO2F4] (упрощенно H2[WF8]) + 2 NO + 2 H2O
Mo + 2 HNO3 + 2 HCl MoO2Cl2 + 2NO + 2H2O.
Окисляются в щелочных расплавах:
Mo + 3 KNO3 + 2 KOH –(t) K2MoO4 + 3 KNO2 + H2O.
Окисляются кислородом при нагревании, высшие оксиды летучи:
2 W + 3 O2 –(t) 2 WO3
28.
Получение молибдена и вольфрама• Минералы: молибденит MoS2, шеелит CaWO4, вольфрамит (Fe,Mn)WO4
молибденит
2 MoS2 + 7 O2 –(600 C) 2 MoO3 + 4 SO2
MoO3 + 3 H2 –(600 C) Mo + 3 H2O
шеелит
CaWO4 + 2 HCl H2WO4 + CaCl2
H2WO4 –(800 C) WO3 + H2O
WO3 + 3 H2 –(850 C) W + 3 H2O
29.
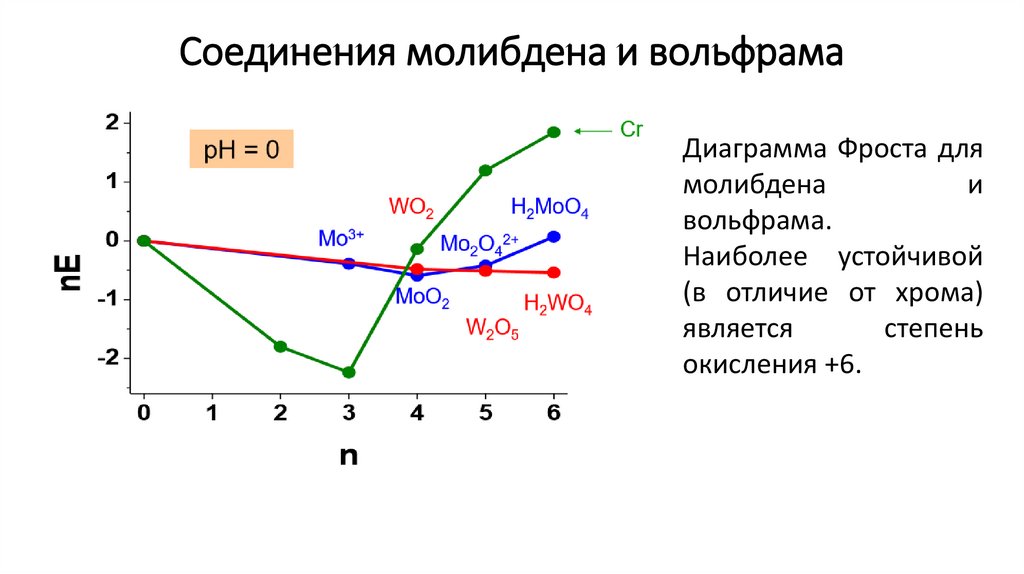
Соединения молибдена и вольфрамаДиаграмма Фроста для
молибдена
и
вольфрама.
Наиболее устойчивой
(в отличие от хрома)
является
степень
окисления +6.
30.
Оксиды молибдена и вольфрама +6• Светло-желтые, слоистая структура. Слои составлены из октаэдров MO6
• Нерастворимы в воде, кислотный характер
проявляется при взаимодействии с щелочами:
MoO3 может быть растворен в концентрированной
HCl с образованием соединений молибденила:
MoO3 + 2 HClконц MoO2Cl2 (лимонно-желтый
раствор). MoO22+ - ион молебденила.
WO3 не проявляет окислительных свойств.
MoO3 – слабый окислитель в кислой среде.
31.
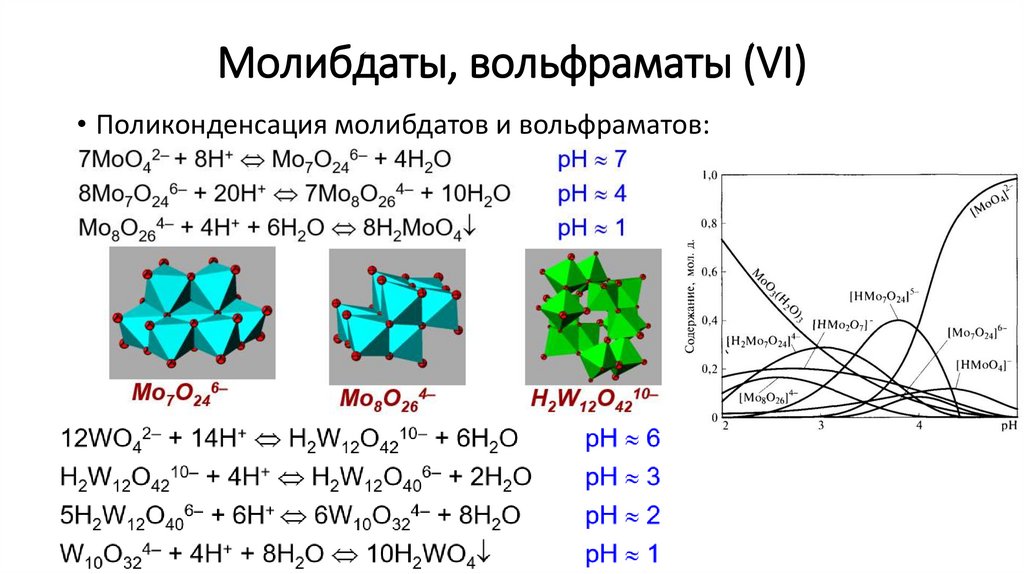
Молибдаты, вольфраматы (VI)• Поликонденсация молибдатов и вольфраматов:
32.
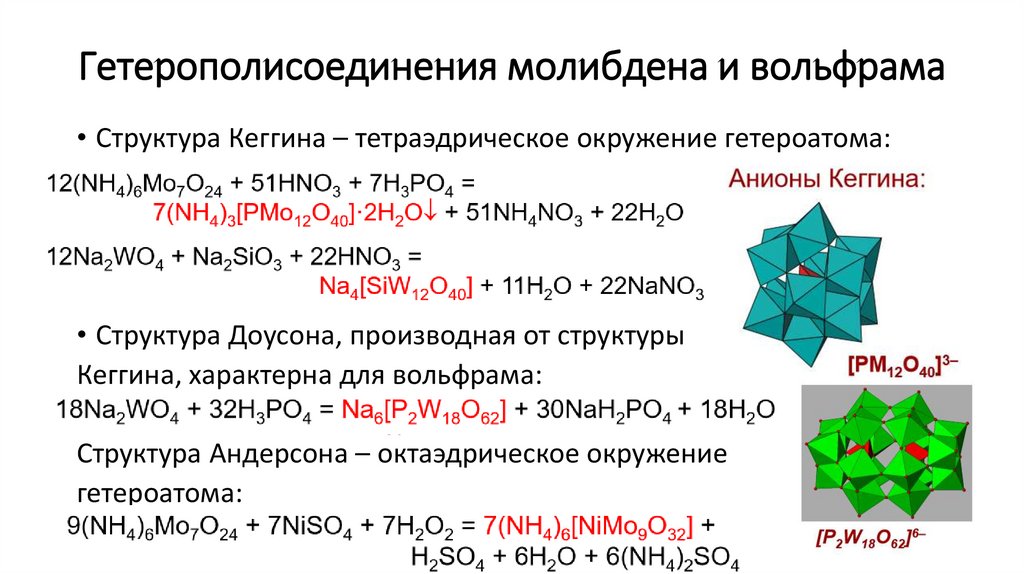
Гетерополисоединения молибдена и вольфрама• Структура Кеггина – тетраэдрическое окружение гетероатома:
• Структура Доусона, производная от структуры
Кеггина, характерна для вольфрама:
Структура Андерсона – октаэдрическое окружение
гетероатома:
33.
Соединения Mo(VI), W(VI)• Сульфиды, тиосоли:
• Пероксидные соединения:
34.
Восстановление соединений Mo(VI) и W(VI)• Возможно лишь в кислой среде.
• Образование «синей» – разновалентных координационных
соединений:
35.
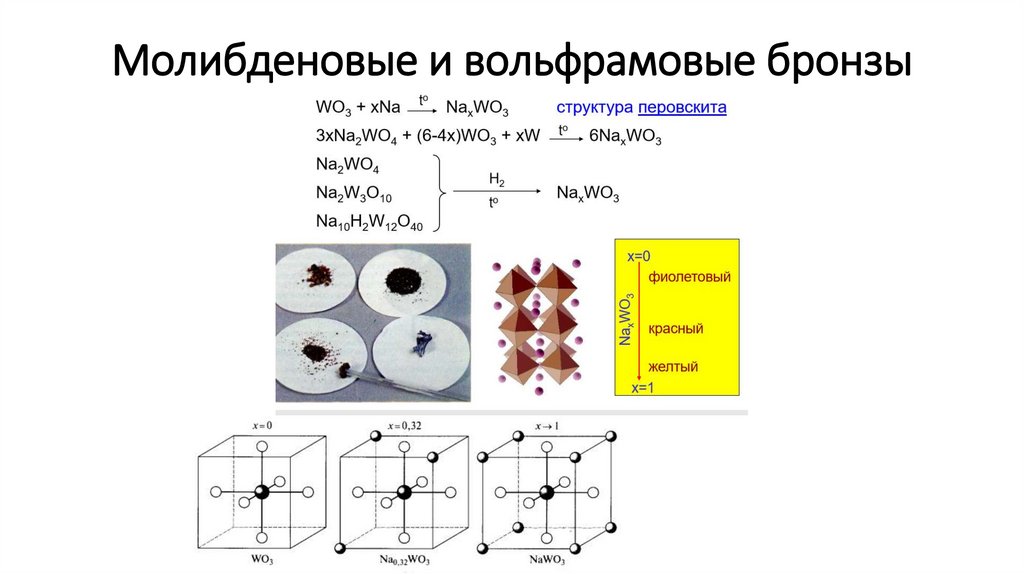
Молибденовые и вольфрамовые бронзы36.
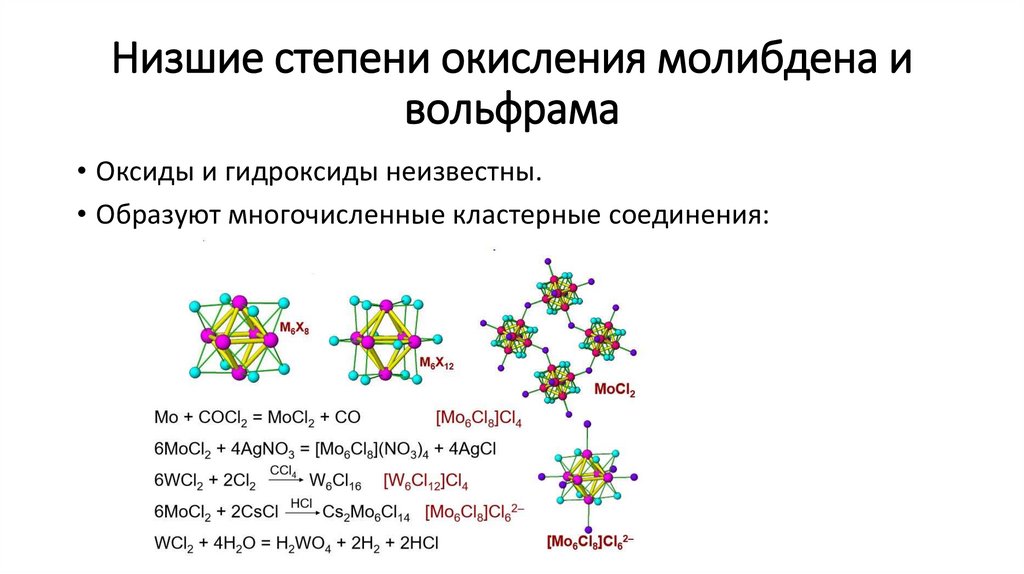
Низшие степени окисления молибдена ивольфрама
• Оксиды и гидроксиды неизвестны.
• Образуют многочисленные кластерные соединения:
























 chemistry
chemistry








