Similar presentations:
7 лекция
1. Лекция 7. РАСТВОРЫ
Ермоленко Анастасия Алексеевна, к.х.н.,старший преподаватель кафедры аналитической химии
2.
ПЛАН ЛЕКЦИИ• I. Классификация растворов.
• II. Растворимость веществ.
• III. Энергия образования
растворов.
• IV. Способы выражения
концентрации растворов.
• V. Свойства растворов.
3.
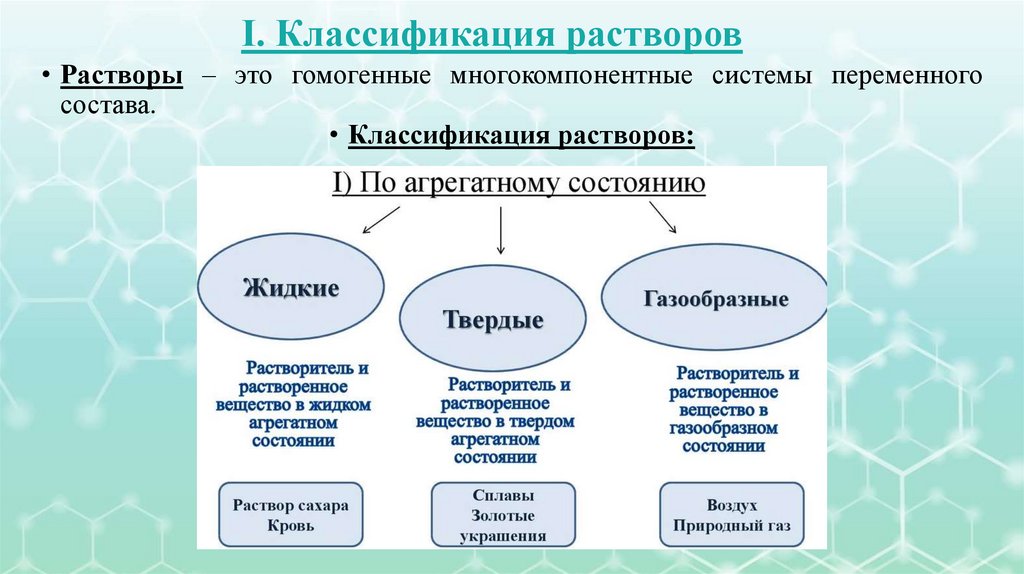
I. Классификация растворов• Растворы – это гомогенные многокомпонентные системы переменного
состава.
• Классификация растворов:
4.
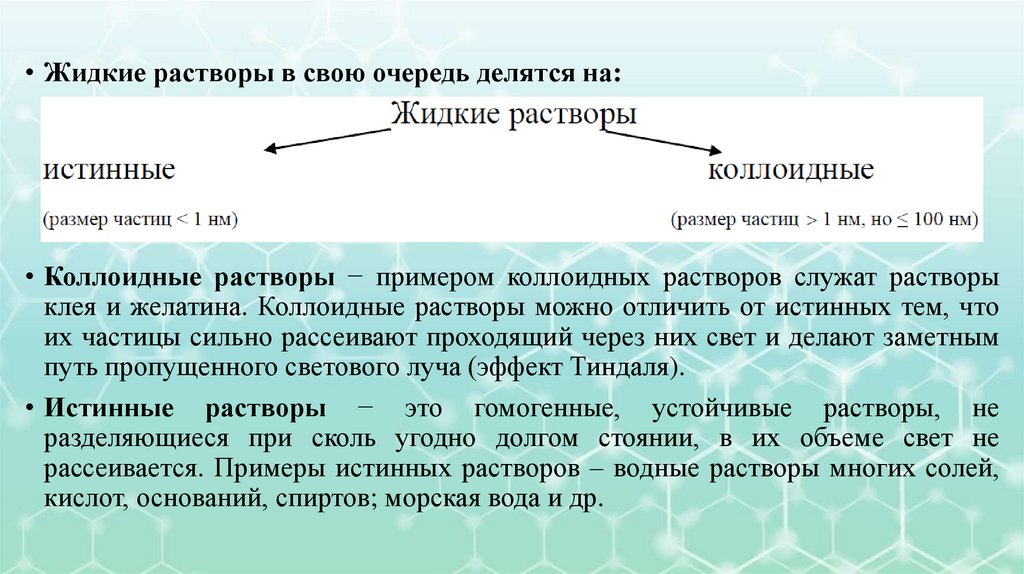
• Жидкие растворы в свою очередь делятся на:• Коллоидные растворы − примером коллоидных растворов служат растворы
клея и желатина. Коллоидные растворы можно отличить от истинных тем, что
их частицы сильно рассеивают проходящий через них свет и делают заметным
путь пропущенного светового луча (эффект Тиндаля).
• Истинные растворы − это гомогенные, устойчивые растворы, не
разделяющиеся при сколь угодно долгом стоянии, в их объеме свет не
рассеивается. Примеры истинных растворов – водные растворы многих солей,
кислот, оснований, спиртов; морская вода и др.
5.
II. Растворимость веществСовременная физико-химическая теория образования растворов
1. Разрушение структуры растворяемого вещества (разрушение химических и
межмолекулярных связей).
2. Взаимодействие растворителя с частицами растворенного вещества (процесс
сольватации или гидратации).
3. Распределение (диффузия) сольватированных частиц в объеме растворителя.
• Растворимостью вещества называется его способность образовывать
однородную систему с другим веществом, выполняющим функции
растворителя.
• Растворимость веществ зависит от природы растворителя, природы
растворенного вещества и от температуры. При повышении
температуры растворимость твёрдых веществ увеличивается.
6.
• Существует эмпирическое правило растворимости «Подобное растворяется вподобном».
• Наибольшая взаимная растворимость достигается в тех случаях, когда силы,
возникающие между компонентами раствора, имеют схожий характер
(возможность наличия водородных связей).
• Если молекулы растворителя неполярны, то
в нем хорошо растворяются вещества с
неполярными
молекулами
и
не
растворяются
полярные
вещества
и
вещества построенные по ионному типу.
(Бензин –масло).
• Растворитель с полярным характером
молeкул хорошо растворяет вещества с
молекулами полярного или ионного типов и
очень плохо – вещества с неполярными
молекулами. (Вода + спирт или вода + соль).
7.
• Предельная растворимость веществ при данной температуре характеризуетсякоэффициентом растворимости, который показывает число граммов вещества,
растворяющегося в 100 г растворителя при данной температуре.
8.
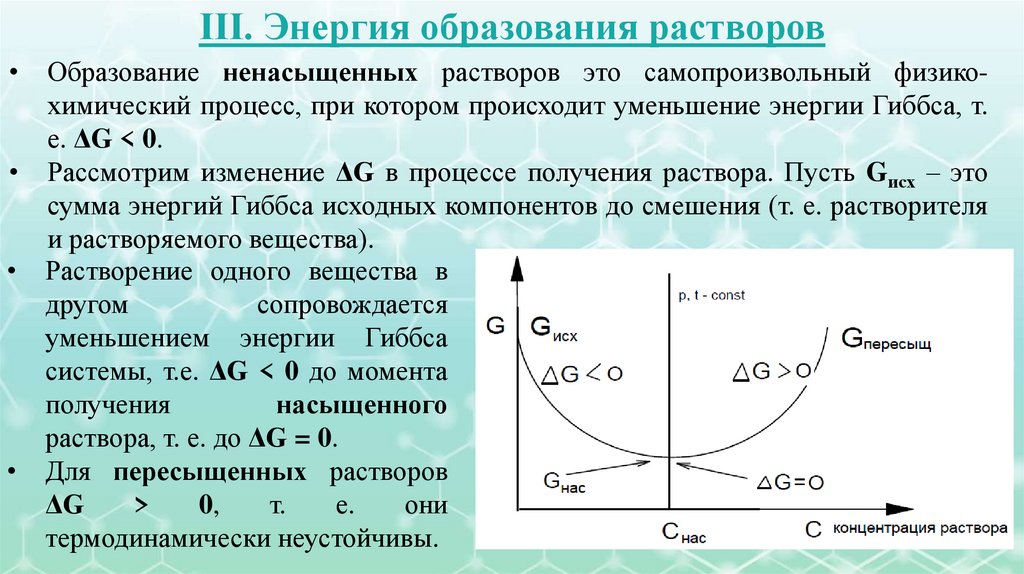
III. Энергия образования растворовОбразование ненасыщенных растворов это самопроизвольный физикохимический процесс, при котором происходит уменьшение энергии Гиббса, т.
е. ΔG < 0.
• Рассмотрим изменение ΔG в процессе получения раствора. Пусть Gисх – это
сумма энергий Гиббса исходных компонентов до смешения (т. е. растворителя
и растворяемого вещества).
• Растворение одного вещества в
другом
сопровождается
уменьшением энергии Гиббса
системы, т.е. ΔG < 0 до момента
получения
насыщенного
раствора, т. е. до ΔG = 0.
• Для пересыщенных растворов
ΔG
>
0,
т.
е.
они
термодинамически неустойчивы.
9.
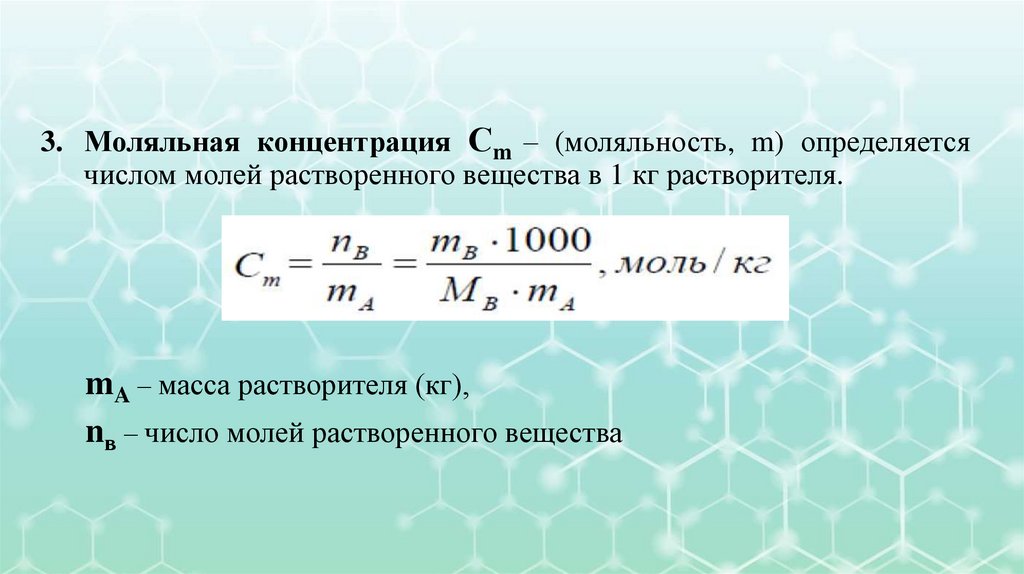
IV. Способы выражения концентрации растворов1. Массовая доля (














 chemistry
chemistry








