Similar presentations:
Презентация Кислоты
1.
Органическиеи неорганические
кислоты
2.
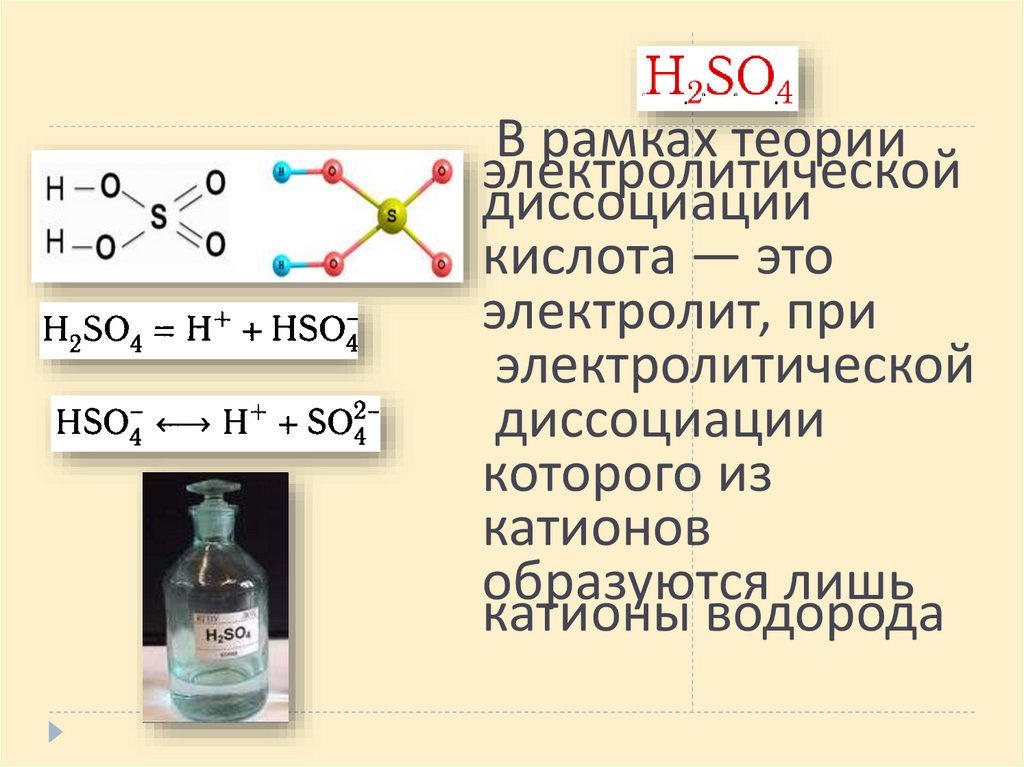
В рамках теорииэлектролитической
диссоциации
кислота — это
электролит, при
электролитической
диссоциации
которого из
катионов
образуются лишь
катионы водорода
3. По определению Льюиса, кислота — это электролит(вещество, участвующее в реакциях с переходом электрона), принимающий
электронную пару вреакции с основанием, то есть веществом,
отдающим электронную пару.
В теории Бренстеда-Лоури, кислота —
вещество, отдающее протон (основание —
вещество, принимающее протон).
4. Классификация кислот 1.по наличию атомов кислорода
-бескислородные(HCl, H2S);-кислородосодержащие (HNO3,H2SO4).
2. По основности — количество кислых атомов водорода:
-Одноосновные (HNO3);
-Двухосновные (H2SeO4, двухосновные предельные
карбоновые кислоты);
-Трёхосновные (H3PO4, H3BO3).
3. По степени диссоциации :
-Сильные — диссоциируют практически
полностью, константы -диссоциации больше 1·10−3 (HNO3);
-Слабые — константа диссоциации меньше 1·10−3 (уксусная
кислота Kд= 1,7·10−5).
5.
. По устойчивости :-Устойчивые (H2SO4);
-Неустойчивые (H2CO3).
5. По принадлежности к классам
химических соединений :
-Неорганические (HBr);
-Органические (HCOOH,CH3COOH);
4
6. Классификация кислот по степени диссоциации:
сильныеслабые
HI иодоводородная
HF фтороводородная
HBr бромоводородная
H3PO4 фосфорная
HCl хлороводородная
H2SO3 сернистая
H2SO4 серная
H2S сероводородная
HNO3 азотная
H2CO3 угольная
H2SiO3 кремниевая
7. Классификация кислот по стабильности (устойчивости):
стабильныенестабильные
кислоты, которые не
кислоты, которые
разрушаются
самопроизвольно:
H2SO4
HCl
H3PO4
быстро разрушаются на
исходные вещества:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
8. Химические свойства кислот:
1. Растворы кислот изменяют окраску индикаторов2. Растворы кислот реагируют с металлами, стоящими в ряду
напряжений до H2
3. Растворы кислот реагируют с основными (амфотерными)
оксидами – оксидами металлов
4. Растворы кислот реагируют с основаниями – реакция
нейтрализации, растворяют нерастворимые основания.
5. Растворы кислот реагируют с солями слабых, летучих кислот
(например, карбонатами)
6. Органические кислоты вступают в реакции этерификации со
спиртами с образованием сложных эфиров.
9. 1. Растворы кислот изменяют окраску индикаторов : при добавлении индикатора «лакмус» – раствор кислоты приобретает красный цвет
1. Растворы кислот изменяют окраскуиндикаторов :
при добавлении индикатора «лакмус» –
раствор кислоты приобретает красный цвет
10.
2. Кислоты реагируют с металлами, стоящими вэлектрохимическом ряду напряжений до H2
кислота + металл → соль + водород
2HCl + Mg → MgCl2 + H2 ↑
молекулярное уравнение реакции
2H+ + 2Cl- + Mg0 → Mg2+ + 2Cl- + H2 ↑
полное ионное уравнение
2H+ + Mg0 → Mg2+ + H2 ↑
сокращенное ионное уравнение (суть реакции)
11. Задание: Составьте уравнения возможных реакций:
1. серная кислота + алюминий →2. соляная кислота + серебро →
3. бромоводородная кислота + цинк →
При составлении уравнений пользуйтесь рядом
напряжений.
Не забывайте, составляя формулы солей, учитывать
валентности металла и кислотного остатка.
12. 3. Растворы кислот реагируют с основными (амфотерными) оксидами – оксидами металлов
3. Растворы кислот реагируют с основными(амфотерными) оксидами – оксидами
металлов
кислота + оксид металла → соль + вода
2HCl + MgO → MgCl2 + H2O
молекулярное уравнение реакции
2H+ + 2Cl- + MgO → Mg2+ + 2Cl-+ H2O
полное ионное уравнение
2H+ + MgO → Mg2+ + H2O
сокращенное ионное уравнение (суть реакции)
13. 4. Растворы кислот реагируют с основаниями - реакция нейтрализации
4. Растворы кислот реагируют соснованиями - реакция нейтрализации
кислота + основание → соль + вода
HCl + NaOH → NaCl + H2O
молекулярное уравнение реакции
H+ + Cl- + Na+ + OH- → Na++ Cl- + H2O
полное ионное уравнение
H+ +OH- → H2O
сокращенное ионное уравнение (суть реакции)
14. Задание: Составьте уравнения возможных реакций:
1. серной кислоты и Fe(ОН)3 →2. соляной кислоты и Ва(ОН)2→
3. сернистой кислоты и NаОН →
Не забудьте порядок действий:
составить формулу соли по валентности металла
и кислотного остатка;
расставить коэффициенты.
15. 5. Растворы кислот реагируют с солями слабых, летучих кислот
кислота 1 + соль 1 → соль 2 + кислота 22HCl + K₂CO3 → 2KCl
+ H₂O + CO₂ ↑
молекулярное уравнение реакции
2H++2Cl-+2K++CO32-→2K++2Cl-+H₂O+ CO₂↑
полное ионное уравнение
…
сокращенное ионное уравнение (суть реакции)
16. Задание: Составьте уравнения возможных реакций:
1.2.
3.
соляная кислота + FeS →
азотная кислота + Na2SiO3 →
серная кислота + K2CO3→
17. Для органических кислот характерна реакция этерификации (образование сложных эфиров)
18. Особенности взаимодействия концентрированной серной и азотной кислот с металлами
Азотная кислота:Fe + 6HNO3 = Fe(NO3)3 + 3NO2↑ + 3H2O
Азотная кислота не реагирует с Pt, Au
Азотная кислота пассивирует Al, Cr, Fe
19. Особенности взаимодействия концентрированной серной и азотной кислот с металлами.
Серная кислота:Серная кислота не реагирует с Pt, Au
Серная кислота пассивирует Al, Cr, Fe
20. Правила разбавления серной кислоты.
!!! разбавление концентрированной сернойкислоты сопровождается сильным разогревом, поэтому
кислоту следует добавлять в воду !!!в воду.
Сначала вода,
потом кислота,
Иначе случится
большая беда
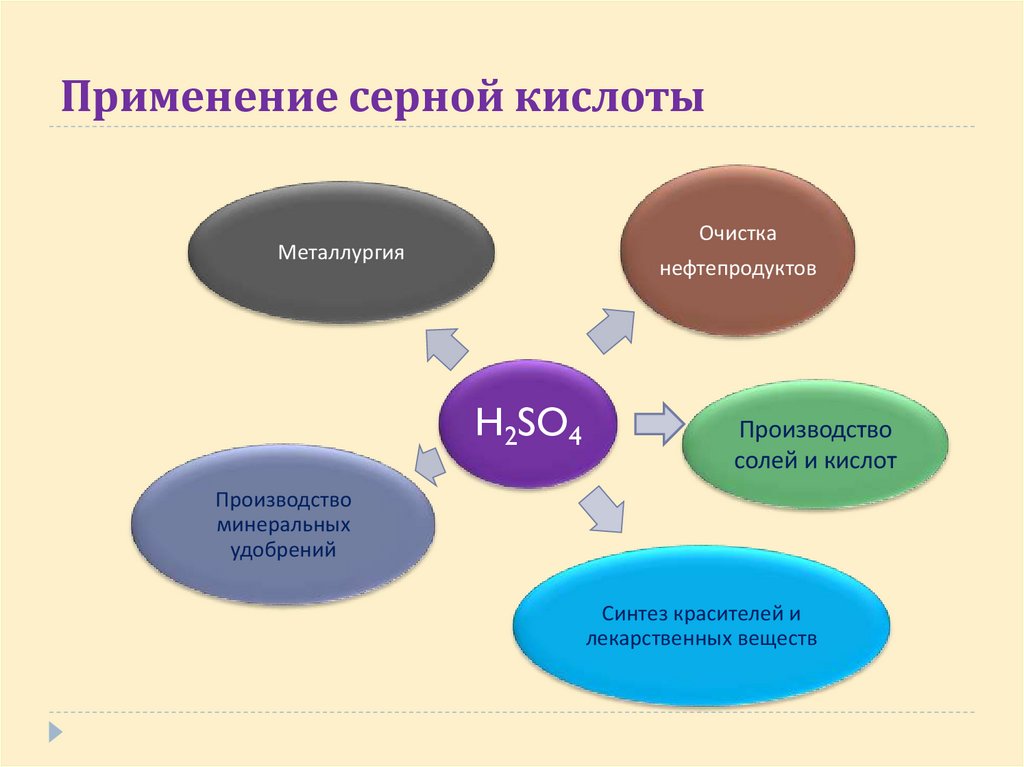
21. Применение серной кислоты
ОчисткаМеталлургия
нефтепродуктов
H2SO4
Производство
солей и кислот
Производство
минеральных
удобрений
Синтез красителей и
лекарственных веществ



















 chemistry
chemistry








