Similar presentations:
Энергетика хим процессов (1)
1.
Энергетикахимических процессов
1
2.
Термодинамикасистема
- открытая
- закрытая
- изолированная
2
3.
Тепловая энергия Q, [Дж]Параметры состояния:
P, T, V, состав системы
3
4.
Функции состояния:Внутренняя энергия U,
Энтальпия H,
Энтропия S,
Энергия Гиббса (изобарноизотермический потенциал) G.
4
5.
Первый закон термодинамикиQ = U + A
U = U2 – U1,
U2 и U1 – внутренняя энергия
системы в состоянии 2 и 1
соответственно.
A = p(V2–V1) = p△V
5
6.
Изохорный процесс:V=const, V = 0, А = 0, тогда
QV = U
Изобарный процесс:
Р=const
V = V2 – V1,
А = р V
Qp = U + р V
Qp = (U2 + рV2) – (U1 + рV1)
6
7.
H = U + рVОтсюда
Qp = Н2 – Н1 = Н
7
8.
Энтальпия, H [кДж/моль]H 0 – эндотермический процесс
H 0 – экзотермический процесс
8
9.
H обр, [кДж/моль]H2(г) + 1/2О2(г) H2O(ж)
при 25 С и 101 кПа
0
= –285,84 кДж
H 298
Н 0, реакция экзотермическая
9
10.
Энтальпия образования простыхвеществ = 0.
H 298(O2) = 0
H 298(Cграфит) = 0
Однако, могут быть исключения:
H 298(O3) = 142,3 кДж/моль,
H 298(Cалмаз) = 1,828 кДж/моль
10
11.
Закон Лавуазье-Лапласа1/2H2 (г) + 1/2Сl2(г) HCl(г)
H 298(HCl) = –92 кДж
HCl(г) 1/2H2 (г) + 1/2Сl2(г)
H 298 = +92 кДж
11
12.
Закон ГессаC + ½O2 = CO
CO + ½O2 = CO2
C + O2 = CO2
13.
Следствие из закона Гесса:H = обрHпродуктов– обрHреагентов
Для реакции в общем виде с
учетом коэффициентов:
аА + bB cC + dD
H = [c Hобр(C) + d Hобр(D)] –
– [a Hобр(A) + b Hобр(B)]
13
14.
Энтропия, S [Дж/(моль К)]Процессы, для которых S 0:
1) расширение газов;
2)
Sтв Sжид Sгаз
SН2О(пар) = 183 Дж/(моль К)
SН2О(жидк.) = 69 Дж/(моль К)
SН2О(лед) = 43,89 Дж/(моль К)
3) растворение кристаллических веществ.
15.
Процессы, для которых S 0:1) сжатие газов;
2) конденсация и кристаллизация
веществ.
По следствию из закона Гесса:
S
о
298
=
o
S298 (продуктов)
о
S298 (реагентов)
16.
Без расчетов определить изменениеэнтропии:
NH4NO2(к) = N2О(г) + 2H2О(г)
V1 (0 моль газа) < V2 (3 моль газа)
△S > 0 энтропия увеличивается
2H2S(г) + 3O2 (г) = 2H2О(к) + SО2(г)
V1 (5 моль газа) > V2 (1 моль газа)
△S < 0 энтропия уменьшается
17.
Энергия Гиббса, G, [кДж/моль]G = Н – Т S
По следствию из закона Гесса:
o
о
о
G298 Gпродуктов G реагентов
Энергия Гиббса образования простых
веществ = 0.
18.
G 0 – процесс термодинамическивозможен (реакция идет
самопроизвольно);
G 0 – процесс термодинамически
невозможен (реакция не идет);
G = 0 – система находится в
состоянии химического равновесия.
19.
Возможность протекания реакцииG = Н – Т S
Реакция экзотермическая
1) Н 0, S > 0,
то всегда G 0, т.е. реакция
протекает при всех t.
2) Н 0, S < 0,
то реакция протекает при низких t
( G 0).
20.
G = Н – Т SРеакция эндотермическая
3) Н > 0, S < 0,
то всегда G > 0 , т.е. реакция не
протекает.
4) Н > 0, S > 0,
то реакция протекает при высоких t
( G 0).
21.
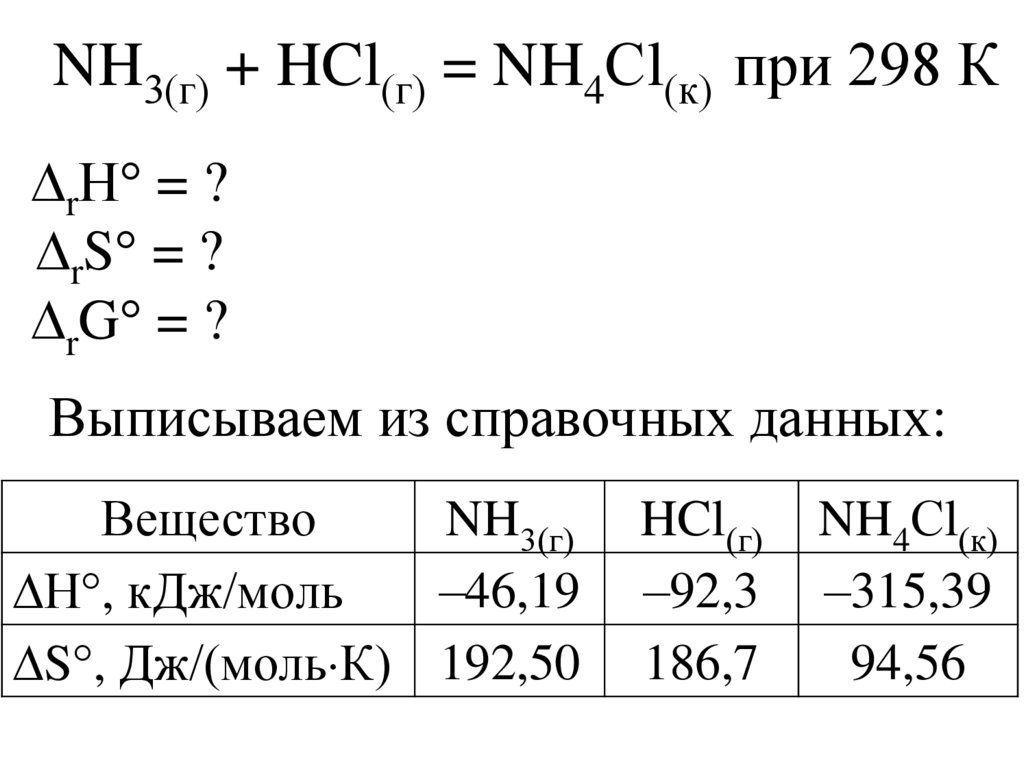
NH3(г) + HCl(г) = NH4Сl(к) при 298 КrН = ?
rS = ?
rG = ?
Выписываем из справочных данных:
Вещество
NH3(г)
–46,19
Н , кДж/моль
S , Дж/(моль К) 192,50
HCl(г)
–92,3
186,7
NH4Сl(к)
–315,39
94,56
22.
Из з-на Гесса энтальпия реакции:rН = Н (NH4Сl(к)) – Н (NH3(г)) – Н (HCl(г))
= –315,39 – (–46,19 – 92,3) = –176,9 кДж
Изменение энтропии реакции:
rS = S (NH4Сl(к)) – S (NH3(г)) – S (HCl(г)) =
= 94,56 – 192,50 – 186,70 = –284,64 Дж/моль К
Используем уравнение Гиббса:
rG = rН – Т rS
rG = – 176,9 + 298 284,64 10–3 = –90,55 кДж
rG 0, реакция идет
23.
Разбор варианта из сборникаиндивидуальных домашних заданий
Задания 1 и 2.
Вычислите изменение стандартной энтальпии
реакции
4 NH3 (г) + 3 O2 (г) = 2 N2 (г) + 6 H2O(ж).
Экзо- или эндотермическая данная реакция?
Вычислите изменение энтальпии реакции, если
в реакцию вступило 34 г аммиака.
24.
Решение4 NH3 (г) + 3 O2 (г) = 2 N2 (г) + 6 H2O(ж)
H 298
кДж/моль
–46,2
0
0
–285,8
rH = 2 0 + 6 (–285,8) – (4 (–46,2) + 3 0) =
= –1530 кДж
Т.к. rH < 0, следовательно реакция
экзотермическая.
Определим количество аммиака, содержащегося в
34 г вещества:
= m / M = 34 / 17 = 2 моль
25.
Составим термохимическое уравнение2 моль
Q
4 NH3(г) + 3 O2(г) = 2 N2(г) + 6 H2O(ж) + 1530 кДж
4 моль
Составим пропорцию: 2 / 4 = Q / 1530
Вычислим количество теплоты из пропорции:
Q = 2 1530 / 4 = 765 кДж
Т.о. если в реакцию вступает 34 г аммиака, то
изменение энтальпии будет равно:
H = – Q = – 765 кДж
26.
Задание 3.Вычислите изменение стандартного изобарноизотермического потенциала G реакции
4 NH3 (г) + 3 O2 (г) = 2 N2 (г) + 6 H2O(ж).
исходя из значения энергии Гиббса образования
G 298. Определите возможность или
невозможность её протекания в стандартных
условиях.
27.
Решение4 NH3 (г) + 3 O2 (г) = 2 N2 (г) + 6 H2O(ж)
G 298
кДж/моль
–16,7
0
0
–237,3
rG = 2 0 + 6 (–237,3) – (4 (–16,7) + 3 0) =
= –1357 кДж
Т.к. rG < 0, следовательно реакция протекает
самопроизвольно в стандартных
условиях.
28.
Задание 4.Используя данные таблицы и изменение
стандартной энтальпии реакции, вычислите
H 298 образования соединения, выделенного в
уравнении.
Уравнение реакции
4 NH3(г) + 3 O2(г) = 2 N2(г) + 6 H2O(ж)
H ,
кДж/моль
–1528,0
Ответ
–46,7
29.
Решение4 NH3(г) + 3 O2(г) = 2 N2(г) + 6 H2O(ж)
H 298
кДж/моль
х
0
0
–285,8
rH = 2 0 + 6 (–285,8) – (4 х + 3 0) = –1528 кДж
–1714,8 – 4х = –1528
–4х = 186,8
х = –46,7
Энтальпия образования аммиака равна:
H 298 = –46,7 кДж/моль
30.
Задание 5.Не производя вычислений, установите знак S
следующего процесса
2 С(к) + 3 Н2 (г) = С2Н6 (г)
Решение
2 С(к) + 3 Н2 (г) =
3 моль газов
С2Н6 (г)
1 моль газа
Следовательно S < 0.
31.
Подтвердим наш вывод об изменении энтропииреакции расчётом.
2 С(к)
S 298
Дж/(моль К)
5,7
+
3 Н2 (г)
=
130,5
rS = 229,5 – (2 5,7 + 3 130,5) = –162 Дж/К
С2Н6 (г)
229,5
32.
ВЫПОЛНИТЕ ЗАДАНИЯ1. При соединении 2,1 г железа с серой
выделилось 3,77 кДж теплоты. Определите энтальпию
образования сульфида железа (II).
2. Определите количество теплоты,
выделившееся при взрыве 8,4 л гремучего газа, взятого
при нормальных условиях, если стандартная энтальпия
образования воды ( Н0298) равна -241,8 кДж/моль.
3. Определить стандартную энтальпию ( Н0298)
образования фосфина РН3, исходя из уравнения:
2 PH3(г) + 4 О2(г) = P2O5(к) + 3 H2O(ж), Н0 = -2360 кДж.
При вычислениях учесть, что стандартны энтальпия
образования ( Н0298) оксида фосфора (V) и воды
соответственно равны -1492 кДж/моль и -285,8
кДж/моль.
33.
ВЫПОЛНИТЕ ЗАДАНИЯ4. При восстановлении 12,7 г оксида меди (II)
углём (с образованием СО) поглощается 8,24 кДж
теплоты. Определите стандартную энтальпию
образования CuO, если стандартная энтальпия
образования СО равна -110,5 кДж/моль.
5. При полном сгорании этилена (с образованием
жидкой воды) выделилось 6226 кДж теплоты.
Определите объём вступившего в реакцию кислорода
при н.у. Стандартные энтальпии образования C2H4(г),
H2O(ж), СО2(г) равны соответственно 52,3; -285,8; -393,5
кДж/моль.
34.
ВЫПОЛНИТЕ ЗАДАНИЯ6. Водяной газ представляет собой смесь равных
объёмов водорода и оксида углерода (II). Найти
количество теплоты, выделяющейся при сжигании 112
л водяного газа, взятого при нормальных условиях.
7. Сожжены с образованием H2O(ж) равные
объёмы водорода и ацетилена, взятых при одинаковых
условиях. В каком случае выделится больше теплоты и
во сколько раз?
8. Не производя вычислений, установить знак
S0 следующих процессов:
а) 2 NH3(г) = N2(г) + 3 H2(г)
б) СO2(к) = СО2(г)
в) 2 NO(г) + O2(г) = 2 NO2(г)
г) 2 H2S(г) + 3 O2(г) = 2 H2O(ж) + 2 SO2(г)
35.
ВЫПОЛНИТЕ ЗАДАНИЯ9. Рассчитать значения изобарноизотермического потенциала ( G0) следующих
реакций и установить, в каком направлении они могут
протекать самопроизвольно в стандартных условиях
при 25 0С:
а) NiO(к) + Pb(к) = Ni(к) + PbO(к)
б) Pb(к) + CuO(к) = PbO(к) + Cu(к)
в) 8 Al(к) + 3 Fe3O4(к) = 9 Fe(к) + 4 Al2O3(к)
10. Вычислить значения изобарноизотермического потенциала ( G0) реакции
CaCO3(к) = CaO(к) + CO2(г)
При 25, 500, 1500 0С. Зависимостью H0 и S0 от
температуры пренебречь. Построить график
зависимости G0 = f(T).






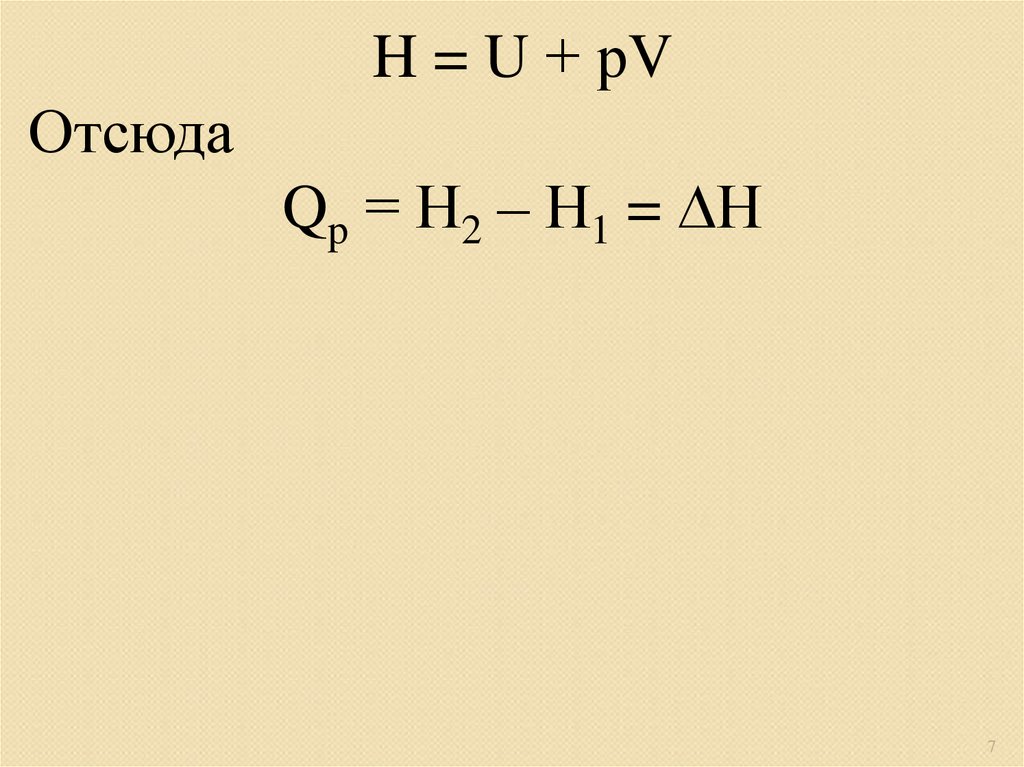



























 chemistry
chemistry








