Similar presentations:
1674119
1.
Расчетыпо химическим
уравнениям
2.
Расчёты по химическим уравнениям.N – число частиц (атомов или молекул)
n – количество вещества (моль)
М – молярная масса (г/моль)
М : М (СО2) = Аr(C) + Ar(O) ∙ 2 =
= 12 + 16 ∙ 2 = 44 (г/моль)
m - масса вещества ( г )
m=ν∙M
Vm – молярный объём Vm = 22.4 л/моль
V = ν ∙ Vm
V – объём газа
3.
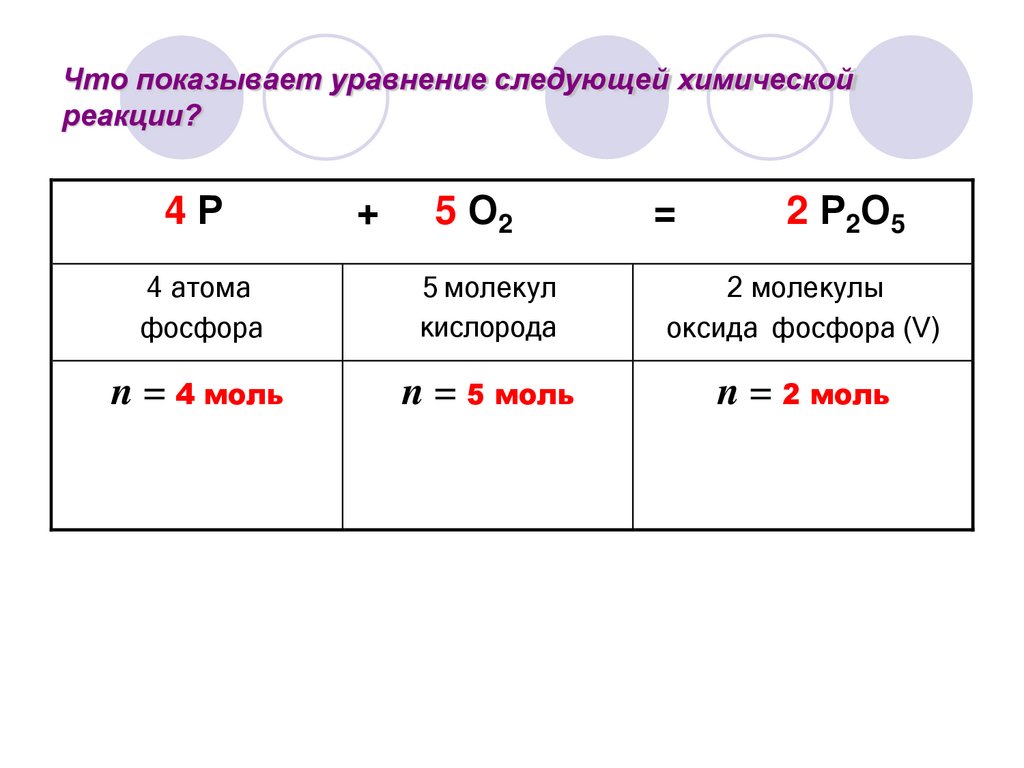
Что показывает уравнение следующей химическойреакции?
4Р
5 О2
=
4 атома
фосфора
5 молекул
кислорода
2 молекулы
оксида фосфора (V)
n = 4 моль
n = 5 моль
n = 2 моль
+
2 Р2О5
4.
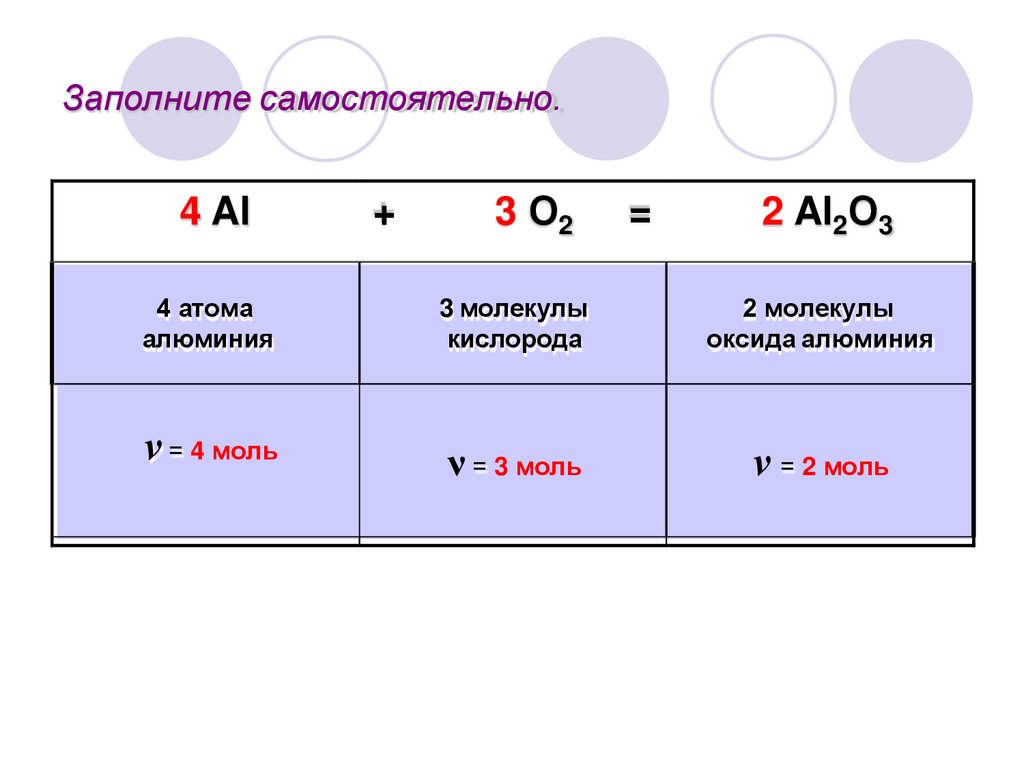
Заполните самостоятельно.4 Al
4 атома
алюминия
ν = 4 моль
+
3 О2
=
2 Al2О3
3 молекулы
кислорода
2 молекулы
оксида алюминия
ν = 3 моль
ν = 2 моль
5.
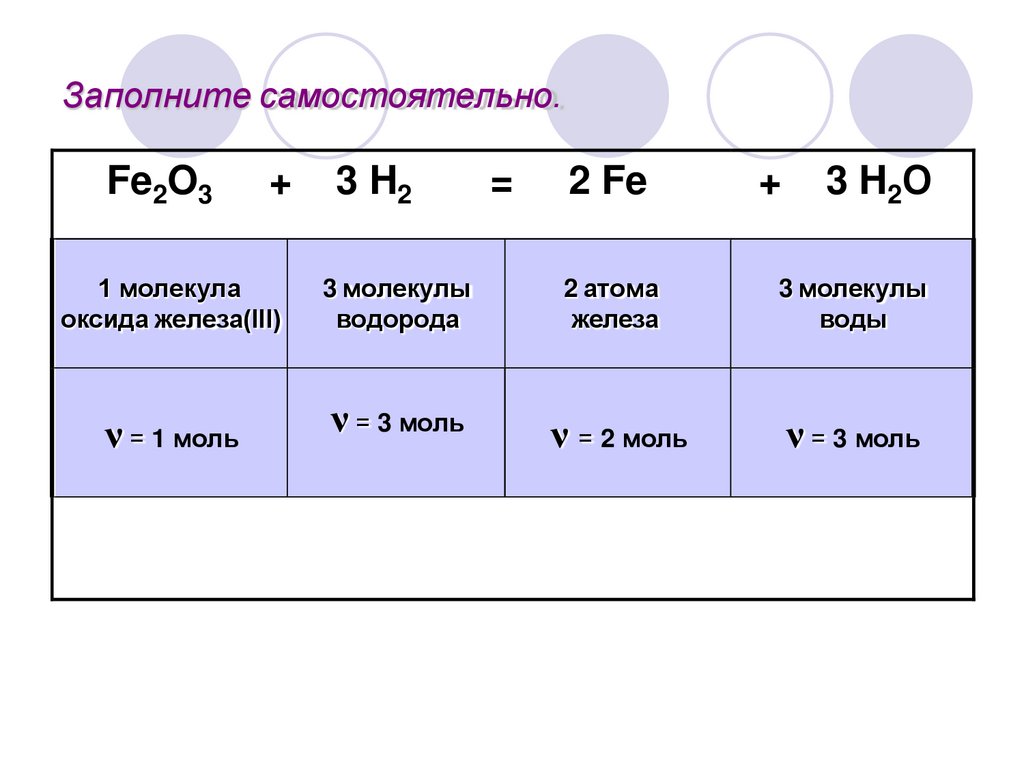
Заполните самостоятельно.Fe2O3
+
1 молекула
оксида железа(III)
ν = 1 моль
3 H2
3 молекулы
водорода
ν = 3 моль
=
2 Fe
+
3 H2О
2 атома
железа
3 молекулы
воды
ν = 2 моль
ν = 3 моль
6.
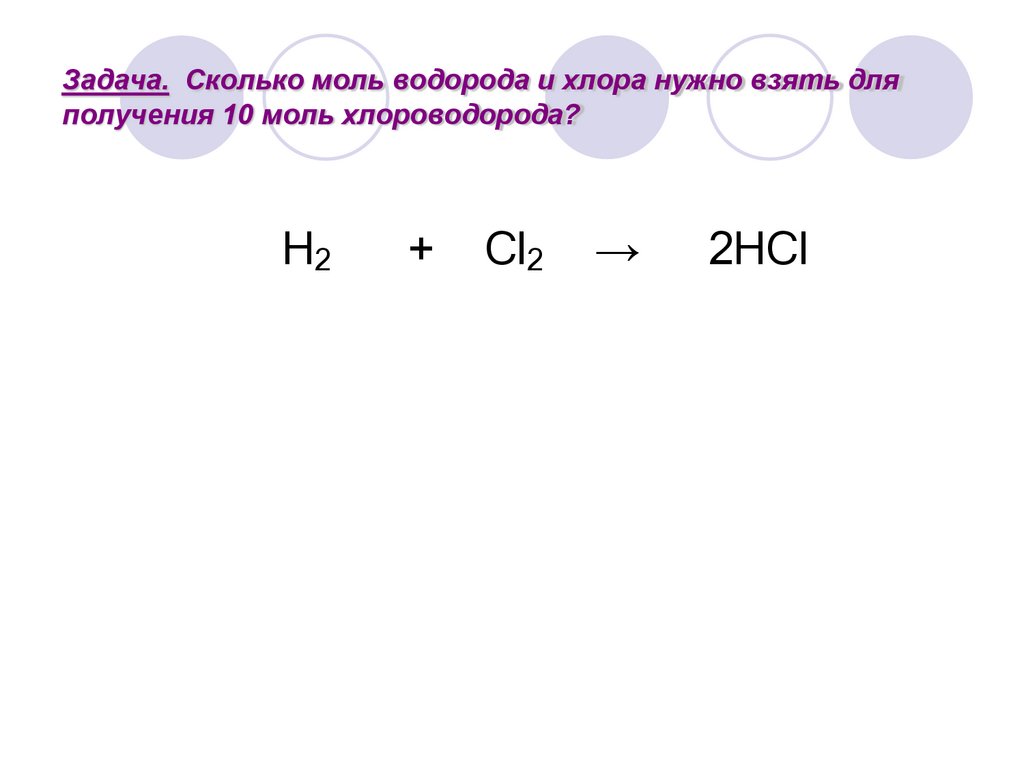
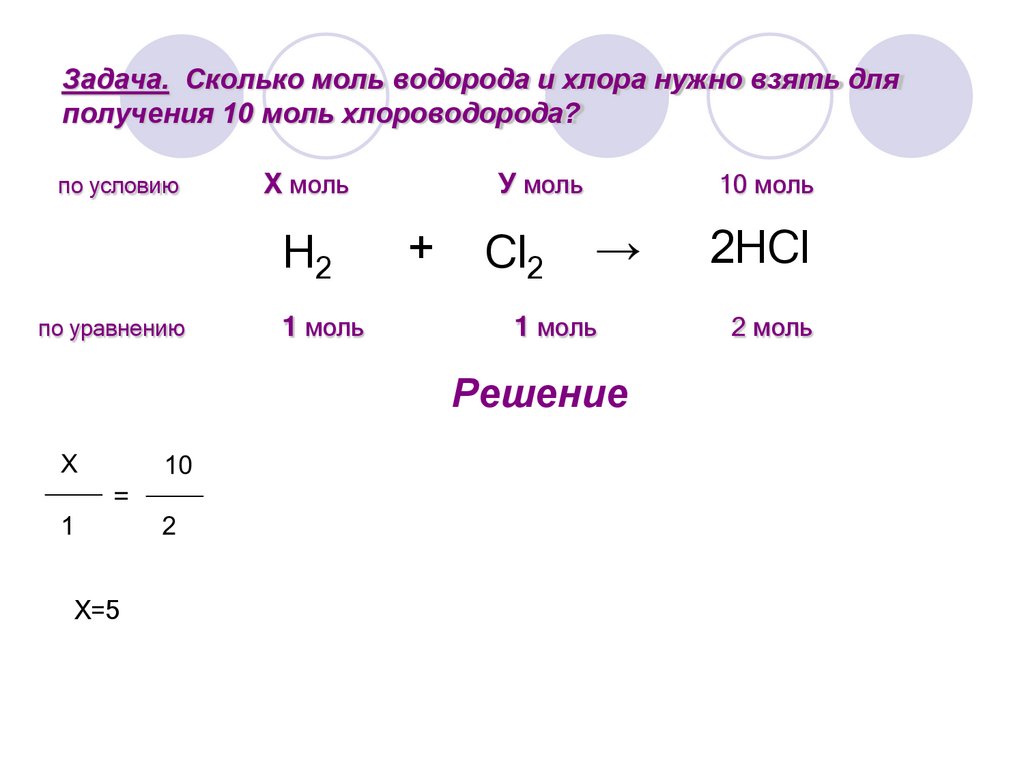
Задача. Сколько моль водорода и хлора нужно взять дляполучения 10 моль хлороводорода?
7.
Задача. Сколько моль водорода и хлора нужно взять дляполучения 10 моль хлороводорода?
H2
+
Cl2
→
2HCl
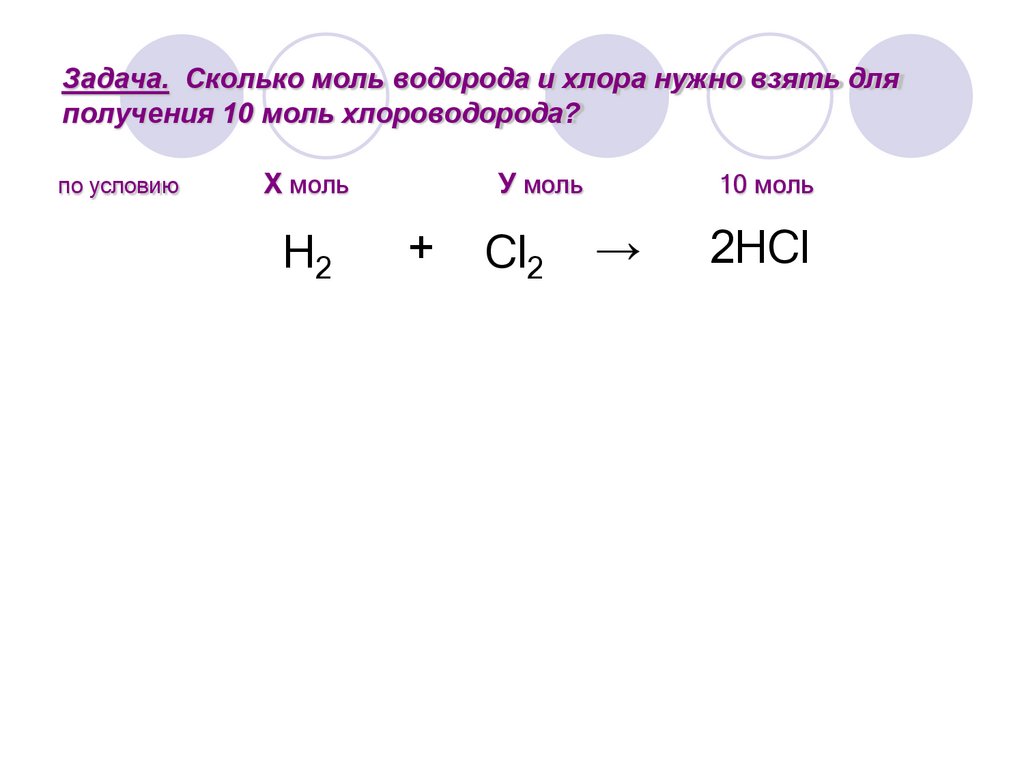
8.
Задача. Сколько моль водорода и хлора нужно взять дляполучения 10 моль хлороводорода?
по условию
Х моль
H2
У моль
+
Cl2
10 моль
→
2HCl
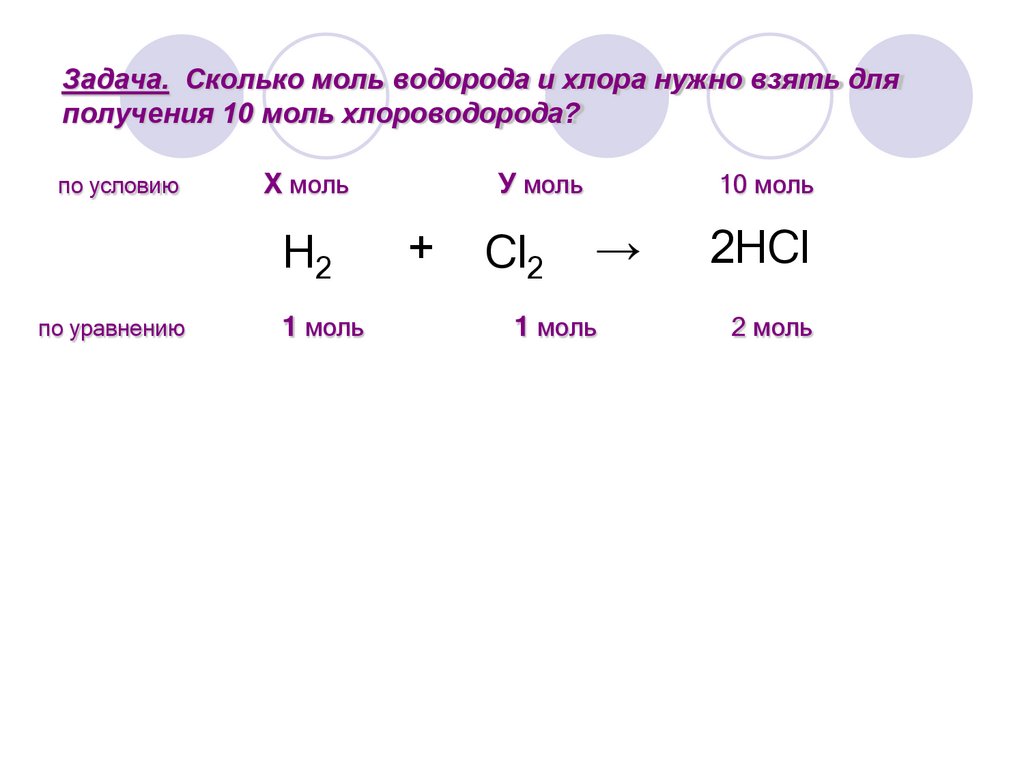
9.
Задача. Сколько моль водорода и хлора нужно взять дляполучения 10 моль хлороводорода?
по условию
Х моль
H2
по уравнению
1 моль
У моль
+
Cl2
10 моль
→
1 моль
2HCl
2 моль
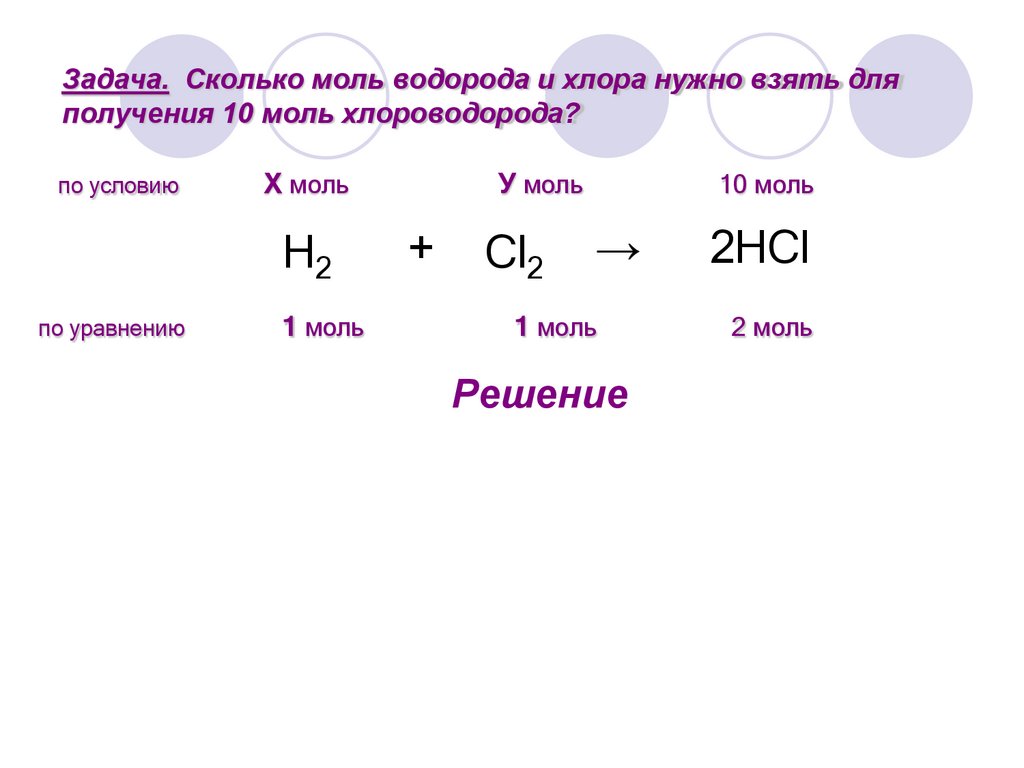
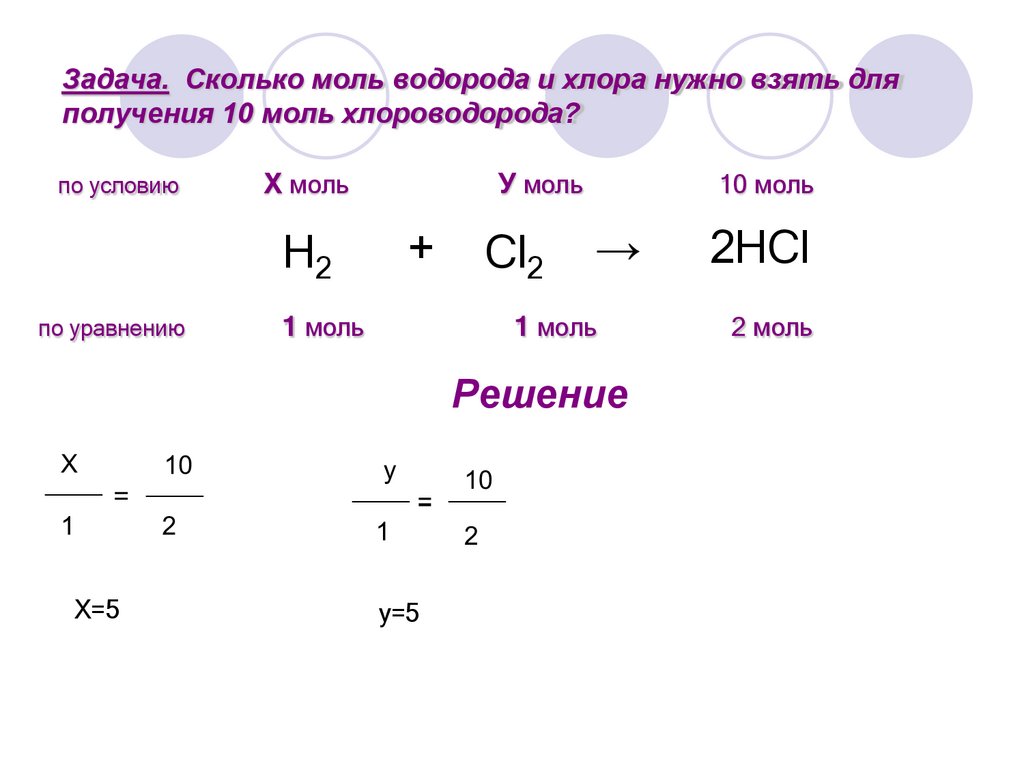
10.
Задача. Сколько моль водорода и хлора нужно взять дляполучения 10 моль хлороводорода?
по условию
Х моль
H2
по уравнению
1 моль
У моль
+
Cl2
10 моль
→
1 моль
Решение
2HCl
2 моль
11.
Задача. Сколько моль водорода и хлора нужно взять дляполучения 10 моль хлороводорода?
по условию
Х моль
H2
по уравнению
1 моль
У моль
+
Cl2
10 моль
→
1 моль
Решение
Х=5
2HCl
2 моль
12.
Задача. Сколько моль водорода и хлора нужно взять дляполучения 10 моль хлороводорода?
по условию
Х моль
H2
по уравнению
У моль
+
1 моль
Cl2
10 моль
→
1 моль
Решение
Х=5
y=5
2HCl
2 моль
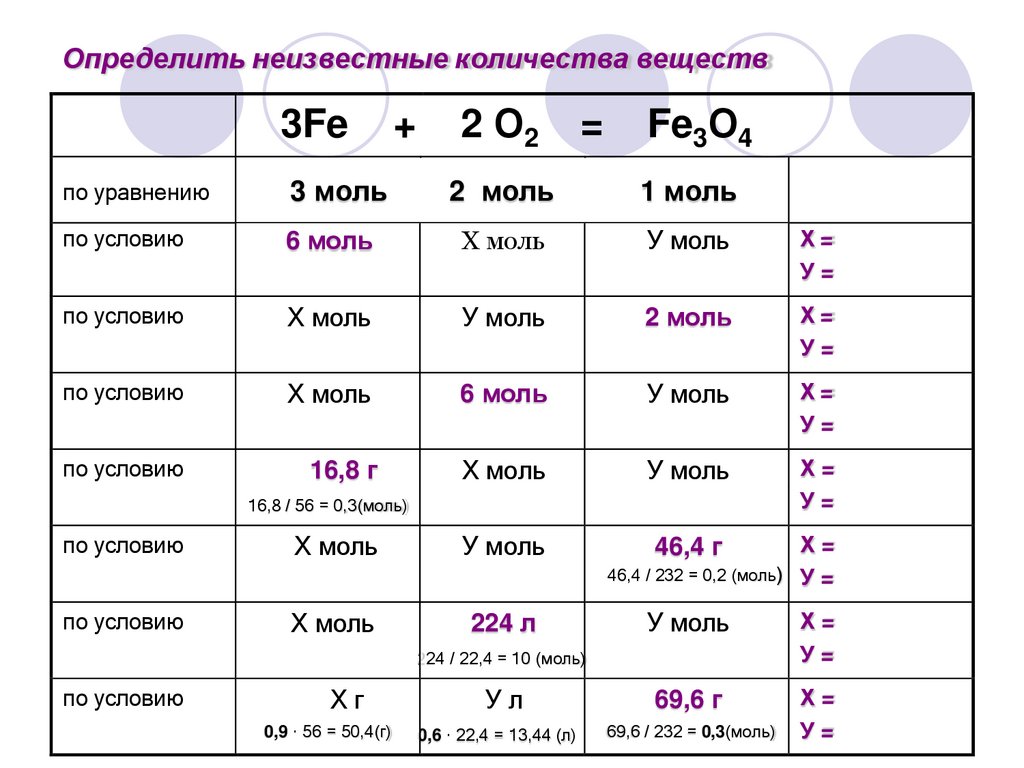
13.
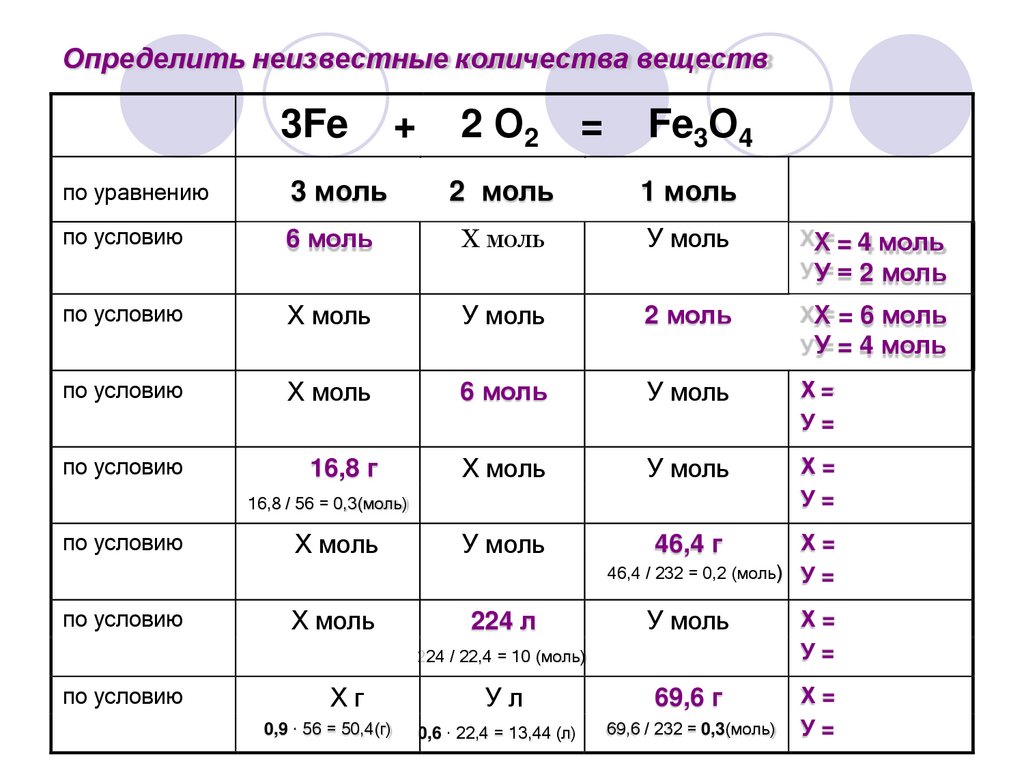
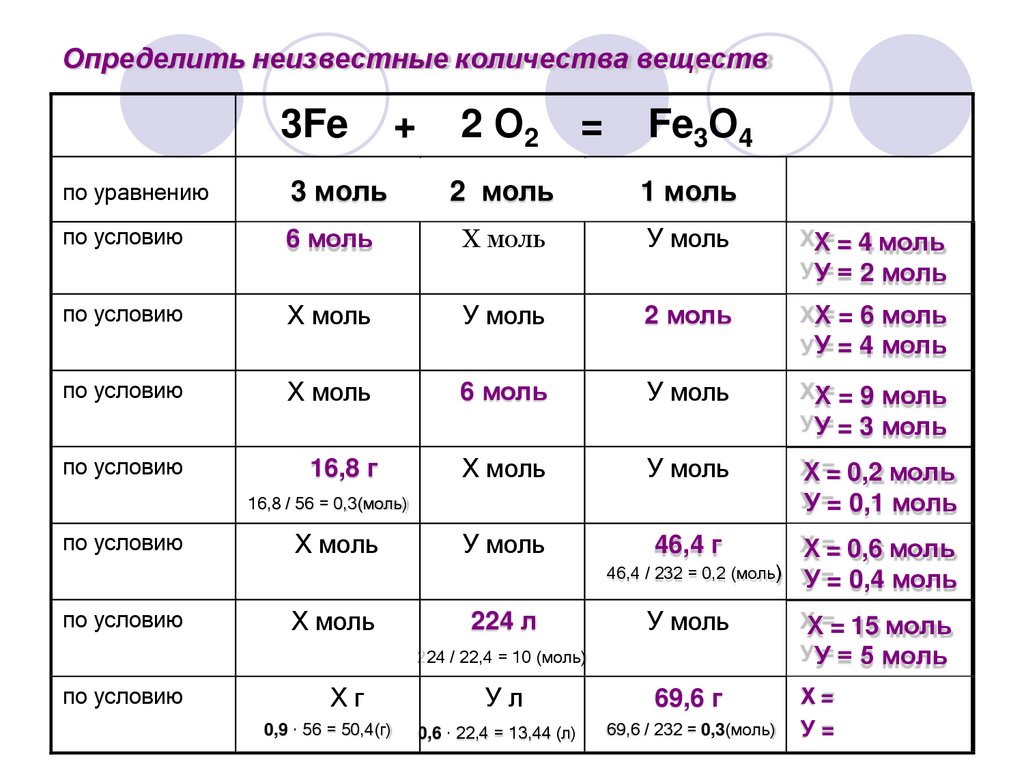
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
Х=
У=
по условию
Х моль
У моль
2 моль
Х=
У=
по условию
Х моль
6 моль
У моль
Х=
У=
по условию
16,8 г
Х моль
У моль
Х=
У=
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
Х=
46,4 / 232 = 0,2 (моль) У =
У моль
Х=
У=
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х=
У=
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
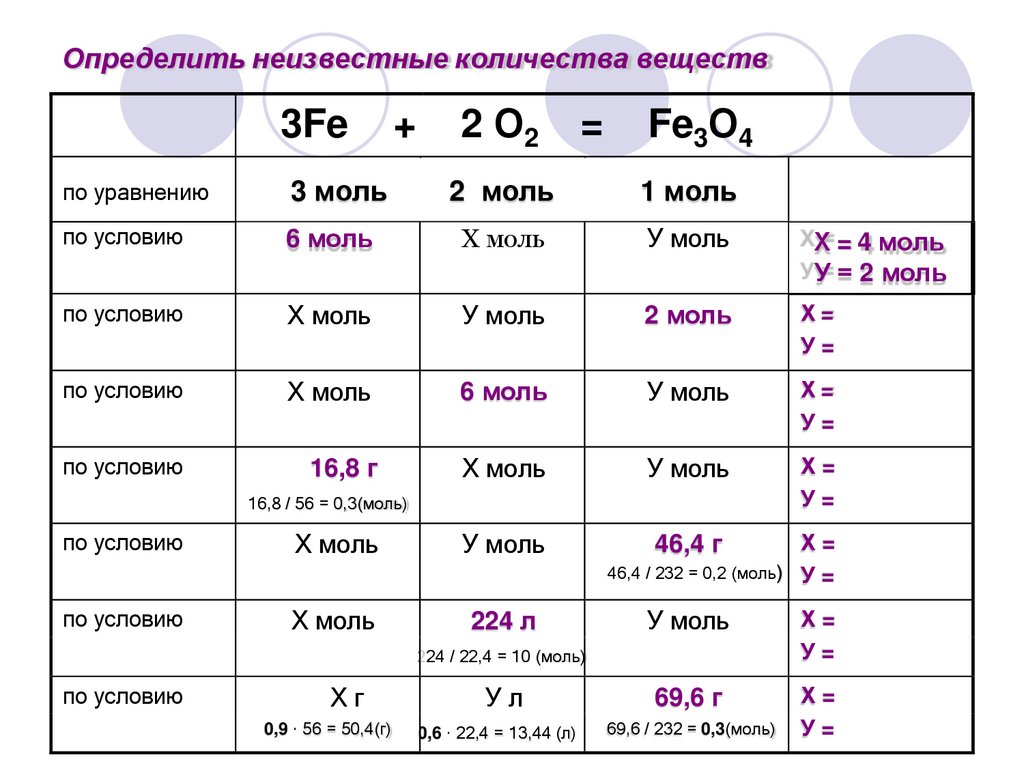
14.
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
ХХ= = 4 моль
У У= = 2 моль
по условию
Х моль
У моль
2 моль
Х=
У=
по условию
Х моль
6 моль
У моль
Х=
У=
по условию
16,8 г
Х моль
У моль
Х=
У=
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
Х=
46,4 / 232 = 0,2 (моль) У =
У моль
Х=
У=
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х=
У=
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
15.
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
ХХ= = 4 моль
У У= = 2 моль
по условию
Х моль
У моль
2 моль
ХХ= = 6 моль
У У= = 4 моль
по условию
Х моль
6 моль
У моль
Х=
У=
по условию
16,8 г
Х моль
У моль
Х=
У=
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
Х=
46,4 / 232 = 0,2 (моль) У =
У моль
Х=
У=
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х=
У=
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
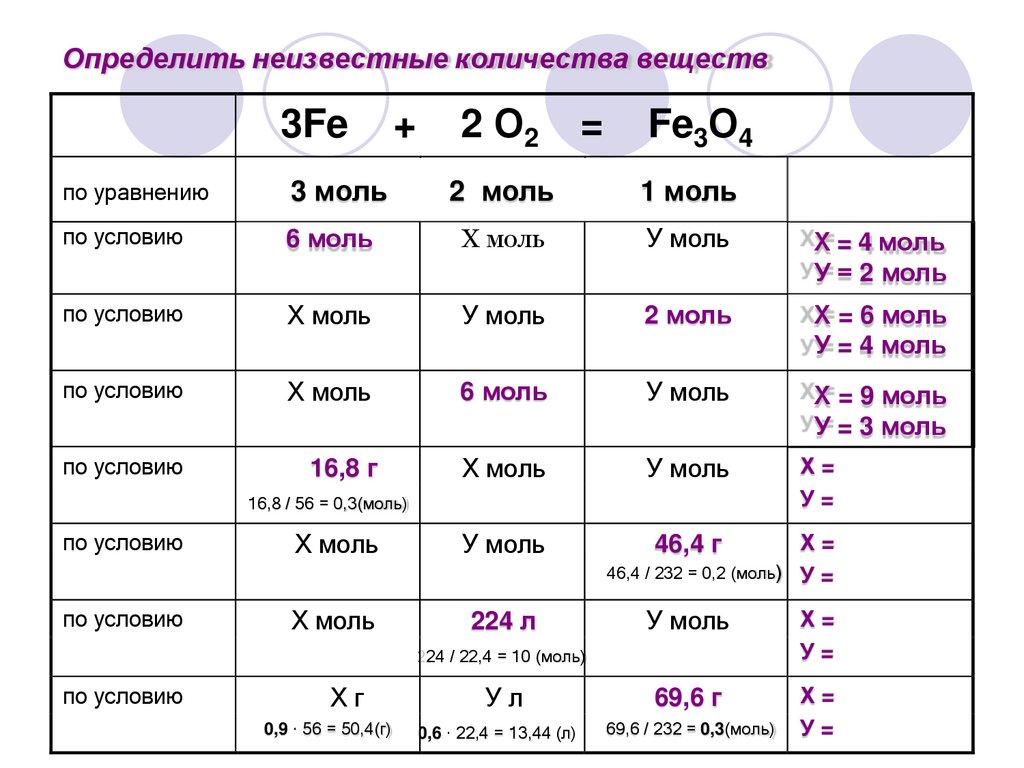
16.
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
ХХ= = 4 моль
У У= = 2 моль
по условию
Х моль
У моль
2 моль
ХХ= = 6 моль
У У= = 4 моль
по условию
Х моль
6 моль
У моль
ХХ= = 9 моль
У У= = 3 моль
по условию
16,8 г
Х моль
У моль
Х=
У=
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
Х=
46,4 / 232 = 0,2 (моль) У =
У моль
Х=
У=
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х=
У=
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
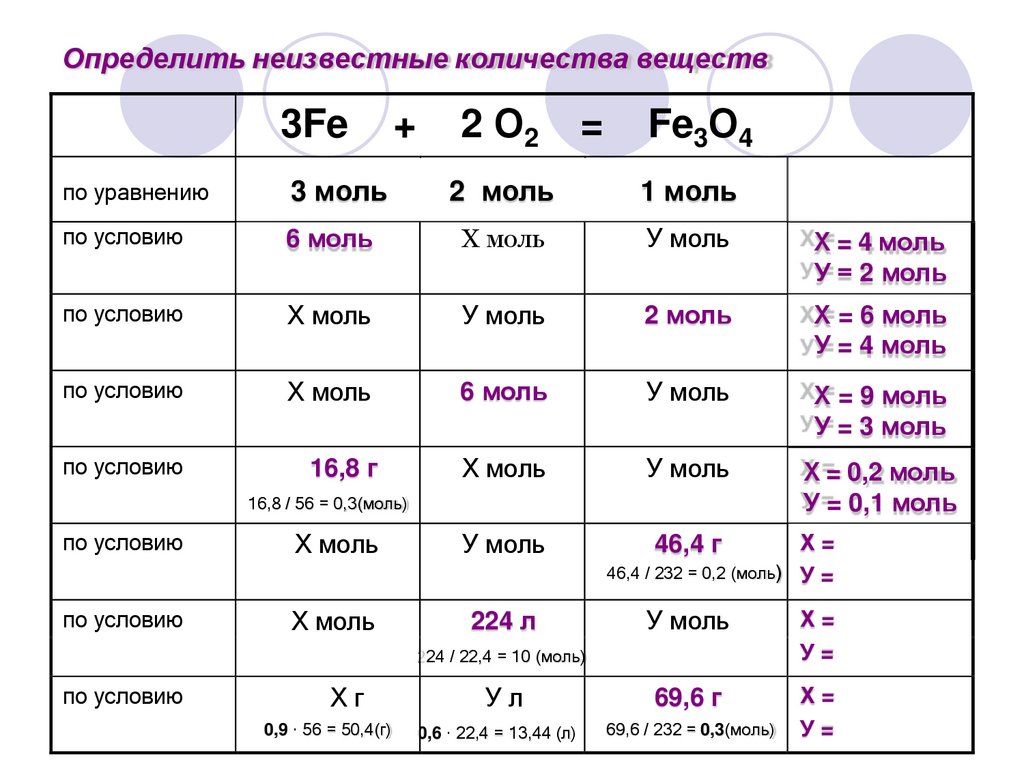
17.
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
ХХ= = 4 моль
У У= = 2 моль
по условию
Х моль
У моль
2 моль
ХХ= = 6 моль
У У= = 4 моль
по условию
Х моль
6 моль
У моль
ХХ= = 9 моль
У У= = 3 моль
по условию
16,8 г
Х моль
У моль
ХХ== 0,2 моль
УУ== 0,1 моль
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
Х=
46,4 / 232 = 0,2 (моль) У =
У моль
Х=
У=
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х=
У=
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
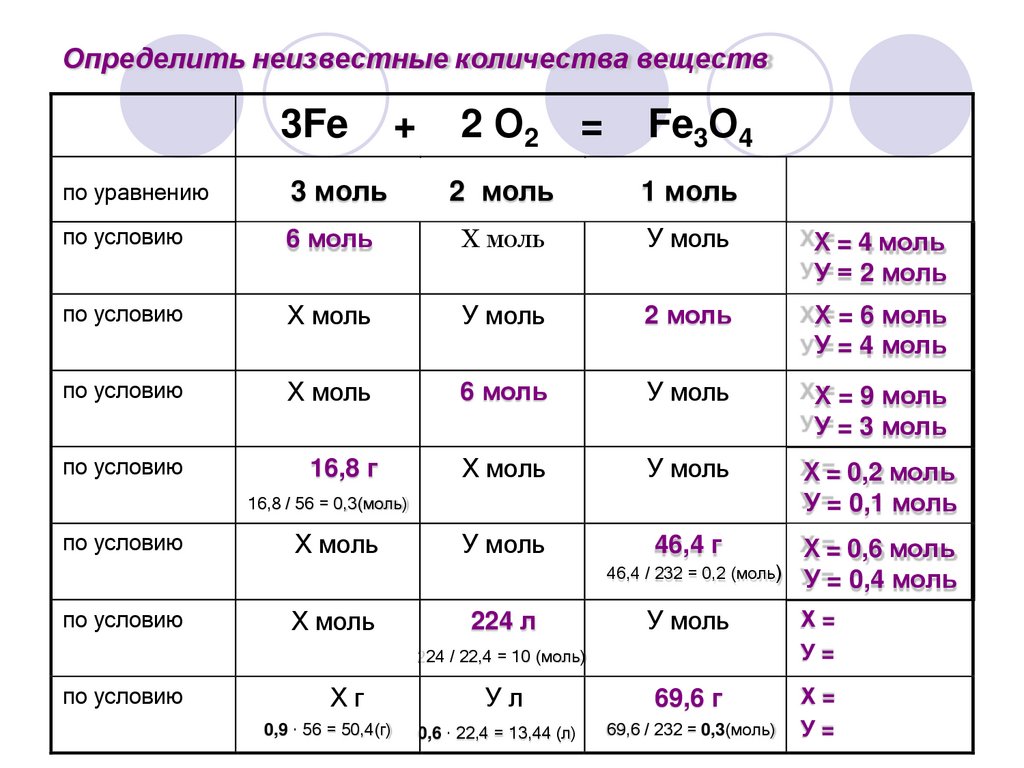
18.
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
ХХ= = 4 моль
У У= = 2 моль
по условию
Х моль
У моль
2 моль
ХХ= = 6 моль
У У= = 4 моль
по условию
Х моль
6 моль
У моль
ХХ= = 9 моль
У У= = 3 моль
по условию
16,8 г
Х моль
У моль
ХХ== 0,2 моль
УУ== 0,1 моль
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
ХХ== 0,6 моль
46,4 / 232 = 0,2 (моль) У =
У = 0,4 моль
У моль
Х=
У=
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х=
У=
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
19.
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
ХХ= = 4 моль
У У= = 2 моль
по условию
Х моль
У моль
2 моль
ХХ= = 6 моль
У У= = 4 моль
по условию
Х моль
6 моль
У моль
ХХ= = 9 моль
У У= = 3 моль
по условию
16,8 г
Х моль
У моль
ХХ== 0,2 моль
УУ== 0,1 моль
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
ХХ== 0,6 моль
46,4 / 232 = 0,2 (моль) У =
У = 0,4 моль
У моль
ХХ== 15 моль
У У= = 5 моль
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х=
У=
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
20.
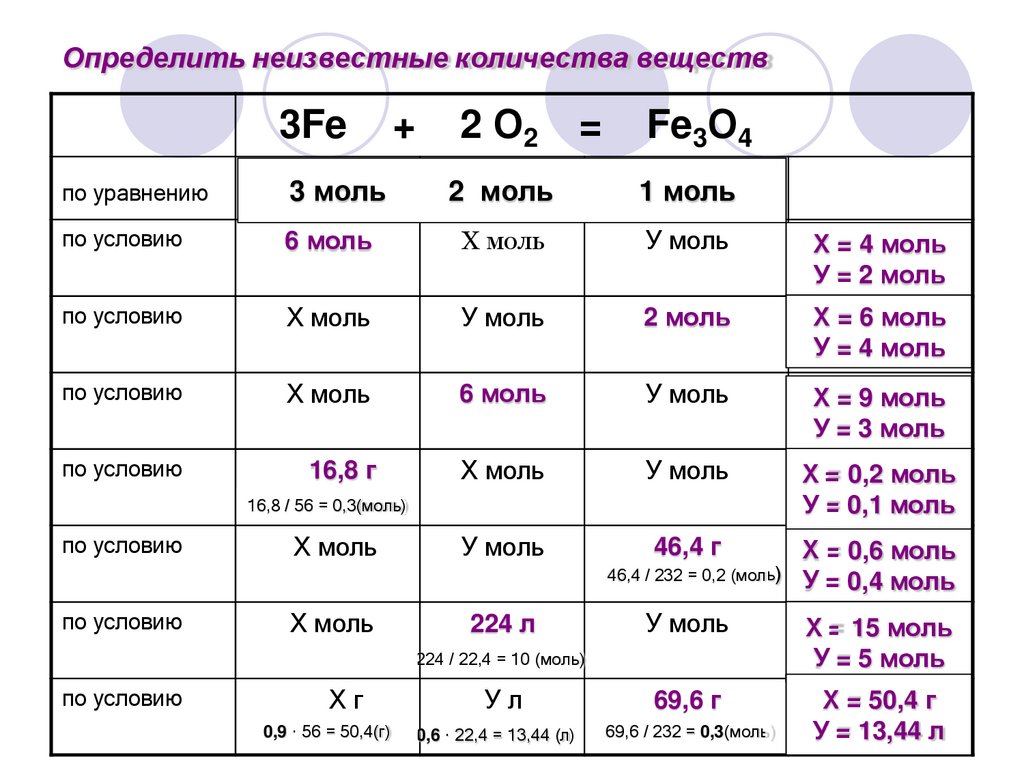
Определить неизвестные количества веществ3Fe
+
2 О2
=
Fe3О4
по уравнению
3 моль
2 моль
1 моль
по условию
6 моль
Х моль
У моль
ХХ= = 4 моль
УУ= = 2 моль
по условию
Х моль
У моль
2 моль
ХХ= = 6 моль
УУ= = 4 моль
по условию
Х моль
6 моль
У моль
ХХ= = 9 моль
УУ= = 3 моль
по условию
16,8 г
Х моль
У моль
Х
Х== 0,2 моль
УУ== 0,1 моль
46,4 г
16,8 / 56 = 0,3(моль)
по условию
Х моль
У моль
по условию
Х моль
224 л
Х
Х== 0,6 моль
46,4 / 232 = 0,2 (моль) У
У== 0,4 моль
У моль
ХХ== 15 моль
УУ= = 5 моль
Ул
69,6 г
0,6 · 22,4 = 13,44 (л)
69,6 / 232 = 0,3(моль)
Х =Х = 50,4 г
УУ= = 13,44 л
224 / 22,4 = 10 (моль)
по условию
Хг
0,9 · 56 = 50,4(г)
21.
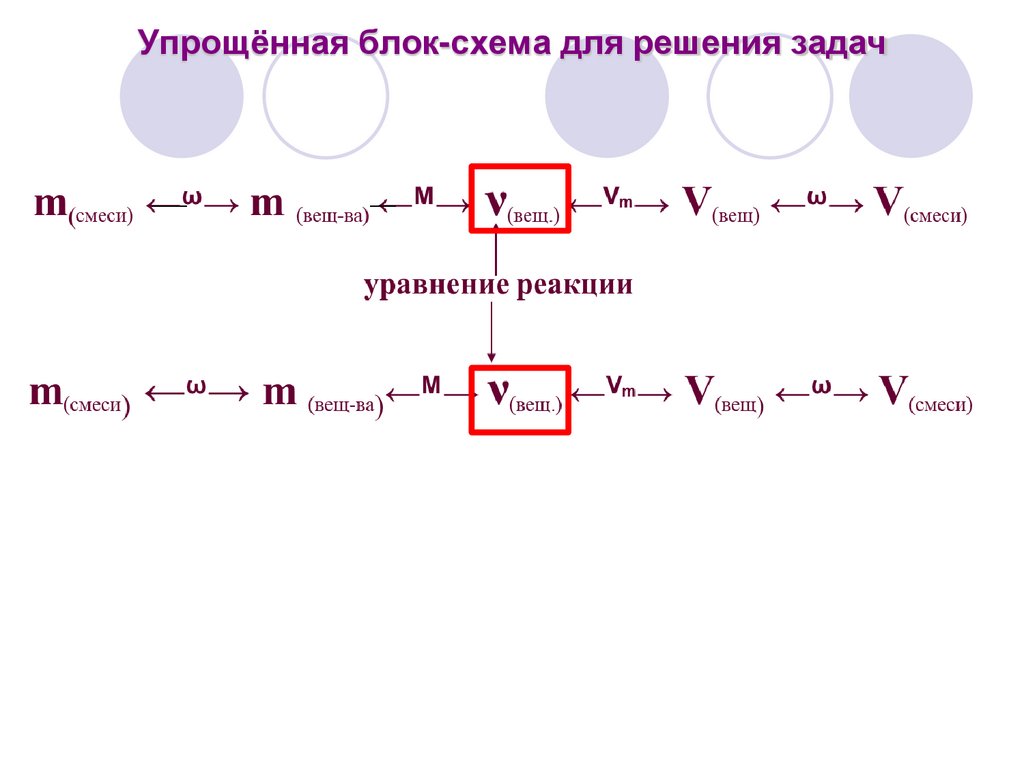
Упрощённая блок-схема для решения задач22.
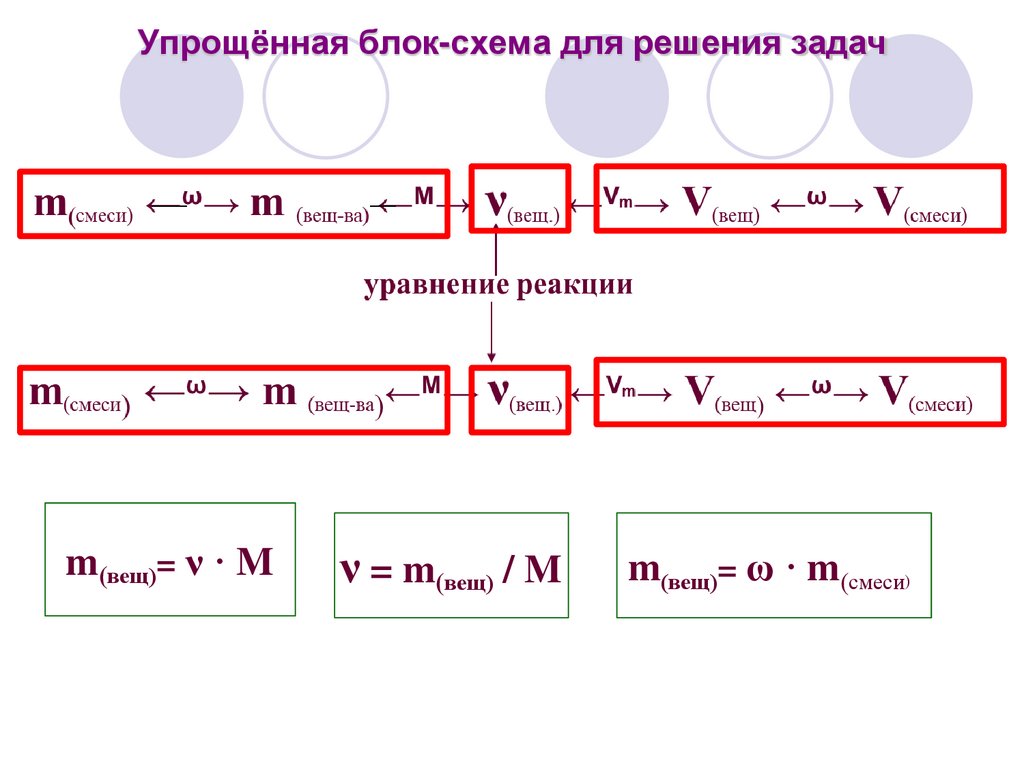
Упрощённая блок-схема для решения задачm(вещ)= ν · M
ν = m(вещ) / M
m(вещ)= ω · m(смеси)
23.
Задача 1.24.
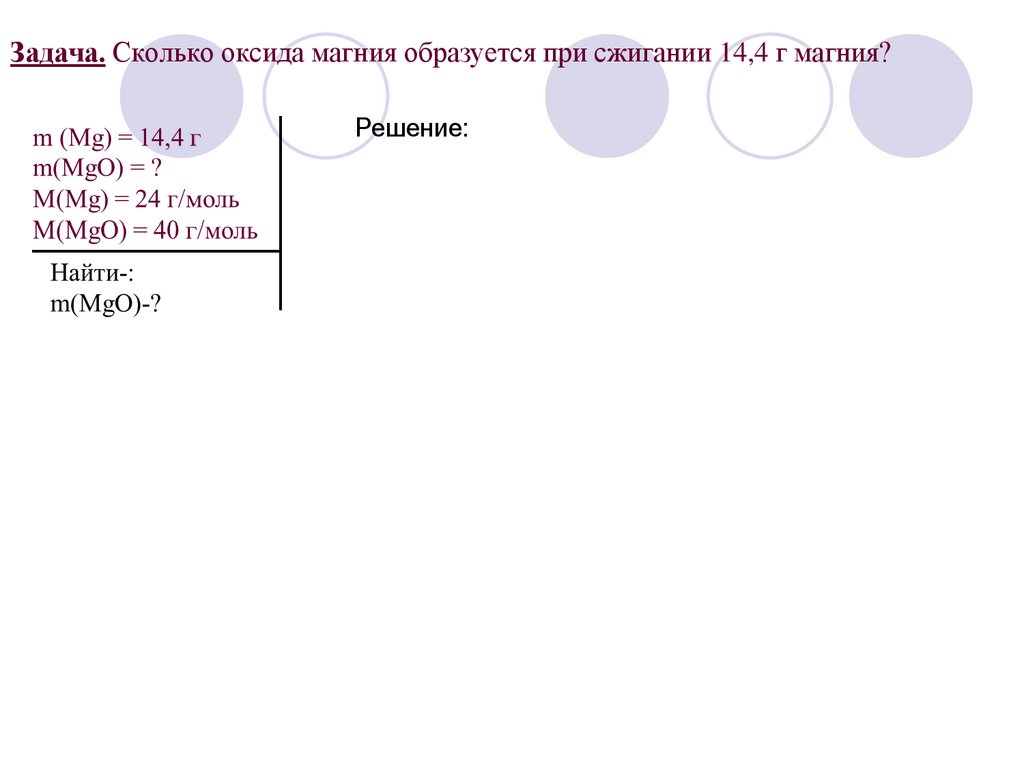
Задача. Сколько оксида магния образуется при сжигании 14,4 г магния?Решение:
25.
Задача. Сколько оксида магния образуется при сжигании 14,4 г магния?Решение:
2Mg + 2O2 = 2MgO
26.
Задача. Сколько оксида магния образуется при сжигании 14,4 г магния?Решение:
2Mg + 2O2 = 2MgO
1)n (Mg) = 14,4 / 24 = 0,6(моль)
27.
Задача. Сколько оксида магния образуется при сжигании 14,4 г магния?Решение:
0,6 моль
х моль
2Mg + 2O2 = 2MgO
1)n (Mg) = 14,4 / 24 = 0,6(моль)
28.
Задача. Сколько оксида магния образуется при сжигании 14,4 г магния?Решение:
0,6 моль
х моль
2Mg + 2O2 = 2MgO
2 моль
2 моль
1)n (Mg) = 14,4 / 24 = 0,6(моль)
29.
Задача. Сколько оксида магния образуется при сжигании 14,4 г магния?Решение:
0,6 моль
х моль
2Mg + 2O2 = 2MgO
2 моль
2 моль
1) n (Mg) = 14,4 / 24 = 0,6(моль)
2) По уравнению:
n(MgO)=n(Mg)=0,6моль
30.
Задача. Сколько оксида магния образуется при сжигании 14,4 г магния?Решение:
0,6 моль
х моль
2Mg + 2O2 = 2MgO
2 моль
2 моль
1) n (Mg) = 14,4 / 24 = 0,6(моль)
2) По уравнению:
n(MgO)=n(Mg)=0,6моль
3) m (MgO) = 0,6 · 40 = 24 (г)
Ответ: 24 г
31.
Задача 2.32.
Задача. Какой объём водорода выделится при взаимодействии 6,5 г цинка,содержащего 10% примеси, с соляной кислотой?
Решение:
33.
Задача. Какой объём водорода выделится при взаимодействии 6,5 г цинка,содержащего 10% примеси, с соляной кислотой?
Решение:
Zn + 2HCl = ZnCl2 + H2
34.
Задача. Какой объём водорода выделится при взаимодействии 6,5 г цинка,содержащего 10% примеси, с соляной кислотой?
Решение:
Zn + 2HCl = ZnCl2 + H2
1) m (Zn) = 0,9 · 6,5 = 5,85 (г)
2) ν (Zn) = 5,85 / 65 = 0,09(моль)
35.
Задача. Какой объём водорода выделится при взаимодействии 6,5 г цинка,содержащего 10% примеси, с соляной кислотой?
Решение:
0,09 моль
х моль
Zn + 2HCl = ZnCl2 + H2
2 моль
1 моль
1) m (Zn) = 0,9 · 6,5 = 5,85 (г)
2) ν (Zn) = 5,85 / 65 = 0,09(моль)
36.
Задача. Какой объём водорода выделится при взаимодействии 6,5 г цинка,содержащего 10% примеси, с соляной кислотой?
Решение:
0,09моль
х моль
Zn + 2HCl = ZnCl2 + H2
2 моль
1 моль
1) m (Zn) = 0,9 · 6,5 = 5,85 (г)
2) ν (Zn) = 5,85 / 65 = 0,09(моль)
По уравнению:
3) ν (H2) = 1/2ν (HCl) = 0,5∙0,09=0,045 (моль)
37.
Задача. Какой объём водорода выделится при взаимодействии 6,5 г цинка,содержащего 10% примеси, с соляной кислотой?
Решение:
0,045 моль
1 моль
Zn + 2HCl = ZnCl2 + H2
2 моль
1 моль
1) m (Zn) = 0,9 · 6,5 = 5,85 (г)
2) ν (Zn) = 5,85 / 65 = 0,09(моль)
По уравнению:
3) ν (H2) = 1/2ν (HCl) = 0,5∙0,09=0,045 (моль)
4) V (H2) = 0,045 · 22,4 = 1,008 (л)
Ответ: 1,008 л
38.
Задача 3.39.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
Решение:
40.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
Решение:
Mg+H2SO4=MgSO4+H2↑
41.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
Решение:
Mg+H2SO4=MgSO4+H2↑
1) m(H2SO4)=0,49∙20=9,8г
42.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
Решение:
Mg+H2SO4=MgSO4+H2↑
1) m(H2SO4)=0,49∙20=9,8г
2) n(H2SO4)=9,8г/98г/моль=0,1моль
43.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
0,1моль
Х моль
Mg+H2SO4=MgSO4+H2↑
1) m(H2SO4)=0,49∙20=9,8г
2) n(H2SO4)=9,8г/98г/моль=0,1моль
44.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
0,1моль
Х моль
Mg+H2SO4=MgSO4+H2↑
1моль
1моль
1) m(H2SO4)=0,49∙20=9,8г
2) n(H2SO4)=9,8г/98г/моль=0,1моль
45.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
0,1моль
Х моль
Mg+H2SO4=MgSO4+H2↑
1моль
1моль
1) m(H2SO4)=0,49∙20=9,8г
2) n(H2SO4)=9,8г/98г/моль=0,1моль
По уравнению:
3) n(H2)=n(H2SO4)=0,1моль
46.
Задача. Какой объём водорода выделится при взаимодействии магнияс 20 граммами раствора серной кислоты, массовая доля кислоты в
котором составляет 49%?
0,1моль
Х моль
Mg+H2SO4=MgSO4+H2↑
1моль
1моль
1) m(H2SO4)=0,49∙20=9,8г
2) n(H2SO4)=9,8г/98г/моль=0,1моль
По уравнению:
3) n(H2)=n(H2SO4)=0,1моль
4) V(H2)=Vm∙n=22,4л/моль ∙0,1моль=2,24л
47.
Подготовкак проверочной работе
48.
Задача.Вычислите массу железа, необходимого для
получения 39 г хлорида железа(III).
Схема уравнения реакции следующая:
Fe + Cl2 → FeCl3
m(FeCl3) =39 г
m(Fe) = ?
M(Fe) = 56 г/моль
M(FeCl3) = 56 + 35,5 · 3 =162,5 г/моль
49.
Задача.Вычислите массу оксида, полученного при
окислении 60 г мышьяка.
Схема уравнения реакции следующая:
2 As + 5O2 → As2O5
m(As) = 60 г
m(As2O5) = ?
M(As) = 75 г/моль
M(As2O5) = 75 ·2 + 16 · 5 = 230 г/моль
50.
Задача.Какой объём водорода образуется при
взаимодействии 30 граммов кальция,
содержащего 20% примеси, с водой?
m (cмеси) = 30 г
ω (Ca) = 100% - 20% = 80%
V(Н2) = ?
M(Ca) = 40 г/моль
51.
Задача.Какой объём углекислого газа(CO2) образуется при
разложении 250 граммов известняка (СаСО3),
содержащего 20% примеси?
m (cмеси) = 250 г
ω (CaCO3) = 100% - 20% = 80%
V(CO2) = ?
M(CaCO3) = 40 + 12 + 16 · 3 = 100 г/моль
52.
Дописать уравнения реакций.Указать тип реакции.
Na + H2 =
2) Hg + O2 =
3) Ag2O =
4) KCl =
5) Fe + H2SO4 =
6) Mg + Cu(NO3)2 =
7) Zn(OH)2 + HCl =
8) BaCl2+ H2SO4 =
1)




























 chemistry
chemistry








