Similar presentations:
4.Метан_этан_10 класс
1.
Метан и этан — простейшиепредставители алканов.
2.
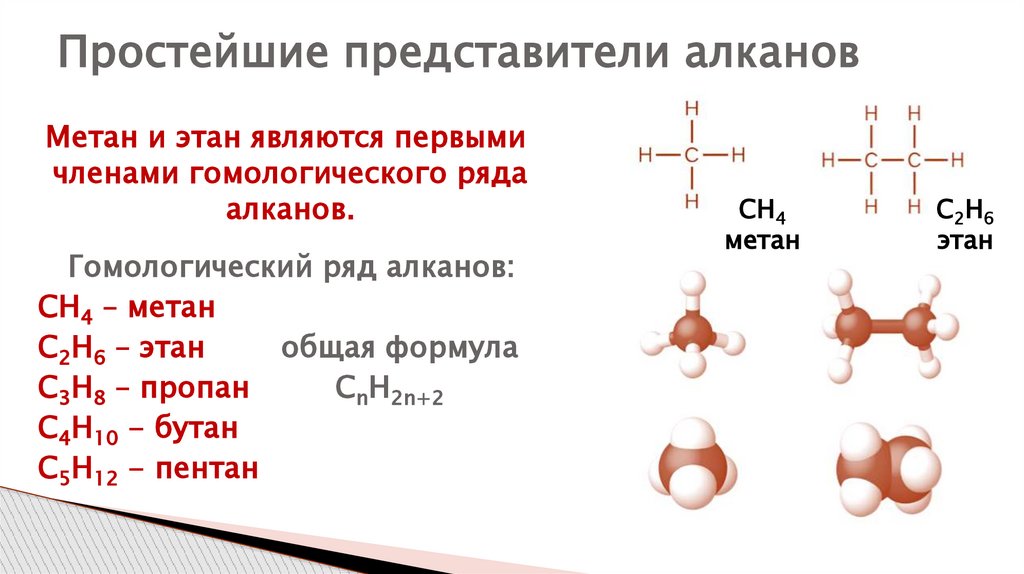
Простейшие представители алкановМетан и этан являются первыми
членами гомологического ряда
алканов.
Гомологический ряд алканов:
СН4 – метан
С2Н6 – этан
общая формула
С3Н8 – пропан
CnH2n+2
С4Н10 - бутан
С5Н12 - пентан
СН4
метан
С2 Н 6
этан
3.
Физические свойстваСН4 - метан
Бесцветный газ;
Без запаха и вкуса;
Практически нерастворим в воде;
Очень низкая плотность (меньше
плотности воздуха);
• Низкая температура кипения (-161°C).
С2Н6 - этан
Бесцветный газ;
Почти не имеет запаха;
Нерастворим в воде;
Плотность чуть ниже плотности воздуха;
Температура кипения низкая (-88,6°C).
Задание.
Определите, в каком из
углеводородов (метан,
этан) больше массовая
доля углерода.
Проверь себя!
1. Mr (CH4) =16
w (C) = 12:16 = 0,75 (75%)
2. Mr (C2H6) =30
w (C) = 24:30 = 0,8 (80%)
В этане массовая доля
углерода больше.
4.
Нахождение в природеСН4 - метан
Метан образуется естественным путём в болотах,
морях и океанах, в рубце крупного рогатого
скота содержатся микроорганизмы, способные
разлагать пищу и выделять метан в процессе
пищеварения. Метан – третий по значимости
(после воды и углекислого газа) парниковый газ.
С2Н6 - этан
Этан встречается в природе в составе природного
газа. Содержание этана в природном газе из
разных газовых месторождений варьируется от
менее чем 1% до более чем 6% по объёму.
5.
Получение метанаВ промышленности:
Извлечение его из природного газа после добычи. Для
этого метан отделяют от других компонентов, таких
как этилен и пропан, с использованием специальных
мембранных технологий или методом фракционной
перегонки.
В лаборатории:
из карбида алюминия
из ацетата натрия
6.
Получение этанаВ промышленности:
В промышленности этан получают из нефти, каменного угля,
природного и попутного газа.
В лаборатории:
гидрирование непредельных углеводородов
реакция Вюрца
7.
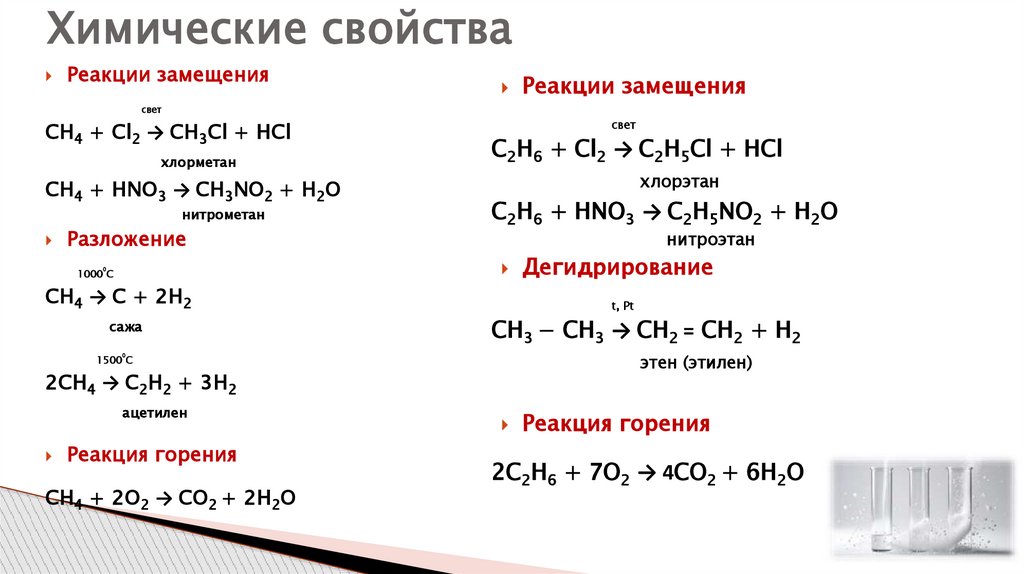
Химические свойстваРеакции замещения
Реакции замещения
свет
СН4 + Cl2 → CH3Cl + HCl
хлорметан
СН4 + HNO3 → CH3NO2 + H2О
нитрометан
Разложение
свет
С2Н6 + Cl2 → C2H5Cl + HCl
хлорэтан
С2Н6 + HNO3 → C2H5NO2 + H2О
нитроэтан
0
1000 С
СН4 → C + 2H2
сажа
t, Pt
СH3 − СH3 → СH2 = СH2 + H2
этен (этилен)
0
1500 С
2СН4 → C2Н2 + 3H2
ацетилен
Реакция горения
СН4 + 2О2 → СО2 + 2Н2О
Дегидрирование
Реакция горения
2С2Н6 + 7О2 → 4СО2 + 6Н2О
8.
Применение метанаИспользуется для производства электроэнергии и тепла, он применяется
в генераторах и котельных установках для обеспечения энергией домов
и промышленных предприятий.
Органический синтез – получение сажи, ацетилена, хлорметанов.
С помощью метана получают биостимуляторы, которые увеличивают
сопротивляемость растений грибам, вирусам, бактериям и нематодам, а
также способствуют ускоренной выработке гормонов роста.
Используется в бытовых газовых плитах и котлах для обогрева домов и
приготовления пищи.
9.
Применение этанаЯвляется
одним из основных ингредиентов топлива для
походных печей из-за его высокой возгораемости,
отсутствия запаха и высокой теплотворной способности.
Органический
синтез – используется для производства
этилового спирта, ацетилена, этиленгликоля и пластмасс.
Свойства этана позволяют ему выступать в роли хладагента
при
низкотемпературном
охлаждении
соединение обозначается как R-170).
(при
этом
10.
Выполни задание.1.
2.
Вычислите, какой объём метана потребуется для
получения 4 кг сажи.
Вычислите, какой объём этилена можно получить из 560 л
этана.
11.
Выполни задание.1.
2.
Вычислите, какой объём метана потребуется для
получения 4 кг сажи.
Вычислите, какой объём этилена можно получить из 560 л
этана.
1. СН4 → C + 2H2
n(C) = 4000 : 12 = 333,3 моль; V(СН4) = 333,3·22,4 = 7467 л (7,5 м3)
2. СH3 − СH3 → СH2 = СH2 + H2
n(C2Н6) = 560 : 22,4 = 25 моль; V(С2Н4) = 25·22,4 = 560 л









 chemistry
chemistry








