Similar presentations:
Природный газ. Углеводороды
1. Природный газ. Углеводороды
2.
Цель урока: познакомится с представителямипредельных углеводородов гомологического
ряда - алканы и выявить их важную роль в
промышленности.
3. Природный газ
одно из важнейших горючихископаемых, занимающие
ключевые позиции в
топливно-энергетических
балансах многих государств,
важное
сырьё для химической
промышленности. Почти на
90% он состоит из
углеводородов, главным
образом метана СН4.
4. Попутный газ
Попутные нефтяные газыявляются побочными
продуктами при добыче
нефти и находятся в ней в
растворенном и в
свободном состоянии в
виде пузырьков или
газовой шапки над
поверхностью. Основными
составляющими
естественного нефтяного
газа являются
углеводороды метанового
ряда.
5.
• Природный газ• Попутный газ
СН4- 80-98%
С2Н6 – 0,5-4%
С3Н8 – 0,2-1,5%
С4Н10 – 0,1-1%
С5Н12 -1%
N2
CO2
H2S
СН4-40%
С2Н6 – 20%
С3Н8 – 20%
С4Н10 – 20%
С5Н12
С6Н14
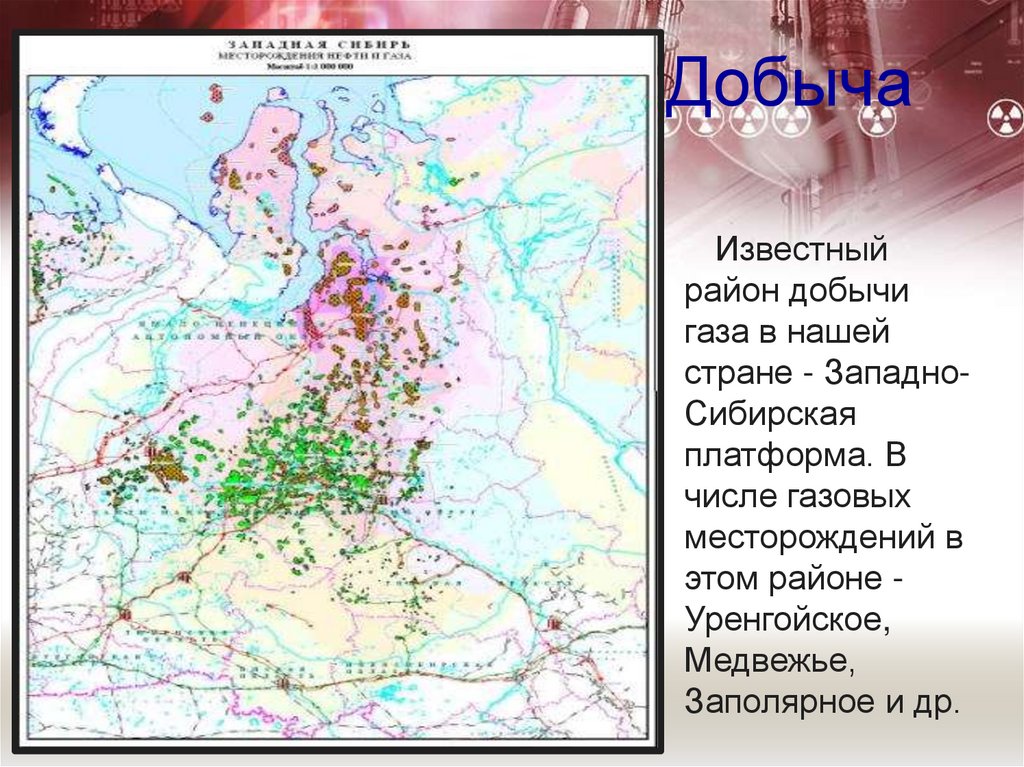
6. Добыча
Известныйрайон добычи
газа в нашей
стране - ЗападноСибирская
платформа. В
числе газовых
месторождений в
этом районе Уренгойское,
Медвежье,
Заполярное и др.
7.
ТранспортировкаОчень
важно и ценно, что природный
газ можно транспортировать на
значительные
расстояния с
относительно небольшими
затратами - по газопроводам.
Первый в
СССР газопровод СаратовМосква был
введён в эксплуатацию в 1946 г.
8. Переработка природного газа
С каждым годом все больше расширяетсяхимическая переработка природного газа, и из
ценного энергетического средства газ становится не
менее важным химическим сырьем. Он служит для
получения ацетилена, метилового спирта, сажи,
хлорированных углеводородов и различных
растворителей.
9. Продукты
Лаки, краски, растворители, резина, пластмасса,антифризы, искусственные волокна, лекарства и … все
это продукты получаемые в ходе синтеза из
углеводородов.
10. Применение
Природный газ широко применяется в качестве горючего вжилых частных и многоквартирных домах для отопления,
подогрева воды и приготовления пищи;
как топливо для машин, котельных, ТЭЦ и др. Сейчас он
используется в химической промышленности как исходное
сырьё для получения различных органических веществ.
В XIX веке природный газ использовался в
первых светофорах и для освещения
11. Экологические проблемы
В экологическом отношении природный газ являетсясамым чистым видом минерального топлива. При
сгорании его образуется значительно меньшее количество
вредных веществ по сравнению с другими видами
топлива. Однако из-за неподготовленности
инфраструктуры для сбора попутного газа, подготовки,
транспортировки и переработки, а также во избежание
затрат на его утилизацию, многие нефтяные компании
просто сжигают его на факелах. Тем самым сильному
загрязнению подвергается окружающая среда
12. Алканы
Предельные углеводороды.Насыщенные углеводороды.
13. Определение алканов
Это предельныеуглеводороды, в молекулах
которых все атомы связаны
одинарными связами
14. Общая формула алканов
Сn H2n+215. уравнения химических реакции горения
• CH4 +2O2 → 2H2O + CO2↑• 2C2H6 +7O2 → 6H2O + 4CO2↑
• C3H8 +5O2 → 4H2O + 3CO2↑
• 2C4H10 +13O2 → 10H2O + 8CO2↑
• C5H12 +8O2 → 6H2O + 5CO2↑
• 2C6H14 +19O2 → 14H2O + 12CO2↑
16. Гомологический ряд
СН4 метанС2Н6 этан
С3Н8 пропан
С4Н10 бутан
С5Н12 пентан
С6Н14 гексан
С7Н16 гептан
С8Н18 октан
С9Н20 нонан
С10Н22 декан
17. Название радикалов
• CH3• C2H5
• C3H7
• C4H9
• C5H11
• C6H13
метил
этил
пропил
бутил
пентил
гексил
18. Физические свойства
• С1 – С4 – газы,• С5 –С15 – жидкости,
• С16 - ∞ -твердые вещества
• Газы и твердые алканы запаха не имеют,
жидкие имеют бензиновый запах. Легче
воды. Плохо растворимы в воде
19. Строение алканов
• Молекула первого члена гомологическогоряда алканов – метан имеет
тетраэдрическое строение.
• Все атомы углерода в молекулах алканов
находятся в состоянии sp3 гибридизации
Угол между связами составляет109 28
длина связи С — С в предельных
углеводородах 0,154 нм.
20.
Строение метана :• Для алканов характерна sp³-гибридизация;
• Длина С-С – связи = 0,154 нм
• Углы между орбиталями = 109° 28´
Рисунок 3.
c
c
c
c
c
c
c
0,154 нм
Гибридизованные облака
Рисунок 1.
+
s
109°28´
Метан
Рисунок 2.
р
Перекрывание гибридных электронных
облаков атомов углерода облаками атомов
водорода (молекула метана).
21. Виды изомерии
• СтруктурнаяУглеродного скелета
Положения кратной связи
Положения функциональной группы
Межклассовая
22. Алгоритм составления названия алканов
• 1.В структурной формуле выбирают самую длинную цепьатомов углерода (главную цепь)
• 2.Атомы углерода главной цепи нумеруют, начиная с того
конца, к которому ближе разветвление (радикал)
• 3.В начале названия перечисляют радикалы и другие
заместители с указанием номеров атомов углерода ,с
которыми они связаны. Если в молекуле присутствует
несколько одинаковых радикалов (два, три, четыре и т. д)
то цифрой указывают место каждого из них в главной цепи
и перед их названием ставят соответственно частицы ди-,
три-, тетра- и т.д.
• 4.Основой названия служит наименование предельного
углеводорода с тем же числом атомов углерода, что и в
главной цепи.
23. Составления названия алканов.
76
5
4
3
2
1
CH3 −CH2 − CH − CH2 − CH2− CH − CH3
ǀ
ǀ
C 2H5
CH3
2-метил-5-этилгептан
24. Получение алканов.
• Получение метана1.В промышленности:
а)из природного газа
б)синтез из оксида углерода (II) и
водорода
Ni,300˚C
CO + 3H2 →
CH4 ↑ +H2O
25. Получение метана
• В лабораторииа)гидролиз карбида алюминия
Al4C3 +12H2O → 3CH4 ↑ +4Al(OH)3
б )сплавление солей уксусной
кислоты со щелочами
CH3COONa +NaOH (т) → CH4 ↑ +Na2CO3
26. Получение гомологов метана.
В промышленностиа) из природного сырья (нефть, газ,
горный воск)
б) синтез из оксида углерода (II) и
водорода
27. Получение гомологов метана.
• В лабораторииа)каталитическое гидрирование непредельных
углеводородов (алкенов,алкинов)
Pt
CnH2n + H2 → CnH2n+2
Ni,150˚C
CnH2n-2 + 2H2 → CnH2n+2
б) взаимодействие галогеноалканов с натрием
(реакция Вюрца)
2R−Br +Na → R−R + 2NaBr
2CH3Br + Na → CH3 − CH3 +2NaBr
28.
Применение алканов:Широко
используются в
качестве
топлива, в том
числе для
двигателей
внутреннего
сгорания.
29. Применение алканов:
1-3 – производствосажи:
(1 – картрижи;
2 – резина;
3 – типографическая
краска)
4-7 – получение
органических веществ:
(4 – растворителей;
5 – хладогентов,
используемых
в холодильных
установках;
6 – метанол;
7 - ацетилен)
30. Домашнее задание: заполните таблицу
НазваниеОбщая
формула
Тип
гибридизац
ии
Виды
изомерии
Физические
свойства
Химически
е свойства
Получение и
применение





























 chemistry
chemistry








