Similar presentations:
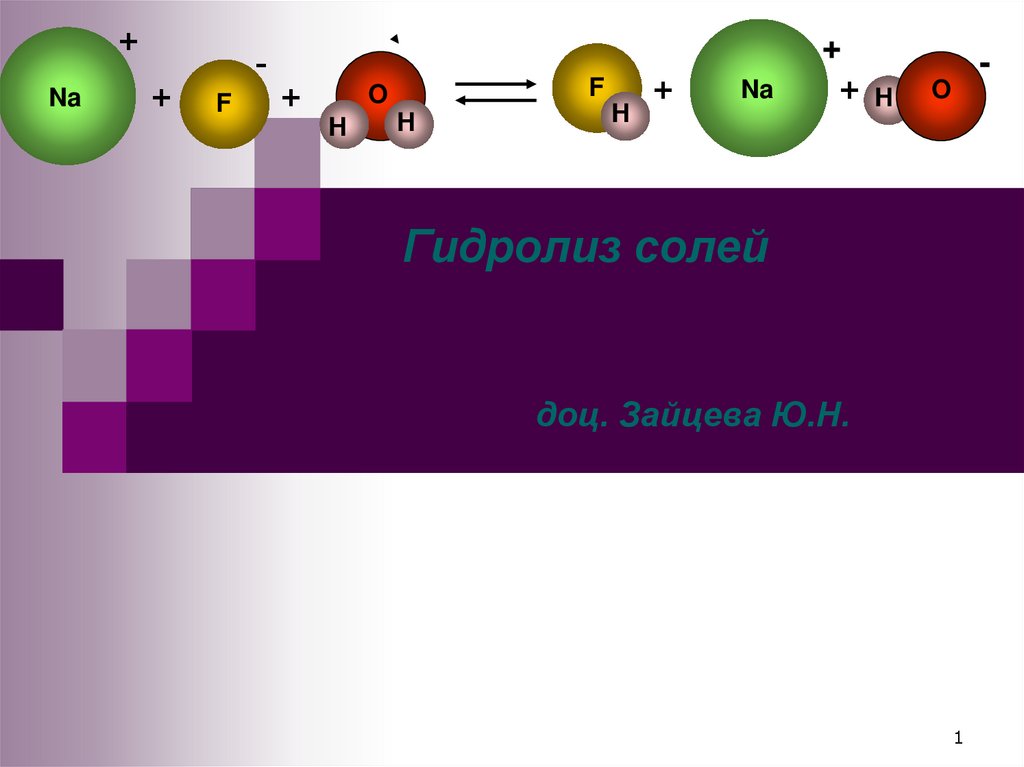
Гидролиз солей
1. Гидролиз солей доц. Зайцева Ю.Н.
+Na
+
+
F
+
H
+
F
O
H
Na
H
+ H
-
O
Гидролиз солей
доц. Зайцева Ю.Н.
1
2.
Гидролиз – это обменное взаимодействие ионов соли сводой, приводящее к образованию
малодиссициированных соединений или ионов, что
вызывает изменение pH раствора.
Процесс гидролиза солей – это процесс обратный
реакции нейтрализации.
1. Влияние природы соли на процесс гидролиза
1) Соли, образованные сильным основанием и сильной
кислотой
NaCl +H2O ⇄
гидролиз не идет, среда нейтральная pH~7
NaOH +HCl → NaCl+H2O – необратимая реакция
гидролизу не подвергаются
2
3.
2) Соли, образованные сильным основанием и слабойкислотой:
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
2Na+ + CO32- + HOH ⇄ HCO3- + OH- + 2Na+
H2CO3 ⇄ H++HCO3-
KI = 4,5 10-7
HCO3- ⇄ H++CO32-
KII = 4,7 10-11
Реакция среды – основная (рН>7). Гидролиз идет по первой ступени.
3) Соли, образованные слабым основанием и сильной
кислотой:
CuCl2 + H2O ⇄ CuOHCl + HCl
Cu2++2Cl- + HOH ⇄ CuOH+ + H+ + 2ClРеакция среды – кислая (рН<7). Гидролиз идет по первой ступени.
3
4.
4) Соли, образованные слабым основанием и слабойкислотой:
(NH4)2S + 2H2O ⇄
2NH4OH + H2S
2NH4+ + S2- + 2HOH ⇄
2NH4OH + H2S
Реакция среды – близка к нейтральной (рН≈7). Гидролиз идет до
конца
Гидролиз идет по иону слабого электролита.
Характер среды определяется природой сильного
электролита
4
5.
Совместный гидролиз2AlCl3+3Na2CO3+3H2O⇄ 2Al(OH)3+3CO2+6NaCl
2Al3+ + 6Cl- + 6Na+ + 3CO32- + 3HOH ⇄ 2Al(OH)3 + 3CO2 + 6Na+ + 6Cl-
Соли, разные по природе, могут усиливать гидролиз друг
друга
5
6. 2. Количественные характеристики процесса гидролиза солей
Равновесие процесса гидролиза характеризуетсяконстантой гидролиза Кг – величина постоянная,
которая характеризует способность данной соли
подвергаться гидролизу.
Константа гидролиза зависит от
природы соли
температуры
и не зависит от концентрации раствора.
6
7.
Константа гидролиза (Кг) – это отношениеионного произведения воды (Кw) к константе
диссоциации слабого основания или слабой
кислоты, образующих данную соль.
7
8.
а) Соль образована слабым основанием и сильнойкислотой (гидролиз по катиону):
NH4Cl + H2O ⇄ NH4OH + HCl
NH4++ HOH ⇄ NH4OH + H+
Kt+ + HOH ⇄ KtOH + H+
KW
Kг
Kb
[H+][OH-]=KW ;
[HOH] ≈ Const;
Чем слабее основание, тем в большей степени
подвергаются гидролизу образованные им соли.
8
9.
б) Соль образована сильным основанием ислабой кислотой (гидролиз по аниону):
Для солей типа CH3COONa
KW
Kг
Ka
Чем слабее кислота, тем в большей степени
подвергаются гидролизу соли, образованные этой
кислотой.
9
10.
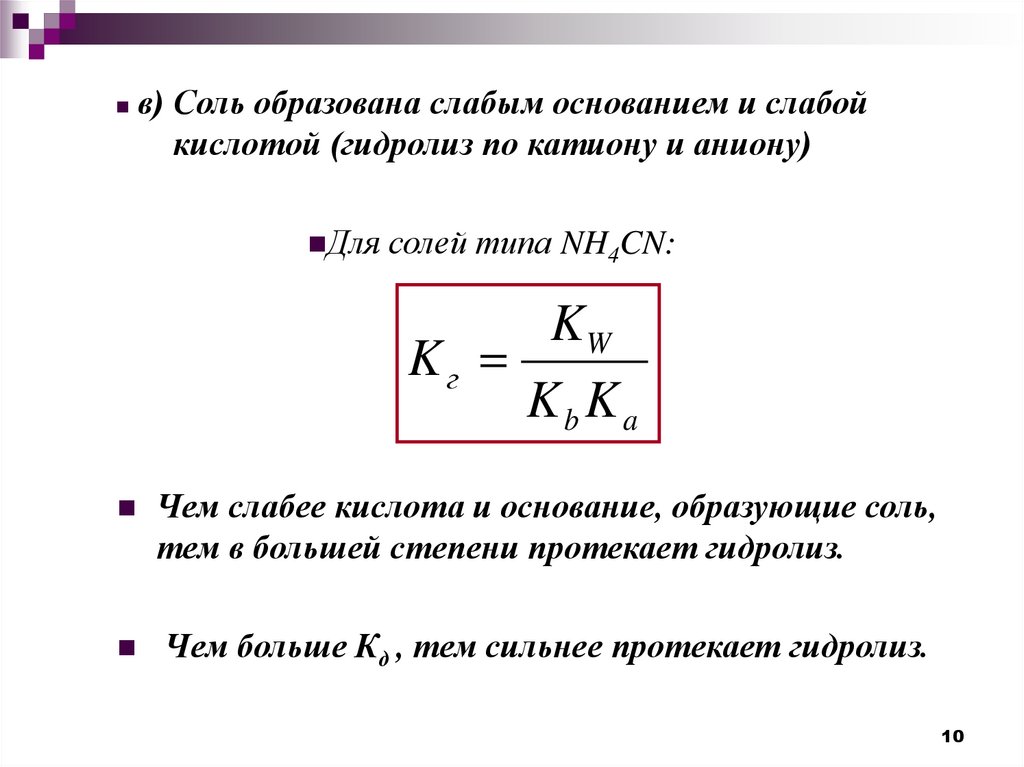
в) Соль образована слабым основанием и слабойкислотой (гидролиз по катиону и аниону)
Для солей типа NH4CN:
KW
Kг
Kb Ka
Чем слабее кислота и основание, образующие соль,
тем в большей степени протекает гидролиз.
Чем больше Кд , тем сильнее протекает гидролиз.
10
11. 2. Степень гидролиза – это доля вещества, подвергшегося гидролизу.
Степень гидролиза (h) – отношение количествагидролизованной соли к общему количеству
растворенной соли, обычно выражаемое в
процентах.
12.
Степень гидролиза зависит от химическойприроды составляющих данную соль ионов.
Чем слабее кислота (основание), образующие
соль, тем выше степень гидролиза.
12
13. 3. Влияние концентрации соли на процесс гидролиза.
hKг
C
По мере разбавления раствора степень гидролиза
возрастает
4. Влияние температуры на процесс гидролиза.
Гидролиз – эндотермический процесс.
Чем выше температура, тем больше степень гидролиза.
Повышение температуры усиливает процесс гидролиза.
13
14.
ДиссоциацияКонстанта диссоциации Кд
Степень диссоциации α
Kд= α2C
Гидролиз
Константа гидролиза Кг
Степень гидролиза h
Kг = h2C
14
15. Правила составления уравнений гидролиза
1.Определить какой кислотой и каким основанием
образована соль.
2. Предварительно оценить характер среды. Характер
среды в растворе соли определяет «сильный ион»
3. Подчеркнуть слабый ион
4. Составить краткое ионное уравнение гидролиза.
Записать уравнение реакции 1 моль воды и одного
«слабого электролита»
15
16. 5. Закончить молекулярное уравнение гидролиза. Для этого полученные в результате гидролиза ионы дополнить ионами не
участвовавшими в реакциигидролиза.
6. Проверить количество всех ионов слева и справа.
При необходимости расставить коэффициенты
16
17. Примеры
1.Определите характер среды в растворе цианида
калия.
2.
Запишите уравнение гидролиза. Укажите значение
рН.
3. Запишите выражение константы гидролиза.
4. Определите как повлияет на протекание гидролиза
нагревание, добавление щелочи, кислоты
17
18. 1. Формула соли KCN. Соль образована сильным основанием КОН и слабой кислотой HCN. Реакция среды - щелочная. Гидролиз по
аниону.2. KCN + Н2О ⇄ НCN + КОН
3. CN- + Н+ОН- ⇄ НCN + ОНрН>7
[ HCN ] [OH ]
Кг
[CN ]
4. +NaOH
+HCl
t0C
18
19.
2. Соль Na3PO4.Соль образована сильным основанием и слабой
кислотой.
Гидролиз по аниону. Среда щелочная.
PO43- + НОН ⇄ (НPO4)2- + ОН Na3PO4 + H2O ⇄ Na2HPO4 + NaOH
Среда щелочная. pH>7
19
20.
3. NH4ClСоль образована слабым основанием и
сильной кислотой.
Гидролиз по катиону. Среда кислая
NH4Cl + H2O ⇄ NH4OH + HCl
NH4+ + НОН ⇄ NH4OH + Н+ рН<7
20
21. Указать, не производя вычислений, какая из двух солей – Na2SO3 или Na2CO3 ?
Кд(Н2SO3) = 1,7 . 10-2>
Кд(Н2СO3) = 4,5 . 10-7
Следовательно, Na2CO3 гидролизуется в большей
степени, чем Na2SO3 .
21
22. Пример ZnSO4 ⇄ Zn2+ + SO42-
Zn2++ H2O ⇄ ZnOH++ H+ pH < 72ZnSO4+2H2O ⇄ (ZnOH)2SO4 +H2SO4
22
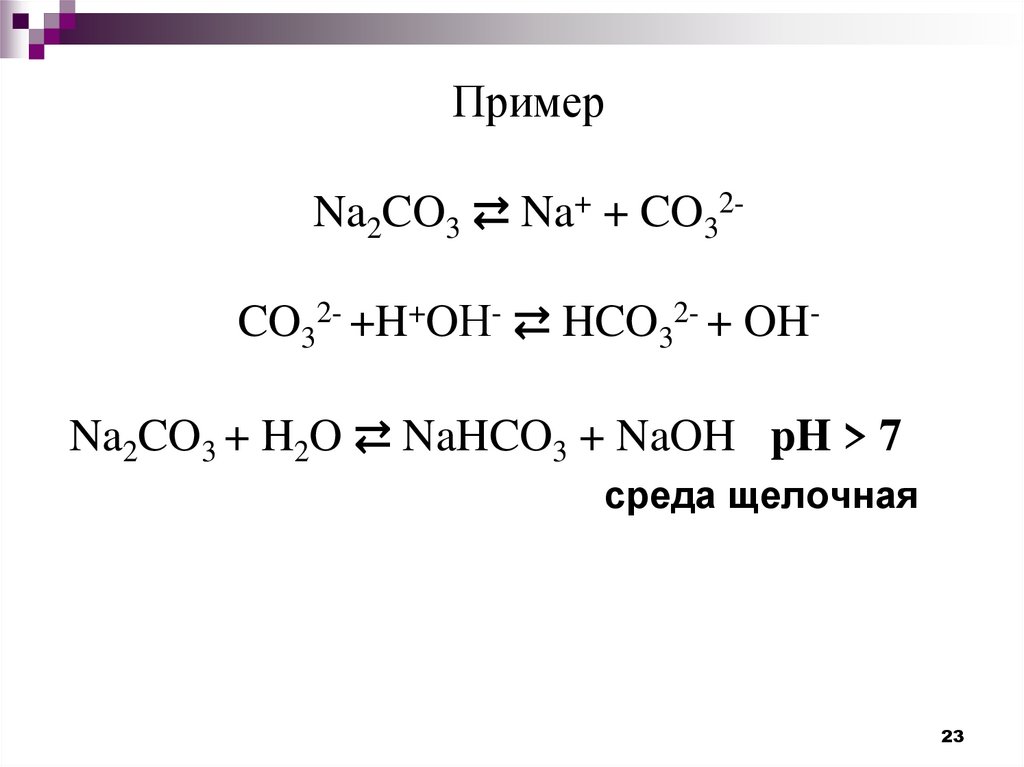
23. Пример Na2CO3 ⇄ Na+ + CO32- CO32- +H+OН- ⇄ HCO32- + OH-
ПримерNa2CO3 ⇄ Na+ + CO32CO32- +H+OН- ⇄ HCO32- + OH-
Na2CO3 + H2O ⇄ NaHCO3 + NaOH pH > 7
среда щелочная
23
24.
Расчет pH в растворе гидролизующейся соли1. Записать уравнение диссоциации соли
2. Записать краткое ионно-молекулярное уравнение гидролиза соли
3. Определить среду в растворе соли
4. Рассчитать константу гидролиза: K Г
5. Рассчитать степень
гидролиза:
h
KW
K д (слабого электролита)
KГ
C(соли)
6. Рассчитать концентрацию ионов H+ (или OH ) в растворе:
[H ] h C(соли)
[OH ] h C(соли)
7. Рассчитать pH раствора:
pH lg[H ]
pOH lg[OH ]
pH 14 pOH
25.
Рассчитать pH в растворе хлорида аммонияс концентрацией 0,001 моль/л (KД1 = 1,8·10 5)
NH4+ + Cl
1. NH4Cl
2. NH4+ H OH ⇄ NH4OH H+
3. pH < 7
4. K Г
5. h
14
KW
10 5 5,6 10 10
K д (NH4OH) 1,8 10
KГ
C(NH 4Cl)
5,6 10 10
10
3
7,5 10 4
6. [H ] h C(соли) 7,5 10 4 10 3 7,5 10 7 моль/л
7. pH lg[H ] lg 7,5 10 4 6,13
26.
Рассчитать pH в растворе карбоната натрияс концентрацией 0,01 моль/л
(для угольной кислоты KД1 = 4·10 7; KД2 = 5·10 11)
1. Na2CO3
2Na+ + CO32
2. CO32 H OH ⇄ HCO3 OH
3. pH > 7
4. K Г
5. h
14
KW
10 11 2 10 4
KД2(H2СO3) 5 10
KГ
C
2 10 4
2
1,4 10 1
10
6. [OH ] h C 1,4 10 1 10 2 1,4 10 3 моль/л
7. pOH lg[OH ] lg1,4 10 3 2,85
pH 14 pH 14 2,85 11,15























 chemistry
chemistry








