Similar presentations:
Семинар №1 (процессы, смеси) нов
1. СЕМИНАР № 1.1 ПО КУРСУ «Уравнения состояния. Термодинамические процессы»
РГУ нефти и газа (НИУ) имени И.М. ГубкинаКафедра термодинамики и тепловых двигателей
«ЭНЕРГОСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ ТРАНСПОРТА ГАЗА»
СЕМИНАР № 1.1 ПО КУРСУ
«УРАВНЕНИЯ СОСТОЯНИЯ.
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ»
Дарья Павловна Никулина
Ст. преп. кафедры термодинамики и тепловых двигателей
2. ЭНЕРГОСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ ТРАНСПОРТА ГАЗА
ЛЕКТОР – доц., канд. техн. наук ЗАВЬЯЛОВ АЛЕКСЕЙ ПЕТРОВИЧПРАКТИКА – ст.преп. НИКУЛИНА ДАРЬЯ ПАВЛОВНА
ОБЪЕМ КУРСА – 2 семестра.
I СЕМЕСТР (ОСЕНЬ):
2 ЧАСА ЛЕКЦИЙ,
1 ЧАС ПРАКТИЧЕСКИХ ЗАНЯТИЙ.
II СЕМЕСТР (ВЕСНА):
1 ЧАС ЛЕКЦИЙ,
1 ЧАС ПРАКТИЧЕСКИХ ЗАНЯТИЙ.
ВИДЫ ИТОГОВЫХ КОНТРОЛЬНЫХ ИСПЫТАНИЙ:
I семестр - (ДЗ+1 практ. контр. работа+ 1 теор. контр. работа) - ЭКЗАМЕН ;
II семестр – КУРСОВОЙ ПРОЕКТ, (реферат+ 1 теор. контр. работа+итоговая
контрольная работа) – ДИФФ. ЗАЧЕТ.
2
3.
ОСНОВНЫЕ РАСЧЕТНЫЕ СООТНОШЕНИЯ, ИСПОЛЬЗУЕМЫЕ ПРИ РЕШЕНИИЗАДАЧ ПО ТЕМЕ СЕМИНАРА
Абсолютное давление
есть предел отношения нормальной
составляющей силы к площади, на которую действует эта сила
Fn F
p lim
.
f 0 f
f n
Давление в системе СИ измеряется в Паскалях ( н / м
2
pбар
Различают барометрическое (атмосферное)
(манометрическое)
и абсолютное давление
ман
, избыточное
pабс .
p
)
.
В расчетные соотношения термодинамики входят только абсолютное
давление
исследуемой системы
, значение которого можно
абс
определить из следующего соотношения:
p
pабс p ман pбар
3
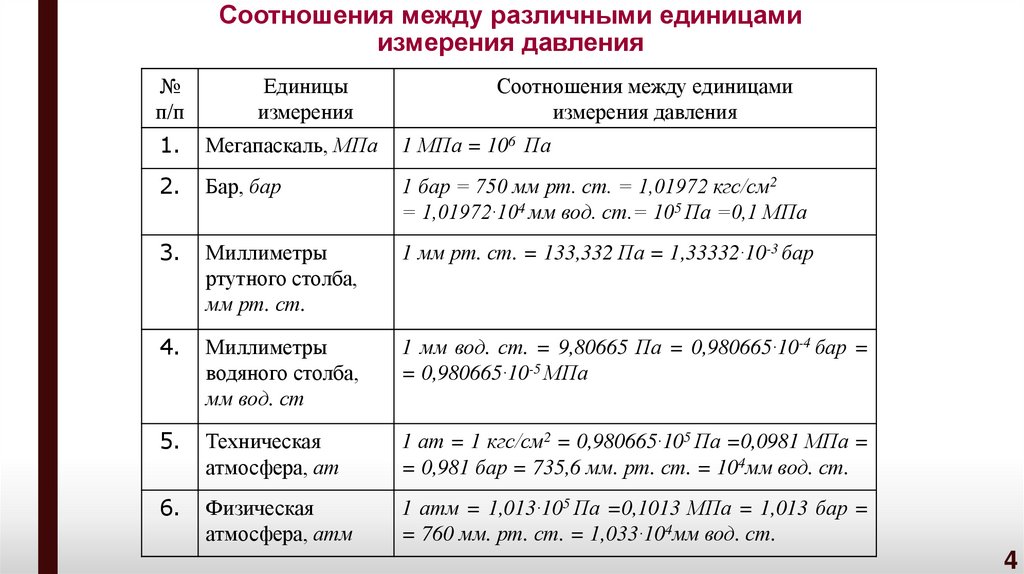
4. Соотношения между различными единицами измерения давления
№п/п
Единицы
измерения
Соотношения между единицами
измерения давления
1.
Мегапаскаль, МПа
1 МПа = 106 Па
2.
Бар, бар
1 бар = 750 мм рт. ст. = 1,01972 кгс/см2
= 1,01972·104 мм вод. ст.= 105 Па =0,1 МПа
3.
Миллиметры
ртутного столба,
мм рт. ст.
1 мм рт. ст. = 133,332 Па = 1,33332·10-3 бар
4.
Миллиметры
водяного столба,
мм вод. ст
1 мм вод. ст. = 9,80665 Па = 0,980665·10-4 бар =
= 0,980665·10-5 МПа
5.
Техническая
атмосфера, ат
1 ат = 1 кгс/см2 = 0,980665·105 Па =0,0981 МПа =
= 0,981 бар = 735,6 мм. рт. ст. = 104мм вод. ст.
6.
Физическая
атмосфера, атм
1 атм = 1,013·105 Па =0,1013 МПа = 1,013 бар =
= 760 мм. рт. ст. = 1,033·104мм вод. ст.
4
5.
Уравнения состояния идеального и реального газаИдеальным газом называется такой газ, в котором молекулы
являются материальными точками, не имеющие между собой
никакого взаимодействия, кроме соударений.
Формы представления уравнения Клайперона:
для 1 кг
для
G кг
для 1 кмоля
для
G
кмолей
pv RT
pV GRT
pv R T
pV G R T
где R – универсальная газовая постоянная, R 8314 Дж /( кмоль К )–
R характеристическая газовая постоянная, R R / , Дж/(кг·К)
– количество киломолей газа, G G / ;
– молярная
G
масса газа, кг/кмоль.
5
6.
В инженерных расчетах часто пользуютсяуравнением
состояния,
рекомендуемом
для
реальных газов и газовых смесей
pv zRT ,
где z – коэффициентом сжимаемости, z f
,
– приведенное давление, p / pк ;
– приведенная температура, T / Tк ;
pк
- критическое давление;
температура.
Tк
,
- критическая
Коэффициент сжимаемости z учитывает различие между
идеальным и реальными газами (для идеального газа
z = 1), зависит от давления, температуры и характеристик,
определяемых природой газа.
6
7.
Уравнение первого начала термодинамики длязакрытой термодинамической системы по балансу
рабочего тела
Q Q Q dU L
Математическое
выражение
первого
начала
термодинамики для закрытой термодинамической
системы
по
балансу
рабочего
тела
в
дифференциальной форме для простых тел
■для термодинамической системы
Q dU L dU pdV
■для 1 кг системы
q du l du pdv
7
8.
Уравнение первого начала термодинамики дляоткрытой термодинамической системы по балансу
рабочего тела
Q Q Q dH W
Математическое
выражение
первого
начала
термодинамики для открытой термодинамической
системы
по
балансу
рабочего
тела
в
дифференциальной форме для простых тел
■для термодинамической системы
Q dH W dH Vdp
■для 1 кг системы
q dh w dh vdp
8
9.
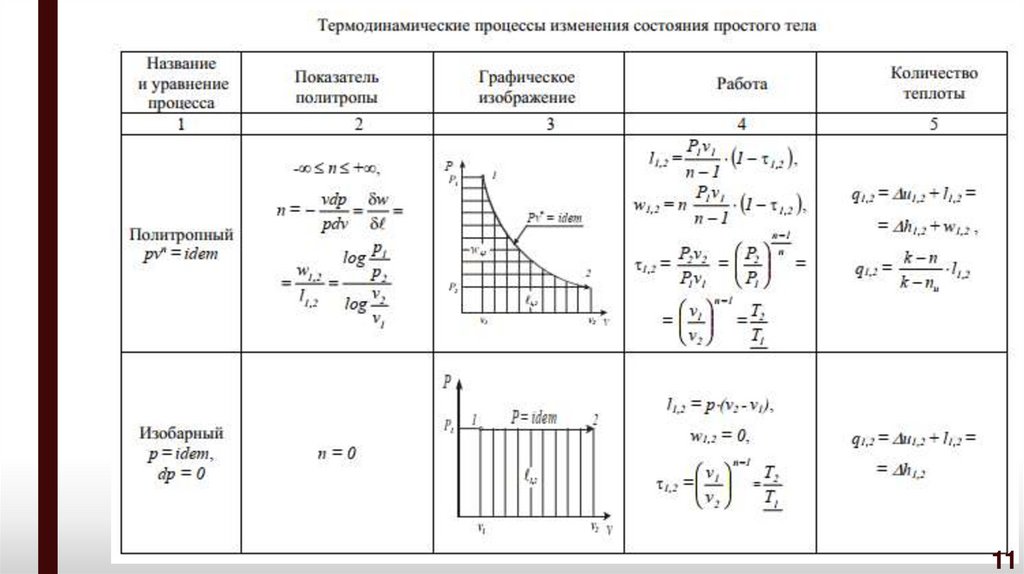
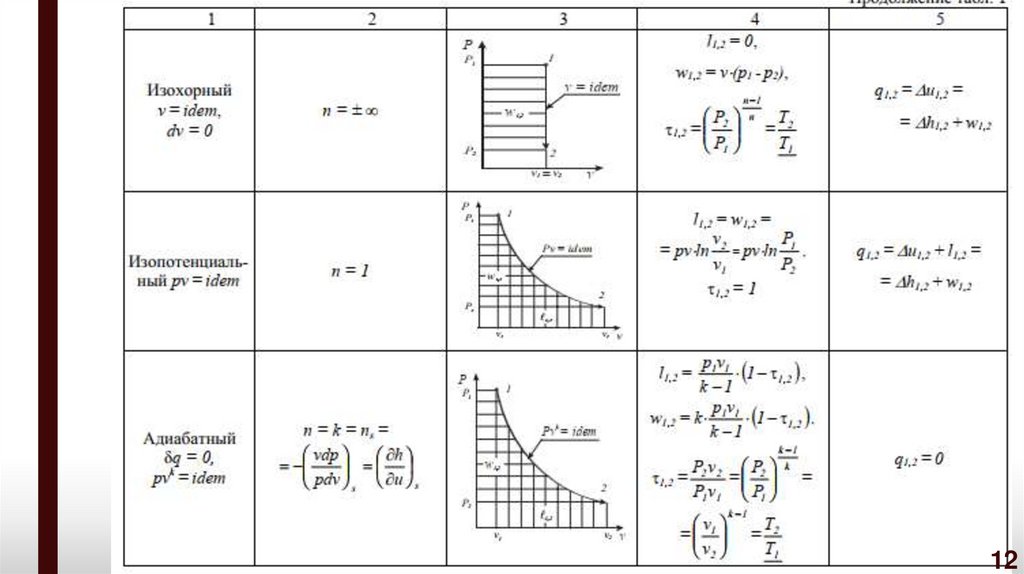
Политропнымпроцессом
с
постоянным
показателем
называется обратимый термодинамический процесс изменения
состояния простого тела, подчиняющийся уравнению, которое может
быть представлено в следующих формах:
pv n idem C;
p
где n – показатель политропы
1/ n
v idem C1 ;
pv pv ,
n
1 1
n
2 2
( n idem),
p1
log
vdp w w1,2
p2
n
pdv
l1,2 log v2
v1
9
10.
Удельная термодинамическая и потенциальная работы вполитропном процессе 1-2 определяются из соотношений:
1,2
p1v1
l1,2
1 1,2 ;
n 1
n
w1,2 n l1,2
p1v1 1 1,2 ,
n 1
где - характеристика расширения или сжатия в политропном
n 1
процессе,
n 1
n
p2 v2 p2
1,2
p1v1 p1
v1
v2
T2
.
T1
Выражение характеристики расширения или сжатия в
политропном процессе 1,2 через соотношение температур
справедливо только для систем, которые можно считать
идеальным газом.
10
11.
1112.
1213. ЗАДАЧИ
Задача № 11 кг метана (идеальный газ) политропно расширяется от
p1 = 0,2 МПа до p2 = 0,1 МПа, причем объем его увеличился в 4
раза; начальная температура метана равна 20 °С. Определить
показатель политропы, начальный и конечный объем, конечную
температуру, термодинамическую и потенциальную работу.
Изобарная теплоемкость равна cр=2,24 кДж/(кг∙К). Изобразить
процесс в координатах p-v.
Решение
1. Показатель политропы
p1
0,2
log
log
p2
n
0,1 0,5 .
v2 log 4
log
v1
13
14.
2. Значение температуры метана в конце процесса расширенияопределяется с использованием соотношения по определению
характеристики расширения или сжатия 1,2
v1
T2
v2
n 1
1
T1
4
0 ,5 1
293,15 586 ,3 К .
3. Характеристическая газовая постоянная метана (CH4)
R 8314
R
519,63 Дж / ( кг К ).
16
4. Удельный объем метана в начальной и конечной точке
процесса:
R T1 519,63 293,15
3
v1
0,76
м
/ кг;
6
p1
0,2 10
v2 4 v1 4 0,76 3,04 м3 / кг.
14
15.
5. Удельные термодинамическая и потенциальная работы врассматриваемом процессе расширения
p1v1
0,2 106 0,76
l1,2
1 1,2
1 2 304 кДж / кг;
n 1
0,5 1
w1,2 n l1,2 0,5 304 152 кДж / кг.
6. Изображение процесса в координатах p-v
3
3
v
0,76
м
/
кг;
v
3,04
м
/ кг;
n 0,5; 1
2
Ответ:
T2 586 ,3 К ; l1,2 304 кДж / кг; w1,2 152 кДж / кг.
15
16.
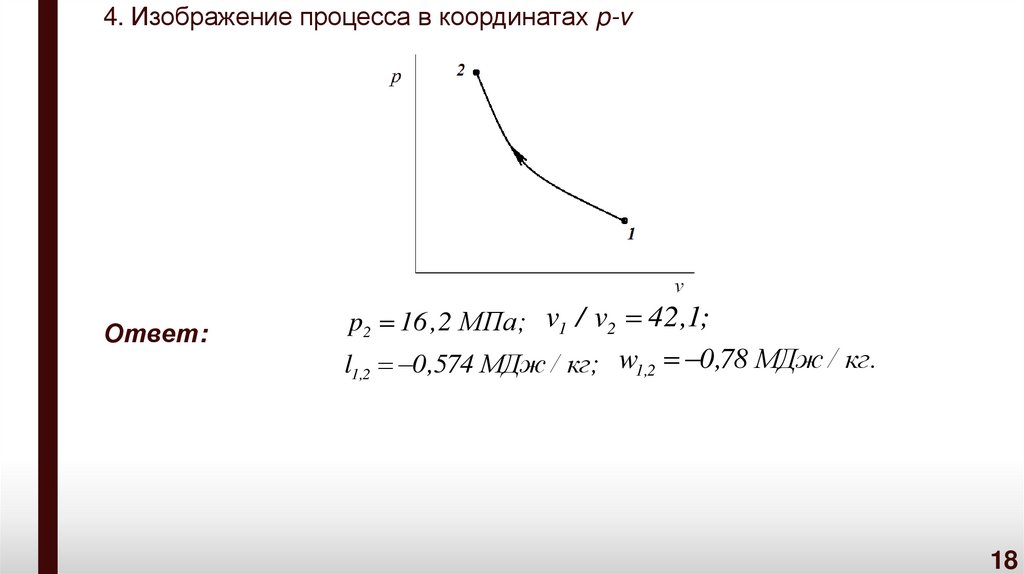
Задача № 2В цилиндре дизельного двигателя воздух (идеальный газ) с
начальными параметрами: давление – 0,1 МПа и температура –20 °С сжимается в процессе с показателем политропы n =1,36.
Сжатие идет до достижения воздухом температуры 700 °С.
Определить конечное давление, степень сжатия v1/v2 и удельные
термодинамическую и потенциальную работы. Изобразить
процесс в координатах p-v.
Решение
1. Значение давления воздуха в конце процесса сжатия
определяется с использованием соотношения по определению
характеристики расширения или сжатия 1,2
T2
p2
T1
n
n 1
973,15
p1 0,1 10
253
,
15
6
1,36
1,36 1
16,2 МПа.
16
17.
2. Степень сжатия воздуха в процессе также находится сиспользованием соотношения по определению характеристики
расширения или сжатия 1,2
v1 T2
v2 T1
1
n 1
973,15
253,15
1
1,36 1
42,1.
3. Удельные термодинамическая и потенциальная работы в
рассматриваемом процессе сжатия
p1v1
RT1 T2 RT1 T1 T2
l1,2
1 1,2
1
n 1
n 1
T1 n 1 T1
R T1 T2 287 720
0,574 МДж / кг;
n 1
1,36 1
w1,2 n l1,2 1,36 0,574 0,78 МДж / кг.
где
.
R
– характеристическая газовая постоянная воз-духа,
R
R 8314
287 Дж / ( кг К )
29
17
18.
4. Изображение процесса в координатах p-vОтвет:
p2 16 ,2 МПа; v1 / v2 42,1;
l1,2 0,574 МДж / кг; w1,2 0,78 МДж / кг.
18
19. Задачи для самостоятельного решения
Задача № 35
кг
метана
сжимается
политропно
с
показателем
n
=
2
от
p1 = 0,1 МПа. до p2 = 0,6 МПа. Начальная температура метана равна t1 = 15 0С.
Определить работу и конечные параметры метана. Изобарная теплоемкость равна cр =
2,24 кДж/(кг·К). Изобразить процесс в координатах p V .
Задача № 4
Какое количество теплоты необходимо подвести, чтобы нагреть 2 м3 воздуха при
постоянном давлении p = 0,3 МПа от температуры 100 0С до 500 0С. Какую работу при
этом
совершает
воздух.
Изобарная
теплоемкость
воздуха
равна
cр = 1,005 кДж/(кг К). Изобразить процесс в координатах p V .
Задача № 5
Сжатие 2,2 кмоля воздуха происходит адиабатно от начального давления 0,1 МПа и
температуры 15 0С до давления 0,9 МПа. Определить термодинамическую работу,
количество теплоты, изменение внутренней энергии и энтальпии адиабатного процесса.
Изобарная теплоемкость равна cр = 1,005 кДж/(кг К). Изобразить процесс в координатах
. p V
19
20. СЕМИНАР № 1.2 ПО КУРСУ «Смесеобразование, свойства смесей»
РГУ нефти и газа (НИУ) имени И.М. ГубкинаКафедра термодинамики и тепловых двигателей
«ЭНЕРГОСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ ТРАНСПОРТА ГАЗА»
СЕМИНАР № 1.2 ПО КУРСУ
«СМЕСЕОБРАЗОВАНИЕ, СВОЙСТВА СМЕСЕЙ»
Дарья Павловна Никулина
Ст. преп. кафедры термодинамики и тепловых двигателей
21.
ОСНОВНЫЕ РАСЧЕТНЫЕ СООТНОШЕНИЯ, ИСПОЛЬЗУЕМЫЕПРИ РЕШЕНИИ ЗАДАЧ ПО ТЕМЕ СЕМИНАРА
«Смеси газов, смесеобразование, свойства газовых смесей»
■Термодинамическая система – объект исследования термодинамики может
представлять собой смесь химически не взаимодействующих между собой
чистых веществ. Предполагается также, что структура отдельных компонентов
смеси в процессе смесеобразования и стабилизации смеси не изменяется.
■Рабочими телами большинства типов энерготехнологического оборудования,
используемого при промысловой подготовке и магистральном транспорте
природного газа, являются смеси – это природный газ, воздух и продукты
сгорания, жидкие и газообразные топлива, масла и т.д.
21
22.
Из закона сохранения материи следуетn
n
G Gi .
G Gi
i 1
i 1
,
Состав смеси задается массовыми, объемными или молярными
концентрациями (долями) компонентов, входящими в смесь.
Gi
Gi ,
mi
n
G
Gi
i 1
Gi
Gi
ri
n
.
G
Gi
i 1
Из закона сохранения
n
,
m
1
i
i 1
n
r 1.
i 1
i
22
23.
Средняя (кажущаяся) молярная масса смеси m :n
G
n
n
i Gi
G i 1 i
m
,
ri i ;
G
G
G
i 1
i 1
G
G
G
1
1
m n
n
n
n
.
Gi
Gi
mi
G
Gi
i 1
i 1 i
i 1 G i
i 1 i
Зависимость между значениями массовой и молярной концентраций
компонентов
Gi i Gi
i
mi
ri
G m G
m
или
mi i
.
ri m
23
24.
Газовая постоянная смесиR
Rm
m
n
R
1
mi Ri n
.
1
ri
i 1
n
mi
i 1 Ri
i 1 i
Теплоемкость смеси
n
czm mi , czm,i
i 1
Псевдокритиеские давление
n
pпк ri ,pк ,i
i 1
n
czm ri czm,i .
i 1
pпк и температура T газовых смесей
пк
n
Tпк ri Tк ,i .
i 1
Приведенные давление и температура смеси
p
,
pпк
T
.
Tпк
24
25.
Объемная концентрация компонента vi в смеси определяется какотношение приведенного объема Vi ,пр компонента при давлении и
температуре смеси к объему всей смеси V при тех же условиях
vi
Для идеального газа
Vi ,пр
V
.
G i R Tm
Vi ,пр
pm
G RTm
V
pm
Gi
vi
ri .
G
Для реальных газов и их смесей
pmVi ,пр zi Gi Ri Tm zi Gi R Tm
pmV z G Rm Tm z G R Tm
zi Gi zi
vi
ri .
V
z G
z
Vi ,пр
25
26. Следствия закона Дальтона
■ Парциальное давление i-го компонента в смеси идеальных газовопределяется через полное давление смеси
и молярную
концентрацию компонента
pi ri pm .
■ Сумма парциальных давлений всех компонентов смеси идеальных
газов равна полному давлению смеси
n
n
n
p r p p r p .
i 1
i
i 1
i
m
m
i 1
i
m
26
27.
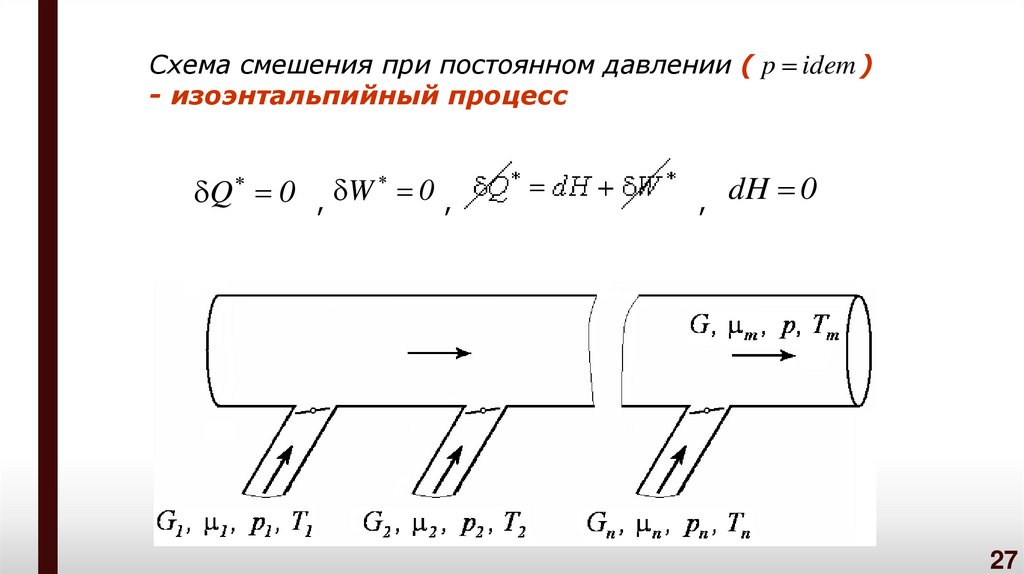
Схема смешения при постоянном давлении ( p idem )- изоэнтальпийный процесс
Q 0 , W 0 ,
,
dH 0
27
28.
Tm , Vm ????pVm z G Rm Tm z G R Tm
n
G Gi
i 1
n
G Gi
i 1
n
n
i 1
i 1
H 2 H 1 G c pm Tm Gi c pm,i Ti G c pm Tm Gi c pm,i Ti 0
Tm
1
n
c pm mi c pm ,i
i 1
n
ri c pm ,i Ti c mi c pm ,i Ti
с pm i 1
n
1
pm i 1
n
c pm ri c pm ,i
i 1
28
29.
RRm
m
n
R
1
mi Ri n
1
ri
i 1
n
mi
i 1 Ri
i 1 i
n
pпк ri pк , i
i 1
p
pпк
T
Tпк
n
Tпк ri Tк , i
i 1
z f ( , )
29
30. ЗАДАЧИ
Задача № 1Газовая смесь (идеальный газ) имеет следующий массовый состав:
метан m(CH4)=60%;
азот m(N2)=5%;
углекислый газ m(CO2)=7%;
этилен m(С2Н4)=12%;
водород m(Н2)=4%;
этан m(С2Н6)=12%.
Определить молярную массу, газовую постоянную и плотность смеси, а
также молярные концентрации и парциальные давления компонентов смеси,
если давление смеси равно p=1,5 бар, а температура – t=27 °С.
Решение
1. Средняя молярная масса смеси при известном массовом составе
1
1
14,46 кг / кмоль.
mi 0,6 0,05 0,07 0,12 0,04 0,12
16
28
44
28
2
30
i 1 i
m n
30
31.
2. Характеристическая газовая постоянная смесиRm
R 8314
574,97 Дж / ( кг К ).
m 14,46
3. Плотность смеси по уравнению Клапейрона
pm
1,5 10 5
m
0,87 кг / м3 ,
Rm Tm 574,97 300,15
где Tm – температура смеси,
Tm t 273,15 27 273,15 300 ,15
. К.
4. Из зависимости между массовой и молярной концентрациями
компонентов смеси
m m
ri i
.
i
определяются значения молярной концентрациями компонентов смеси:
rCH4
rH2
0,07 14,46
0,6 14,46
0,05 14,46
0,12 14,46
0,023; rC2 H4
0,540; rN2
0,026; rCО2
0,062;
44
16
28
28
0,04 14,46
0,289;
2
rC2 H6
0,12 14,46
0,06.
30
31
32.
5. Значения парциального давления компонентов смеси определяютсяиз математического выражения одного из следствий закона Дальтона
pCH4 ri pm 0,540 1,5 10 5 81кПа;
pN2 ri pm 0,026 1,5 10 5 3,9 кПа;
pCО2 ri pm 0,023 1,5 10 5 3,45 кПа;
pC2 H4 ri pm 0,062 1,5 105 9,3кПа;
pH2 ri pm 0,289 1,5 10 5 43,35 кПа;
pC2 H6 ri pm 0,06 1,5 105 9 кПа.
Задача решена,
все искомые характеристики определены.
32
33.
Задача № 2При давлении 820 мм рт. ст. и температуре 37 °С плотность смеси
кислорода О2 и углекислого газа СО2 составляет ρ=1,72 кг/м3. Определить
массовые и молярные концентрации компонентов смеси, а также газовую
постоянную смеси.
Решение
1. Характеристическая газовая постоянная смеси
pm
109324
Rm
204,93 Дж / ( кг К ),
m Tm 1,72 310,15
где pm – давление смеси,
pm 820 105 / 750 109324 Па;
Tm – температура смеси,
Tm t 273,15 37 273,15 310,15 К .
2. Средняя молярная масса смеси
R
8314
m
40,57 кг / кмоль.
R m 204,93
33
34.
3. Так как1 r r
CO2
O2
CO2
CO2 m ,
можно определить молярную концентрацию углекислого газа
m O2
40,57 32
rCO2
0,714
CO2 O2
44 32
и значение молярной концентрации кислорода
rO2 1 0,714 0,286.
4. Далее определяются значения массовой концентрации углекислого газа и
кислорода:
rСО2 СО2 0,714 44
mCO2
0,774;
m
40,57
rO2 O2 0,286 32
mO2
0,226.
m
40,57
Ответ:
Rm 204,93 Дж / ( кг К ); rCO 0,714;
2
rO2 0,286; mCO 0,774;
2
mO2 0,226.
34
35. Задачи для самостоятельного решения
Задача № 3Объемный состав сухих продуктов сгорания топлива (не содержащих водяных паров)
следующий: СО2=12,3%; О2=7,2%; N2=80,5 %. Найти среднюю молекулярную массу
смеси, газовую постоянную смеси, а также плотность и удельный объем продуктов
сгорания при р=100 кПа и t=800 °С.
Задача № 4
При давлении 920 мм рт. ст. и температуре 97 °С плотность смеси метана и
углекислого газа равна 2,8 кг/м3. Определить массовые и объемные концентрации
смеси.
Задача № 5
В смеси окиси углерода и углекислого газа находится 12 кг СО. Молекулярная масса
смеси равна 41. Определить массовые и молярные концентрации смеси.
35
36. СЕМИНАР № 1.3 ПО КУРСУ «Термодинамические свойства природного газа»
РГУ нефти и газа (НИУ) имени И.М. ГубкинаКафедра термодинамики и тепловых двигателей
«ЭНЕРГОСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ ТРАНСПОРТА ГАЗА»
СЕМИНАР № 1.3 ПО КУРСУ
«ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ПРИРОДНОГО ГАЗА»
Дарья Павловна Никулина
Ст. преп. кафедры термодинамики и тепловых двигателей
37.
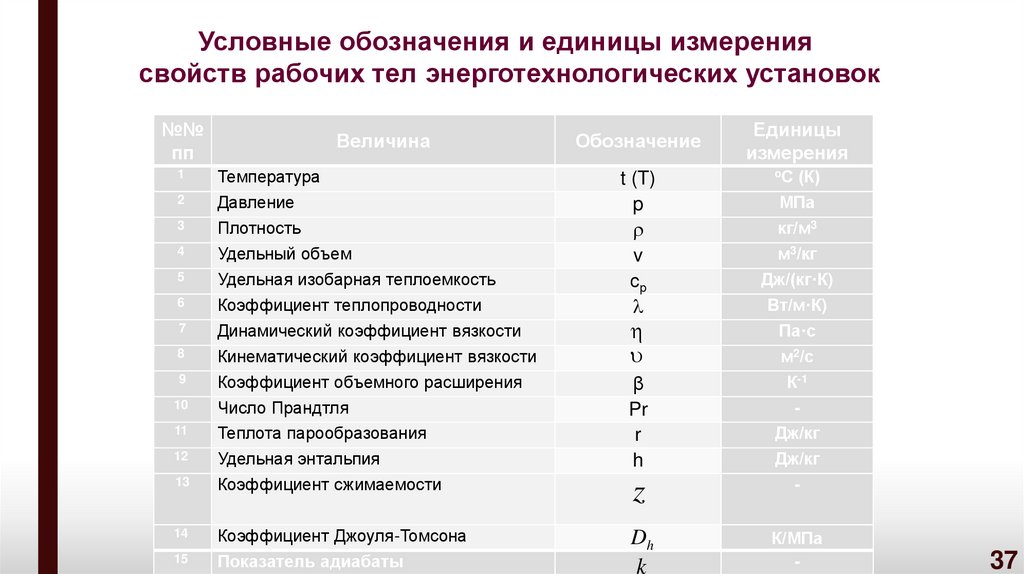
Условные обозначения и единицы измерениясвойств рабочих тел энерготехнологических установок
№№
пп
Величина
Обозначение
Единицы
измерения
оС (К)
1
Температура
2
Давление
3
4
Плотность
Удельный объем
5
Удельная изобарная теплоемкость
6
Коэффициент теплопроводности
7
Динамический коэффициент вязкости
8
Кинематический коэффициент вязкости
9
Коэффициент объемного расширения
10
Число Прандтля
11
Теплота парообразования
12
Удельная энтальпия
13
Коэффициент сжимаемости
z
-
14
Коэффициент Джоуля-Томсона
Показатель адиабаты
Dh
К/МПа
-
15
t (T)
p
v
ср
МПа
кг/м3
м3/кг
Дж/(кг·К)
Вт/м·К)
Па·с
β
Pr
r
h
К-1
k
м2/с
Дж/кг
Дж/кг
37
38. Природный газ
К энерготехнологическому оборудованию, в котором рабочим теломявляется природный газ, относятся линейные участки магистральных
газопроводов,
циклоны-пылеуловители,
фильтры-сепараторы,
центробежные нагнетатели природного газа, оборудование систем
сбора и промысловой подготовки природного газа, оборудование
системы охлаждения природного газа на КС.
Основным компонентом в природном газе, транспортируемом по
магистральным газопроводам, является метан CH 4 : его молярная
концентрация в природном газ составляет rCH4 0 ,95 0 ,98 . Наряду с
метаном, в состав природных газов входят высококипящие алканы,
водяные пары и т.д.
38
39.
Анализ математических моделей процессов, происходящих притранспорте природного газа, показал, что для расчета этих процессов
требуются следующие термодинамические характеристики природного
газа:
потенциальная функция pv ;
плотность ;
коэффициент сжимаемости z;
удельная энтальпия h;
удельная изобарная теплоемкость cpm;
произведение удельной изобарной теплоемкости на
коэффициент Джоуля-Томсона cp Dh;
коэффициент Джоуля-Томсона Dh;
показатели адиабатного k, изотермического nt и
изоэнтальпийного процессов nh;
высшая Qвр и низшая Qнр теплота сгорания природного газа.
39
40.
Расчетные соотношения по определению термодинамических характеристик природного газаСреднее относительное
№№ п/п
Термодинамические характеристики,
единицы измерения
расхождение между расчетными и
Расчетные соотношения
опытными значениями ,
y f ( T , p , rCH 4 )
максимальная относительная
1
Потенциальная функция pv, Дж/кг
pv = – 180900+ 25030 T0,5 – 4,175 10-2 p +
2 ,05
+ 1,224 10-2 T0,205 p – 2391 T0,65 rмет
2
Коэффициент сжимаемости z
z = – 0,226 + 9,093 T-0,33 – 4,837 10-7 p +
1 ,67
+ 1,988 10-7 T0,15 p – 766300 T-2,7 rмет
3
4
Плотность
, кг/м3
Удельная
энтальпия h , кДж/кг
5
Удельная изобарная теплоемкость
cpm, кДж/(кг К)
= – 78,72 + 35600 T-1,2 + 1,396 10-4 p0,89 +
+ 2,234 10-8 T1,2 p + 3,652 10-4 T2 rмет +
+ 3,647 10-13 p2 rмет – 1,328 10-7 T p r 0 ,498
мет
h = – 13400 + 2,667 T – 34,771 10-6 p +
+ 7,817 10-8 T p – 29,898 10-4 Т2 –
– 5,882 10-13 p2 + rмет (26940 –
– 13640 rмет +3,065 10-9 T p + 21,758 10-4 Т2 +
+ 5,927 10-13 p2) 0 ,92
rмет
cpm = 3,347 – 7,561 10-4 Т1,4 + 1,088 10-7 p1,1 –
– 2,737 10-9 Т0,76 p1,05 + + 7,777 10-10 T3,7
ошибка max.
= 0,23 %, max = 0,66 %
= 0,22 %, max = 1,0 %
= 0,85 %, max = 4,5 %
= 0,08 %, max = 0,59 %
= 0,53 %, max = 2,6 %
40
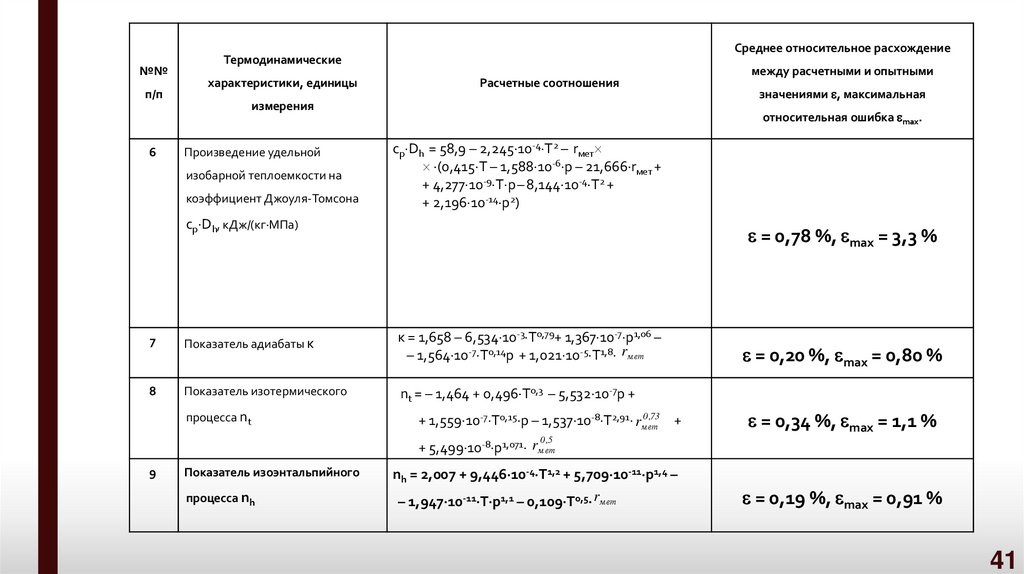
41.
№№п/п
6
Среднее относительное расхождение
Термодинамические
характеристики, единицы
Расчетные соотношения
измерения
Произведение удельной
изобарной теплоемкости на
коэффициент Джоуля-Томсона
значениями , максимальная
относительная ошибка max.
cp Dh = 58,9 – 2,245 10-4 Т2 – rмет
(0,415 Т – 1,588 10-6 p – 21,666 rмет +
+ 4,277 10-9 T p – 8,144 10-4 Т2 +
+ 2,196 10-14 p2)
cp Dh, кДж/(кг МПа)
= 0,78 %, max = 3,3 %
7
Показатель адиабаты к
к = 1,658 – 6,534 10-3 Т0,79+ 1,367 10-7 p1,06 –
– 1,564 10-7 Т0,14p + 1,021 10-5 T1,8 rмет
8
Показатель изотермического
nt = – 1,464 + 0,496 Т0,3 – 5,532 10-7p +
процесса nt
между расчетными и опытными
0 ,73
+ 1,559 10-7 Т0,15 p – 1,537 10-8 T2,91 rмет
+
= 0,20 %, max = 0,80 %
= 0,34 %, max = 1,1 %
0 ,5
+ 5,499 10-8 p1,071 rмет
9
Показатель изоэнтальпийного
процесса nh
nh = 2,007 + 9,446 10-4 Т1,2 + 5,709 10-11 p1,4 –
– 1,947 10-11 Т p1,1 – 0,109 T0,5 rмет
= 0,19 %, max = 0,91 %
41
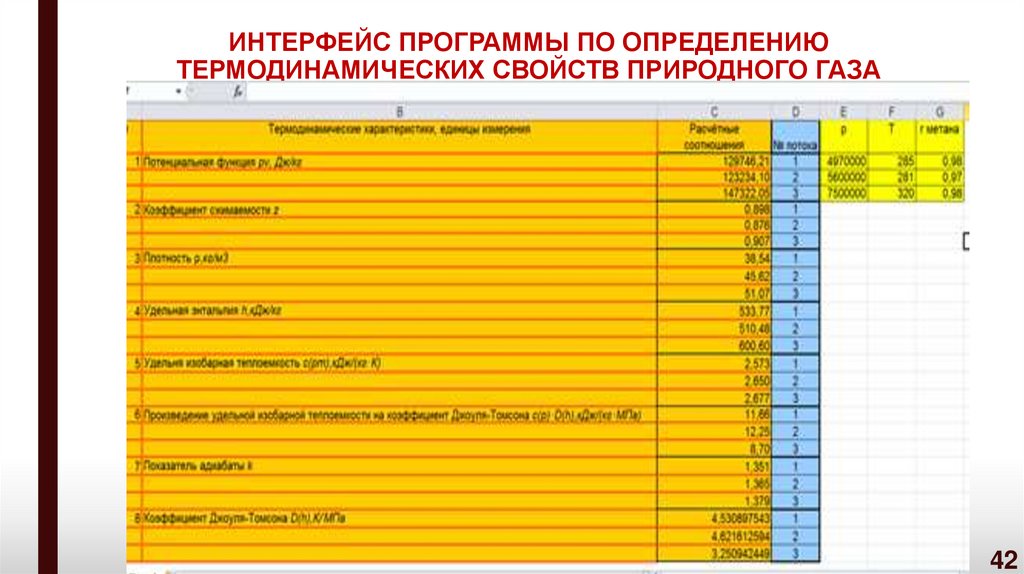
42. ИНТЕРФЕЙС ПРОГРАММЫ ПО ОПРЕДЕЛЕНИЮ ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ ПРИРОДНОГО ГАЗА
4243.
В ГОСТ 30319.1-96 рекомендуются следующие соотношения длярасчета высшей и низшей теплоты сгорания природного газа:
Qвр = 92,819 (0,51447 ρс + 0,05603 – 0,65689 rа – rу);
Qнр = 85,453 (0,52190 ρс + 0,04242 – 0,65197 rа – rу),
где rа , rу – молярные концентрации азота N2 и диоксида углерода CO2 в природном газе;
ρс – плотность природного газа при стандартных условиях (pс = 101325 Па, Тс = 293,15 К).
Плотность природного газа при стандартных условиях, согласно ГОСТ 30319.1-96,
может определяться из уравнения состояния
m pc
с
zc R Tc
где m – средняя (кажущаяся) молярная масса природного газа,
n
m i ri
i 1
43
44.
В соответствии с нормами технологического проектированиямагистральные
газопроводов
расчет
динамического
коэффициента вязкости при давлении до 15 МПа и температурах 250
÷ 400 К следует вести по формуле
где
0 1 B1 B2 2 B3 3
0 ( 1,81 5 ,95 ) 10 6
2 ,36 1,93
B1 0 ,67
2
Кинематический
коэффициент вязкости
2 ,89 2 ,65
B2 0 ,8
2
0 ,354 0 ,314
B3 0 ,1
2
– приведенное давление,
– приведенная температура,
/
p / pпк ;
T / Tпк
.
44
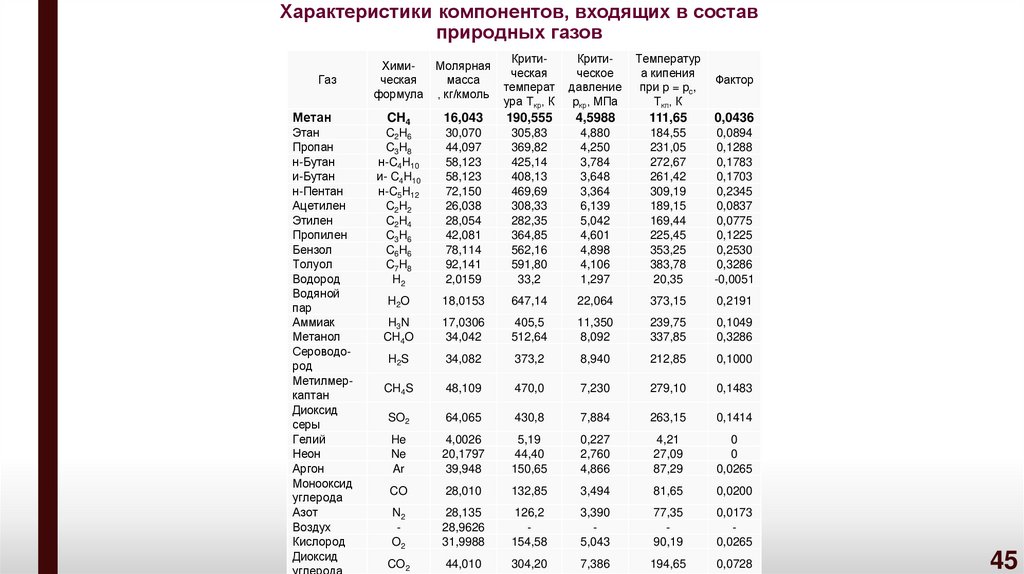
45. Характеристики компонентов, входящих в состав природных газов
ГазМетан
Этан
Пропан
н-Бутан
и-Бутан
н-Пентан
Ацетилен
Этилен
Пропилен
Бензол
Толуол
Водород
Водяной
пар
Аммиак
Метанол
Сероводород
Метилмеркаптан
Диоксид
серы
Гелий
Неон
Аргон
Монооксид
углерода
Азот
Воздух
Кислород
Диоксид
углерода
Химическая
формула
Молярная
масса
, кг/кмоль
Критическая
температ
ура Tкр, К
Критическое
давление
pкр, МПа
Температур
а кипения
при p = pc,
Tкп, К
Фактор
CH4
16,043
190,555
4,5988
111,65
0,0436
C2H6
C3H8
н-C4H10
и- C4H10
н-C5H12
C2H2
C2H4
C3H6
C6H6
C7H8
H2
30,070
44,097
58,123
58,123
72,150
26,038
28,054
42,081
78,114
92,141
2,0159
305,83
369,82
425,14
408,13
469,69
308,33
282,35
364,85
562,16
591,80
33,2
4,880
4,250
3,784
3,648
3,364
6,139
5,042
4,601
4,898
4,106
1,297
184,55
231,05
272,67
261,42
309,19
189,15
169,44
225,45
353,25
383,78
20,35
0,0894
0,1288
0,1783
0,1703
0,2345
0,0837
0,0775
0,1225
0,2530
0,3286
-0,0051
H2O
18,0153
647,14
22,064
373,15
0,2191
H3N
CH4O
17,0306
34,042
405,5
512,64
11,350
8,092
239,75
337,85
0,1049
0,3286
H2S
34,082
373,2
8,940
212,85
0,1000
CH4S
48,109
470,0
7,230
279,10
0,1483
SO2
64,065
430,8
7,884
263,15
0,1414
He
Ne
Ar
4,0026
20,1797
39,948
5,19
44,40
150,65
0,227
2,760
4,866
4,21
27,09
87,29
0
0
0,0265
CO
28,010
132,85
3,494
81,65
0,0200
N2
O2
28,135
28,9626
31,9988
126,2
154,58
3,390
5,043
77,35
90,19
0,0173
0,0265
CO2
44,010
304,20
7,386
194,65
0,0728
45
46.
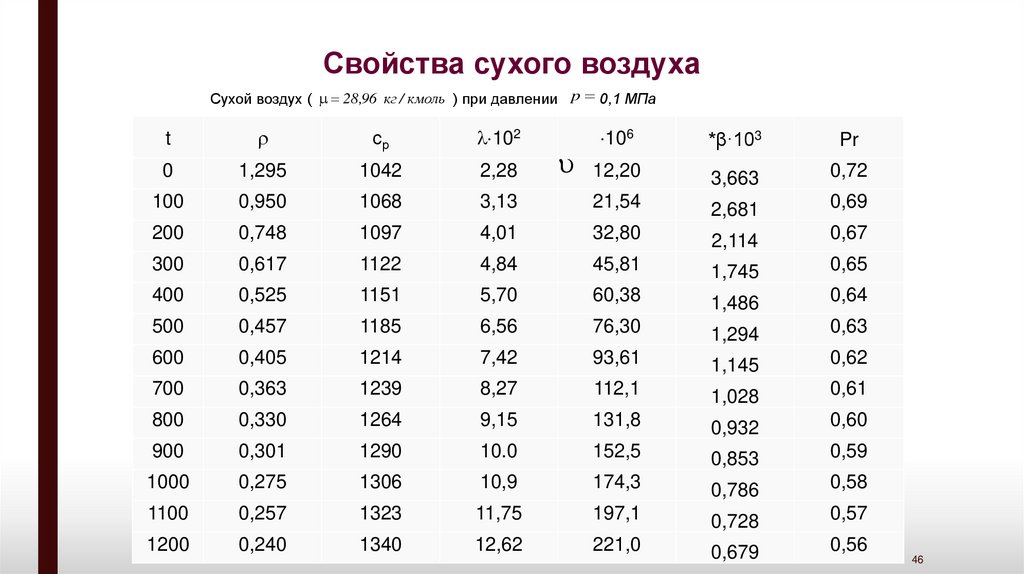
Свойства сухого воздухаСухой воздух ( 28,96 кг / кмоль ) при давлении p 0,1 МПа
t
ср
102
106
0
1,295
1042
2,28
12,20
100
0,950
1068
3,13
200
0,748
1097
300
0,617
400
*β·103
Pr
3,663
0,72
21,54
2,681
0,69
4,01
32,80
2,114
0,67
1122
4,84
45,81
1,745
0,65
0,525
1151
5,70
60,38
1,486
0,64
500
0,457
1185
6,56
76,30
1,294
0,63
600
0,405
1214
7,42
93,61
1,145
0,62
700
0,363
1239
8,27
112,1
1,028
0,61
800
0,330
1264
9,15
131,8
0,932
0,60
900
0,301
1290
10.0
152,5
0,853
0,59
1000
0,275
1306
10,9
174,3
0,786
0,58
1100
0,257
1323
11,75
197,1
0,728
0,57
1200
0,240
1340
12,62
221,0
0,679
0,56
46
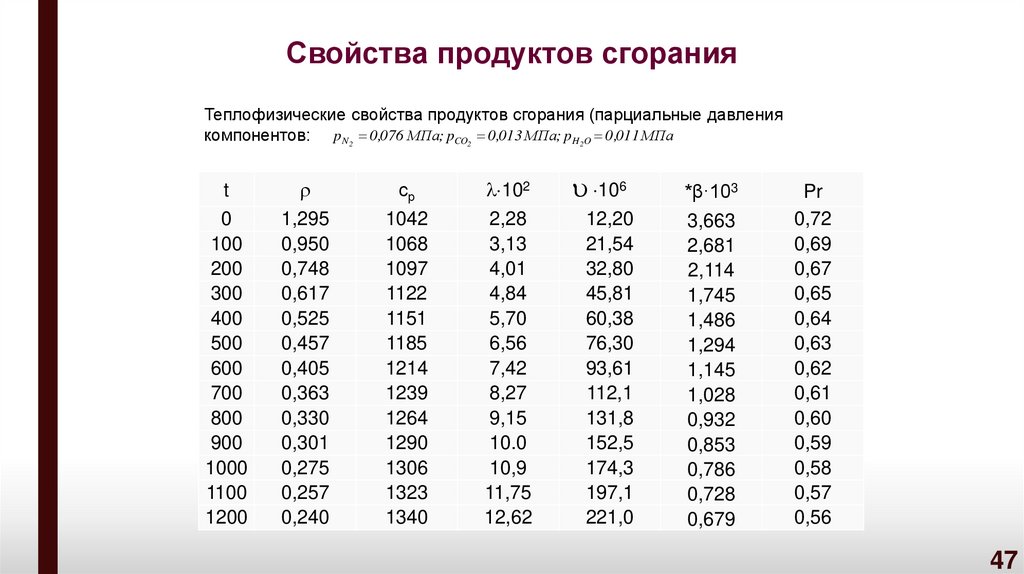
47. Свойства продуктов сгорания
Теплофизические свойства продуктов сгорания (парциальные давлениякомпонентов: p N2 0 ,076 МПа; pCO2 0 ,013 МПа; pH 2O 0 ,011 МПа
t
0
100
200
300
400
500
600
700
800
900
1000
1100
1200
1,295
0,950
0,748
0,617
0,525
0,457
0,405
0,363
0,330
0,301
0,275
0,257
0,240
ср
1042
1068
1097
1122
1151
1185
1214
1239
1264
1290
1306
1323
1340
102
2,28
3,13
4,01
4,84
5,70
6,56
7,42
8,27
9,15
10.0
10,9
11,75
12,62
106
*β·103
12,20
21,54
32,80
45,81
60,38
76,30
93,61
112,1
131,8
152,5
174,3
197,1
221,0
3,663
2,681
2,114
1,745
1,486
1,294
1,145
1,028
0,932
0,853
0,786
0,728
0,679
Pr
0,72
0,69
0,67
0,65
0,64
0,63
0,62
0,61
0,60
0,59
0,58
0,57
0,56
47
48. ЗАДАЧИ
Задача № 1Определить плотность природного газа при молярной концентрации
rCH 4 0 ,96
метана в технологическом газе равной
, а давление и
температура
природного
газа
составляют
соответственно:
.p 4,3 МПа, t 5 0C
Результат расчета по программе
в «Microsoft Excel»
Плотность природного газа при заданном составе газа и
термобарических характеристиках
34,98 кг / м .
3
48
49.
Задача № 2Определить показатель адиабаты природного газа при молярной
концентрации метана в технологическом газе равной rCH 0,97
,а
4
давление и температура природного газа составляют соответственно:
p 5,3 МПа, t 12 0C.
Результат расчета по программе
в «Microsoft Excel»
Показатель адиабаты природного газа при заданном составе газа и
термобарических характеристиках
k 1,355.
49
50. Задачи для самостоятельного решения
Задача № 3h
Определить удельную энтальпию природного газа
, если его
0
температура и давление составляют соответственно: t1 10 C, p1 5,8 МПа
молярная концентрация метана в газе равна rCH 4 0,98 .
Задача № 4
Определить коэффициент Джоуля-Томсона природного 0газа, если его
температура и давление составляют соответственно t1 18 C, p1 6 ,8 МПа
а молярная концентрация метана в газе равна rCH 0,95 .
4
Задача № 5
Определить удельную изобарную теплоемкость природного газа
C pm , если его температура и давление составляют, молярная
концентрация метана в газе равна t1 10 0 C, p.1 5,8 МПа
rCH 0,97
4
50







































 physics
physics








