Similar presentations:
Presentation 3
1. Цитогенетический анализ геномных мутаций и хромосомных аббераций. Метод кариотипирования.
федеральное государственное бюджетное образовательное учреждение высшего образования «Уральскийгосударственный медицинский университет» Министерство здравоохранения Российской Федерации
Кафедра медицинской биологии и генетики
Доклад на тему:
Цитогенетический анализ геномных
мутаций и хромосомных аббераций.
Метод кариотипирования.
Сделал:
Прокин Александр ОЛД-109
2. Начало
• Изучение строения и функции хромосом привело к выделению самостоятельного разделаобласти науки - цитогенетики. Началом развития цитогенетики человека можно считать 50-60
годы, когда впервые появились публикации работ, в которых удалось получить убедительные
картины морфологии всех Х-хромосом человека и правильно определить их диплоидное
число.В 50-х гг. прошлого столетия использование цитогенетических методов послужило
толчком к открытию этиологии нового класса заболеваний у человека - хромосомных
болезней.
3.
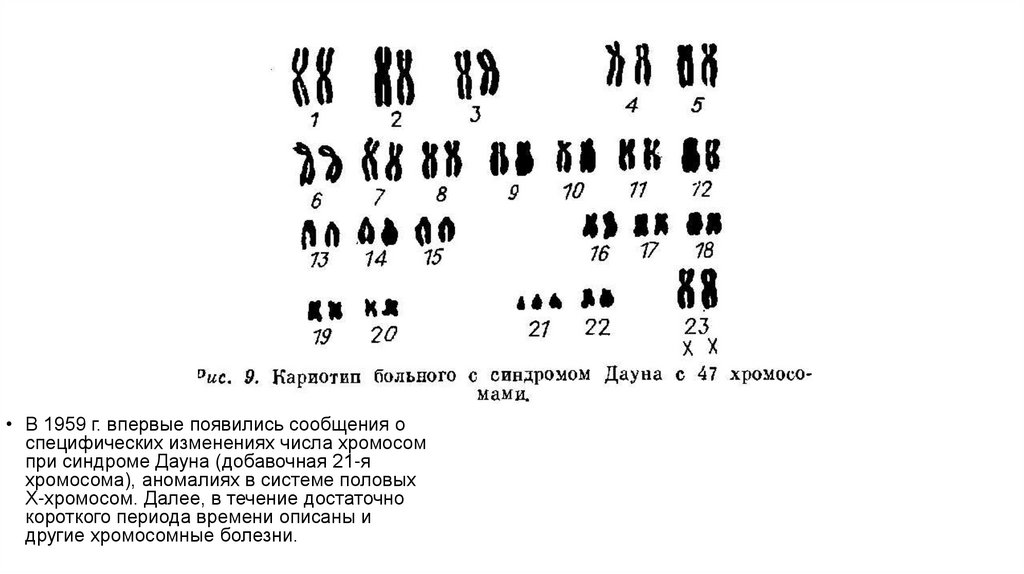
• В 1959 г. впервые появились сообщения оспецифических изменениях числа хромосом
при синдроме Дауна (добавочная 21-я
хромосома), аномалиях в системе половых
Х-хромосом. Далее, в течение достаточно
короткого периода времени описаны и
другие хромосомные болезни.
4. Методы цитогенетического исследования
• Прямыеэто методы получения препаратов делящихся клеток без
культивирования. Прямые методы позволяют проводить
хромосомный анализ клеток опухолей, но в основном
используются для изучения костного мозга. Костный мозг
получают при стернальной пункции, помещают его в
питательную среду, добавляют колхицин (он останавливает
деление клеток на стадии метафазы митоза), инкубируют
клетки около 2-3 часов при 37 °С, а затем готовят
препараты хромосом.
• Не прямые
Непрямые методы связаны с культивированием клеток.
Наиболее простым и доступным методом в клинической
цитогенетике является анализ хромосом лимфоцитов
периферической крови человека на стадии метафазы.
Для этого используется цельная периферическая кровь,
полученная при соблюдении стерильных условий, в
количестве 2,0-5,0 мл. Кровь помещают в питательную
среду с добавлением митогена ФГА
(фитогемагглютинина), стимулирующего митотическое
деление лимфоцитов. Далее культура помещается в
термостат и при 37 °С культивируется 48-72 часа. За 2
часа до окончания культивирования вводится колхицин.
5.
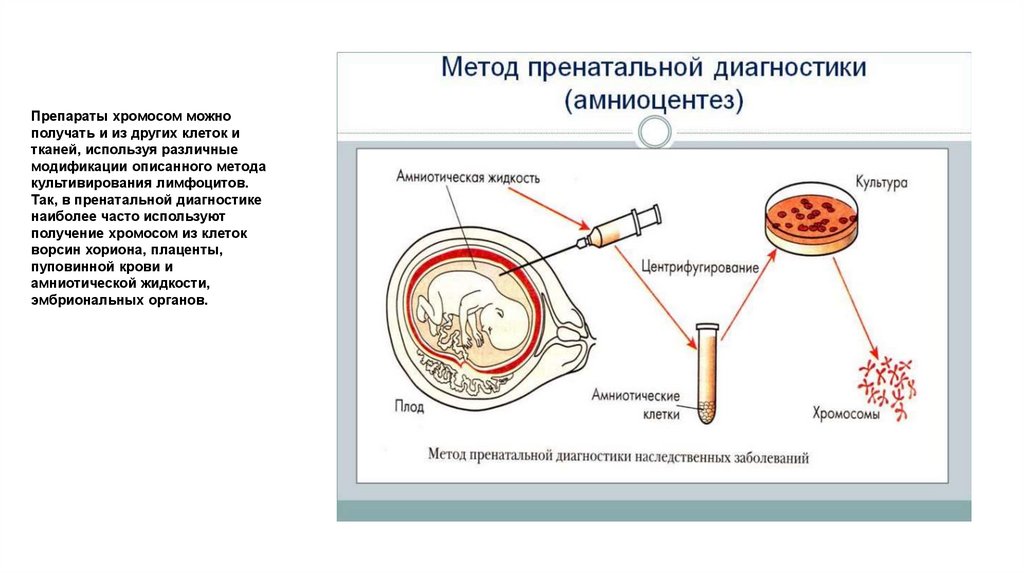
Препараты хромосом можнополучать и из других клеток и
тканей, используя различные
модификации описанного метода
культивирования лимфоцитов.
Так, в пренатальной диагностике
наиболее часто используют
получение хромосом из клеток
ворсин хориона, плаценты,
пуповинной крови и
амниотической жидкости,
эмбриональных органов.
6. Кариотипирование - это тест для изучения хромосом, который может помочь выявить генетические проблемы, ставшие причиной
расстройстваили заболевания.
Кариотипирование делается, чтобы:
Определить наличие аномальных хромосом у плода.
Определить причину врожденных дефектов ребенка.
Определить, наличие аномальных хромосом у взрослого
человека и рассмотреть варианты, как они могут повлиять на
развитие его будущего ребенка.
Определить, являются ли аномальные хромосомы причиной
выкидыша или бесплодия женщины.
7. Анализ
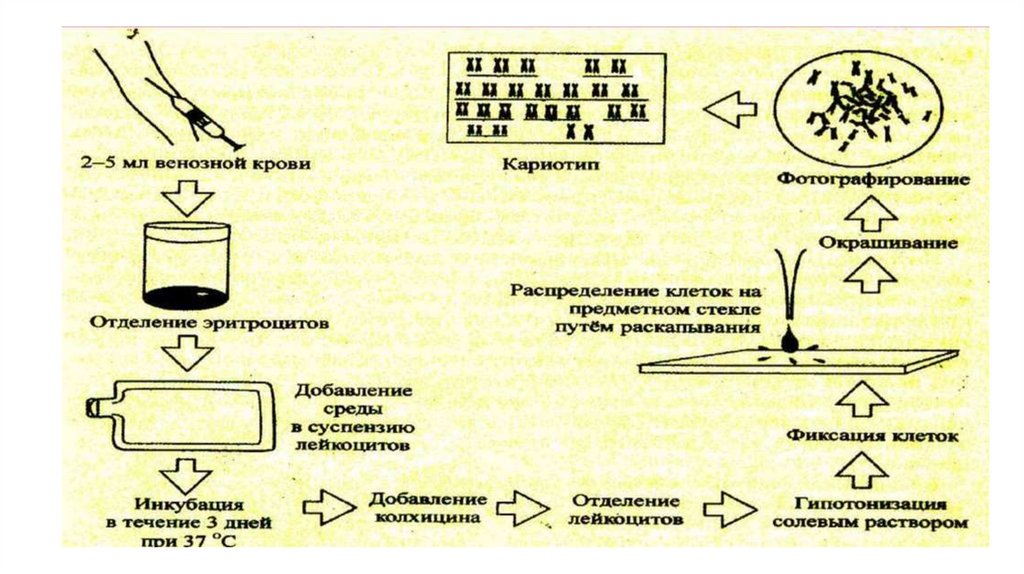
• Анализ кариотипа проводят в три этапа: культивирование лимфоцитовкрови, окраска препарата и его микроскопический анализ. Культивирование
проводят для того, чтобы стимулировать деление лимфоцитов, так как
успех цитогенетического исследования зависит от количества клеток,
находящихся на стадии метафазы, когда хромосомы находятся в наиболее
компактной форме. Продолжительность культивирования обычно
составляет 72 часа. Для увеличения количества метафазных клеток в
конце культивирования в среду вводят колхицин, который
приостанавливает деление на стадии метафазы, разрушает веретено
деления и увеличивает конденсацию хромосом. Далее клетки помещают в
гипотонический раствор, который приводит к разрыву ядерной оболочки и
свободному перемещению хромосом в цитоплазме. На следующем этапе
клетки фиксируют смесью этанола и уксусной кислоты в соотношении 3:1,
их суспензию раскапывают на предметные стекла и высушивают. В
зависимости от целей кариотипирования используют различные методы
дифференциального окрашивания хромосом (G-, R-, C-, Q-методы).
Процедура окрашивания занимает несколько минут и приводит к
появлению рисунка поперечной исчерченности, специфичного для каждой
хромосомы. Световое микроскопирование окрашенных препаратов
является самым трудоемким этапом всего исследования, требующим
высокой квалификации. Для выявления хромосомных аномалий
необходимо проанализировать не менее 30 метафазных пластинок.
8.
9. G-окрашивание
• Использование такого метода окрашивания позволяет провести подсчет хромосом иих групповую принадлежность, проанализировать повреждения хромосом,
называемые хромосомными аберрациями. Однако этот метод имеет ограничения
при кариотипировании, поскольку не дает возможности индивидуальной
идентификации хромосом. Методы окраски хромосом, дающие достаточно полное
представление о кариотипе, появились в 70-х гг. нашего столетия - это методы
дифференциального окрашивания хромосом. Большое практическое значение этих
методов состоит в том, что дифференциальная окраска позволяет
идентифицировать все хромосомы человека, благодаря специфическому
линейному рисунку - продольной окрашиваемости для каждой хромосомы в
соответствии с типом окраски. На практике наибольшее применение получили
методы дифференциальной окраски красителем
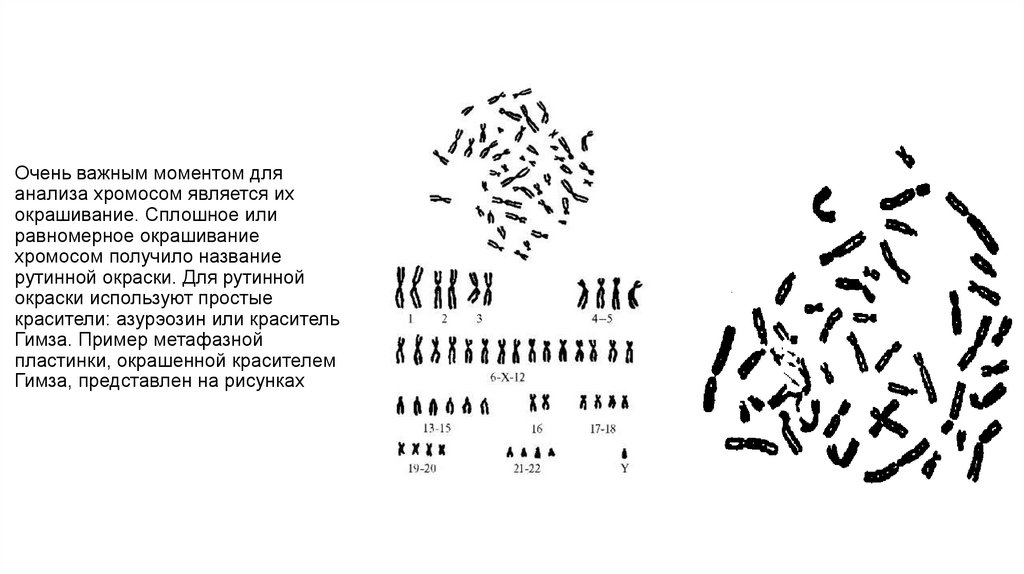
10. Очень важным моментом для анализа хромосом является их окрашивание. Сплошное или равномерное окрашивание хромосом получило
названиерутинной окраски. Для рутинной
окраски используют простые
красители: азурэозин или краситель
Гимза. Пример метафазной
пластинки, окрашенной красителем
Гимза, представлен на рисунках
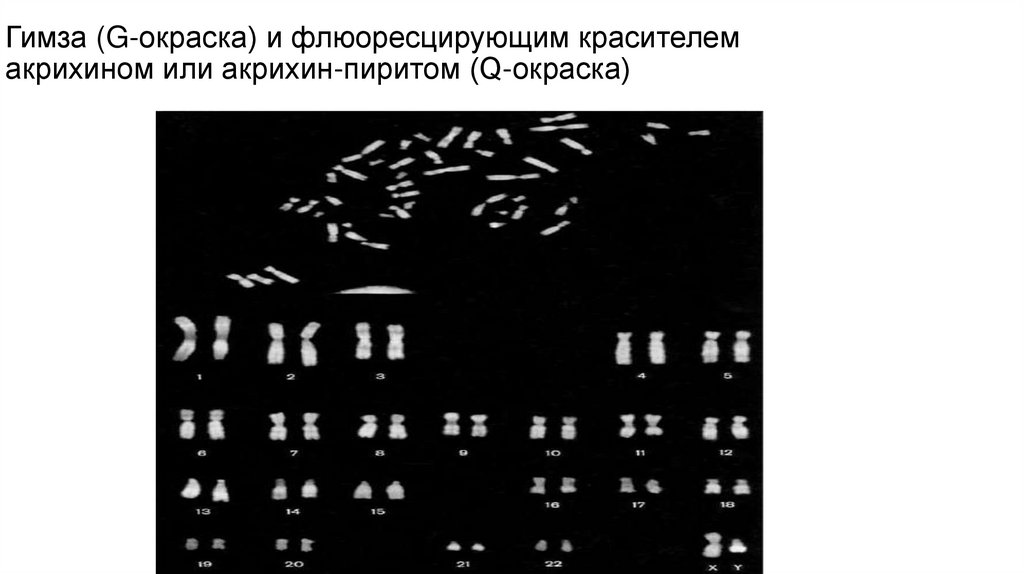
11. Q-окраска
• В популяциях человека существует межиндивидуальная вариабельность отдельныхучастков хромосом, выявляемых с помощью Q-окраски – Q-полиморфизм
хромосом. Он выражается в особенно ярко светящихся сегментах, локализованных
в центромерных участках хромосом 3 и 4, а также в коротких плечах и спутниках
всех акроцентрических хромосом человека 13–15, 21 и 22. кроме того, у лиц
мужского пола ярко флюоресцирующейся областью является и дистальная часть
длинного плеча хромосомы Y – сегмент q12. Этот участок Y-хромосомы обладает
выраженным межиндивидуальным полиморфизмом и четко наследуется по мужской
линии. Все перечисленные ярко флюоресцирующие участки хромосом являются
областями локализации гетерохроматина – некодирующихся повторяющихся
последовательностей ДНК
12. Гимза (G-окраска) и флюоресцирующим красителем акрихином или акрихин-пиритом (Q-окраска)
13. R-окраска
• R-окраска (от англ. Reverse – обратная) отличается противоположностью рисунка Gокраске. Темноокрашенными здесь являются эухроматиновые участки хромосом,а светлыми – гетерохроматиновые. Существует несколько модификаций метода Rокраски и каждый из них имеет кодировку по международной цитогенетической
номенклатуре. Наиболее приемлемой является обработка препаратов Ba(OH)2
с прогреванием их при 60 °С и последующей отмывкой в дистиллированной воде
и окрашиванием раствором красителя Гимза. Кодировка R-окраски, полученной
таким способом – RHG.
14.
15. С-окрашивание
С-окраска (от англ. Constitutive heterohromatin – конститутивный гетерохроматин) выявляется в видевариабельных
по
величине
темноокрашенных
сегментов
конститутивного
гетерохроматина
в прицентромерных районах хромосом, в то время как эухроматиновые участки хромосом прокрашиваются
очень
бледно.
В популяциях человека, также как и в случае Q-окрашивания, существует межиндивидуальная
вариабельность по определенным участкам хромосом, в данном случае по величине блоков Сгетерохроматина, выявляемых с помощью С-окраски (С-полиморфизм хромосом). По локализации выделяют
4 типа С-хроматина:
• 1) собственно центромерный, присущий всем хромосомам, с относительно небольшими по площади
темноокрашенными блоками;
• 2) более крупные блоки гетерохроматина, располагающиеся в прицентромерных районах длинных плечей
аутосом 1, 9 и 16, обладающие четко выраженным межиндивидуальным полиморфизмом;
• 3) большой блок гетерохроматина дистальной части длинного плеча Y-хромосомы, заметно варьирующий
по величине у разных лиц мужского пола;
• 4) гетерохроматин коротких плеч акроцентрических хромосом.
16.
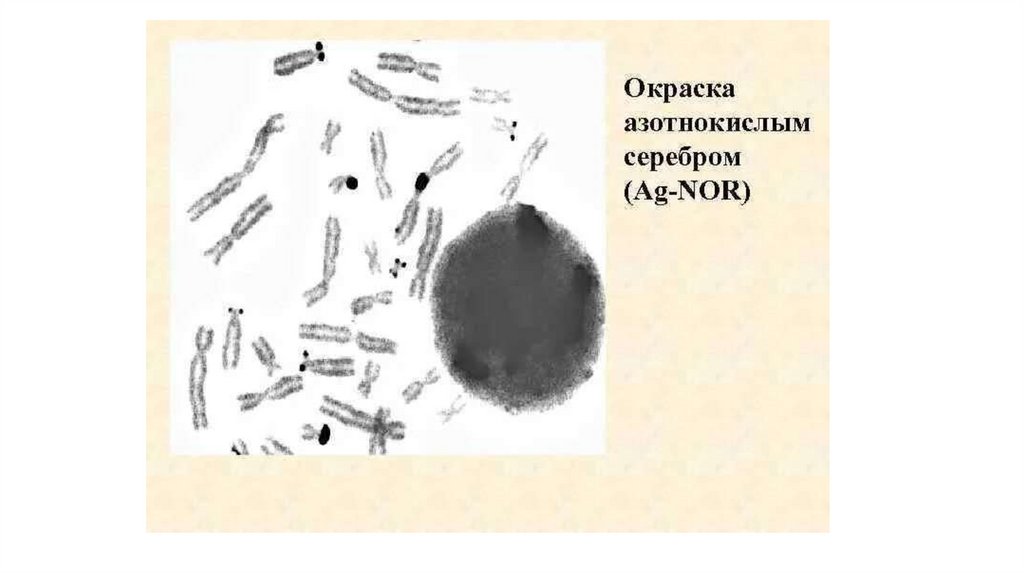
17. NOR-окраска или Ag-окраска
• NOR-окраска (от англ. Nucleolar Organizer Region – Ядрышко-Образующие Районы – ЯОР)или Ag-окраска (серебрение) – применяется для выявления ядрышкообразующих районов,
расположенных в коротких плечах (сегмент q12 – спутничная нить) всех 5 пар
акроцентрических хромосом человека (13, 14, 15, 21 и 22), с помощью окрашивания солями
серебра. Известно, что районы ядрышковых организаторов содержат гены рибосомальной
РНК (рРНК). Ряды рРНК транскрипционных единиц располагаются тандемно вдоль ДНК
и отделяются друг от друга нетранскрибируемыми последовательностями – спейсерами.
Транскрибируемый район и нетранскрибируемый спейсер тандемно повторяются примерно
40 раз в каждой из 5 пар акроцентрических хромосом, составляя около 400 копий
рибосомных генов на геном. В настоящее время для визуализации этих районов на
метафазных хромосомах применяют метод серебрения Хоуэлла и Блэка, основанный на
использовании комбинации 50 % раствора нитрата серебра с желатиновым проявителем
окраски в условиях прогревания препаратов при 60 %С.
18.
19. T-окрашивание
• Т-окраска (от англ. Telomere – теломера) – применяется для выявления теломерных районовхромосом в коротких и длинных плечах.
20.
21.
• Методы цитогенетической диагностики, применяемые в клинической генетике, часто используются в комплексе с другимиметодиками лабораторной диагностики, дополняя друг друга. Это позволяет более точно диагностировать сложные
проявления наследственных и врожденных заболеваний человека. Все вопросы назначения того или иного
цитогенетического исследования осуществляются при медико-генетическом консультировании. В целом же все
практические проблемы, решаемые лабораторными цитогенетическими методами, можно свести к следующим:
• подозрение на хромосомную болезнь по клинической симптоматике;
• наличие у ребенка множественных врожденных пороков развития, не относящихся к генному синдрому;
• многократные спонтанные аборты, мертворождения или рождение детей с врожденными пороками развития;
• нарушение репродуктивной функции неясного генеза у женщин и мужчин (первичная аменорея, бесплодный брак и др.);
• существенная задержка умственного и физического развития ребенка;
• пренатальная диагностика (риск по возрасту, в связи с наличием транслокации у родителей, при рождении предыдущего
ребенка с хромосомной болезнью);
• подозрение на синдромы, характеризующиеся хромосомной нестабильностью;
• лейкозы (для дифференциальной диагностики, оценки эффективности лечения и прогноза течения);
• оценка мутагенных воздействий (радиационных, химических).
22. Цитогенетические методы сразу же нашли практическое применение в диагностике хромосомных болезней.
• Так, например, на консультацию по поводу бесплодия обратились супруги (23-24 лет),живущие в браке 3 года. Жена в течение 3 лет наблюдалась в женской консультации по
поводу бесплодия и получала все это время достаточно интенсивную терапию. При этом муж
не был обследован. При осмотре мужа врачом-генетиком был заподозрен синдром
Клайнфельтера (высокий рост, скудное оволосение по женскому типу, избыточное развитие
молочных желез, недоразвитие одного яичка). При цитогенетическом исследовании
кариотипа подтвержден диагноз синдрома Клайфельтера. Его хромосомный набор - 47,XXY.
Эта хромосомная патология и явилась причиной бесплодия.
23.
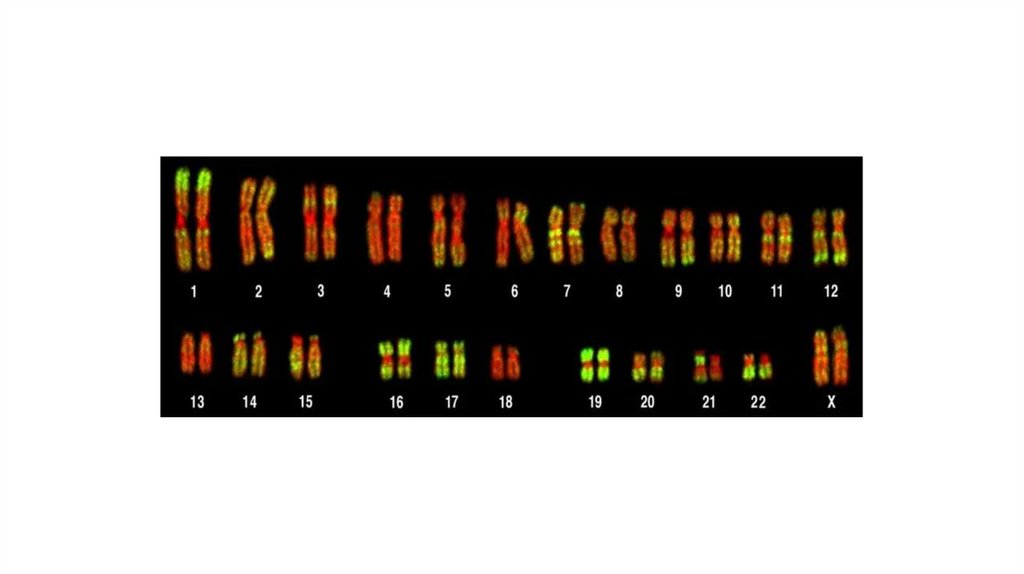
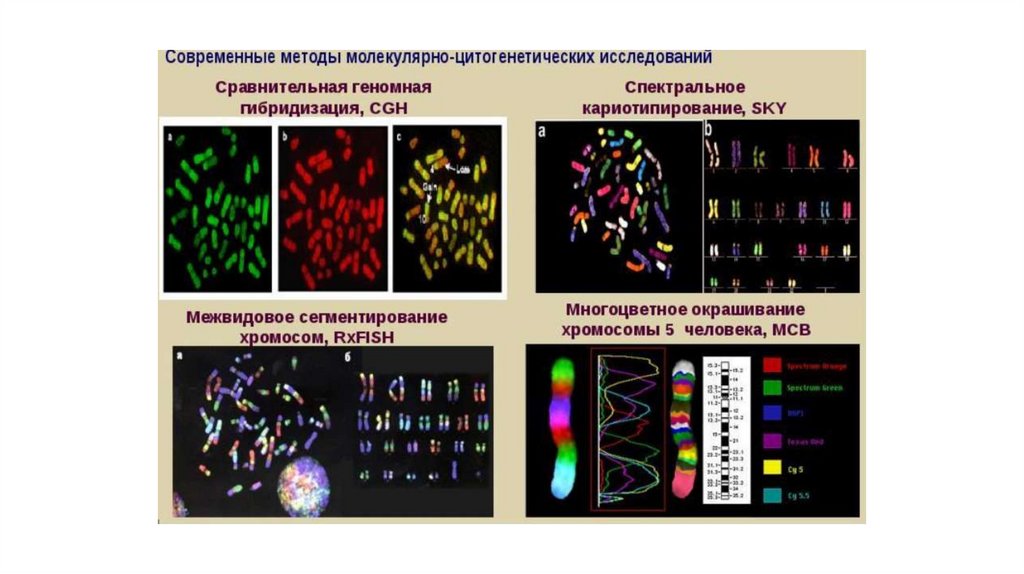
• С развитием медицинской генетики и совершенствованиеммикроскопической техники был разработан целый ряд новых
технологий, основанных на принципах гибридизации
нуклеиновых кислот на препарате, применение которых
позволило в значительной степени увеличить эффективность
выявления хромосомных аномалий, а в ряде случаев дополнить
или заменить цитогенетический анализ определенным
молекулярно-цитогенетическим методом. Использование
соответствующего молекулярно-цитогенетического метода
зависит от разрешающей способности технологии.
Биомедицинское направление, целью которого явилось
изучение хромосом с помощью последних достижений в
области молекулярной биологии, сформировалось как наука и
получило название молекулярная цитогенетика.
24.
25. Вывод
• В нашей стране, как и во всем мире, цитогенетические методы прочно вошли в арсеналнеобходимых диагностических процедур для решения сложных дифференциальнодиагностических задач практически во всех областях медицины. Особое же значение эти
методы имеют при оказании помощи больным педиатрического, акушерско-гинекологического
и эндокринологического профилей.

















 biology
biology








