Similar presentations:
Генетический аппарат клетки. Лекции № 3
1. Лекции № 3
Тема: Генетический аппаратклетки
2. План лекции:
1. Клетка – элементарная структурно- функциональнаяединица живого.
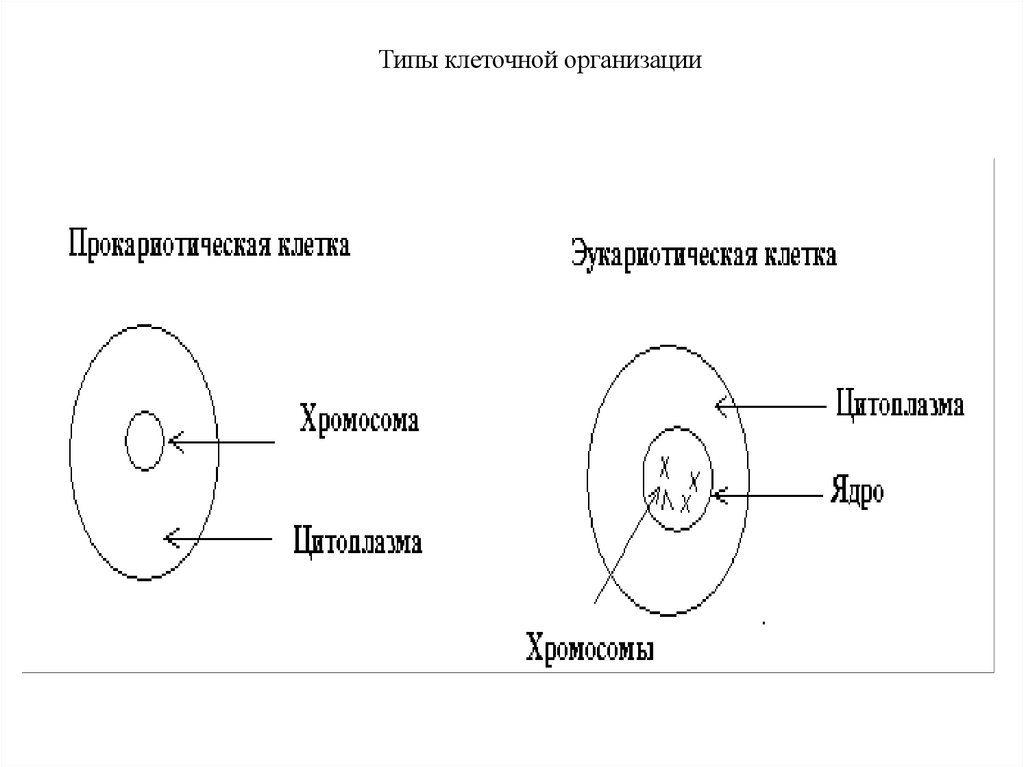
2. Типы клеточной организации: про- и эукариоты.
3. Уровни структурной организации генетического
материала клеток.
4. Денверская и Парижская классификация хромосом.
5. Кариотип человека, медицинское значение.
3.
3.1 Клетка – элементарная структурно- функциональнаяединица живого.
В 1839 году создана клеточная теория. Основные положения
клеточной
теории
Шлейдена-Шванна
заключаются
в
следующем:
1. Все без исключения растительные и животные организмы
состоят из клеток.
2. Клетки растений и животных гомологичны по
происхождению и аналогичны по функции.
3 Клеточное строение, однородность по происхождению и
сходство по функции клеток характеризуют рост и развитие
организмов.
Немецкий патолог Рудольф Вирхов в 1855 году подытожил
целый ряд исследований на растительных и животных объектах,
которые убедительно показали, что новообразование клеток
происходит путем их деления. «Каждая клетка – от клетки».
4.
Позднее в 70-х годах Х1Х в, благодаря усовершенствованиюгистологической техники и работы целой плеяды ученых были
обнаружены хромосомы, открыты общие и специальные
органоиды клетки: клеточный центр (1876), митохондрии
(1894), аппарат Гольджи (1898). В начале ХХ в И.Д.Чистяков
дал описание фаз митотического деления. В конце1898 г
И.Н.Горожанкин и С.Т. Навашин изучали цитологические
основы оплодотворения у растений.
Широкое использование новейших методов физики и химии в
ХХ веке, в частности, посредством электронной микроскопии
были открыты такие важнейшие клеточные органоиды, как
эндоплазматическая сеть, рибосомы и лизосомы. Применение
методов молекулярной биологии привело к открытию роли
ДНК как носителя наследственной информации в клетке и к
расшифровке генетического кода.
5.
Первые описания хромосом появились в статьях и книгахразных авторов в 70-х годах XIX века, и приоритет открытия
хромосом отдают разным людям. Среди них такие имена, как
И. Д. Чистяков (1873), А. Шнейдер (1873), Э. Страсбургер
(1875), О. Бючли (1876) и другие [Филипченко Ю.А.Генетика. —
Л.: Типография "Печатный Двор", 1929. — 379 с.]. Чаще всего
годом открытия хромосом называют 1882 год, а их
первооткрывателем — немецкого анатома В. Флеминга, который
в своей фундаментальной книге «Zellsubstanz, Kern und
Zelltheilung» (нем.) собрал и упорядочил сведения о них,
дополнив результатами собственных исследований. Термин
«хромосома» был предложен немецким гистологом Г.
Вальдейером в 1888 году. «Хромосома» в буквальном переводе
означает «окрашенное тело», поскольку оснóвные красители
хорошо связываются хромосомами.
6.
После переоткрытия в 1900 году законов Менделя потребовалосьвсего один-два года для того, чтобы стало ясно, что хромосомы
при мейозе и оплодотворении ведут себя именно так, как это
ожидалось от «частиц наследственности». В 1902 году Т. Бовери
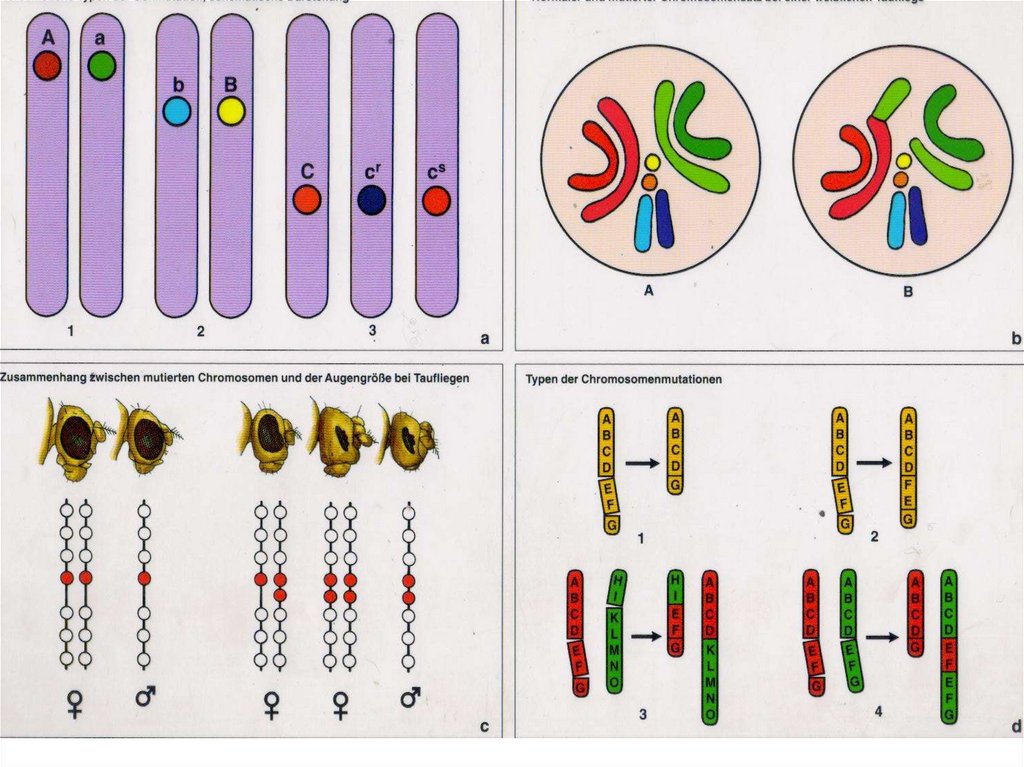
и в 1902—1903 годах У. Сеттон (Walter Sutton) независимо друг
от друга выдвинули гипотезу о генетической роли хромосом.
У ДНК-содержащих вирусов, бактерий и сине-зеленых
водорослей, а также в саморегулирующихся органеллах клеток
эукариот (пластидах и митохондриях), хромосома представляет
собой двуспиральную молекулу ДНК. У большинства форм она
образует кольцо, которое закручено в шпильку и хромосома
сверхспирализована. У бактерий геном организован в некое тело
или тела, которые занимают около трети объема клетки и
называются нуклеоидами.
7.
К началу ХХ века углубленное изучение поведения этихструктур в ходе
самовоспроизведения клеток, при
созревании половых клеток, при оплодотворении и раннем
развитии зародыша обнаружило строго закономерные
динамические изменения их организации. Это привело
немецкого цитолога эмбриолога Т. Бовери (1902-1907) и
американского цитолога У. Сеттона (1902-1903) к
утверждению тесной связи наследственного материала с
хромосомами, что легло в основу хромосомной теории
наследственности
8.
Типы клеточной организации9.
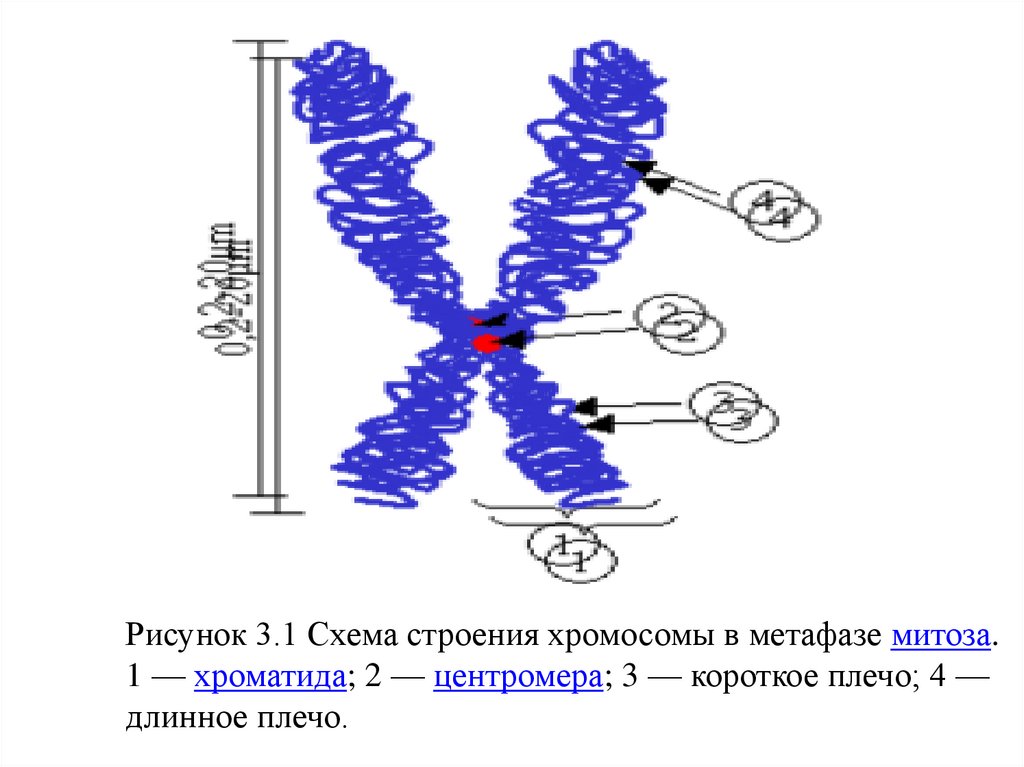
3.2 Морфология метафазных хромосомНа стадии метафазы митоза хромосомы состоят из двух
продольных копий, которые называются сестринскими
хроматидами и которые образуются при репликации. У
метафазных хромосом сестринские хроматиды соединены в
районе первичной перетяжки, называемой центромерой.
Центромера отвечает за расхождение сестринских хроматид в
дочерние клетки при делении. На центромере происходит
сборка кинетохора — сложной белковой структуры,
определяющей прикрепление хромосомы к микротрубочкам
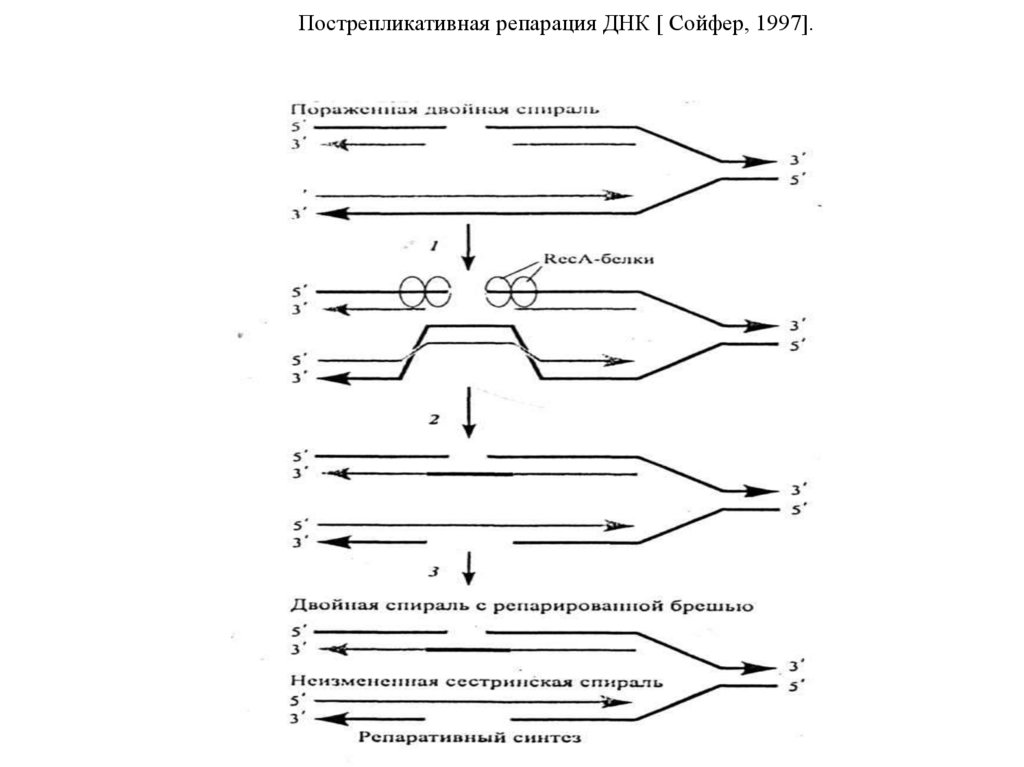
веретена деления — движителям хромосомы в митозе
[Вершинин А. В,2007]. Центромера делит хромосомы на две
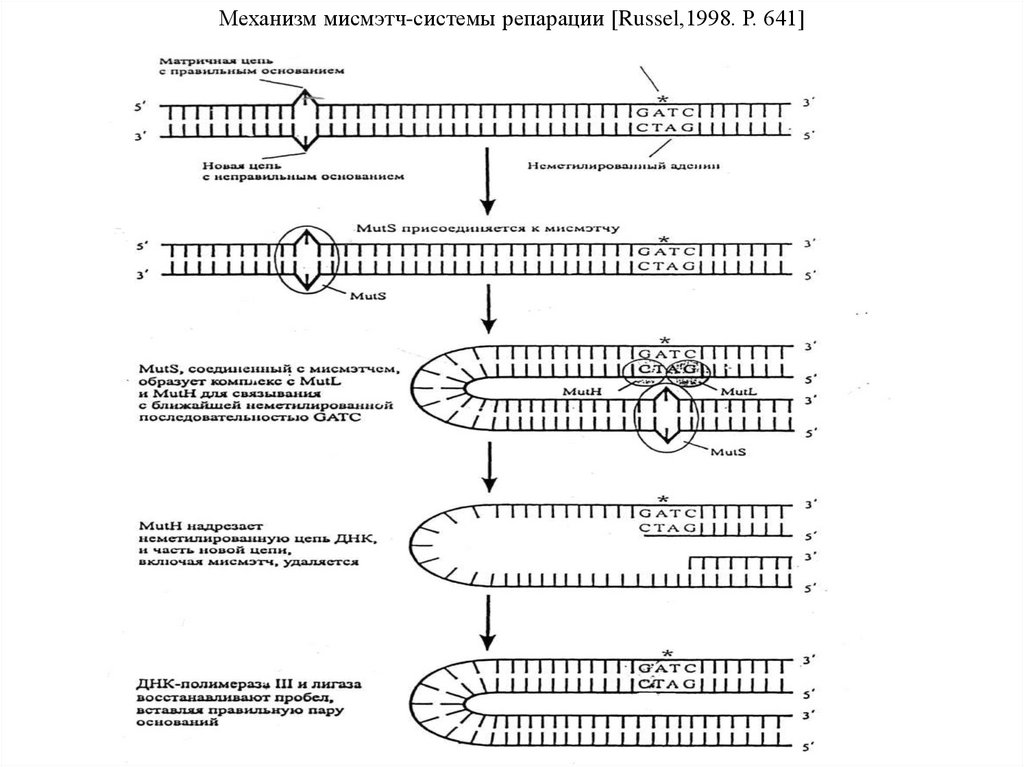
части, называемые плечами. У большинства видов короткое
плечо хромосомы обозначают буквой p, длинное плечо —
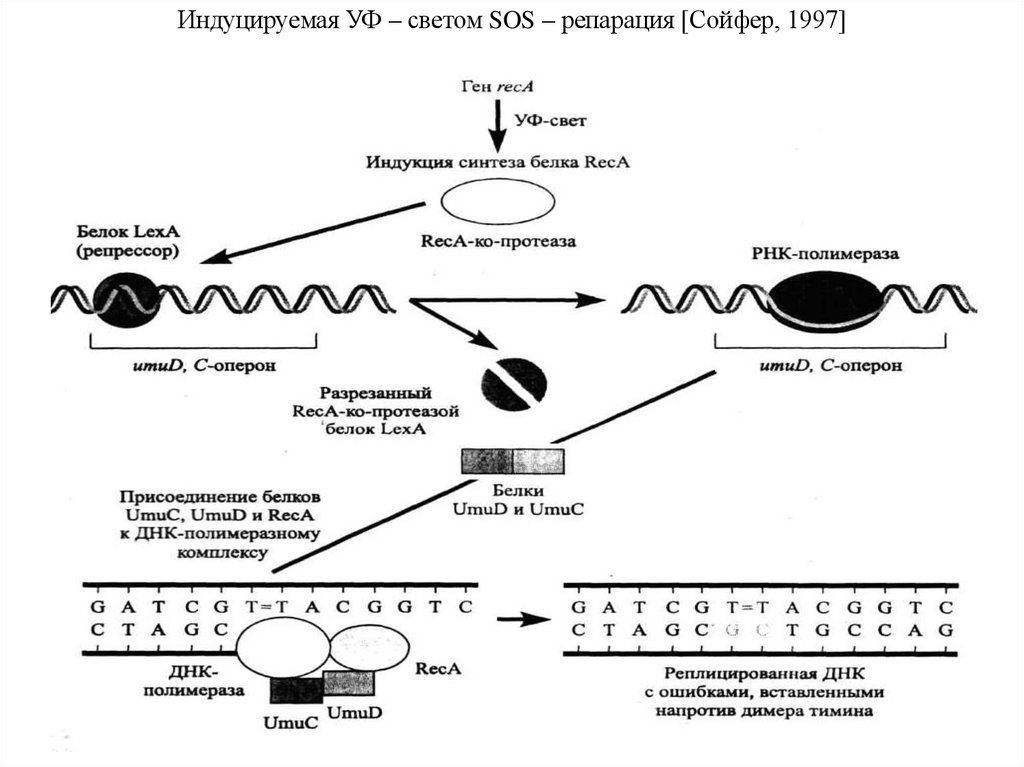
буквой q. Длина хромосомы и положение центромеры являются
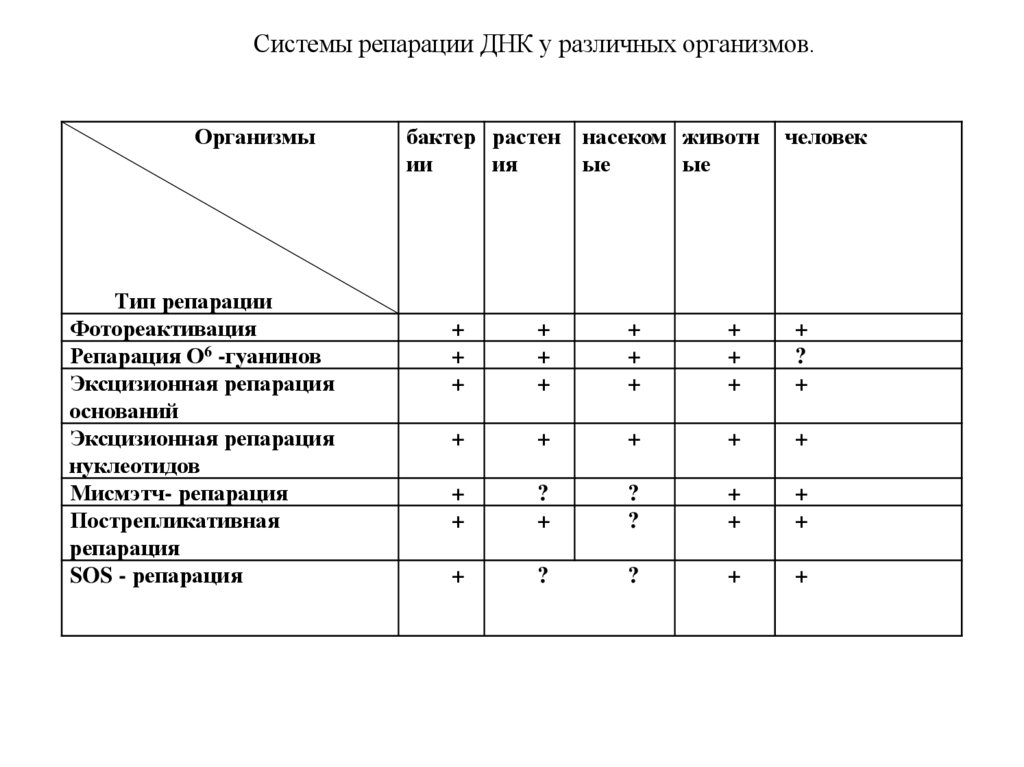
основными морфологическими признаками метафазных
хромосом.
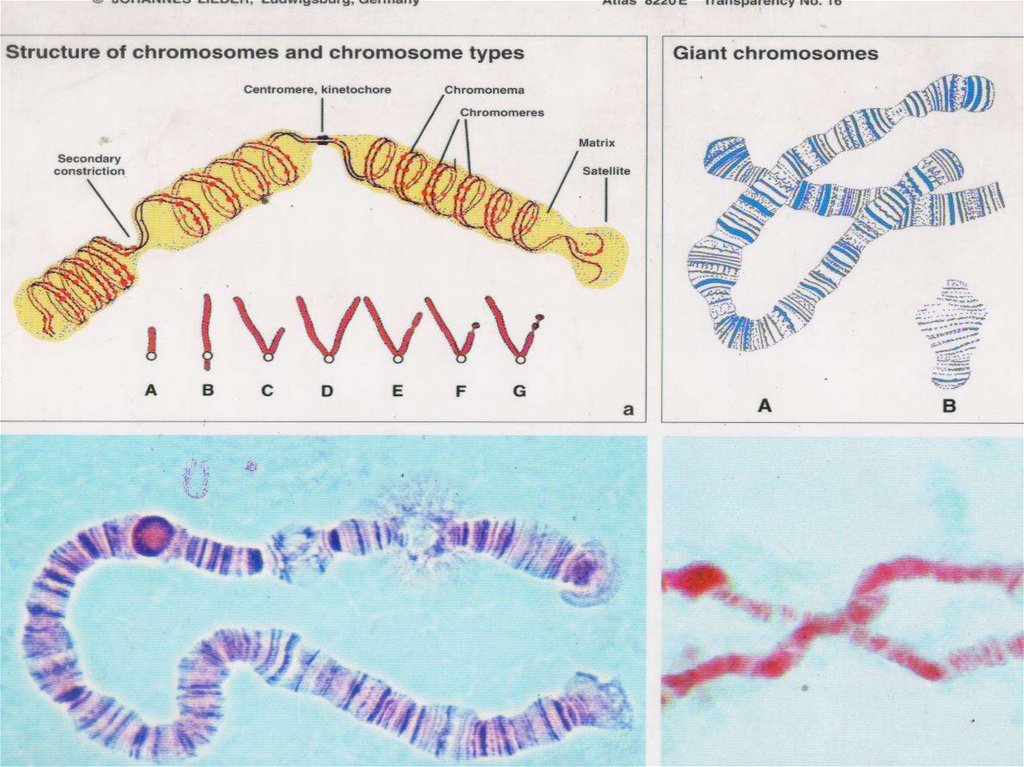
10.
Рисунок 3.1 Схема строения хромосомы в метафазе митоза.1 — хроматида; 2 — центромера; 3 — короткое плечо; 4 —
длинное плечо.
11.
Рисунок 3.2 Хромосомные территории в интерфазномядре фибробласта человека
12.
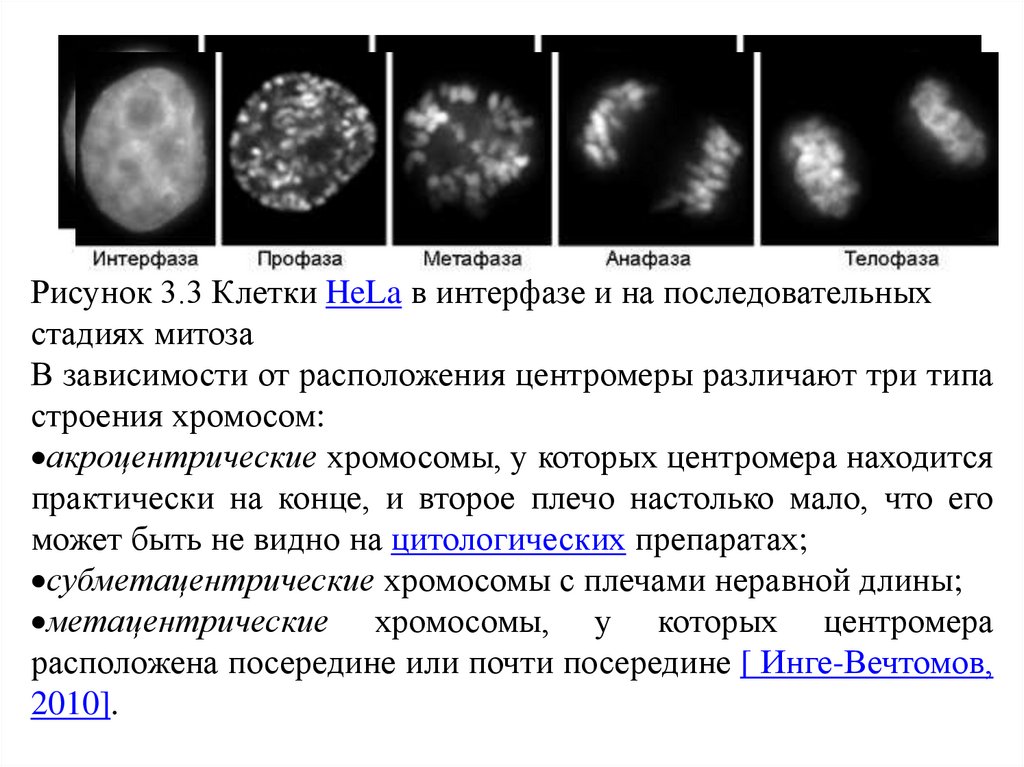
Рисунок 3.3 Клетки HeLa в интерфазе и на последовательныхстадиях митоза
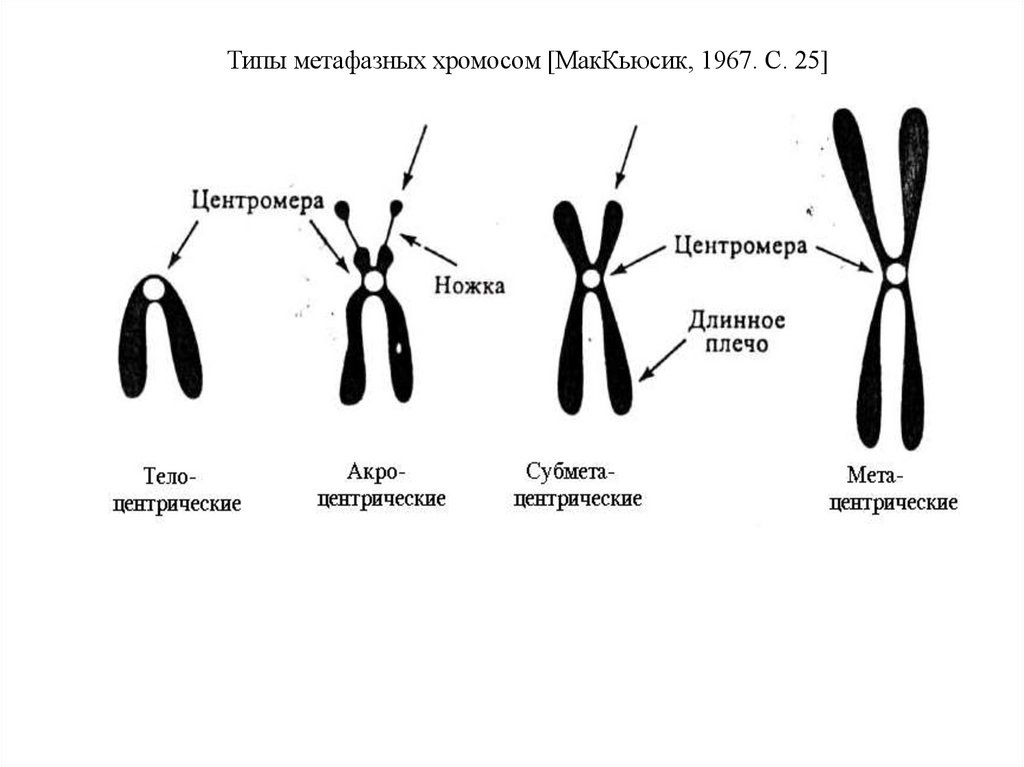
В зависимости от расположения центромеры различают три типа
строения хромосом:
акроцентрические хромосомы, у которых центромера находится
практически на конце, и второе плечо настолько мало, что его
может быть не видно на цитологических препаратах;
субметацентрические хромосомы с плечами неравной длины;
метацентрические хромосомы, у которых центромера
расположена посередине или почти посередине [ Инге-Вечтомов,
2010].
13.
Типы метафазных хромосом [МакКьюсик, 1967. С. 25]14.
3.3 Уровни компактизации хромосомной ДНКИзучение химической организации хромосом эукариотических
клеток показало, что они состоят в основанном из ДНК и
белков, которые образуют нуклеопротеиновый комплекс –
хроматин, получивший свое название за способность
окрашиваться основными красителями. Количество ДНК в
ядрах
клеток
организма
данного
вида
постоянно
пропорционально их плоидности. В диплоидных соматических
клетках организма ее вдвое больше, чем в гаметах. Увеличение
числа хромосомных наборов в полиплоидных клетках
сопровождается пропорциональным увеличением количества
ДНК в них.
Белки составляют значительную часть вещества хромосом. На
их долю приходится около 65% массы этих структур. Все
хромосомные белки разделяются на две группы: гистоны и
негистоновые белки.
15.
Гистоны представлены пятью фракциями: Н1, Н2А, Н2В, Н3 иН4. Являясь положительно заряженными основными белками,
они достаточно прочно соединяются с ДНК, чем препятствуют
считыванию заключенной в ней биологической информации. В
этом состоит их регуляторная роль. Кроме того, эти белки
выполняют
структурную
функцию,
обеспечивая
пространственную организацию ДНК в хромосомах.
Число фракций негистоновых белков превышает 100. Среди
них ферменты синтеза и процессинга РНК, редупликации и
репарации ДНК. Кислые белки хромосом выполняют также
структурную и регуляторную роль. Помимо ДНК и белков в
составе хромосом обнаруживаются также РНК, липиды,
полисахариды, ионы металлов.
РНК
хромосом
представлена
отчасти
продуктами
транскрипции, еще не покинувшими место синтеза. Некоторым
фракциям свойственна регуляторная функция.
16.
Регуляторная роль компонентов хромосом заключается в«запрещении» или «разрешении» списывания информации с
молекулы ДНК.
Массовое соотношение ДНК : гистоны : негистоновые белки :
РНК : липиды – равны 1:1:0,2-0,5:0,1-0,15:0,01-0,03. Другие
компоненты встречаются в незначительном количестве.
Хроматин в зависимости от периода и фазы клеточного цикла
меняет свою организацию. В интерфазе при световой
микроскопии он выявляется в виде глыбок, рассеянных в
нуклеоплазме ядра. При переходе клетки к митозу, особенно в
метафазе, хроматин приобретает вид хорошо различимых
отдельных интенсивно окрашенных телец – хромосом.
В процессе электронно-микроскопических
и физикохимических исследований в составе интерфазного хроматина и
метафазных хромосом были выявлены нити (фибриллы)
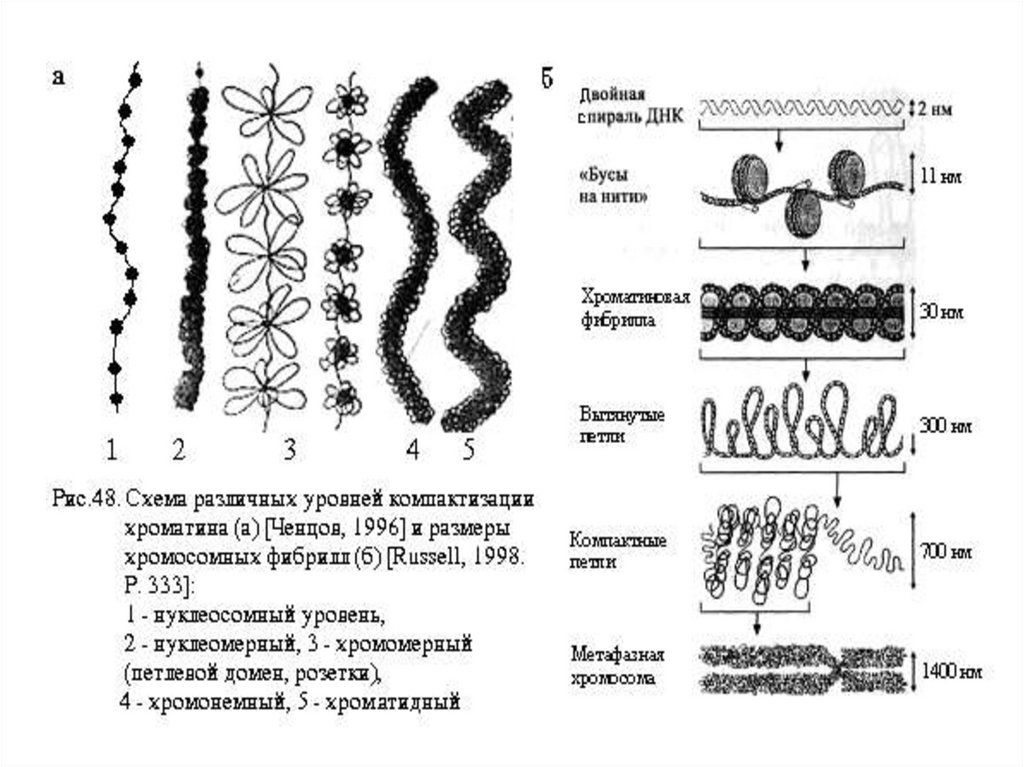
диаметром 3,0-5,0, 10, 20-30 нм. Полезно вспомнить, что
диаметр двойной спирали ДНК составляет примерно 2 нм,
диаметр нитчатой структуры интерфазного хроматина равен
17.
Диплоидный набор хромосом (2n), свойственный соматическимклеткам
организмов
данного
вида,
являющийся
видоспецифическим
признаком
и
характеризующийся
определенным числом, строением и генетическим составом,
называется кариотипом. У отдельных особей разного пола
имеется разное количество хромосом (ХХ или Х0) или чаще
(ХХ и ХУ).
В 1974 году сразу четверо исследователей показали наличие
нуклеосом в составе хроматина ядер: Коренберг обнаружил, что
хроматин состоит из субъединиц, содержащих по 200 п. н. ДНК
и по две молекулы 4 типов гистонов, М. Нолль изолировал эти
структуры, а А. Олинс и Д. Олинс опубликовали первые
электронно-микроскопические фотографии нуклеосом.
18.
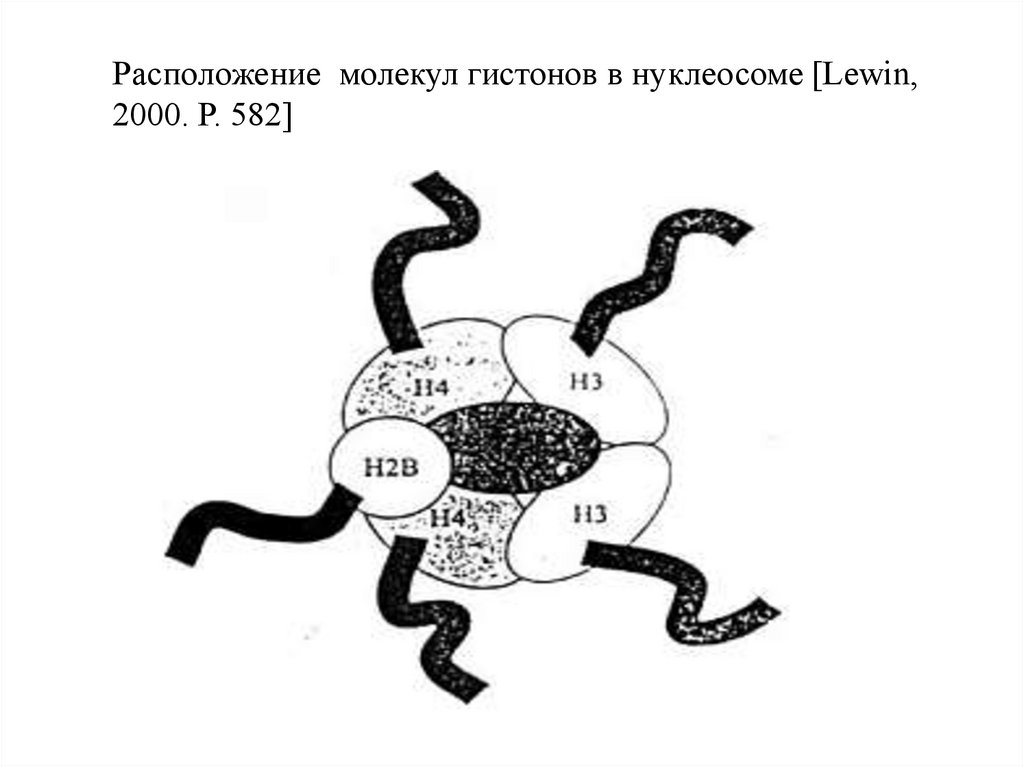
Расположение молекул гистонов в нуклеосоме [Lewin,2000. Р. 582]
19.
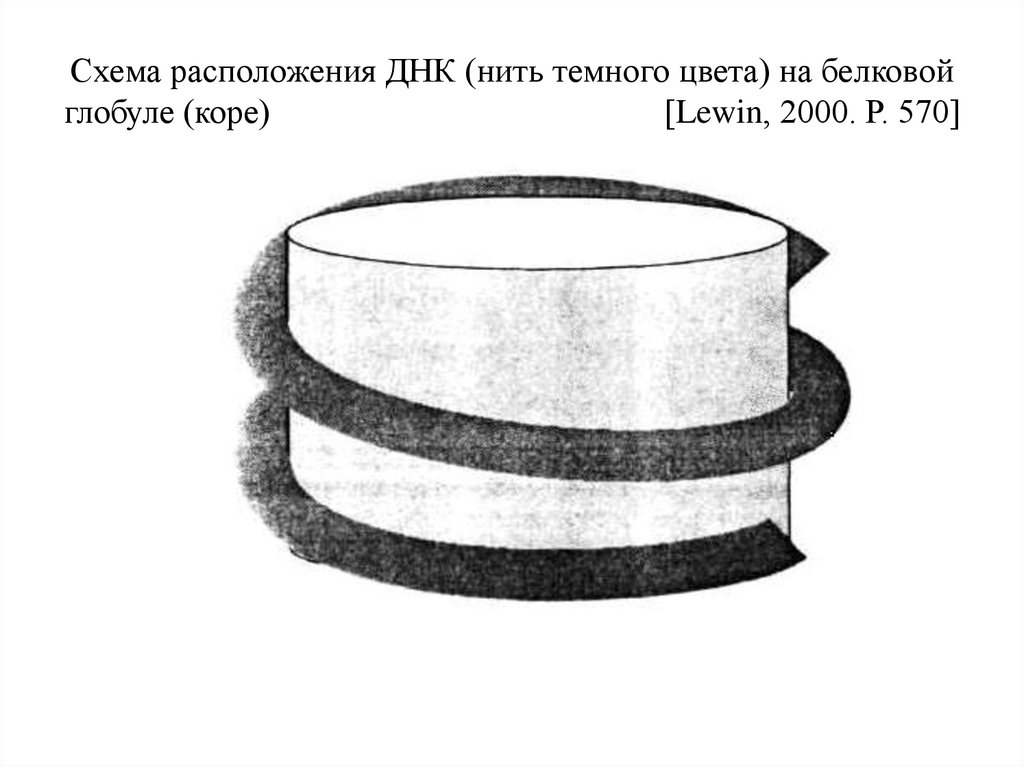
Схема расположения ДНК (нить темного цвета) на белковойглобуле (коре)
[Lewin, 2000. Р. 570]
20.
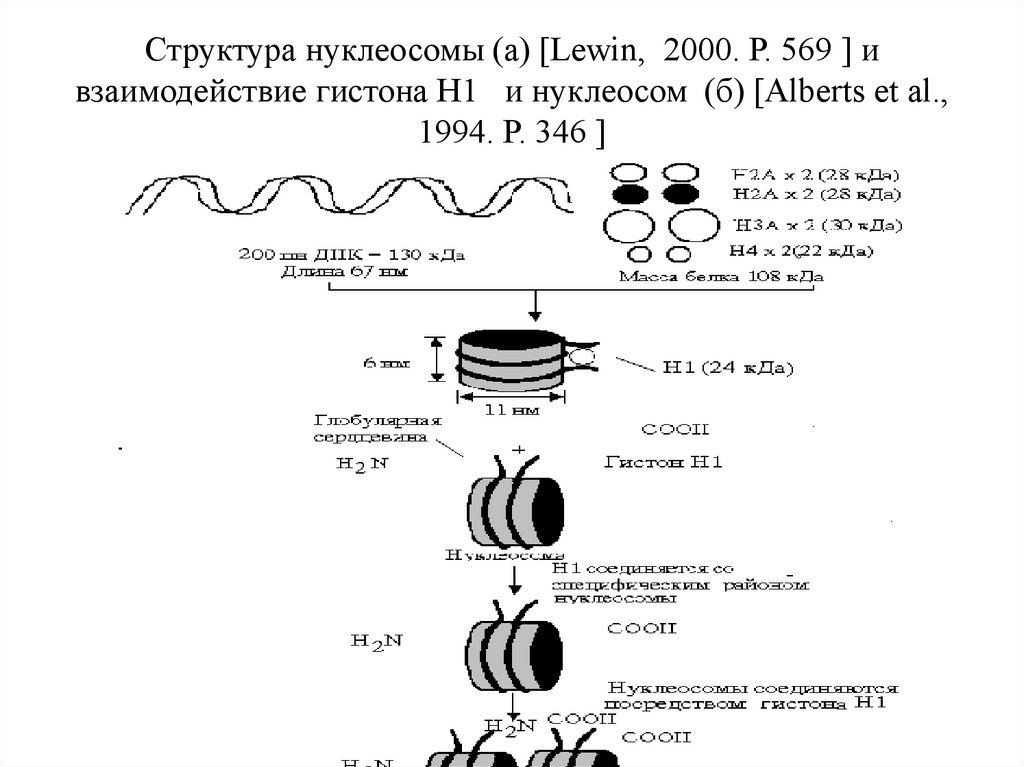
Более 90% ДНК в клетке присутствует в составе нуклеосом.ДНК делает два оборота вокруг октамерной частицы,
состоящей из гистонов Н2А, Н2В, Н3 и Н4, длина этого участка
ДНК=146 п.н., еще около 50 п.н. приходится на участок между
нуклеосомами – линкер. После упаковки ДНК в нуклеосомные
структуры длина ее уменьшается в 6 раз и образует нить
диаметром – 10 нм.
Дальнейшая компактизация нуклеосомной нити обеспечивается
гистоном Н1, который соединяется с линкерной ДНК и двумя
соседними белковыми телами, сближает их друг с другом. В
результате образуется более компактная структура, построенная
по типу соленоида. Такая хроматиновая фибрилла, называемая
также элементарной, имеет диаметр 20-30 нм и соответствует
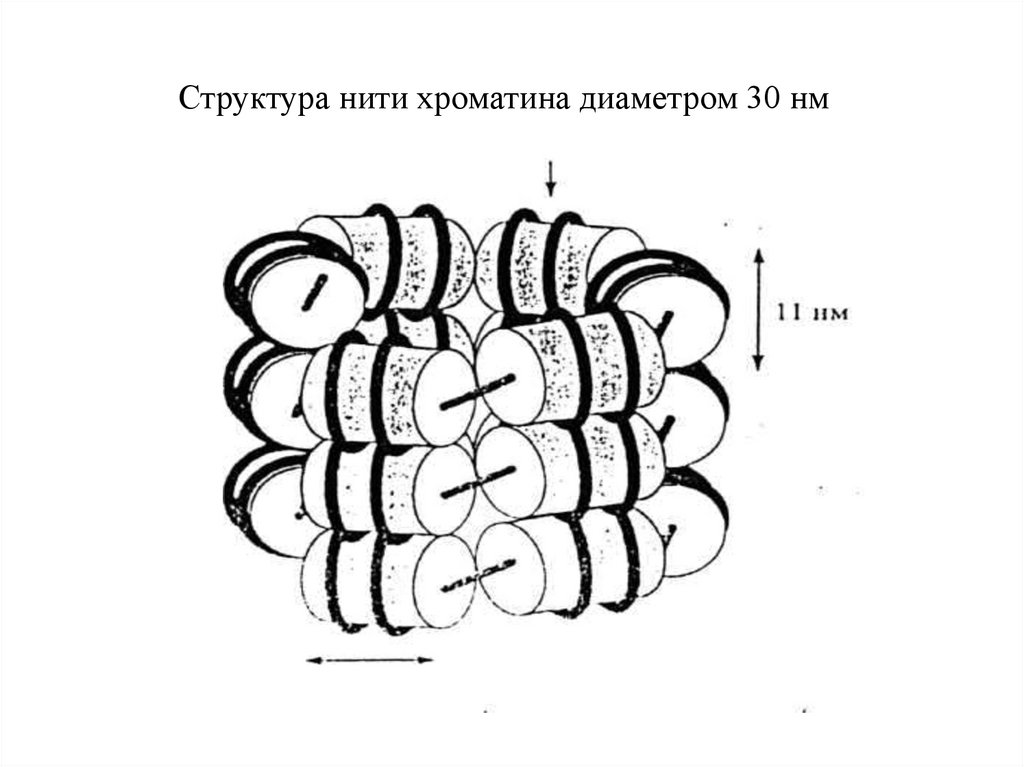
нуклеомерному уровню упаковки ДНК (диаметр 30 нм).
21.
Следующий третий - хромомерный (диаметр 300нм) обусловленукладкой хроматиновой фибриллы в петли. В их образовании,
по-видимому, принимают участие негистоновые белки, которые
способны
узнавать
специфические
нуклеотидные
последовательности вненуклеосомной ДНК, отдаленные друг от
друга на расстояние в несколько тысяч пар нуклеотидов. Эти
белки сближают указанные участки с образованием петель из
расположенных между ними фрагментами хроматиновой
фибриллы. Участок ДНК, соответствующий одной петле,
содержит от 20 000 до 80 000 п.н. Возможно, каждая петля
является функциональной единицей генома. В результате такой
упаковки хроматиновая фибрилла преобразуется в структуру
диаметром 300 нм, называемой интерфазной хромомерой и
четвертый – хромонемный (диаметр 700нм) уровень упаковки
ДНК в хроматиде и наконец метафазная хромосома (диаметр
нити 1400 нм), которую можно наблюдать в световом
22.
Структура нуклеосомы (а) [Lewin, 2000. Р. 569 ] ивзаимодействие гистона Н1 и нуклеосом (б) [Alberts et al.,
1994. Р. 346 ]
23.
Структура нити хроматина диаметром 30 нм[Lewin, 1994. Р. 812)
24.
25.
Точное количество хромосом человека равно 46, впервыеустановлено в 1956г французкими цитогенетиками Чийо и
Леваном.
Сложность
была
связана
с
беспорядочным
расположением хромосом в анализируемых препаратах.
В этой связи в 1960 году в Денвере (США) была разработана
Денверская классификация хромосом человека, которая в
зависимости от размера и по соотношению плеч поделила
хромосомы на 7 групп (А.В,C,D,E,F,G) :
Группа А - крупные метацентрические 1-3 пары хромосом,
Группа B - крупные субметацентрические – 4-5 пары хромосом,
Группа С - средние субметацентрические с 6-12 пары хромосом и Х
хромосома.
Группа D – средние акроцентрические с13 по15 пары хромосом.
Группа Е – мелкие субметацентрические – 16-18 пары хромосом.
Группа F – самые мелкие метацентрические хромосомы – 19-20
пары хромосом.
Группа G –самые мелкие акроцентрические – 21-22 пары хромосом
и У хромосома.
26.
3.5. Дифференциальнаяклассификация хромосом.
окраска
метафазных
хромосом.
Парижская
При монохромном окрашивании хромосом (ацето-кармином, ацетоорсеином, окрашиванием по Фёльгену или Романовскому-Гимзе)
можно идентифицировать число и размеры хромосом; их форму,
определяемую прежде всего положением центромер, наличием
вторичных перетяжек, спутников. В подавляющем числе случаев для
идентификации индивидуальных хромосом в хромосомном наборе
этих признаков недостаточно. Кроме того, монохромно окрашенные
хромосомы часто очень похожи у представителей разных видов.
Дифференциальное окрашивание хромосом, различные методики
которого были разработаны в начале 70-х годов XX века, снабдило
цитогенетиков мощнейшим инструментом для идентификации как
индивидуальных хромосом в целом, так и их частей, облегчив тем
самым процедуру анализа генома.
27.
Методы дифференциального окрашивания делятся на двеосновные группы:
методы
селективного
окрашивания
определённых
хромосомных районов, таких как блоки конститутивного
гетерохроматина, активные ядрышкообразующие районы,
центромерные и теломерные районы;
методы дифференциального окрашивания эухроматиновых
районов хромосом, обеспечивающие выявление в
эухроматиновых районах чередующихся сегментов, так
называемых бэндов (англ. band — полоса, лента, тесьма),
которые окрашиваются с различной интенсивностью
[Рубцов Н.Б,2006]. Основным методом дифференциальной
окраски, широко использующийся в клинической
цитогенетике является метод окрашивания хромосом
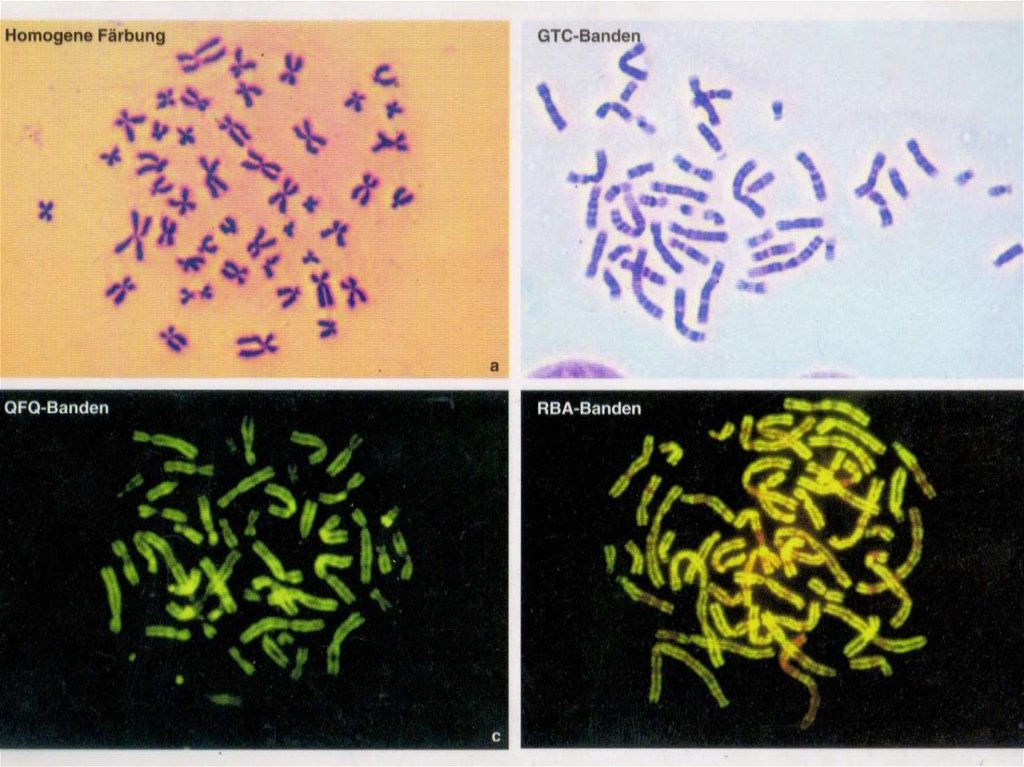
краской Гимза (G- окрашивание) (рисунок 3.11).
28.
Рис. 3.11 (Рис. 66.1, Harrison). Метафазные хромосомылимфоцитов человека http://humbio.ru/humbio/har/00544273.htm.
Метафазные хромосомы лимфоцитов здорового человека,
окрашенные красителем Гимзы (G-окрашивание). На врезке расположение хромосом в интактной клетке, на основном рисунке
29.
Для повышения точности цитогенетического анализа частоиспользуют прометафазные и даже профазные хромосомы, что
позволяет увеличить число распознаваемых сегментов
дифференциального
окрашивания
до
850
и
1700,
соответственно.
В данной клетке видны примерно 500 полос, с помощью
других методов можно различить более мелкие полосы.
Обычно гомологичные хромосомы окрашиваются одинаково.
Исключение составляют некоторые полиморфные участки,
например, темная околоцентромерная полоса на 9-й хромосоме
обычно находится на длинном плече (слева), но иногда
расположена на коротком плече (справа).
Для получения отчетливой G-окраски обычно используют
мягкую обработку хромосом раствором трипсина с
последующим окрашиванием красителем РомановскогоГимзы. По общепринятой трехбуквенной номенклатуре,
которая часто используется в записи цитогенетического
диагноза, такая окраска обозначается GTG (G-окраска –
30.
Кариотип человека в норме состоит из 23-х пар хромосом,которые располагают под номерами в порядке убывания их
линейных размеров (Рисунок 3.12).
Систематические изображение G – сегментов хромосом
человека и система их
обозначения согласно
решениям Парижской конференции в 1971г. Цифрами
обозначены номер хромосом; X и Y - половые хромосомы ; р –
короткое, q – длинное плечи хромосом
31.
АТ-богатые G-положительные районы связывают большееколичество красителя, что приводит к их более интенсивной
флуоресценции.
Использование
этого
метода
позволяет
идентифицировать Y-хромосому даже в интерфазе, поскольку иезначительная ее часть состоит из необычайно АТ-богатого
гетерохроматина, который при связывании с флуорохромами дает
бриллиантовое свечение.
Рисунок обратный G-бендингу получается при помощи R-метода
дифференциального окрашивания путем тепловой денатурации. ГЦпары, которых больше в G-отрицательных районах хромосом, более
устойчивы к этой процедуре. Подавляющее большинство G+районов соответствует R- и наоборот (Рисунок 3.14).
Само название этого метода происходит от английского слова
reversed– обратный. R+-районы реплицируются в первой половине
фазы S клеточного цикла, а G+-районы - во второй. Существуют
методики выявления R-бендинга путем введения в клетки
модифицированных предшественников синтеза ДНК в середине
фазы S. Тогда R+-районы не будут содержать модифицированных
32.
33.
Если перед окрашиванием митотические хромосомы обработатьщелочными растворами, вымывающими ДНК в первую очередь из
районов с низкой плотностью хроматина, можно наблюдать
интенсивное окрашивание прицентромерных районов всех
хромосом и практически полное интенсивное окрашивание Yхромосомы.
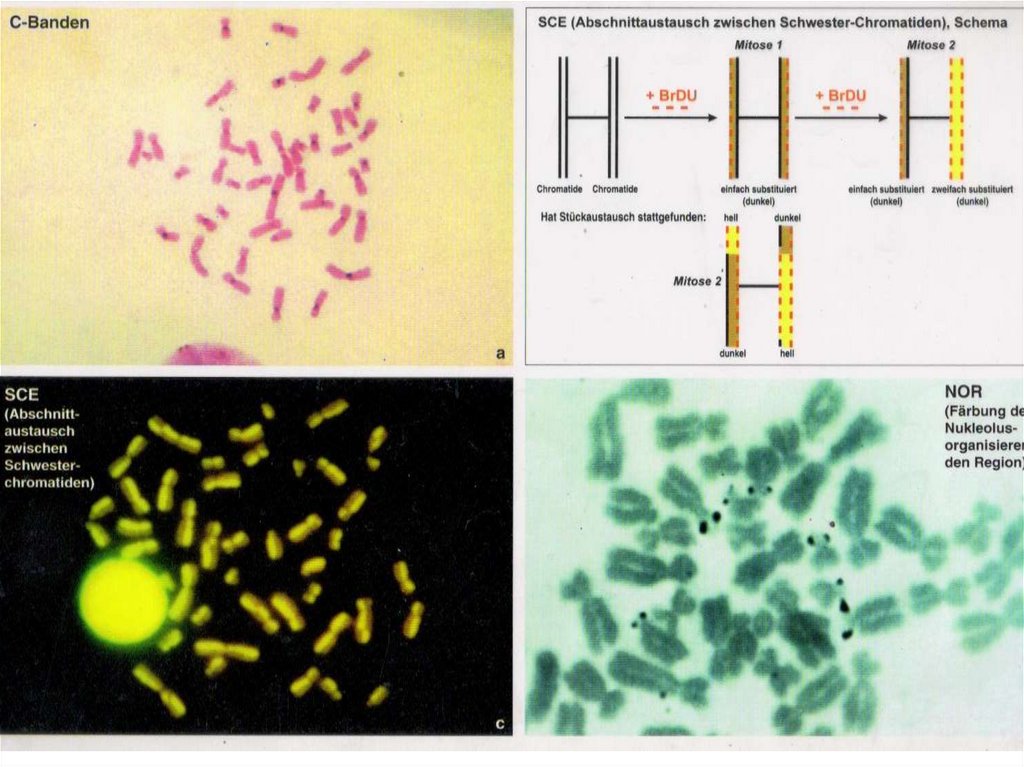
Такой подход называется C-методом дифференциального
окрашивания хромосом или C-бендингом. C-положительные
(интенсивно окрашенные при использовании этого метода) районы
хромосом соответствуют участкам генетически инертного
хроматина – или гетерохроматина. Различная степень окрашивания
районов хромосом при C-окраске говорит о неоднородности
распределения гетерохроматина по длине хромосом.
К началу митоза каждая хромосома состоит из двух идентичных
сестринских
хроматид.
Хромосомы
идентифицируют
по
относительной длине, положению центромеры, а также
характерному расположению и ширине полос, полученных при
дифференциальном окрашивании. Число полос, различимых под
34.
35.
36.
3.7 Кариотип человека, медицинское значение.Методы молекулярной генетики сделали возможной
идентификацию огромного числа меньших по размеру и
потому не выявляемых при световой микроскопии
полиморфных участков ДНК. Эти участки выявляют как
полиморфизм
длин
рестрикционных
фрагментов,
варьирующие по числу тандемные повторы и полиморфизм
коротких тандемных повторов (моно-, ди-, три- и
тетрануклеотидных). Такая изменчивость фенотипически
обычно не проявляется.
Однако полиморфизм служит удобным инструментом
пренатальной
диагностики
благодаря
сцеплению
определенных маркеров с мутантными генами, вызывающими
заболевания (например, при миопатии Дюшенна ), а также
при установлении зиготности близнецов, установлении
отцовства и прогнозирования отторжения трансплантата.
37.
Трудно переоценить значение таких маркеров, особенношироко распространенных в геноме высокополиморфных
коротких тандемных повторов, для картирования генома
человека. В частности, они позволяют установить точный
порядок и характер взаимодействия локусов, играющих
важную роль в обеспечении нормального онтогенеза и
клеточной дифференцировки. Это касается и тех локусов,
мутации в которых приводят к наследственным заболеваниям.
Различимые под микроскопом участки на коротком плече
акроцентрических аутосом обеспечивают синтез рРНК и
образование ядрышек, поэтому их называют районами
ядрышкового организатора. Благодаря внедрению современных
методов анализа хромосом (кариотипа) были картированы
гены многих наследственных заболеваний человека (рисунок
3.20).
38.
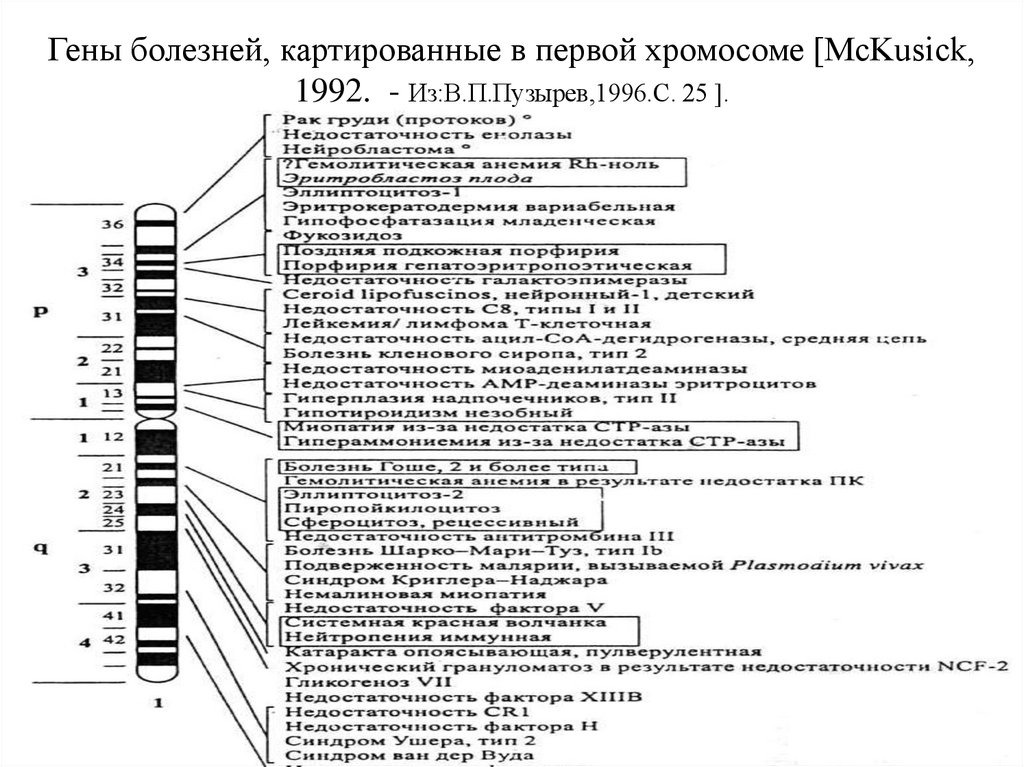
Гены болезней, картированные в первой хромосоме [McKusick,1992. - Из:В.П.Пузырев,1996.С. 25 ].
39. Литература:
Биология. Под ред. Ярыгина В.Н. М., 2001.Бочков Н.П. и др. Медицинская генетика. М., 1984.
Генетика. Под ред. Иванова В. И. М., 2006.
Заяц Р.Г.и др. Общая и медицинская генетика. Ростов-на-Дону,
2002.
5. Инге-Вечтомов С.Г. Генетика с основами селекции. М., 1989.
6. Кемп П., Армс К. Введение в биологию. М., 1988.
7. Медицинская биология и генетика. Под ред. проф. Куандыкова.
Е.У. Алматы, 2004.
8. Муминов Т.А., Куандыков Е.У. Основы молекулярной биологии
(курс лекций). Алматы, 2007.
9. Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная биология. М.,
2003.
10. Фаллер Д. М., Шилдс Д. Молекулярная биология клетки. М.,
2006.
1.
2.
3.
4.
40. Контрольные вопросы (обратная связь):
1. Назовите типы метафазных хромосом.2. Чем представлен генетический материал
прокариот и эукариот.
3. Денверская и Парижская классификация
хромосом человека.
41. Лекции № 3.2(11-12 )
Тема: Наследственнаяизменчивость
42. План лекции:
1. Изменчивость, определение, типы.2. Рекомбинативная изменчивость.
3. Мутационная изменчивость. Мутагенные факторы,
мутагенез.
4. Классификация мутаций.
5. Значение мутаций в возникновении
наследственных болезней человека.
43.
Результаты изучения явления комбинативной изменчивостииспользуются в медико-генетическом консультировании,
особенно на его втором и третьем этапах: прогноз потомства,
формирование заключения и объяснение смысла генетического
риска. В консультировании будущих супружеских пар
используется установление вероятности наличия у каждого из
двух индивидуумов аллелей, полученных от общего предка и
идентичных
по
происхождению.
Для
этого
используют коэффициент родства, выражаемый в долях
единицы. У монозиготных близнецов он равен 1, у родителей и
детей, братьев и сестёр - 1/2, у деда и внука, дяди и племянника
- 1/4, у двоюродных сибсов (братьев и сестёр) - 1/8, у
троюродных сибсов - 1/32 и т.д.
Для характеристики степени гомозиготизации организма
используется коэффициент инбридинга, который отражает
долю локусов в генотипе потомка конкретной пары
родителей, по которым он гомозиготен:
44.
При этом n = n1 и равно числу поколений, считая от общегопредка до родителей индивидуума; Fz - коэффициент инбридинга
для общего предка (если предок неинбреден, то Fz = 0).
Неблагоприятные последствия инбридинга высокой степени (с
большим значением коэффициента инбридинга) служат
генетическим
обоснованием
нежелательности
близкородственных браков у человека. Различают следующие
системы браков: 1) случайный подбор брачной пары в
определённой группе людей (панмиксия); 2) более частое, чем
при панмиксии, вступление в брак индивидуумов, состоящих в
родстве (инбридинг); 3) более редкое, чем при панмиксии,
вступление
в
брак
индивидуумов,
состоящих
в
родстве (аутбридинг).
45.
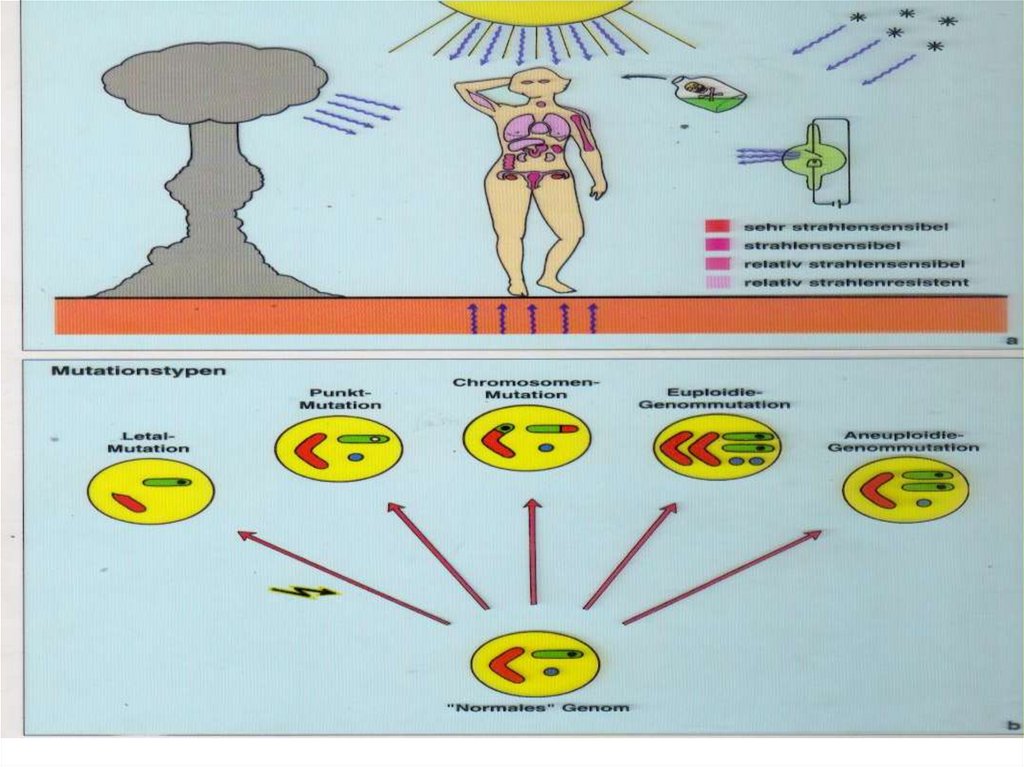
8.4. Мутационная изменчивостьМутационная изменчивость возникает в результате изменения
структуры наследственного материала. Процесс возникновения
мутаций называют мутагенезом, а факторы среды, вызывающие
появление мутаций, — мутагенами. Установлено мутагенное
влияние различных факторов на живые организмы и клетки
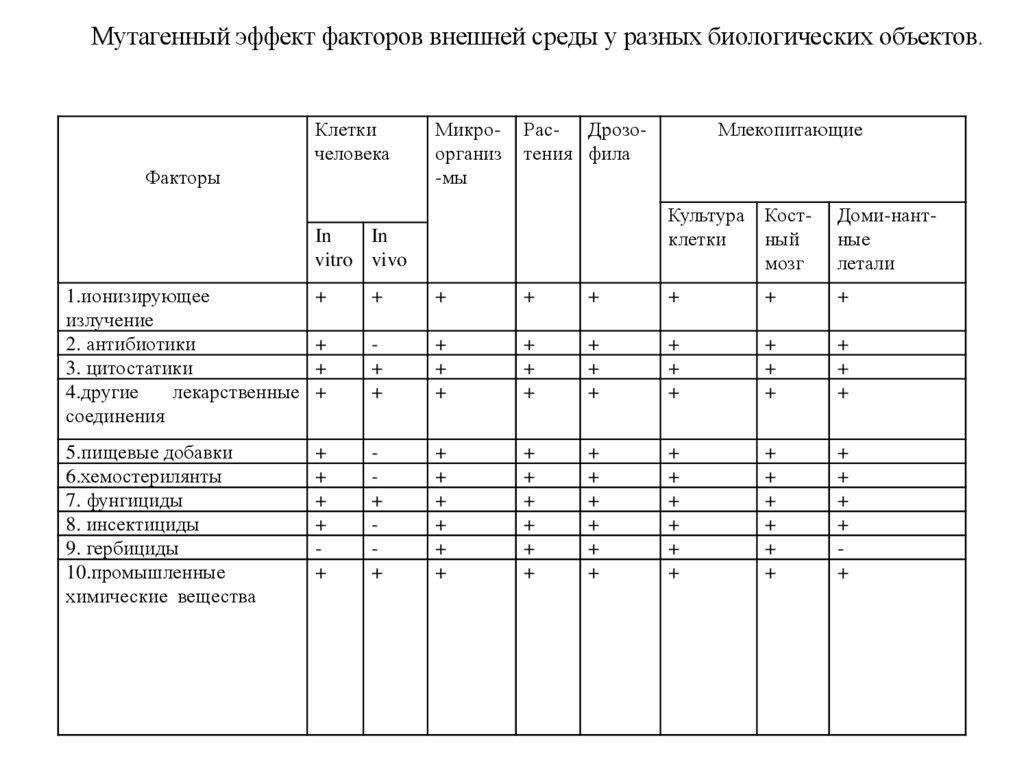
(таблица8.1).
Термин «мутация» предложил голландский ботаник Гуго де
Фриз в своем классическом труде «Мутационная теория» (1901 —
1903 гг.), основные положения которого до сих пор не утратили
значения:
1.мутации возникают внезапно, дискретно, без переходов;
2.они константны в своем проявлении;
3.мутации наследуются;
4.они могут быть как полезными, так и вредными (добавим, а
также - нейтральными);
5.выявление мутаций зависит от количества проанализированных
особей;
46.
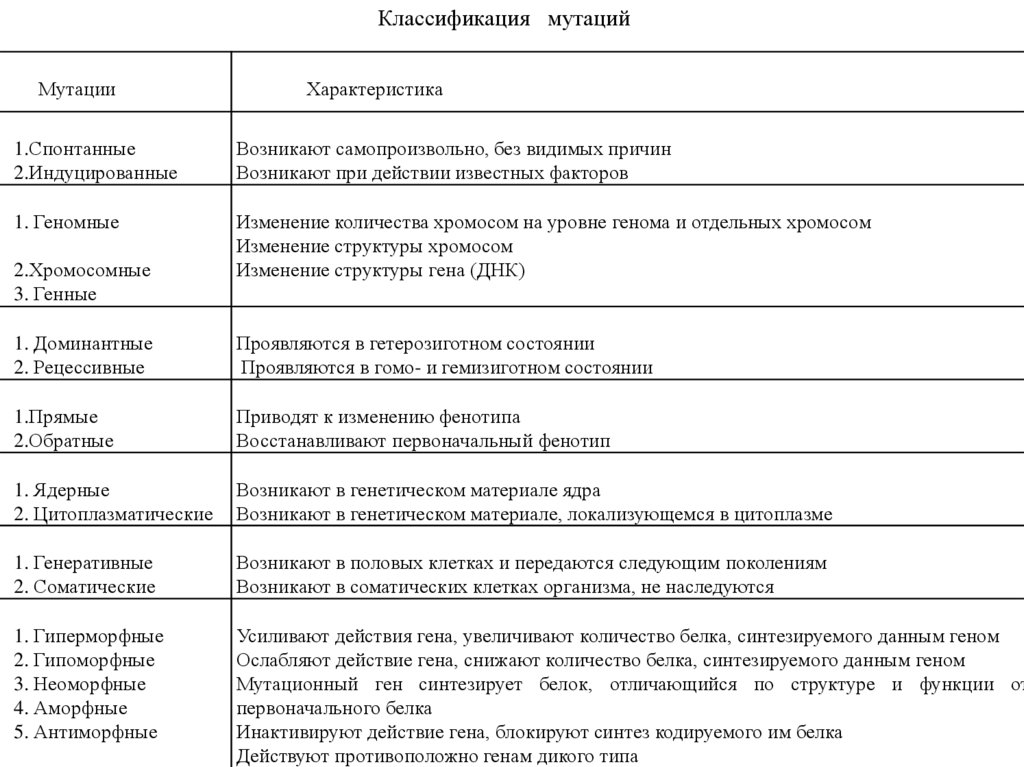
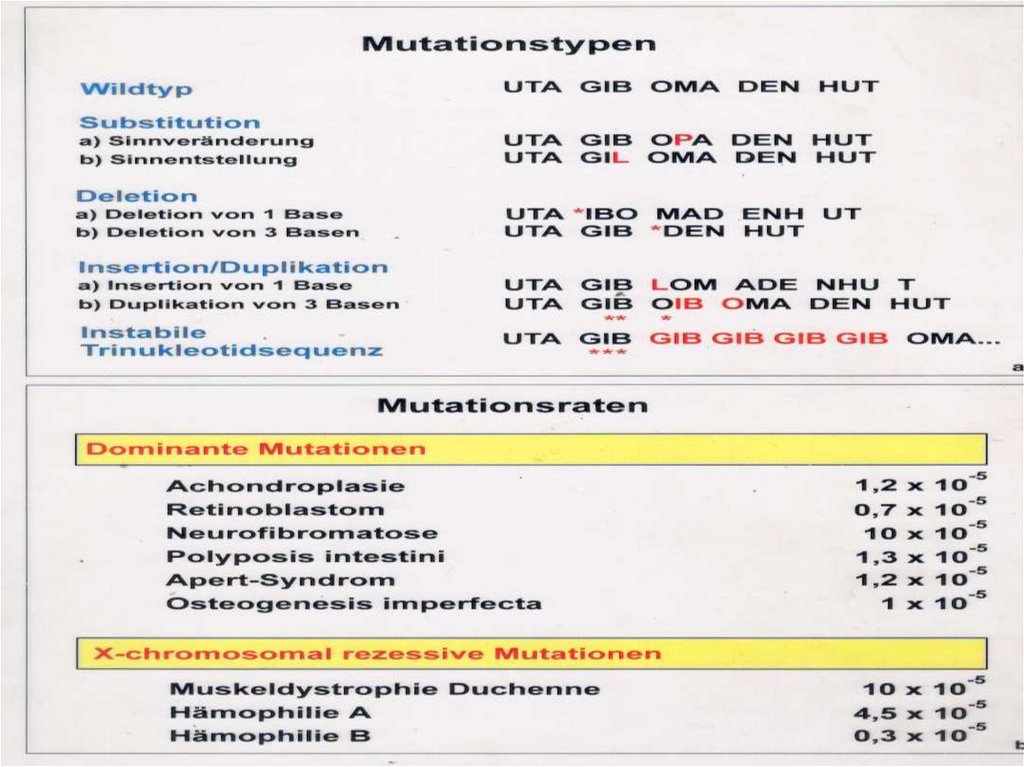
Классификация мутацийМутации
Характеристика
1.Спонтанные
2.Индуцированные
Возникают самопроизвольно, без видимых причин
Возникают при действии известных факторов
1. Геномные
Изменение количества хромосом на уровне генома и отдельных хромосом
Изменение структуры хромосом
Изменение структуры гена (ДНК)
2.Хромосомные
3. Генные
1. Доминантные
2. Рецессивные
Проявляются в гетерозиготном состоянии
Проявляются в гомо- и гемизиготном состоянии
1.Прямые
2.Обратные
Приводят к изменению фенотипа
Восстанавливают первоначальный фенотип
1. Ядерные
2. Цитоплазматические
Возникают в генетическом материале ядра
Возникают в генетическом материале, локализующемся в цитоплазме
1. Генеративные
2. Соматические
Возникают в половых клетках и передаются следующим поколениям
Возникают в соматических клетках организма, не наследуются
1. Гиперморфные
2. Гипоморфные
3. Неоморфные
4. Аморфные
5. Антиморфные
Усиливают действия гена, увеличивают количество белка, синтезируемого данным геном
Ослабляют действие гена, снижают количество белка, синтезируемого данным геном
Мутационный ген синтезирует белок, отличающийся по структуре и функции от
первоначального белка
Инактивируют действие гена, блокируют синтез кодируемого им белка
Действуют противоположно генам дикого типа
47.
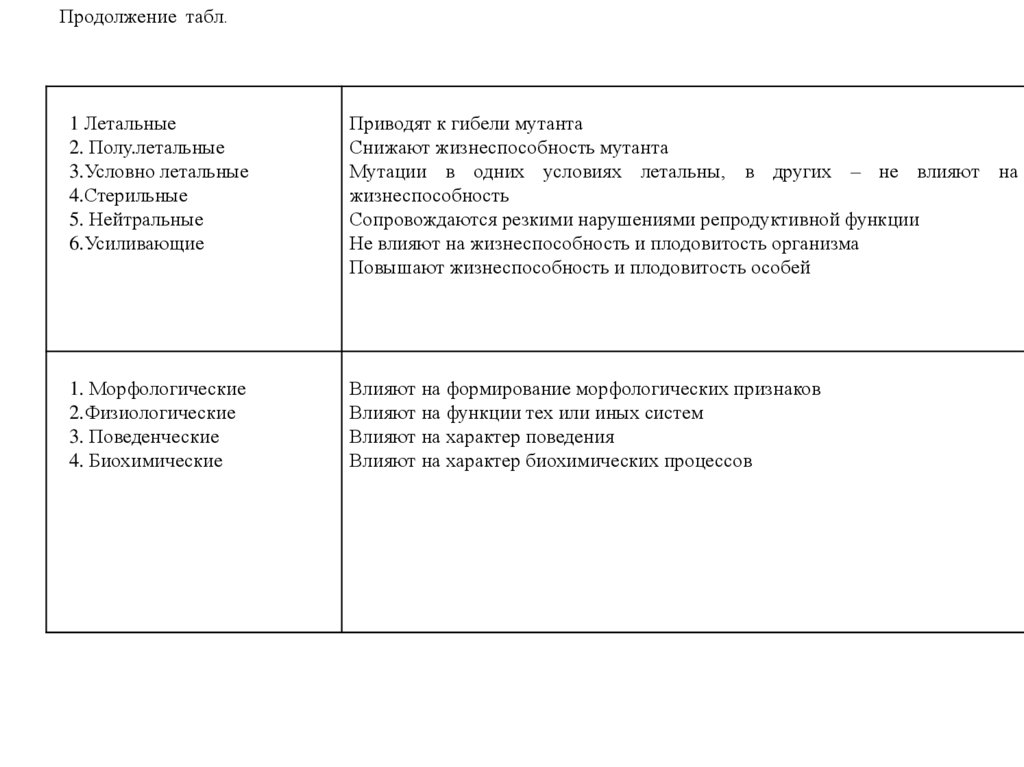
Продолжение табл.1 Летальные
2. Полу.летальные
3.Условно летальные
4.Стерильные
5. Нейтральные
6.Усиливающие
Приводят к гибели мутанта
Снижают жизнеспособность мутанта
Мутации в одних условиях летальны, в других – не влияют на
жизнеспособность
Сопровождаются резкими нарушениями репродуктивной функции
Не влияют на жизнеспособность и плодовитость организма
Повышают жизнеспособность и плодовитость особей
1. Морфологические
2.Физиологические
3. Поведенческие
4. Биохимические
Влияют на формирование морфологических признаков
Влияют на функции тех или иных систем
Влияют на характер поведения
Влияют на характер биохимических процессов
48.
Мутагенный эффект факторов внешней среды у разных биологических объектов.Клетки
человека
Факторы
Микроорганиз
-мы
Рас- Дрозотения фила
In
In
vitro vivo
Млекопитающие
Культура Костклетки
ный
мозг
Доми-нантные
летали
1.ионизирующее
излучение
2. антибиотики
3. цитостатики
4.другие
лекарственные
соединения
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
5.пищевые добавки
6.хемостерилянты
7. фунгициды
8. инсектициды
9. гербициды
10.промышленные
химические вещества
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
49.
Таким образом, под мутациями подразумеваются дискретные,стабильные изменения наследственного материала, приводящие к
изменению фенотипа. Процесс возникновения мутаций называют
мутационным, или мутагенезом (последний термин чаще
употребляют в отношении индуцированных мутаций). Организм,
приобретший какой-либо новый признак и тем самым изменивший
свой фенотип в результате мутации, называют мутантом.
Впервые теорию непрерывно идущего в органическом мире
мутационного процесса, в результате которого от константных
видов «временами отщепляются новые формы», выдвинул СИ.
Коржинский — российский академик, директор ботанического сада
при Петербургском университете. Книга СИ. Коржинского
«Гетерогенезис и эволюция», изданная в России в 1899 г. и
переведенная на немецкий язык в 1901 г., стала известна Г. де
Фризу в процессе его работы над «Мутационной теорией» и
послужила объектом цитирования и обсуждения.
50.
Определение характера и частоты мутаций - тончайшийэкспериментальный прием, широко используемый генетиками
для решения многих фундаментальных проблем. Но особая
важность детального изучения мутационного процесса
обусловлена тем, что именно мутации служат первоосновой
многих наследственных болезней человека. Следовательно,
проблема профилактики наследственной патологии хотя бы
частично может быть решена только при выяснении механизма
становления мутаций.
51.
Мутационные изменения чрезвычайно разнообразны. Они могутзатрагивать практически все морфологические, физиологические
и биохимические признаки организма, могут вызвать резкие или,
наоборот, едва заметные фенотипические отклонения от нормы.
В основе мутационной изменчивости лежат структурные
изменения генов и хромосом. В зависимости от характера
изменений в генетическом материале различают:
1) геномные (генотипические) мутации, заключающиеся в
изменении числа хромосом в клетке.
2) хромосомные перестройки, или аберрации - преобразования
структуры хромосом, основанные на их разрыве;
3) генные (точковые) мутации, представляющие собой вставку,
выпадение, замену или изменение пары нуклеотидов;
4) инсерции - вставки («врезания») молекул ДНК или их
фрагментов в ген, приводящие чаще всего к его инактивации или
к сильному полярному эффекту в оперонах;
52.
Мута́ция(лат. mutatio — изменение) — стойкое (то есть такое,которое
может
быть
унаследовано
потомками
данной клетки или организма) изменение генома. Термин
предложен
Гуго
де
Фризом.
(TheMutationTheory
(немецкоеиздание, 1900—1903), (английскоеиздание, 1910—
1911).SpeciesandVarieties: TheirOriginbyMutation. — 1905.Plant
Breeding — 1907 (немецкий перевод, 1908).
Процесс возникновения мутаций получил
название мутагенеза.
8.5. Причины мутаций
Мутации делятся на спонтанные и индуцированные.
Спонтанные мутации возникают самопроизвольно на
протяжении всей жизни организма в нормальных для него
условиях окружающей среды с частотой около 1091012 на нуклеотид за клеточную генерацию организма.
Индуцированными
мутациями
называют наследуемые
изменения генома, возникающие в результате тех или иных
мутагенных
воздействий
в
искусственных
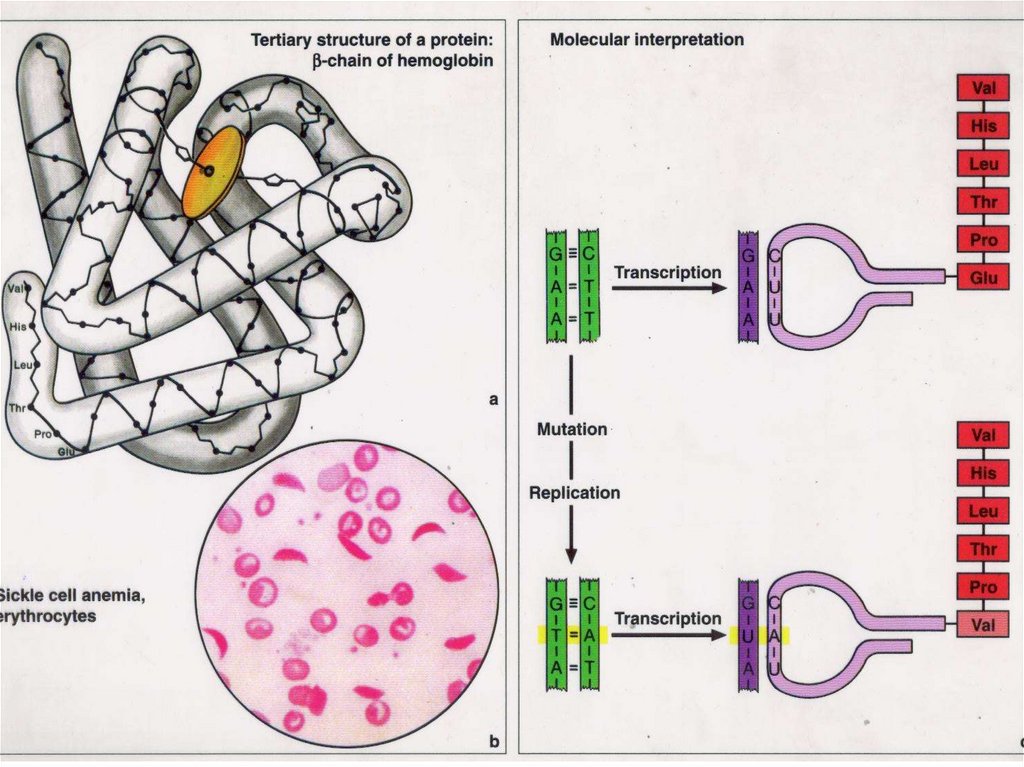
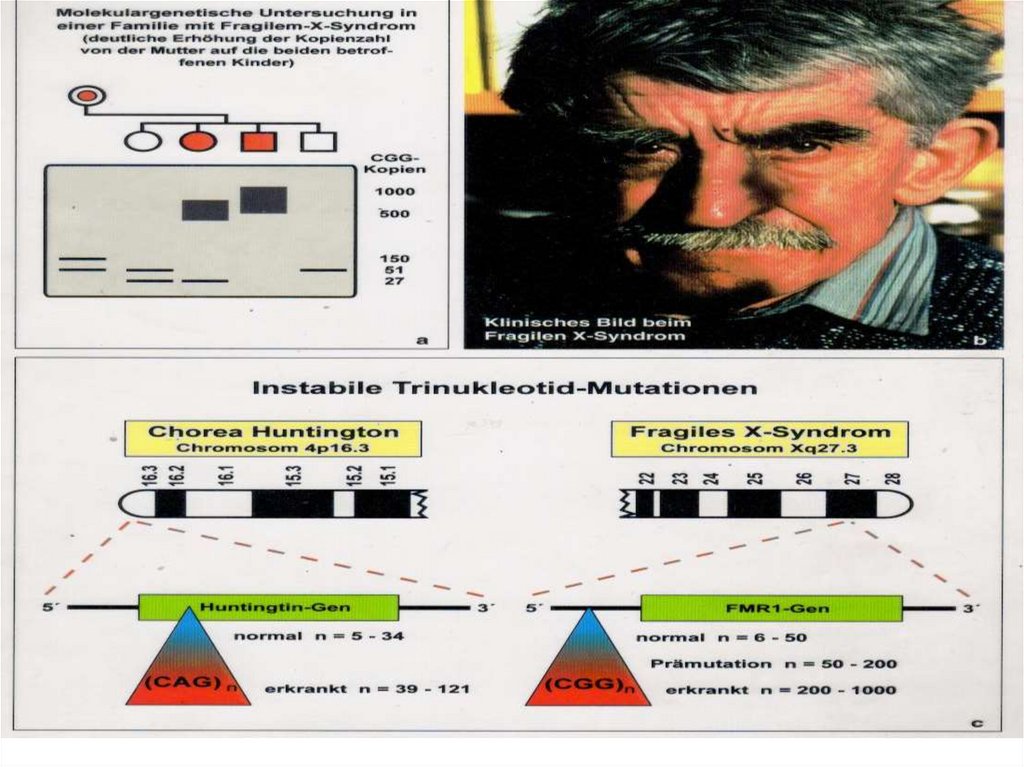
53. Геномы человека и шимпанзе различаются лишь на 1% нуклеотидных последовательностей.
54.
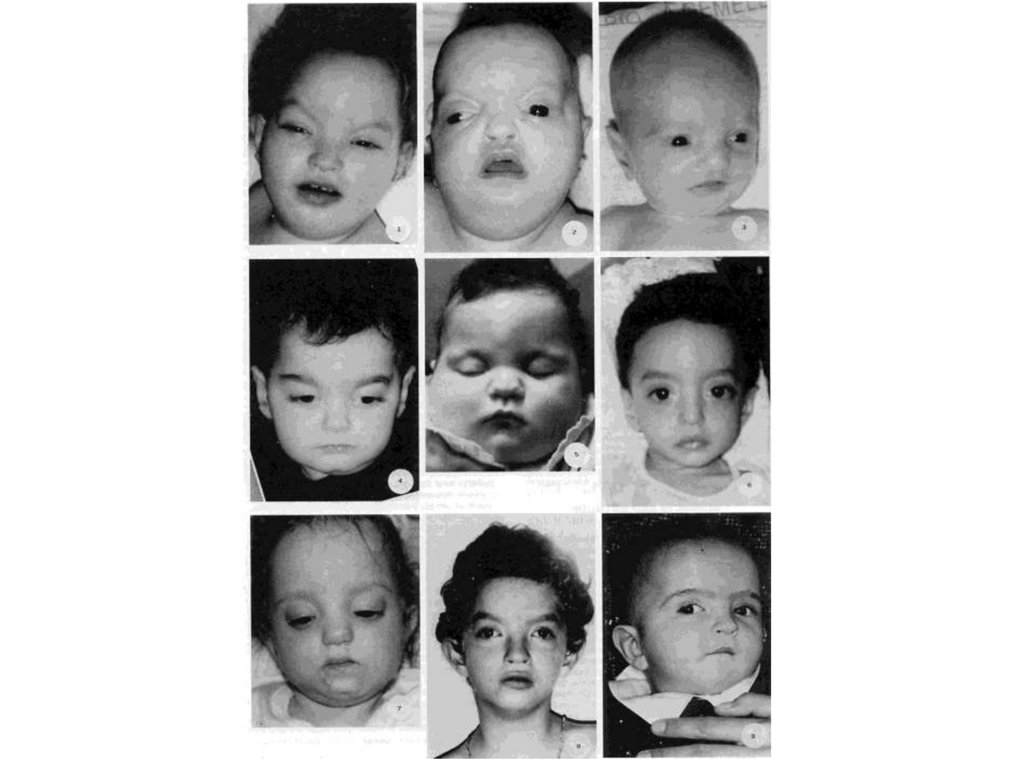
55. Человечество отягощено огромным грузом патологических мутаций
56.
57.
58.
59.
60.
61.
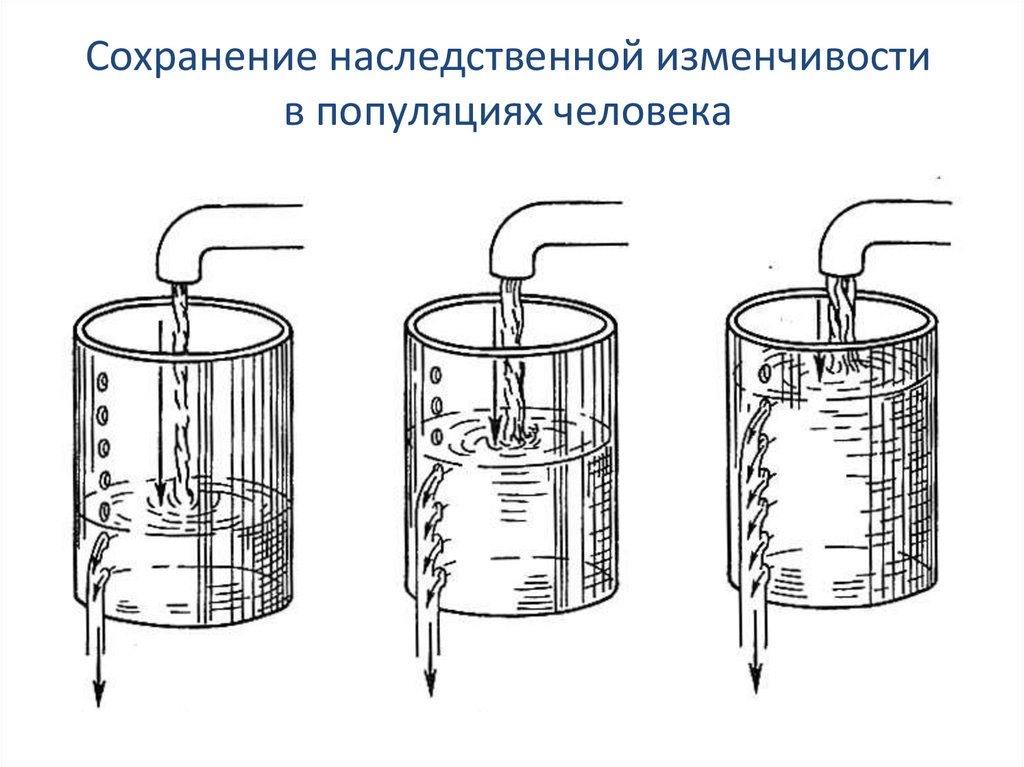
Сохранение наследственной изменчивостив популяциях человека
62.
Джонатан Китс. «Божественная ДНК»63.
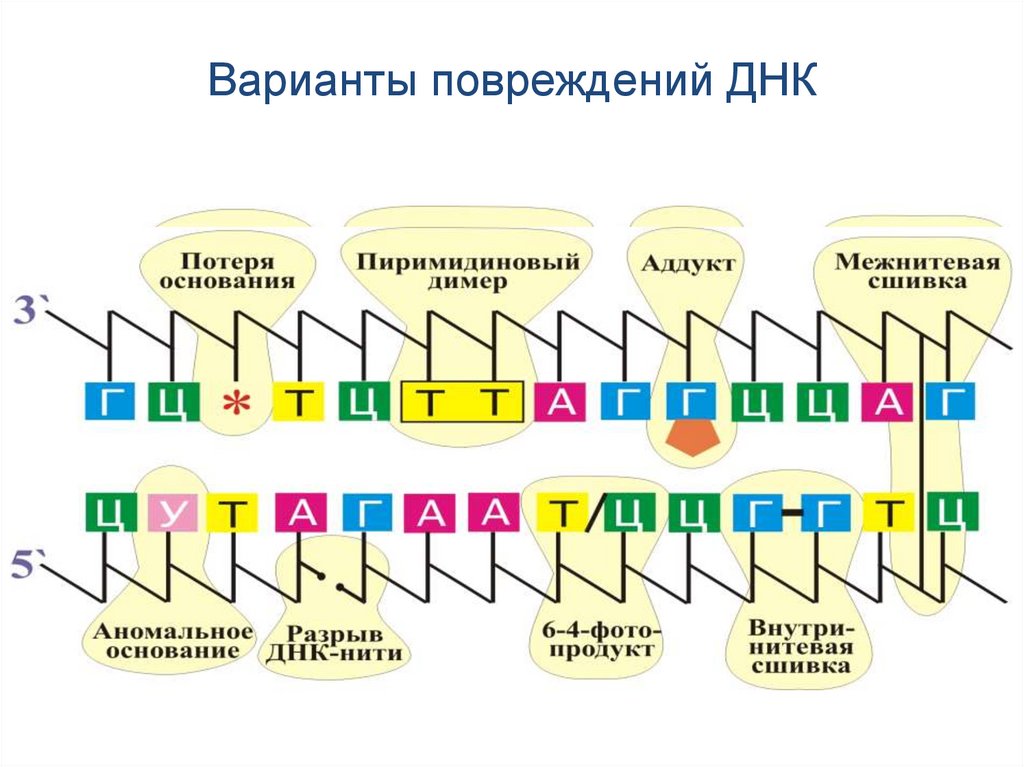
Варианты повреждений ДНК64.
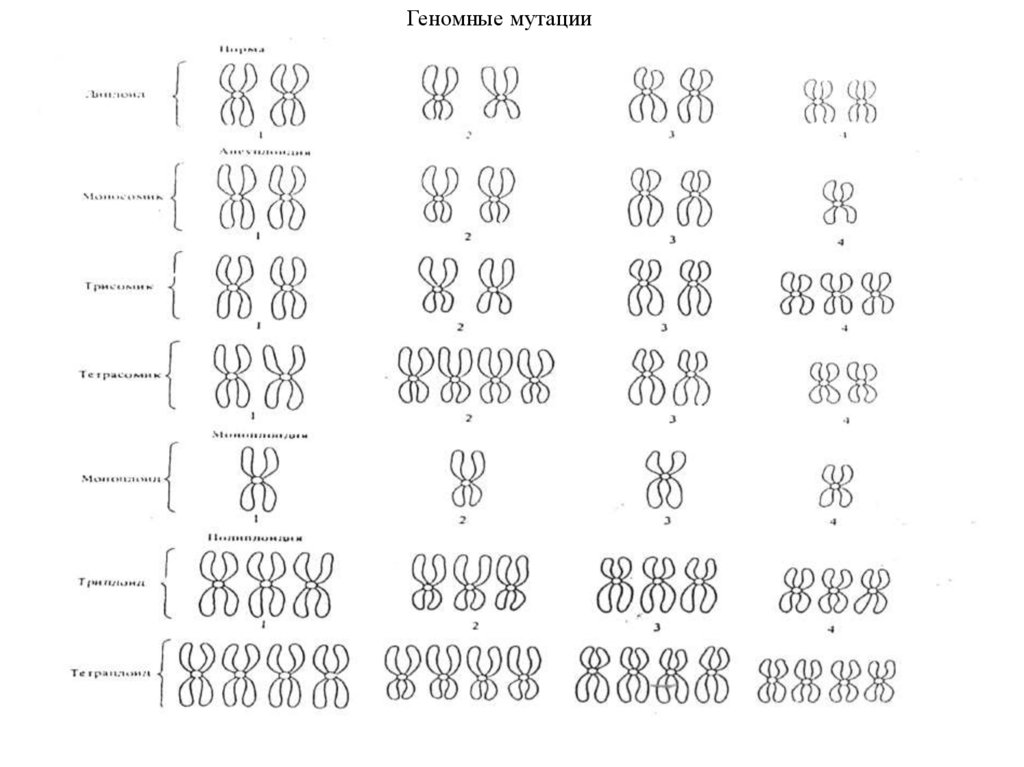
Геномные мутации65.
Типы хромосомных мутаций66.
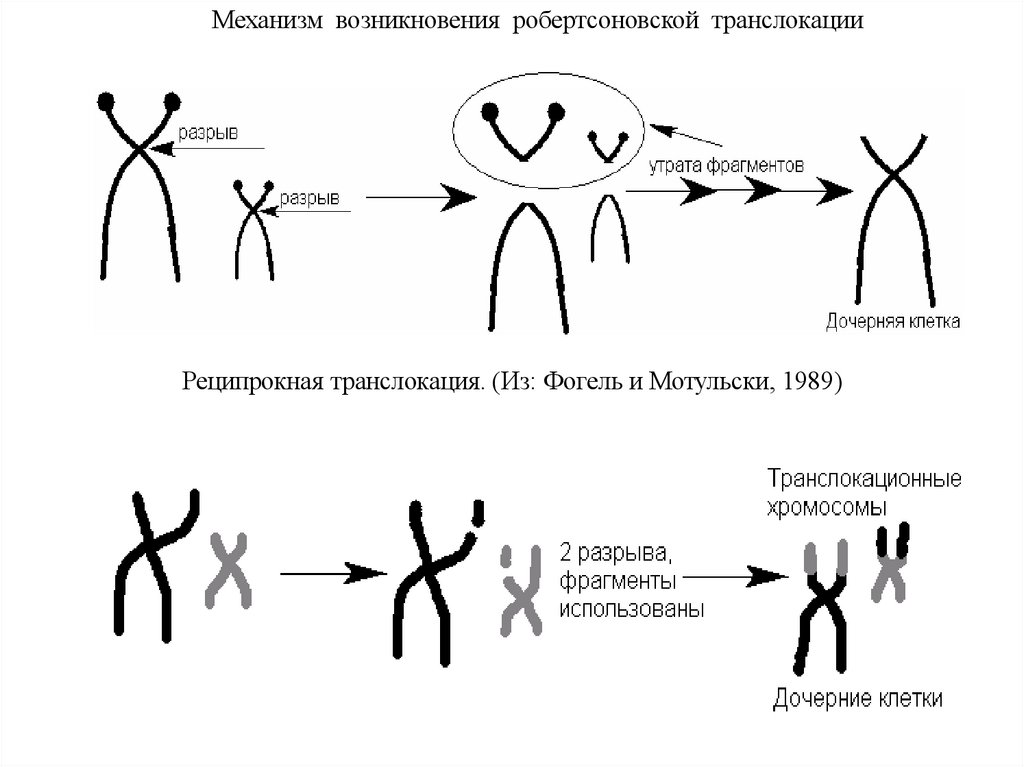
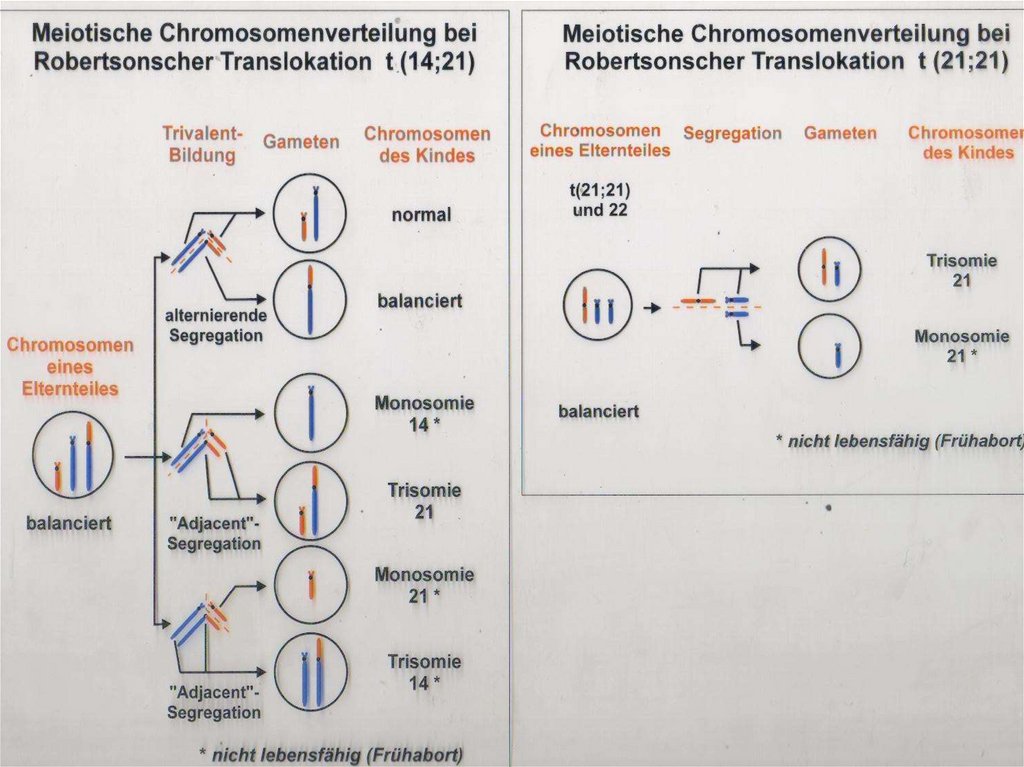
Механизм возникновения робертсоновской транслокацииРеципрокная транслокация. (Из: Фогель и Мотульски, 1989)
67.
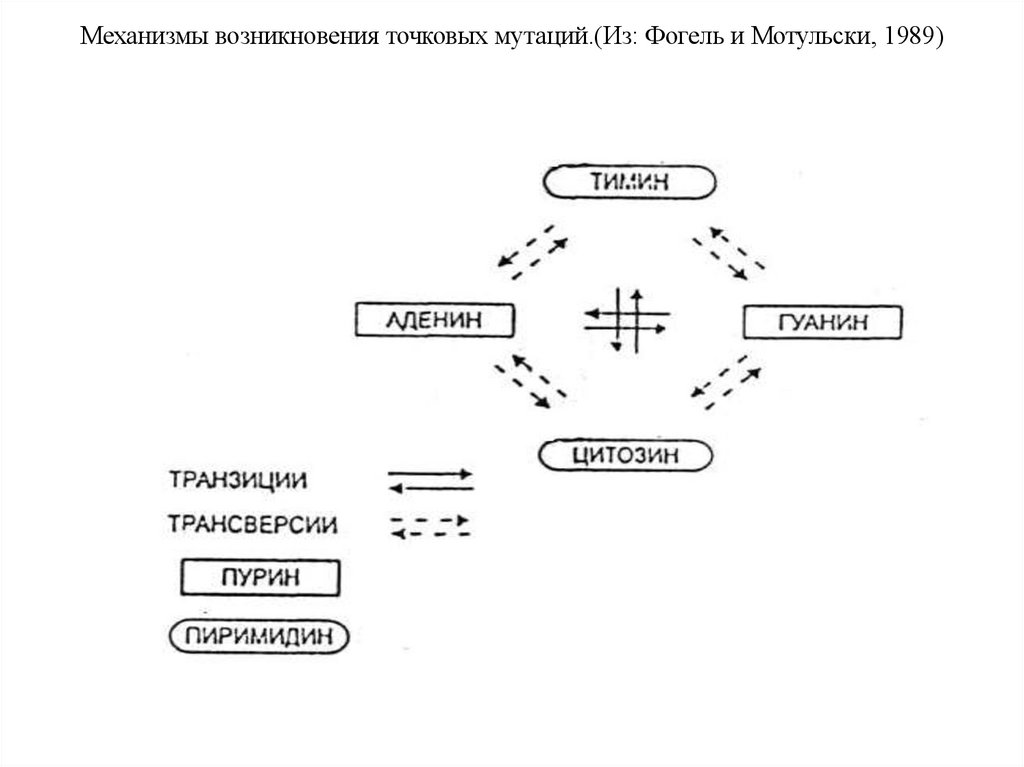
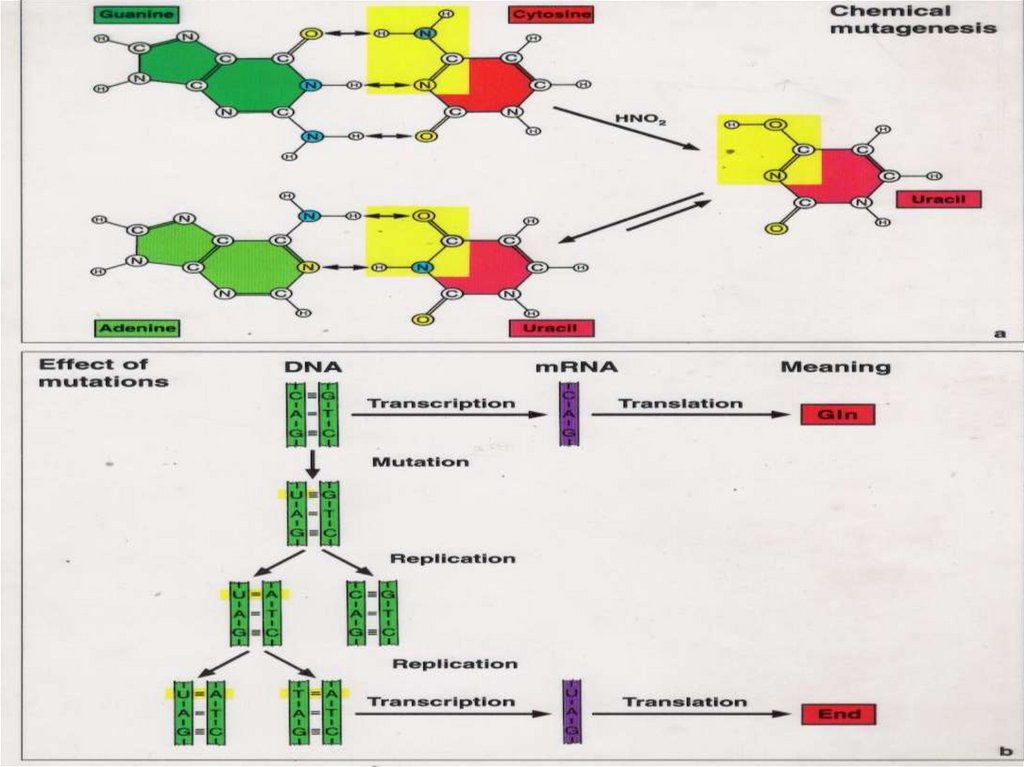
Механизмы возникновения точковых мутаций.(Из: Фогель и Мотульски, 1989)68.
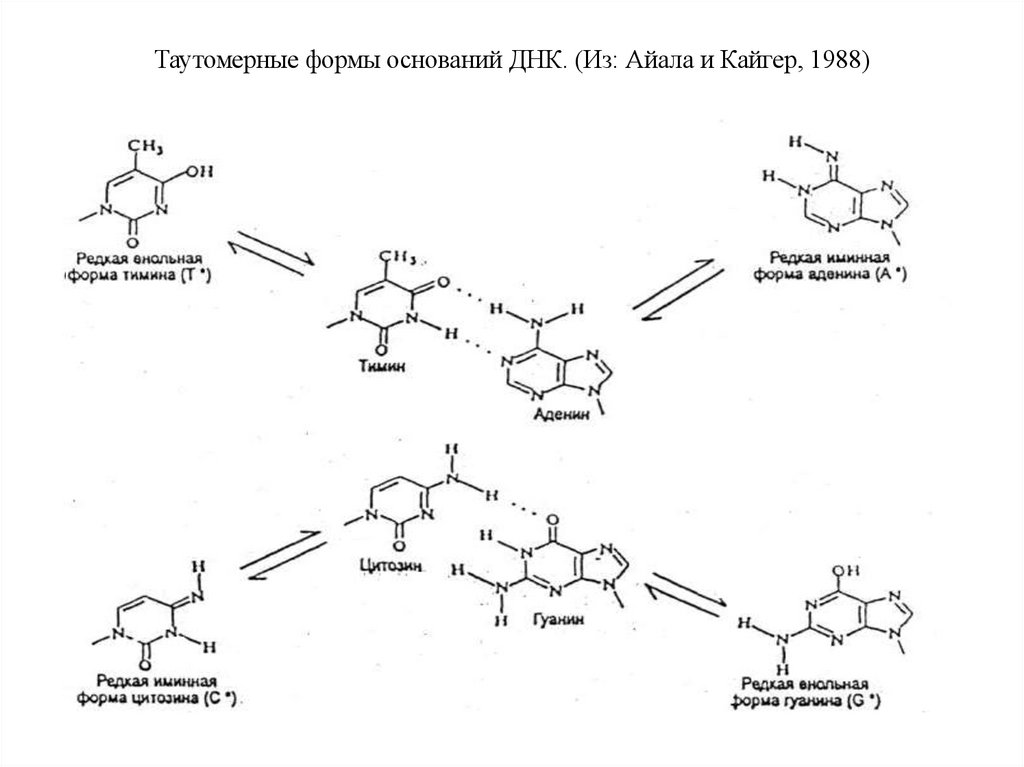
Таутомерные формы оснований ДНК. (Из: Айала и Кайгер, 1988)69.
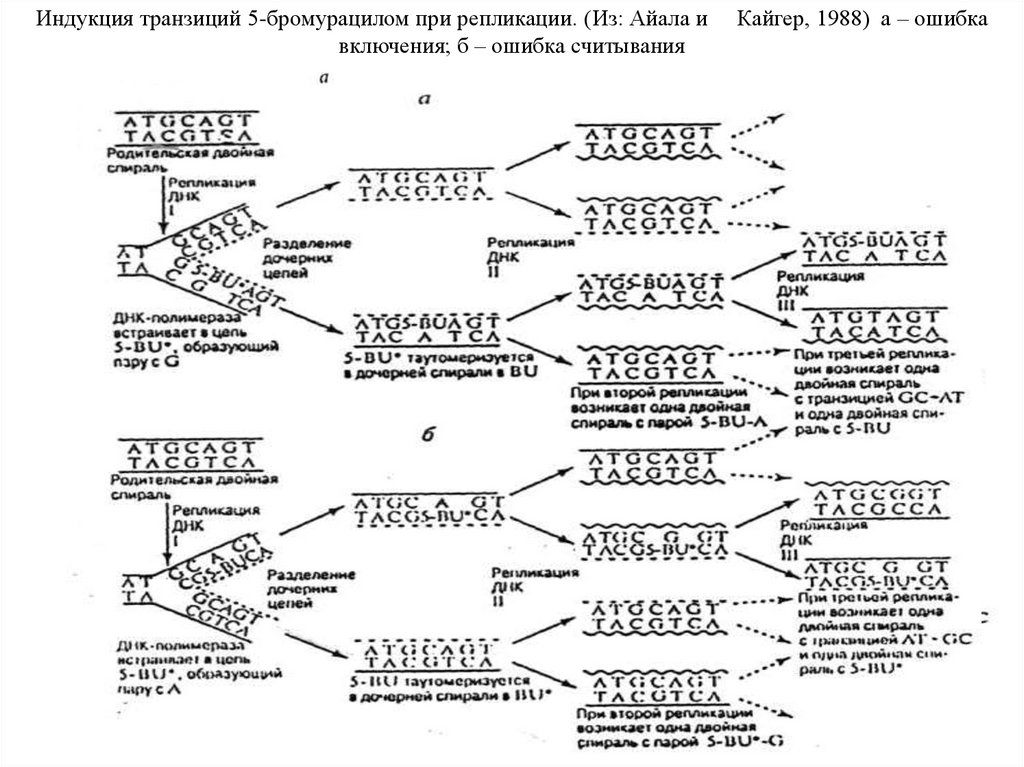
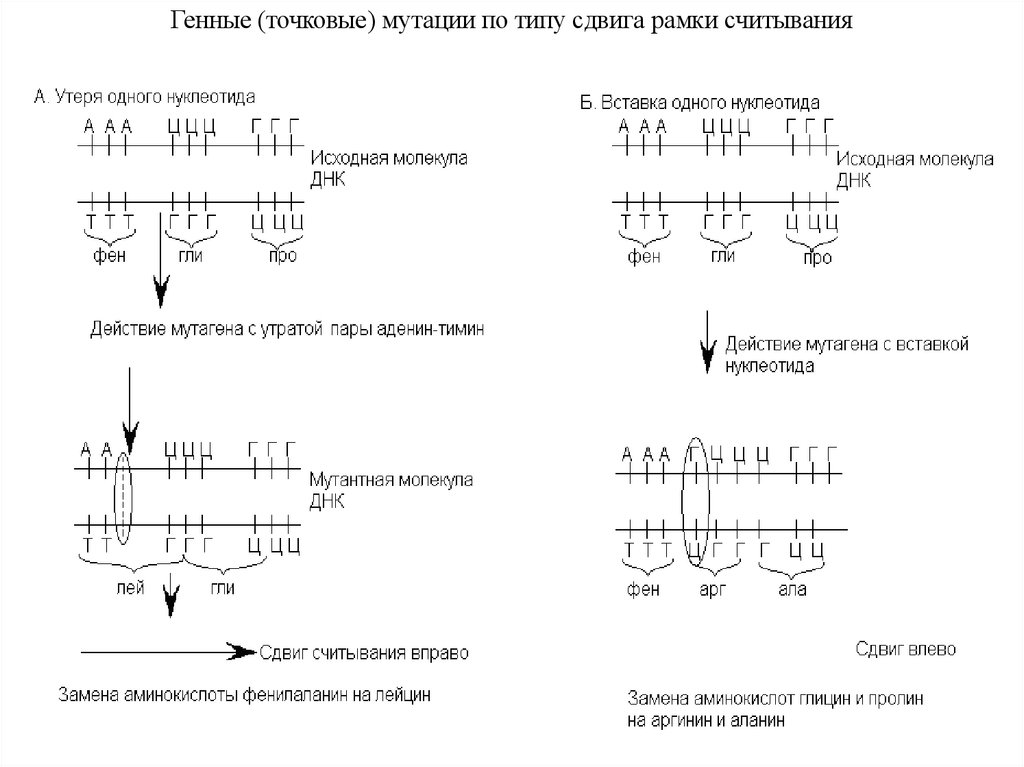
Индукция транзиций 5-бромурацилом при репликации. (Из: Айала ивключения; б – ошибка считывания
Кайгер, 1988) а – ошибка
70.
Генные (точковые) мутации по типу сдвига рамки считывания71.
Принципы и результаты идентификации точковых мутаций различными методами( По: В. Н. Горбунова, В. С. Баранов, 1997)а – SSCP-анализ; б – НА-метод; в – DGGE-метод;
г - СМС-метод. Дорожка 1 – образец ДНК нормальной гомозиготы; дорожка 2 – образец ДНК
гетерозиготы по точковой мутации; дорожка 3 – образец ДНК гомозиготы по точковой мутации.
72.
CMC (Chemical Mismatch Cleavage) -метод химическогорасщепления не комплементарных сайтов – основан на
способности некоторых химических агентов специфически
разрывать нить ДНК в месте локализации неспаренного
основания.
Так,
цитозин
чувствителен
к
действию
гидроксиламина, а тимин – к действию осмия тетраоксида.
Некоторые модификации метода используют чувствительность
тимина и гуанина к карбодиимиду. Последующая обработка
пиперидином приводит к полному разрыву молекулы ДНК в
модифицированном сайте. Выявление мутаций осуществляют с
помощью с помощью меченых ДНК-зондов, соответствующих,
как правило, нормальным вариантам последовательности ДНК.
Такими зондами могут быть синтезированные олигонуклеотиды,
клонированные
последовательности
ДНК
или
ее
амплифицированные фрагменты. При проведении исследования
эталонную меченую ДНК смешивают с избытком тестируемой
ДНК (или РНК).
73.
Тестируемыми образцами ДНК могут служить клонированныеДНК, обработанные соответствующими эндонуклеазами, либо
амплифицированные фрагменты. Смесь нагревают до полной
денатурации двухнитевых молекул и затем охлаждают, чтобы
создать условия для образования дуплексов. При наличии
мутаций в тестируемых образцах ДНК в гетеродуплексах,
возникших в результате гибридизации между однонитевыми
молекулами эталонной и тестируемой ДНК, образуются места
негомологичного
спаривания.
После
обработки
соответствующими химическими агентами идентификация и
локализация мутантных сайтов в исследуемых участках ДНК
проводится путем электрофореза и радиоавтографии. Появление
укороченных фрагментов ДНК на электрофореграмме ( а точнее –
необычных бэндов в нижней части геля) свидетельствует о
наличии мутантного сайта, а определение размера укороченных
фрагментов однозначно определяет локализацию этого сайта в
исходной тестируемой молекуле ДНК.
74.
Преимуществами метода являются: возможность исследоватьпротяженные участки ДНК – до 2 тыс. п.о; способность
одновременно выявить и локализовать несколько мутаций в
одном
фрагменте
ДНК;
возможность
одновременно
использовать несколько ДНК-зондов для поиска мутаций –
мультиплексный вариант методики.
К недостаткам можно отнести
высокую токсичность
используемых химических реактивов, которая может быть
ослаблена использованием карбодиимида для идентификации
GT – гетеродуплексов.
ПДРФ -анализ,
Асимметричная ПЦР,
GAWT – ПЦР проводят в присутствии праймеров, несущих
сайт узнавания для фермента Т7-РНК-полимеразы. После
амплификации в системе in vitro проводят транскрипцию
амплификата
с
помощью
Т7
РНК-полимеразы,
и
образовавшуюся
одноцепочечную РНК используют для
секвенирования – метод GAWT (genome amplification with
75.
Метод лигирования «по соседству», метод близкоголигирования
(pro-ximity
ligation
assay,
PLA
высокочувствительный метод анализа взаимодействия белков
(обычно факторов транскрипции) с ДНК. Основанный на
лигировании двух олигонуклеотидов, один из которых
содержит нуклеотидную последовательность-мишень, а
другой связан с антителами к белку. Когда происходит
взаимодействие белок-ДНК, олигонуклеотид коннектор
соединяет
эти два олигонуклеотида, а ДНК-лигаза
осуществляет их лигирование. Наличие лигированных
олигонуклеотидов определяется с помощью ПЦР в режиме
настоящего времени, количественная ПЦР. Метод предложен С
Густавсдоттиром с соавт в 2007 г. И много др методов. см гл 11
учебник Джайнакбаев Н.Т., Ермекова С.А.2021 г. С205-227.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87. Литература:
1. Генетика. Под ред. Иванова В.И. М., 2006.2. Геномика – медицине. Под ред. Иванова В.И. М., 2005.
3. Жимулев И.Ф. Общая и молекулярная генетика. Новосибирск, 2006.
4. Бочков Н.П. Клиническая генетика. М., 2006.
5. Фогель Ф., Мотульски А. Генетика человека. М., 1990.
6. Льюин Б. Гены. М., 1987.
7. Муминов Т.А., Куандыков Е.У. Основы молекулярной биологии (курс
лекций). Алматы, 2007.
8. http://www.nsu.ru/education/biology/molbiol/Lecture6/Lec61.htm
9. http://www.vigg.ru/humangenome/publicat/borinsk1.html
10. http://t0syara.narod.ru/06-06.html
11. http://molgenet.narod.ru/impobzor.htm
12. http://vivovoco.rsl.ru/VV/JOURNAL/VRAN/DNA/DNA.
HTMhttp://vivovoco. rsl.ru/VV/JOURNAL/VRAN/DNA/DNA.HTM
13. http://www.informika.ru/text/database/biology/data/biology6.html
88. Контрольные вопросы (обратная связь):
1. Механизмы возникновения рекомбинативнойизменчивости.
2. Причины возникновения мутаций (мутагенные
факторы).
3. Геномные мутации.
4. Хромосомные мутации.
5. Генные (точковые) мутации.
89. Лекция № 13
Тема: Репарация ДНК90. План лекции:
1. Репарация, определение, типы.2. Световая репарация (фотореактивация).
3. Темновая (эксцизионная) репарация.
4. Пострепликативная репарация.
5. SOS – репарация.
91.
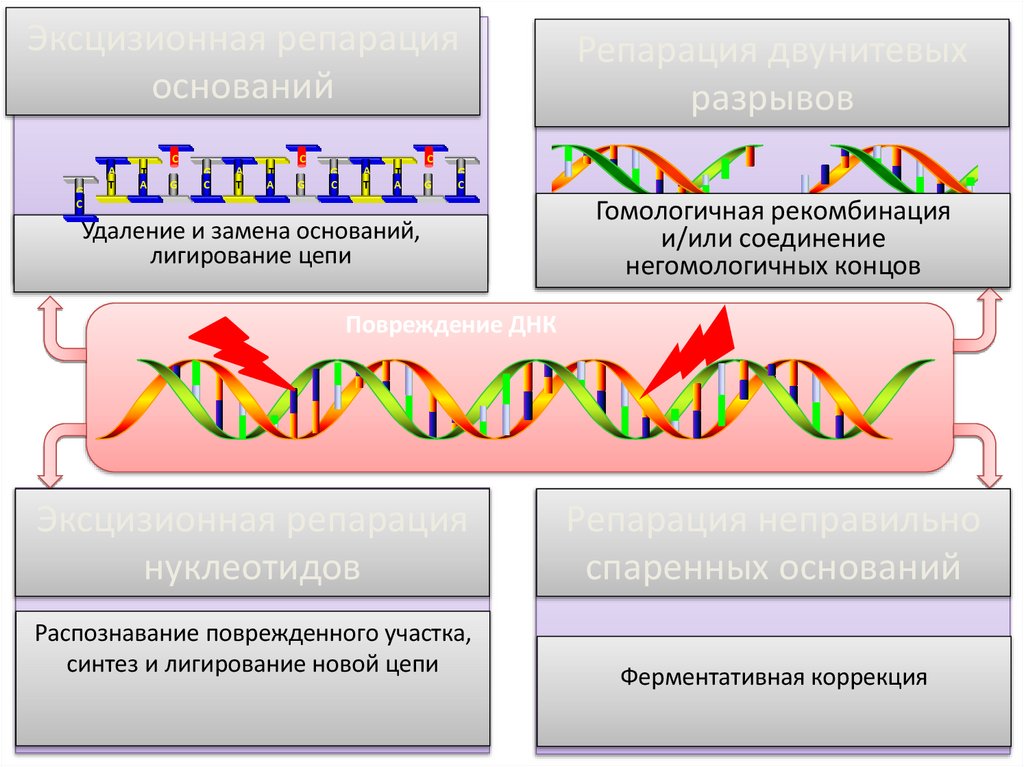
Эксцизионная репарацияоснований
C
G
C
A
T
T
A
G
C
G
C
A
T
T
A
G
Репарация двунитевых
разрывов
C
G
C
A
T
T
A
G
G
C
Удаление и замена оснований,
лигирование цепи
Гомологичная рекомбинация
и/или соединение
негомологичных концов
Повреждение ДНК
Эксцизионная репарация
нуклеотидов
Распознавание поврежденного участка,
синтез и лигирование новой цепи
Репарация неправильно
спаренных оснований
Ферментативная коррекция
92.
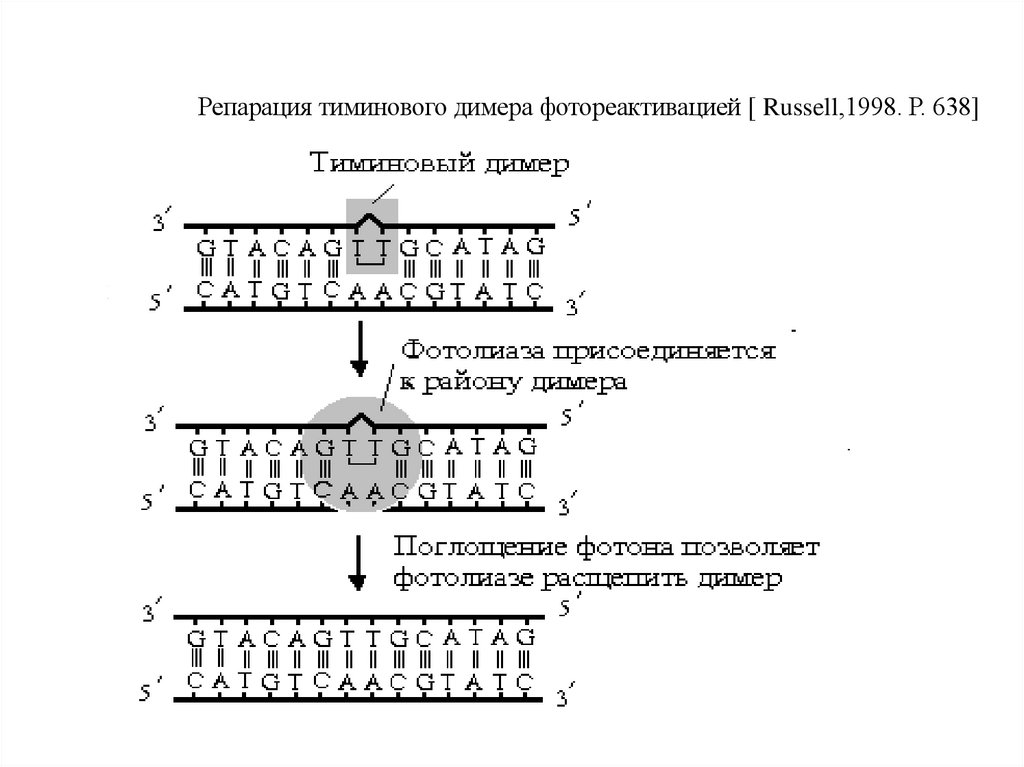
Схематически световая репарация(обнаружена А. Кельнером)выглядит следующим образом:
1. Нормальная молекула ДНК
↓
Облучение УФ-светом
↓
2. Мутантная молекула ДНК – образование пиримидиновых
димеров.
↓
Действие видимого света
↓
3. Синтез фермента фотолиазы
↓
4. Расщепление димеров пиримидиновых оснований
↓
5. Восстановление нормальной структуры ДНК
93.
Репарация тиминового димера фотореактивацией [ Russell,1998. Р. 638]94.
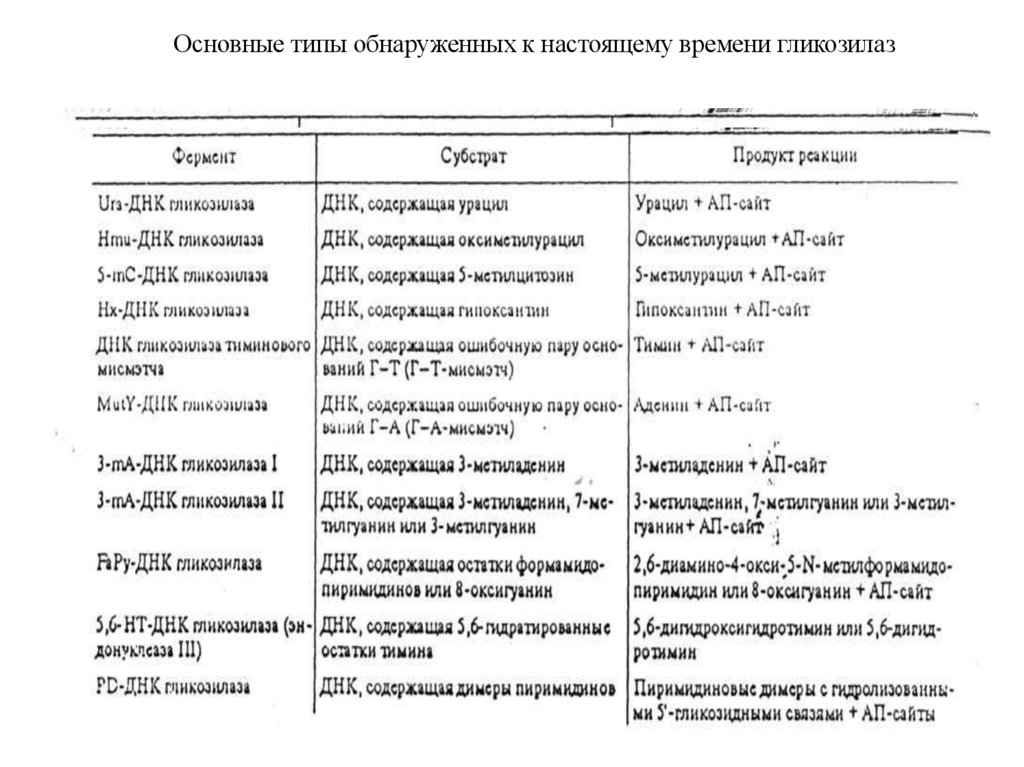
Основные типы обнаруженных к настоящему времени гликозилаз95.
Модель репарации гликозилазами [ Lehmann, Р. 147]96.
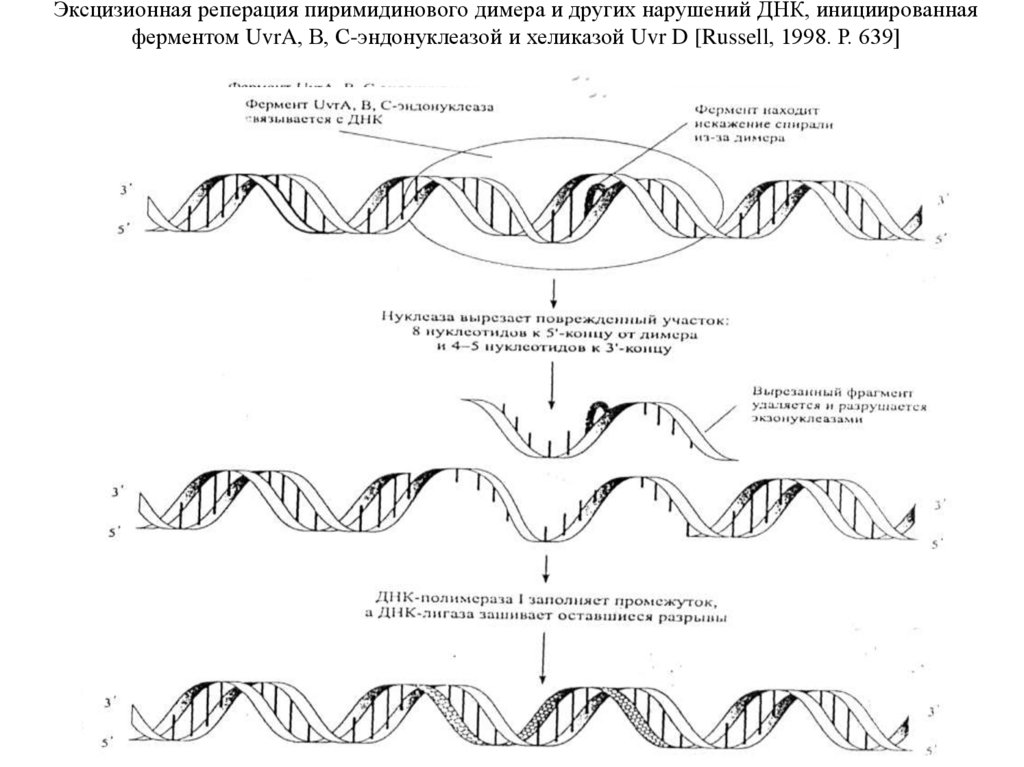
Эксцизионная реперация пиримидинового димера и других нарушений ДНК, инициированнаяферментом UvrA, В, С-эндонуклеазой и хеликазой Uvr D [Russell, 1998. Р. 639]
97.
У. Рап и П. Ховард-Фландерс в 1968г обнаружилинарушения механизмов световой и темновой репарации
после облучения УФ-светом, связанной с мутациями генов,
ответственных за синтез эксинуклеаз, а также проведения
экспериментов в темноте. С помощью пострепликативной
репарации клетки восстанавливали структуру и функции
поврежденной ДНК. В процессе пострепликативной
репарации синтезируется белок uvr A, который соединяется
с нормальной цепью ДНК и вырезает из нее фрагмент,
равный по длине бреши, и встраивает его в брешь. Цепь
сшивается лигазой. Дочерняя молекула восстанавливает
нормальную
структуру.
Вырезанный
участок
из
материнской нити застраивается ДНК-полимеразой I. А
поврежденная
исходная
материнская
цепь
не
восстанавливается.
98.
Пострепликативная репарация ДНК [ Сойфер, 1997].99.
Механизм мисмэтч-системы репарации [Russel,1998. Р. 641]100.
Алкилирующие соединения могут добавлять к пуриновыми пиримидиновым основаниям алкильные боковые группы
(метиловые,
этиловые,
пропиловый,
бутиловые)
Репарация О6 –метилгуанинов - отщепление метильной
группы с помощью метилтрансферазы приводит к
прямому восстановлению структуры ДНК, но для
репарации каждого алкильного основания необходима
новая молекула фермента метилтрансферазы.
Репарация АП-сайтов может происходить с помощью
инсертазы, которая встраивает в брешь то же самое
основание
эксцизионная
репарация оснований
Эксцизионная репарация нуклеотидов может встраивать
нуклеотиды или отрезки ДНК в месте повреждения, а
Репарация одонитевых разрывов происходит с помощью
полинуклеотидлигазы
101.
Индуцируемая УФ – светом SOS – репарация [Сойфер, 1997]102.
Системы репарации ДНК у различных организмов.Организмы
Тип репарации
Фотореактивация
Репарация О6 -гуанинов
Эксцизионная репарация
оснований
Эксцизионная репарация
нуклеотидов
Мисмэтч- репарация
Пострепликативная
репарация
SOS - репарация
бактер растен насеком животн
ии
ия
ые
ые
человек
+
+
+
+
+
+
+
+
+
+
+
+
+
?
+
+
+
+
+
+
+
+
?
+
?
?
+
+
+
+
+
?
?
+
+
103.
104.
105.
106.
107. Литература:
1. Генетика. Под ред. Иванова В.И. М., 2006.2. Жимулев И.Ф. Общая и молекулярная генетика.
Новосибирск, 2007.
3. Муминов Т.А., Куандыков Е.У. Основы
молекулярной биологии (курс лекций). Алматы, 2007.
4. Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная
биология. М., 2003.
5. Ермекова С.А. Молекулярная биология. Алматы., 2017.
108. Контрольные вопросы (обратная связь):
1. Репарация, определение, типы.2. Механизмы световой репарации.
3. Механизмы эксцизионной репарации.
4. Пострепликативная репарация.
5. SOS – репарация.


























































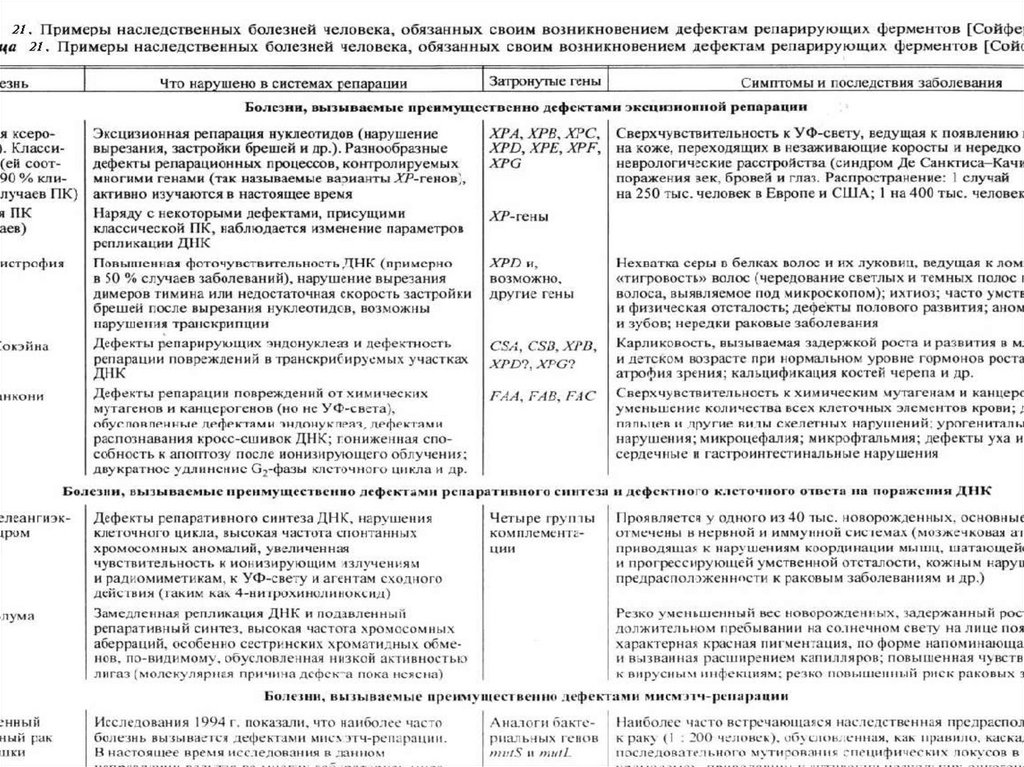
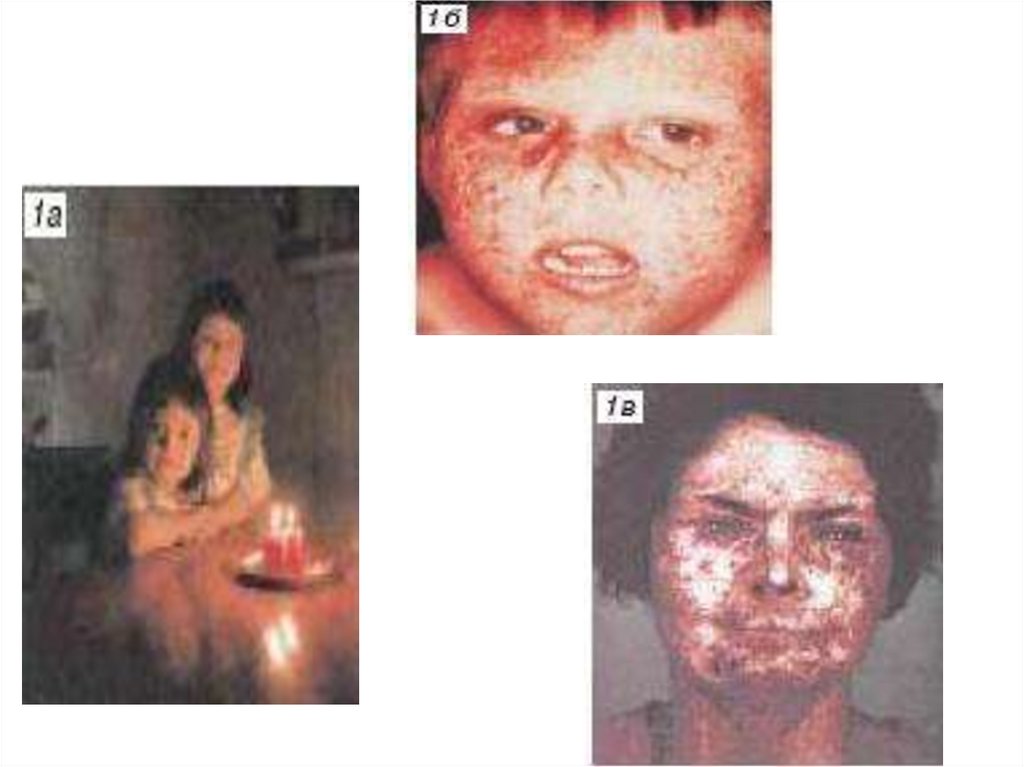
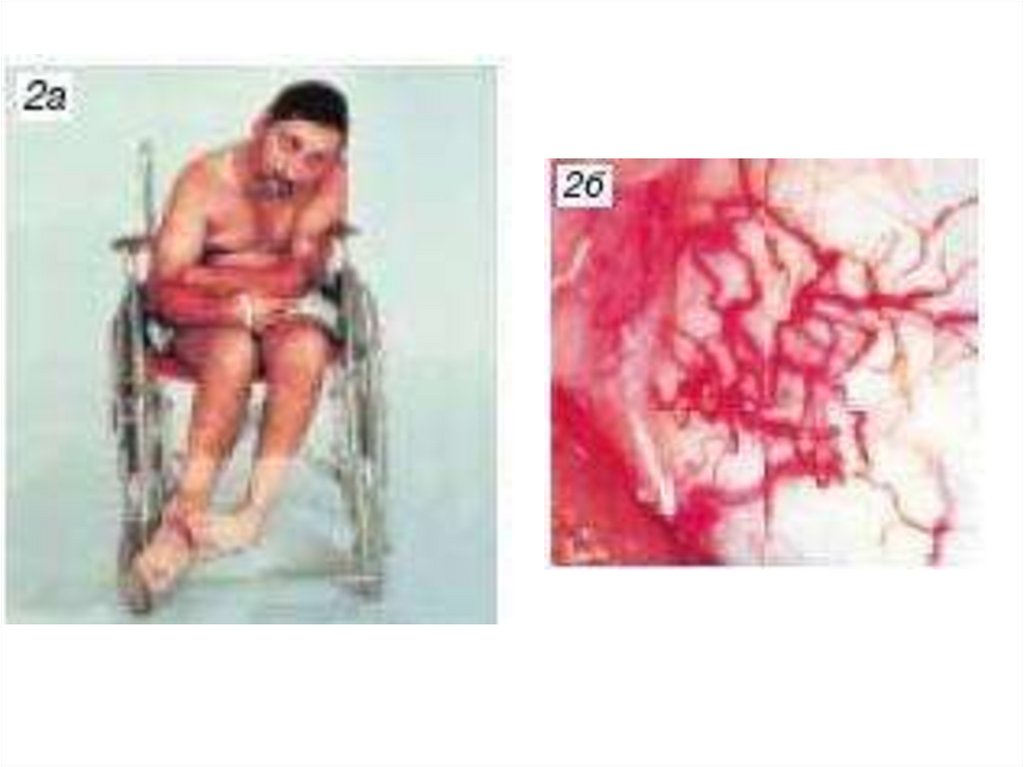
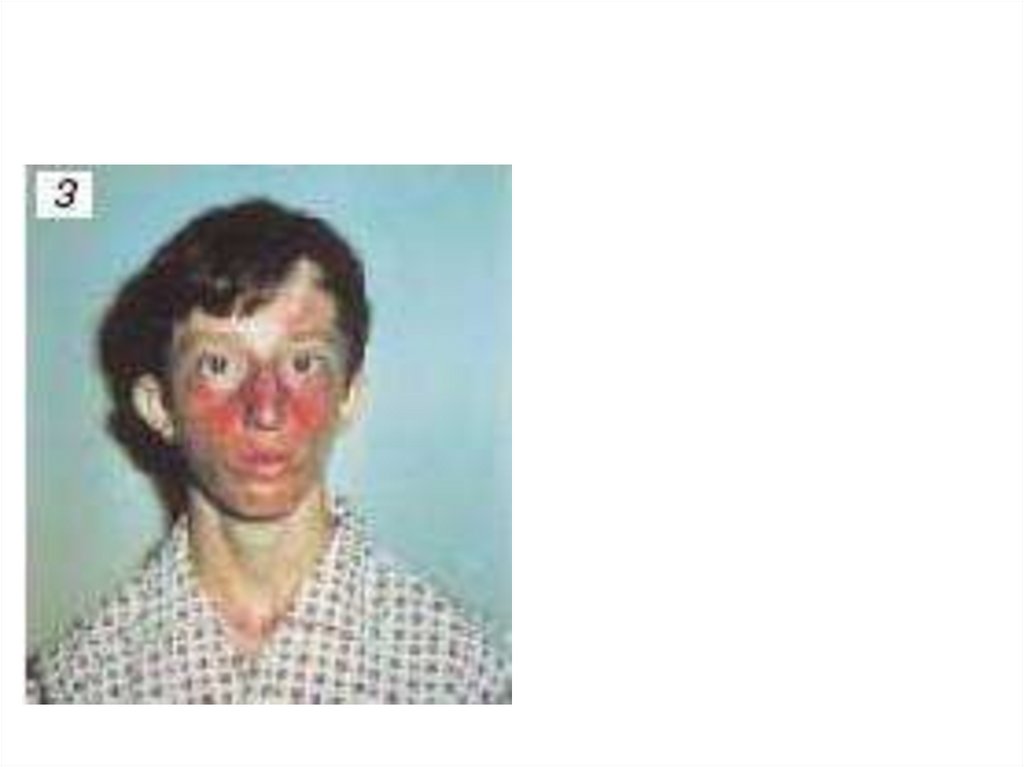


 biology
biology








