Similar presentations:
Тема_19_Хлороводород_Соляная_кислота_
1. ХИМИЯ
Хлороводород. Соляная кислота, химическиесвойства, получение, применение.
2.
Физические свойства хлороводорода- Бесцветный газ с резким запахом.
- Растворимость в воде по объему (500:1)
- «дымит» на влажном воздухе.
Строение молекулы
H – Cl
Сравнение молекулы HCl с молекулами других галогено-водородов
H – F H-Cl H – Br H - I
3.
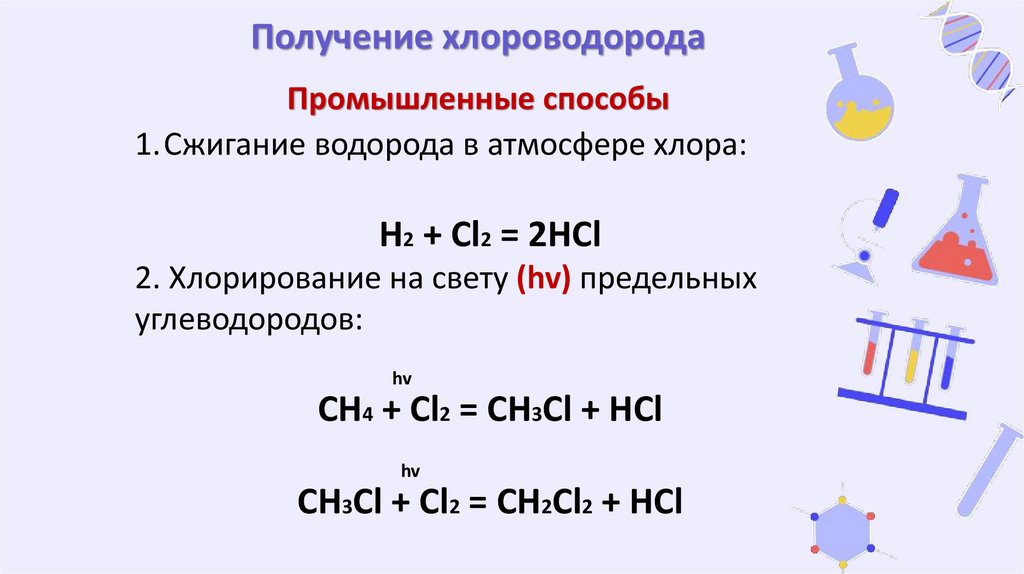
Получение хлороводородаПромышленные способы
1.Сжигание водорода в атмосфере хлора:
H2 + Cl2 = 2HCl
2. Хлорирование на свету (hv) предельных
углеводородов:
hv
CH4 + Cl2 = CH3Cl + HCl
hv
CH3Cl + Cl2 = CH2Cl2 + HCl
4.
Получение хлороводородаЛабораторные способы
1.Получение из солей соляной кислоты (хлолридов):
t
NaCl + H2SO4(конц) = NaHSO4 + HCl
t›530°C
NaCl + NaHSO4 = Na2SO4 + HCl
2. Гидролиз хлоридов неметаллов:
SiCl4 + 3H2O = H2SiO3 + 4HCl
5.
Химические свойства HCl1. Сильная кислота:
+
-
HCl + H2O = H3O + Cl +
упрощенно: HCl = H + Cl
2. Взаимодействие с металлами:
Fe + 2HCl = FeCl2 + H2
3. Взаимодействие с основными и амфотерными
оксидами:
FeO + 2HCl = FeCl2 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
6.
4. Взаимодействие с основаниями:Fe(OH)3 + 3HCl = FeCl3 + 3H2O
5. Взаимодействие с солями:
Na2S + 2HCl = 2NaCl + H2S
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
7.
Хлориды металловСоли соляной кислоты
NaCl, CuCl2, FeCl3, AlCl3 и др.
1. HCl и хлориды окисляются сильными окислителями:
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
5KCl + KClO3 + 3H2CO4 = 3K2SO4 + CL2 + 3H2O
2. Качественная реакция на HCl и хлориды:
HCl + AgNO3 = AgCl + HNO3
NaCl + AgNO3 = AgCl + NaNO3
AgCl – белый творожистый осадок.
+
-
Ag + Cl = AgCl







 chemistry
chemistry








