Similar presentations:
ифт он үш
1.
«Дәрілер технологиясы және фармакогнозия» кафедрасыGMP талаптары және негізгі
ережелері
Орындаған: Медетбек Д.Д.
Қабылдаған: Нурбаева С.Е.
Тобы: ФҚҚ-01-24
2.
Жоспары:I. Кіріспе
• GMP қайдан шықты, не үшін керек
II. Негізгі бөлім
Қауіпсіздік, тиімділік, сапа – үш негізгі тірек
Құжаттама, персонал, ғимарат, валидация, сапа жүйесі
Гигиена, тренинг, жауапкершілік бөлінуі
Асептика, ауа айналымы, калибрлеу
III. Қорытынды
Пайдаланылған әдебиеттер
3.
Кіріспе•GMP – Good Manufacturing Practice,
“Дұрыс өндіру тәжірибесі”
•Фармацевтикалық өнімнің сапасын
қамтамасыз етуге бағытталған стандарттар
жиынтығы
•Халықаралық деңгейде міндетті талап
• Дәрілік заттардың қауіпсіздігін
қамтамасыз ету
• Өндіріс процесінің бірізділігін
сақтау
• Адам денсаулығын қорғау
• Қателіктерді алдын алу
4.
GMP-ның жалпыталаптары
5.
GMP негізгі принциптері• Құжаттаманың толықтығы
• Персоналдың біліктілігі
• Өндіріс бөлмелерінің талапқа сай
болуы
• Жабдықтардың дұрыс қызмет етуі
• Тұрақты бақылау және валидация
Персоналға қойылатын талаптар
• Арнайы даярлық
• Гигиена ережелерін сақтау
• Жауапкершілік айқын бөлінуі
• Тұрақты оқыту және аттестация
Құжаттама талаптары
• SOP – стандартты операциялық процедуралар
• Жазбалардың толықтығы
• Өндіріс журналдары
• Қателерді тіркеу мен түзету
6.
Өндірістік аймақтар• Таза аймақтар
• Асептикалық өндіріс
• Аймақтар бойынша айырымдылық
• Ауа тазалығы мен қысымның бақылануы
Жабдықтар мен бақылау
• Жабдықтарды валидациялау
• Калибрлеу, квалификация
• Техникалық қызмет көрсету
• Жабдықтың журналдары
7.
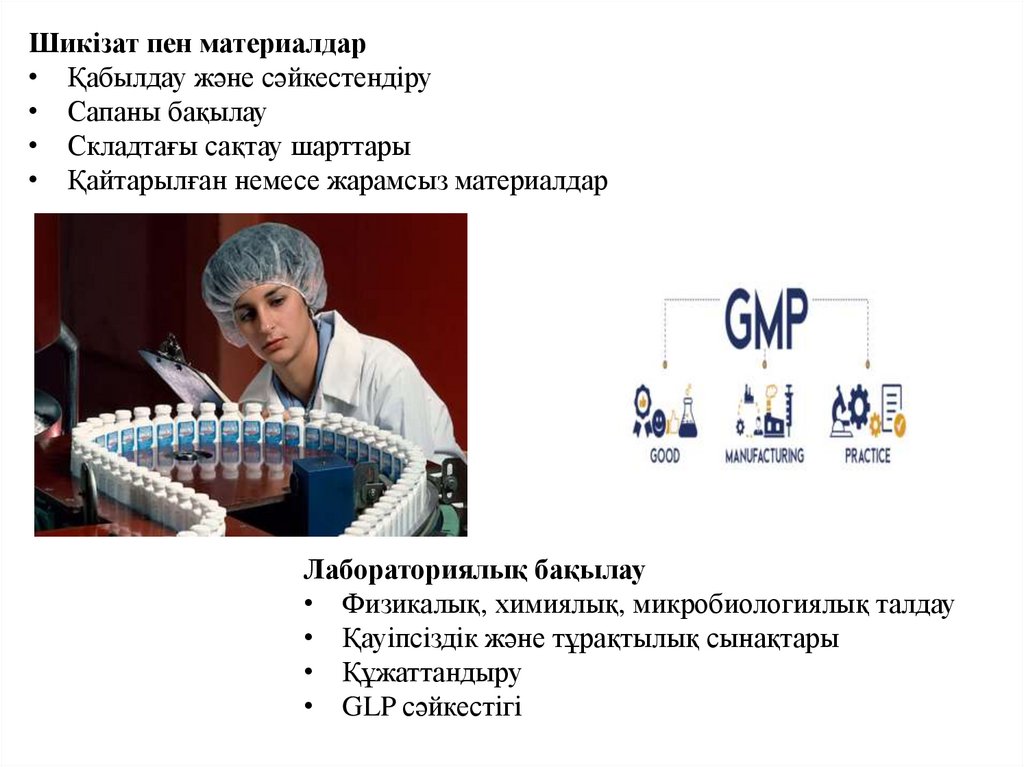
Шикізат пен материалдар• Қабылдау және сәйкестендіру
• Сапаны бақылау
• Складтағы сақтау шарттары
• Қайтарылған немесе жарамсыз материалдар
Лабораториялық бақылау
• Физикалық, химиялық, микробиологиялық талдау
• Қауіпсіздік және тұрақтылық сынақтары
• Құжаттандыру
• GLP сәйкестігі
8.
GMP-ге сәйкес сақтау және тасымалдау• Температуралық режим
• Ылғалдылық бақылауы
• ХОЛДИНГ аймақтары
• Транспортация журналдары
ҚР фармацевтикалық өндірісінде GMP
• 2018 жылдан бастап міндетті енгізу
• ҚР ДСМ Техникалық регламенттері
• “СК-Фармация”, “Нобел”, “Химфарм” – GMP
алған кәсіпорындар
• Ұлттық сараптау орталығының рөлі
GMP енгізудегі қиындықтар
• Жабдықтың қымбаттығы
• Кадр тапшылығы
• Сертификацияның күрделілігі
• Құжаттама жүйесін қалыптастыру