Similar presentations:
Дәріс 1. Өндірістік жағдайларды ұйымдастырудың және дәрілік препараттардың сапасын бақылаудың жалпы принциптері. Халықаралық
1. Дәріс 1. Өндірістік жағдайларды ұйымдастырудың және дәрілік препараттардың сапасын бақылаудың жалпы принциптері. Халықаралық
Дәріскер:Чопабаева Н.Н. х.ғ.д., доцент
әл-Фараби атындағы ҚазҰУ
2. ДДҰ бойынша дәрілік зат сапасының анықтамасы
Дәрілік заттың (ДЗ) сапасы – өзара байланыстыфакторлардың екі тобымен (міндетті элементтермен)
айқындалатын ДЗ-ның болжамды пайдалану үшін
жарамдылығы.
Жарамдылық факторлары:
Қолдану тиімділігі мен қауіпсіздігі (денсаулық үшін);
Сапа спецификациясы (нормативтік құжат) талаптарына
сәйкестігі
3. Мемлекеттік реттеу процесінде халықаралық стандарттардың рөлі
Дәрі-дәрмектердіәзірлеудің, өндірудің және
таратудың әр кезеңінде сапаға теріс әсер етуі
мүмкін қателіктер мен ауытқулардың алдын алу
үшін нақты шаралар қабылданады. Осылайша,
дәрілік заттың бүкіл өмірлік циклын қамтитын және
бірізділікті қамтамасыз етуге бағытталған сапаны
қамтамасыз ету тізбегі туралы айтуға болады.
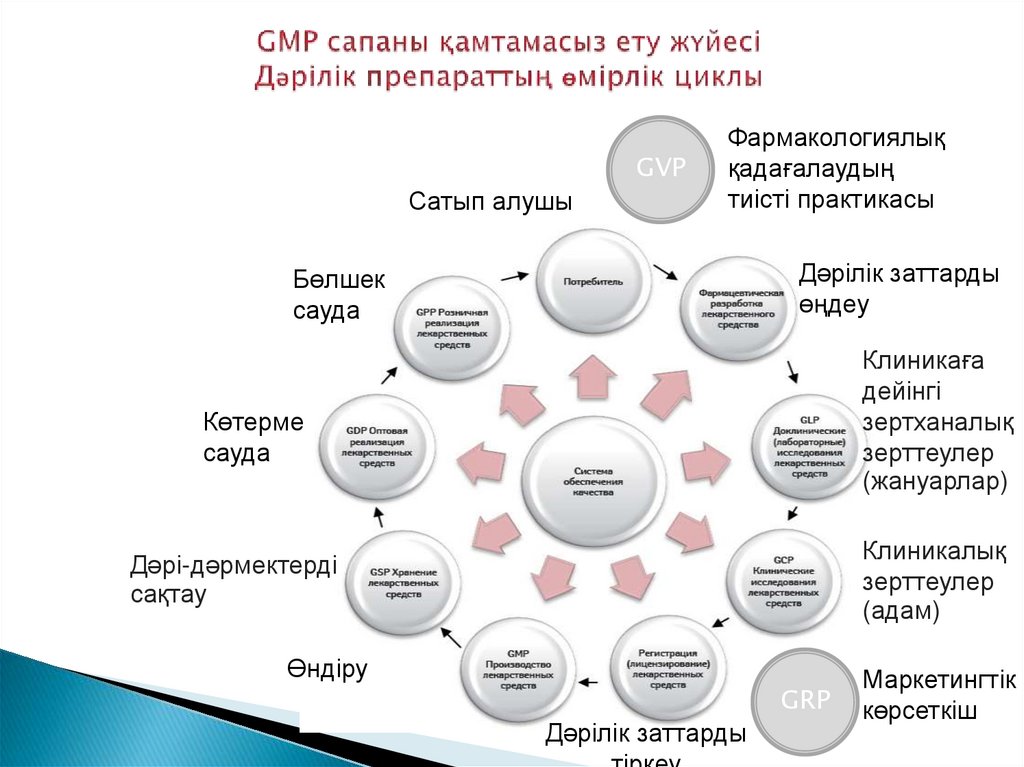
4. GMP сапаны қамтамасыз ету жүйесі Дәрілік препараттың өмірлік циклы
GVPСатып алушы
Фармакологиялық
қадағалаудың
тиісті практикасы
Дәрілік заттарды
өңдеу
Бөлшек
сауда
Клиникаға
дейінгі
зертханалық
зерттеулер
(жануарлар)
Көтерме
сауда
Клиникалық
зерттеулер
(адам)
Дәрі-дәрмектерді
сақтау
Өндіру
GRP
Дәрілік заттарды
Маркетингтік
көрсеткіш
5. "Тиісті фармацевтикалық практиканы бекіту туралы« Қазақстан Республикасы Денсаулық сақтау министрінің м.а. 2021 жылғы 4
1) Тиісті зертханалық практика стандарты (GLP) осы бұйрыққа 1қосымша;2) Тиісті клиникалық практика стандарты (GCP) осы бұйрыққа 2қосымша;
3) Тиісті өндірістік практика стандарты (GMP) осы бұйрыққа 3қосымша;
4) Бөлудің тиісті практикасының стандарты (GDP) осы бұйрыққа 4қосымша;
5) Тиісті дәріханалық практика стандарты (GPP) осы бұйрыққа 1қосымша;
6) Фармакологиялық қадағалаудың тиісті практикасының стандарты
(GVP) осы бұйрыққа 5-қосымша.
6. Мемлекеттік реттеу процесінде халықаралық стандарттардың рөлі
Фармацевтикалықсапа
жүйесі
(PQS)
бұл
фармацевтикалық өнімнің тиімділігі мен қауіпсіздігін
және олардың сапа тұрғысынан формальды талаптарға
сәйкестігін қамтамасыз ету жөніндегі шаралар кешені.
Ел деңгейінде бұл жүйеге фармацевтикалық заңнама, дәрідәрмектерді тіркеу және өндіріс, импорт, көтерме және
бөлшек сауда кәсіпорындарын лицензиялау тәртібі кіреді
Фармакопеялық бағдарлама, зертханалық қызметтер
(өндірістен, институттардан, орталықтардан тәуелсіз
бақылау және талдау зертханалары), инспекция және
жанама дәрілік реакцияларды қадағалау бағдарламасы.
7. GMP ("Good Manufacturing Practice") ережелері
Тиісті өндірістік практика бөлмелерге,персоналға, жабдықтарға және т. б.
қойылатын жалпы талаптарды қоса алғанда,
өндірісті қазіргі заманғы дұрыс жүргізу
жөніндегі ең аз практикалық нұсқауларды
қамтитын, өндірістік процесті ұйымдастыру
тәртібін, өндірілген өнімнің сапасына
бақылау жүргізу тәртібін белгілейтін жалпы
нұсқаулық болып табылады.
8. Тиісті өндірістік практика (GMP) стандарты (2021 жылғы 4 ақпандағы № ҚР ДСМ-15 бұйрығы)
бөлім дәрілік заттарды өндіруге қойылатын негізгі талаптардықамтиды;
I
II бөлім активті фармацевтикалық субстанциялармен операциялардың
барлық түрлерін қамтиды;
бөлімде егжей-тегжейлі нұсқаулар болып табылмайтын тиісті
өндіріс ережелерімен байланысты құжаттар жиынтығын қамтиды.
III
19 қосымшалар
9. GMP негізгі талаптары:
1. Негізгі талаптар2. Персонал
3. Бөлмелер мен жабдықтар
4. Құжаттамалар
5. Өндіріс
6. Сапаны бақылау
7. Басқа ұйымға берілетін қызмет немесе аутсорсинг
8. Шағымдар, сапа ақаулары және өнімді кері қайтару
9. Өзін-өзі инспекциялау
1 - 19 қосымшалар
10. Фармацевтикалық сапа жүйесі
Өндіруші дәрілік заттарды олардың өз мақсатына,тіркеу дерекнамасының талаптарына және (немесе)
клиникалық зерттеу хаттамасына сәйкестігіне кепілдік
беретіндей және пациенттер үшін дәрілік заттардың
қауіпсіздігіне, сапасына және тиімділігіне байланысты
тәуекелді барынша азайтатындай етіп өндіреді.
Осы мақсатқа қол жеткізу үшін тиісті өндірістік
практиканы және сапа үшін тәуекелдерді басқаруды
қамтитын жан-жақты әзірленген және дұрыс жұмыс
істейтін фармацевтикалық сапа жүйесі жасалады. Бұл
жүйе құжатталады және оның тиімділігі бақыланады.
11. GMP ережелері фармацевтикалық сапа жүйесінің ажырамас бөлігі болып табылады. Фармацевтикалық сапа жүйесінің көмегімен
(i) қызметкерлер тиісті түрде дайындалған және міндеттері нақты
бөлінген;
(ii) бөлмелер мен жабдықтар мақсаты бойынша пайдалануға және
оларға тиісті техникалық қызмет көрсетуге жарамды;
(iii) материалдардың, аралық өнімдердің, сусымалы өнімдердің және
дайын өнімнің тиісті сипаттамаларын әзірлеуді, өндірістік процесті
нақты түсінуді және тиісті жазбаларды жүргізуді қамтамасыз ететін
тиісті құжаттама жүйесі қамтылған;
(iv) өндірістік процесс дәйекті өндірісті (тиісті әзірлеу сатысын),
өнімнің сапасын және оның тиісті спецификацияларға сәйкестігін
қамтамасыз ету үшін жеткілікті;
(v) функционалды түрде өндірістен тәуелсіз сапаны бақылау жүйесі
бар;
12. Тиісті өндірістік практиканы ("GMP") сақтау фармацевтикалық сапа жүйесінің ажырамас бөлігі болып табылады. Атап айтқанда,
(vi) жоспарланған өзгерістерді перспективті бағалау және олардынормативтік талаптарды ескере отырып енгізгенге дейін бекіту
үшін (яғни, рұқсат етілген дәрілік заттар жағдайында өзгерістер
енгізу рәсімдері немесе егер зерттелетін персонал талап етілетін
өнімге тиісті түрде оқытылған жағдайда клиникалық зерттеуді
елеулі өзгертуге рұқсат беру рәсімдері), сондай-ақ жүзеге
асырылған өзгерістерді бағалау үшін мүмкіндік бар;
(vii) сапа ақаулары және технологиялық процестен ауытқулар
мүмкіндігінше тезірек анықталады, себептері зерттеледі және
тиісті түзету және / немесе алдын алу шаралары қабылданады;
(viii) дәрілік заттар мен олардың бастапқы және сыни
шикізаттарының қадағалануын қамтамасыз ету үшін тиісті
жүйелер енгізілді.
13. Тиісті өндірістік практика (GMP)
Тиістіөндірістік практика өнімнің өз мақсатына
сәйкес сапа стандарттары бойынша, сондай-ақ
тіркеу дерекнамасының талаптарына, клиникалық
зерттеулер хаттамасына және осы өнімнің
ерекшелігіне сәйкес тұрақты өндірілуіне және
бақылануына кепілдік беретін сапаны басқару
бөлігі болып табылады.
Тиісті
өндірістік практика өндіріспен де, сапаны
бақылаумен де байланысты.
14. Тиісті өндірістік практиканың негізгі талаптары
1) барлық өндірістік процестер жинақталған тәжірибенегізінде айқындалады, жүйелі түрде қайта қаралып
отырады және ерекшелігіне сәйкес қажетті сападағы
дәрілік препараттарды тұрақты өндіру қабілетін растайды;
2) өндірістік процестің тәуекел шегіндегі сатылары және
үдерістің елеулі өзгерістері валидациядан өтеді;
3) осы Стандарт талаптарын орындау үшін барлық қажетті
жағдайлар қамтамасыз етілуі тиіс, онда мыналар
қамтылады:
4) талапқа сәйкес оқытылған, қажетті біліктілігі бар
қызметкер;
15. Тиісті өндірістік практиканың негізгі талаптары
5) тиісті ій-жайлар мен аудандар;6) тиісті құрал-жабдықтар және қызметтік құрылғылар;
7) тиісті материалдар, контейнерлер және заттаңбалар;
8) фармацевтикалық сапа жүйесіне сәйкес бекітілген
рәсімдер мен нұсқаулықтар;
9) тиісті сақтау және тасымалдау шарттары;
16. Тиісті өндірістік практиканың негізгі талаптары
10) нұсқаулықтар мен рәсімдер қолда бар құралдарға нақтықолданылатындай жазбаша түрде түсінікті және тиянақты
тілде жазылады;
11) рәсімдер нақты қадағаланады және қызметкер оларды
дұрыс орындауға оқытылады;
12) өндіріс процесінде белгіленген әдістемелер мен
нұсқаулықтарда
көзделген
кезеңдердің
іс
жүзінде
жүргізілгенін, сондай-ақ өнімнің саны мен сапасы
белгіленген нормаларға сәйкес келетінін құжатпен
растайтын жазбалар (қолмен жазу тәсілімен және (немесе)
техникалық құралдарды қолдана отырып) жасалады;
17. Тиісті өндірістік практиканың негізгі талаптары
13) кез келген елеулі ауытқулар құжат жүзінде толықресімделеді және ауытқу себептерін анықтау және тиісті
түзету және сақтандыру шараларын жүзеге асыру
мақсатында тексеріледі;
14) толық серия тарихын қадағалауға мүмкіндік беретін
таратылуы бойынша құжаттаманы қоса алғанда, серияға
(мысалы, серияның дерекнамасына) қатысты жазбалар
түсінікті және қолжетімді түрде сақталады;
18. Тиісті өндірістік практиканың негізгі талаптары
15) өнімнің көтерме саудада таратылуы кезінде оныңсапасы
үшін
тәуекелдерді
азайтып,
Тиісті
дистрибьюторлық практика стандартын есепке алу қажет;
16) сату немесе жеткізу кезінде өнімнің кез келген
сериясын қайтарып алу жүйесінің болуы;
17) жеткізілген өнімге шағымдар көзделген, ақаулардың
себептері тексеріледі және сапасы нашар өнімге қатысты
да, осындай жағдайларға жол бермеу үшін де тиісті
шаралар қабылдануы тиіс.
19. GMP талаптары
БөлмелерӨндіріс аймақтары
Қойма аймақтары
Сапаны бақылау аймақтары
Көмекші аймақтар
20. Өзін-өзі бақылау
кәсіпорынның осы стандарттыңталаптарына сәйкестігін тексеру және қажетті
түзету әрекеттерін ұсыну үшін жүргізіледі.
Өзін-өзі
бақылауды кәсіпорын штатына кіретін
арнайы тағайындалған білікті адамдар дербес және
мұқият жүргізеді. Қажет болған кезде тәуелсіз
аудитті бөгде ұйымдардың сарапшылары жүргізеді.
21. Әдебиеттер:
https://www.ema.europa.eu/en/human-regulatory/researchdevelopment/compliance/good-manufacturing-practiceҚазақстан Республикасының "Халық денсаулығы және денсаулық
сақтау жүйесі туралы« Кодексі (04.05.2010 ж. өзгерістер мен
толықтыруларымен№193-IV)
"Тиісті фармацевтикалық практиканы бекіту туралы"Қазақстан
Республикасы Денсаулық сақтау министрінің 2021 жылғы 4
ақпандағы
№
ҚР
ДСМ-15
бұйрығы.
https://adilet.zan.kz/rus/docs/V2100022167
Регламент (ЕО) № 1235\2010





















 medicine
medicine








