Similar presentations:
Вопросы теории нитрования
1. Вопросы теории нитрования
2. Лекция 1
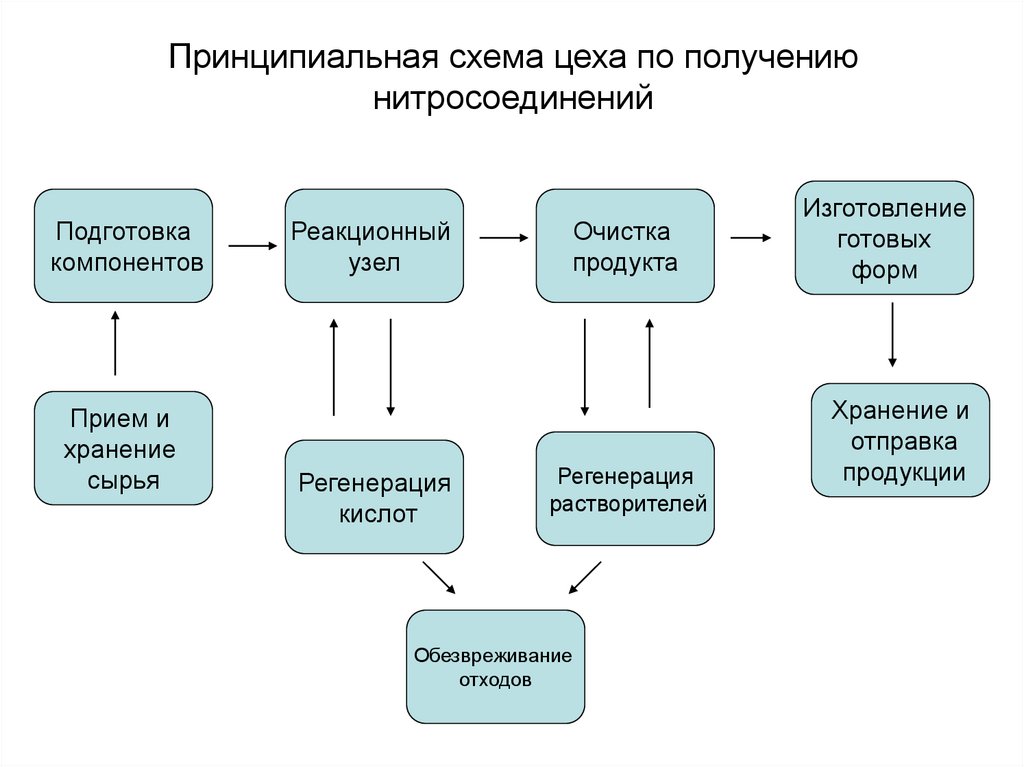
3. Принципиальная схема цеха по получению нитросоединений
Подготовкакомпонентов
Прием и
хранение
сырья
Реакционный
узел
Регенерация
кислот
Очистка
продукта
Регенерация
растворителей
Обезвреживание
отходов
Изготовление
готовых
форм
Хранение и
отправка
продукции
4.
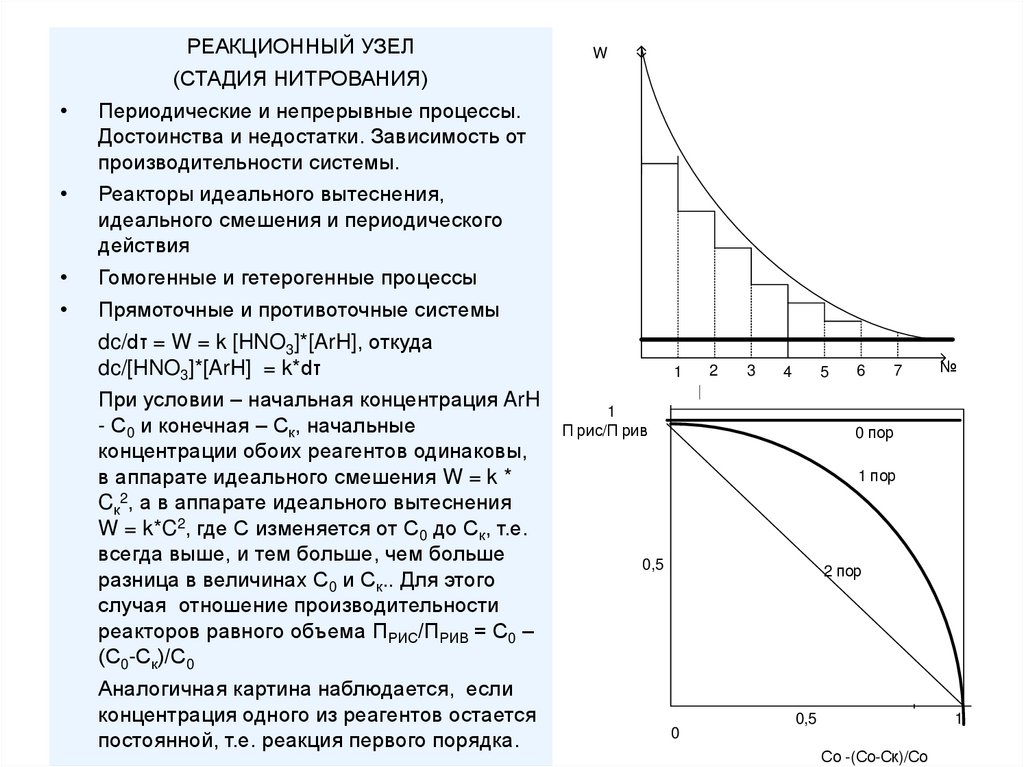
РЕАКЦИОННЫЙ УЗЕЛ(СТАДИЯ НИТРОВАНИЯ)
W
Периодические и непрерывные процессы.
Достоинства и недостатки. Зависимость от
производительности системы.
Реакторы идеального вытеснения,
идеального смешения и периодического
действия
Гомогенные и гетерогенные процессы
Прямоточные и противоточные системы
dc/dτ = W = k [HNO3]*[ArH], откуда
dc/[HNO3]*[ArH] = k*dτ
При условии – начальная концентрация ArH
- С0 и конечная – Ск, начальные
концентрации обоих реагентов одинаковы,
в аппарате идеального смешения W = k *
Cк2, а в аппарате идеального вытеснения
W = k*C2, где С изменяется от С0 до Ск, т.е.
всегда выше, и тем больше, чем больше
разница в величинах С0 и Ск.. Для этого
случая отношение производительности
реакторов равного объема ПРИС/ПРИВ = С0 –
(С0-Ск)/С0
Аналогичная картина наблюдается, если
концентрация одного из реагентов остается
постоянной, т.е. реакция первого порядка.
1
2
3
4
5
1
П рис/П рив
6
7
№
0 пор
1 пор
0,5
2 пор
0,5
1
0
Со -(Со-Ск)/Со
5.
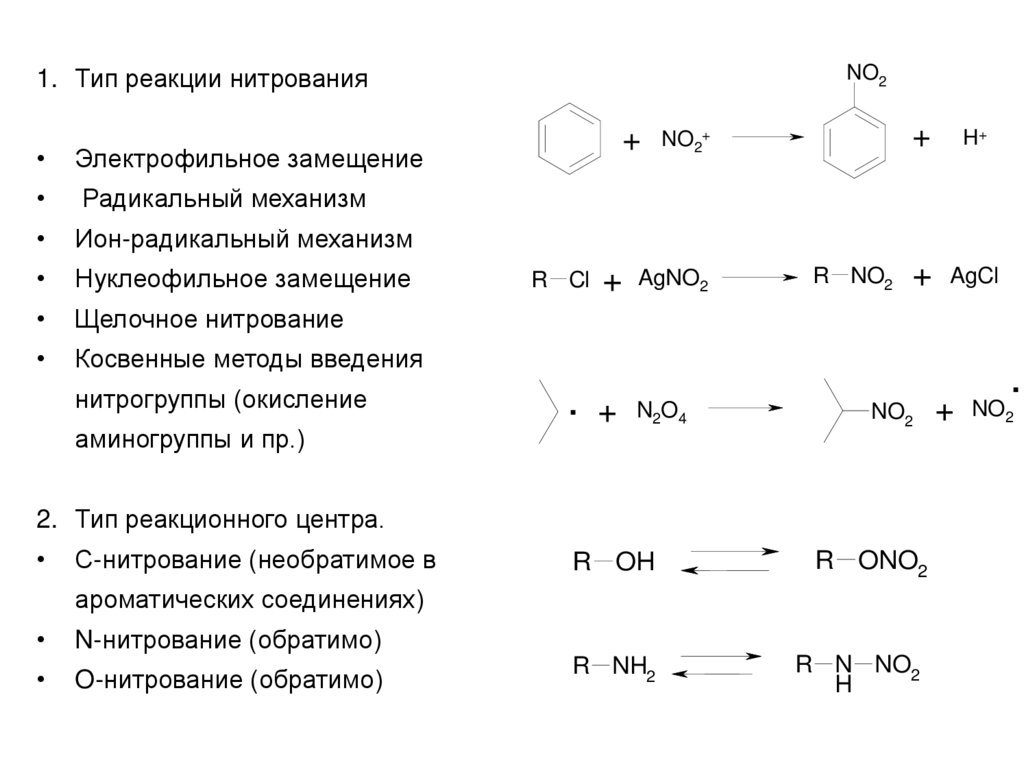
1. Тип реакции нитрованияЭлектрофильное замещение
Радикальный механизм
Ион-радикальный механизм
Нуклеофильное замещение
Щелочное нитрование
Косвенные методы введения
нитрогруппы (окисление
аминогруппы и пр.)
NO2
+
+ NO2+
R Cl + AgNO2
. + NO
2
R NO2
+ AgCl
.
4
NO2
2. Тип реакционного центра.
С-нитрование (необратимое в
R OH
R ONO2
R NH2
R N NO2
H
ароматических соединениях)
N-нитрование (обратимо)
O-нитрование (обратимо)
H+
+ NO2
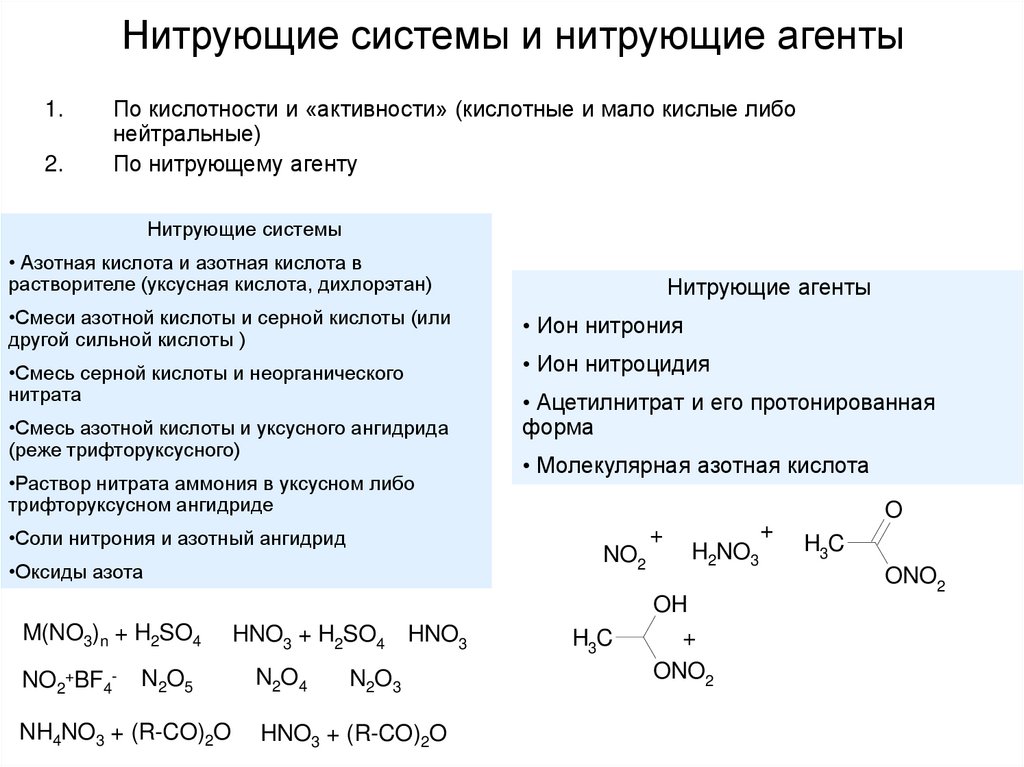
6. Нитрующие системы и нитрующие агенты
1.2.
По кислотности и «активности» (кислотные и мало кислые либо
нейтральные)
По нитрующему агенту
Нитрующие системы
• Азотная кислота и азотная кислота в
растворителе (уксусная кислота, дихлорэтан)
•Смеси азотной кислоты и серной кислоты (или
другой сильной кислоты )
•Смесь серной кислоты и неорганического
нитрата
•Смесь азотной кислоты и уксусного ангидрида
(реже трифторуксусного)
•Раствор нитрата аммония в уксусном либо
трифторуксусном ангидриде
•Соли нитрония и азотный ангидрид
NO2+BF4-
N2O5
NH4NO3 + (R-CO)2O
HNO3 + H2SO4 HNO3
N2O4
• Ион нитрония
• Ион нитроцидия
• Ацетилнитрат и его протонированная
форма
• Молекулярная азотная кислота
NO2
•Оксиды азота
M(NO3)n + H2SO4
Нитрующие агенты
N2O3
HNO3 + (R-CO)2O
H3C
+
+
H2NO3
OH
+
ONO2
O
H3C
ONO2
7.
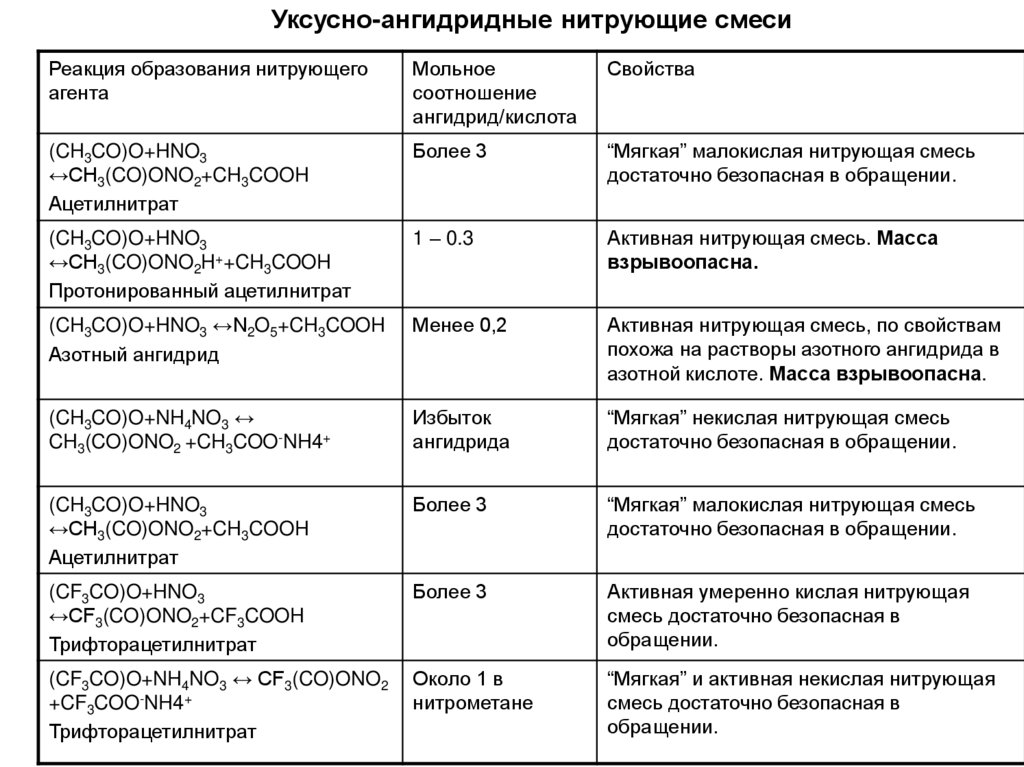
Уксусно-ангидридные нитрующие смесиРеакция образования нитрующего
агента
Мольное
соотношение
ангидрид/кислота
Свойства
(CH3CO)O+HNO3
↔CH3(CO)ONO2+CH3COOH
Ацетилнитрат
Более 3
“Мягкая” малокислая нитрующая смесь
достаточно безопасная в обращении.
(CH3CO)O+HNO3
↔CH3(CO)ONO2H++CH3COOH
Протонированный ацетилнитрат
1 – 0.3
Активная нитрующая смесь. Масса
взрывоопасна.
(CH3CO)O+HNO3 ↔N2O5+CH3COOH
Азотный ангидрид
Менее 0,2
Активная нитрующая смесь, по свойствам
похожа на растворы азотного ангидрида в
азотной кислоте. Масса взрывоопасна.
(CH3CO)O+NH4NO3 ↔
CH3(CO)ONO2 +CH3COO-NH4+
Избыток
ангидрида
“Мягкая” некислая нитрующая смесь
достаточно безопасная в обращении.
(CH3CO)O+HNO3
↔CH3(CO)ONO2+CH3COOH
Ацетилнитрат
Более 3
“Мягкая” малокислая нитрующая смесь
достаточно безопасная в обращении.
(CF3CO)O+HNO3
↔CF3(CO)ONO2+CF3COOH
Трифторацетилнитрат
Более 3
Активная умеренно кислая нитрующая
смесь достаточно безопасная в
обращении.
(CF3CO)O+NH4NO3 ↔ CF3(CO)ONO2
+CF3COO-NH4+
Трифторацетилнитрат
Около 1 в
нитрометане
“Мягкая” и активная некислая нитрующая
смесь достаточно безопасная в
обращении.
8.
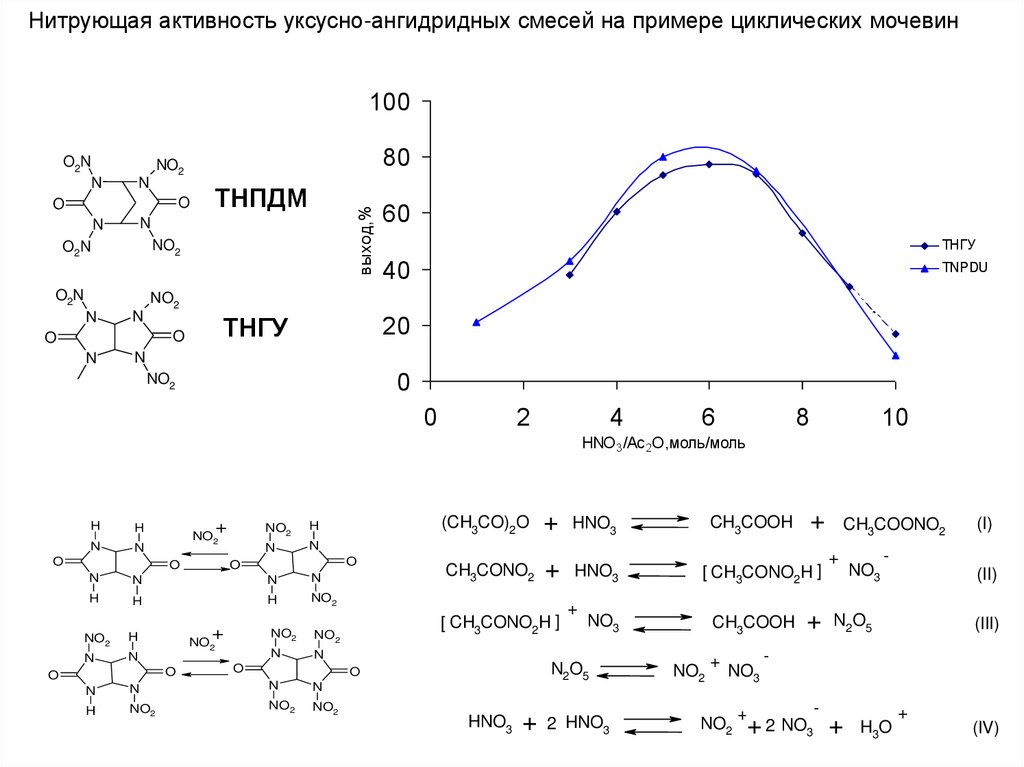
Нитрующая активность уксусно-ангидридных смесей на примере циклических мочевин100
80
NO2
N
O
ТНПДМ
выход,%
O2N
N
O
N
O2N
N
NO2
O2N
60
ТНГУ
40
TNPDU
NO2
N
N
N
20
ТНГУ
O
O
N
0
NO2
0
2
4
6
8
10
HNO3 /Ac 2O,моль/моль
H
N
+
H
NO2
N
O
NO2
H
N
N
O
O
O
N
N
N
N
H
H
H
NO2
NO2
H
N
N
+
NO
2
O
O
N
H
(CH3CO)2O
NO2
NO2
N
N
O
N
N
NO2
NO2
NO2
CH3CONO2 + HNO3
[ CH3CONO2H ]
O
N
+ HNO3
+
CH3COOH
[ CH3CONO2H ]
HNO3 + 2 HNO3
+
NO3
NO2
+
NO3
NO2
+
(I)
(II)
CH3COOH + N2O5
NO3
N2O5
+ CH3COONO2
(III)
-
+ 2 NO3 + H3O
+
(IV)
9. Нитрующие смеси на кислотной основе
Азотная кислота и азотный олеумN2O5 ↔ NO2+ + NO33HNO3 ↔ H3O+ + NO2+ NO3-
Среднекислые активные нитрующие смеси.
Нитрование соединений разлагающихся в
сильнокислой среде. Многие
гетероциклические соединения, синтез
гексогена
Серно-азотные смеси (возможно
использование хлорной кислоты)
HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4HNO3+ 2 Н2S2O7 ↔ H3O+ + NO2+ +
2HS2O7-
Высоко-кислотные активные нитрующие смеси.
Нитрование соединений устойчивых в
сильнокислой среде (ароматические и
некоторые гетероциклические)
Нитраты металлов в серной кислоте
NaNO3 + H2SO4 ↔ Na+ + HSO4- + HNO3
HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4H2SO4 +H2O ↔H3O+ + HSO4-
Система отличается пониженной кислотностью
и отсутствием оксидов азота. Нитрование
легкоокисляющихся соединений.
HNO3+ P2O5↔ N2O5 + 2HPO3
N2O5 ↔ NO2+ + NO3Азотный ангидрид в полифосфорных
кислотах
Активные нитрующие смеси с низкой
кислотностью. Нитрование соединений
разлагающихся в сильнокислой среде. Многие
гетероциклические соединения.
10. Механизм нитрования
Механизм реакции – совокупность элементарных процессов
Методы изучения: изучение кинетики процессов, физико-химическине (спектральные) и
расчетные методы установления структуры промежуточных соединений и переходных
состояний.
Скорость и порядок химической реакции.
Порядок реакции – сумма стехиометрических коэффициентов в уравнении реакции
n*A + m*B = k* C, W=k*[A]n*[B]m, порядок = n+m
Необратимая реакция первого порядка А →B ; W=d[A]/dt=k*[A] ; [A]=[A0]*e-k*t
Необратимая реакция второго порядка А+B →C ; W=d[A]/dt=k*[A]*[B], в случае [B]»[A],
[B]≈[B0]=const и W=k*[B0]*[A]=k`*[A] где k`=k*[B0]
Молекулярнось реакции – число частиц одновременно участвующих в элементарном акте
взаимодействия.
Механизм ароматического нитрования
Ранее предполагалось присоединение – отщепление азотной кислоты.
O2N
+ HNO3
H
NO2
OH
H
-H2O
11.
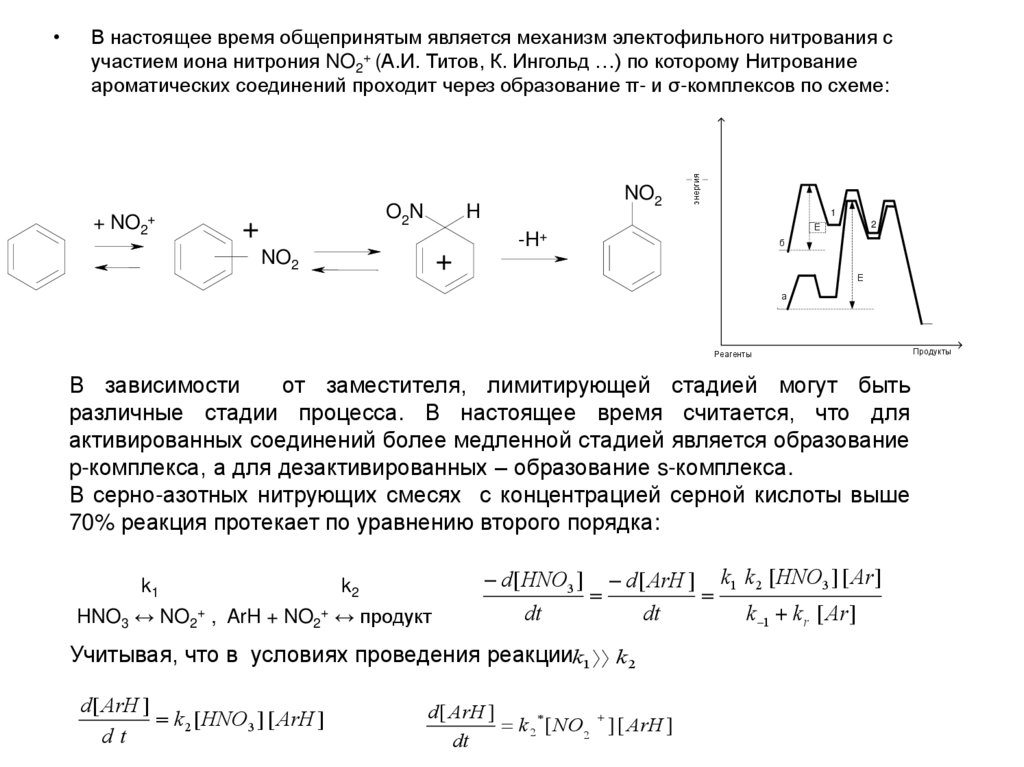
В настоящее время общепринятым является механизм электофильного нитрования сучастием иона нитрония NO2+ (А.И. Титов, К. Ингольд …) по которому Нитрование
ароматических соединений проходит через образование π- и σ-комплексов по схеме:
+ NO2+
+
NO2
H
O2N
+
NO2
энергия
1
2
Е
-H+
б
Е
а
Реагенты
В зависимости
от заместителя, лимитирующей стадией могут быть
различные стадии процесса. В настоящее время считается, что для
активированных соединений более медленной стадией является образование
p-комплекса, а для дезактивированных – образование s-комплекса.
В серно-азотных нитрующих смесях с концентрацией серной кислоты выше
70% реакция протекает по уравнению второго порядка:
k1
k2
HNO3 ↔ NO2+ , ArH + NO2+ ↔ продукт
d [ HNO3 ] d [ ArH ] k1 k 2 [ HNO3 ] [ Ar ]
dt
dt
k 1 k r [ Ar ]
Учитывая, что в условиях проведения реакцииk1 k 2
d [ ArH ]
k 2 [ HNO3 ] [ ArH ]
dt
d [ ArH ]
k 2 [ NO2 ] [ ArH ]
dt
Продукты
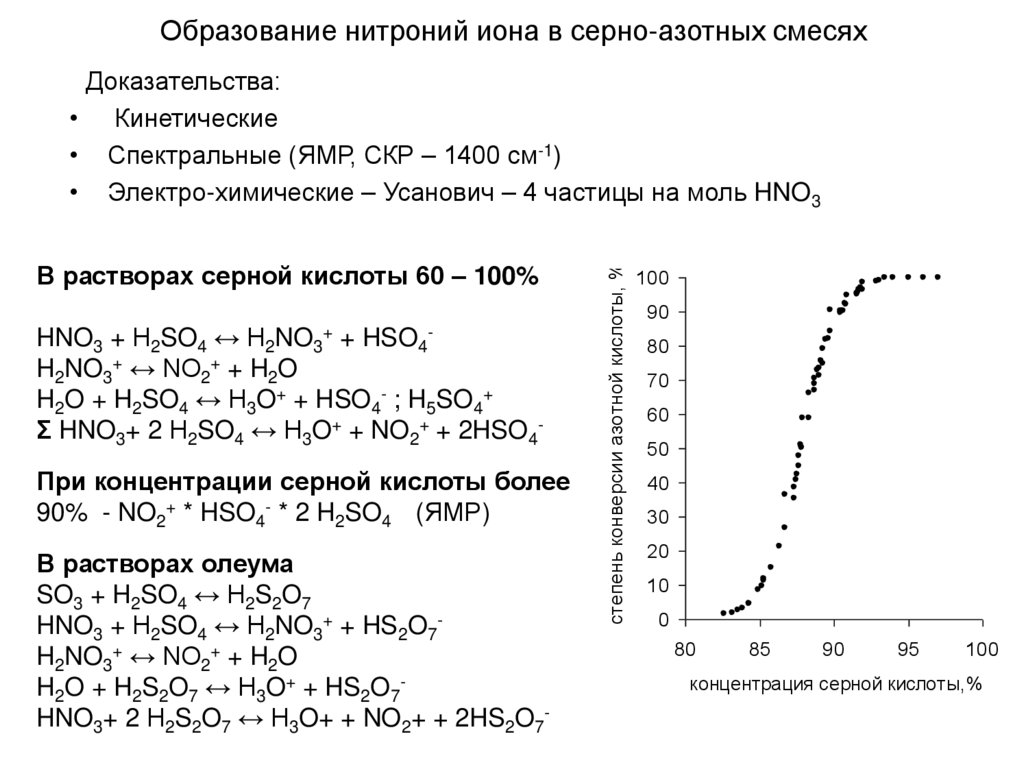
12. Образование иона нитрония
В безводной кислоте2HNO3 ↔ H2NO3+ + NO3- ↔
↔ H2O + NO2+ + NO3HNO3 + H2O ↔ H3O+ + NO3Σ 3HNO3 ↔ H3O+ + NO2+ + NO3По данным криоскопии
в 95-100% кислоте образуется гидрат
2 HNO3 * H2O
в 95-100% кислоте образуется гидрат
HNO3 * H2O
В более разбавленной кислоте
увеличивается доля реакции
HNO3 + H2O ↔ H3O+ + NO3До 60% азотной кислоты нитрующий
агент – ион нитрония.
В этих растворах в отличии от серной
кислоты существует вода в
молекулярной форме и велика доля
молекулярной азотной кислоты.
HNO3
, моль/л
HNO3%
HNO3 св
моль/л
H2O
своб.
, моль/л
NO2+ моль/л
100
NO3моль/л
0.3
95
22.8
18.7
0
0.0122
0.06
90
21.3
12.3
0
5.09E-04
0.19
85
19.8
8.25
0.82
8.26E-06
0.43
80
18.5
3.94
1.18
2.67E-07
0.74
75
17.1
1.88
1
1.19E-08
1.11
71
9.27E-10
64
2.17E-11
60
4.70E-12
2
0
-2
log [C], моль/л
• В азотной кислоте
-4
-6
log[HNO3 своб], моль/л
-8
log[H2O своб.], моль/л
log[NO2+] моль/л
-10
log[NO3-], моль/л
-12
-14
60
70
80
Азотная кислота %
90
100
13. Образование нитроний иона в серно-азотных смесях
В растворах серной кислоты 60 – 100%HNO3 + Н2SO4 ↔ H2NO3+ + HSO4H2NO3+ ↔ NO2+ + H2O
H2O + H2SO4 ↔ H3O+ + HSO4- ; H5SO4+
Σ HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4При концентрации серной кислоты более
90% - NO2+ * HSO4- * 2 H2SO4 (ЯМР)
В растворах олеума
SO3 + H2SO4 ↔ H2S2O7
HNO3 + Н2SO4 ↔ H2NO3+ + HS2O7H2NO3+ ↔ NO2+ + H2O
H2O + H2S2O7 ↔ H3O+ + HS2O7HNO3+ 2 Н2S2O7 ↔ H3O+ + NO2+ + 2HS2O7-
степень конверсии азотной кислоты, %
Доказательства:
• Кинетические
• Спектральные (ЯМР, СКР – 1400 см-1)
• Электро-химические – Усанович – 4 частицы на моль HNO3
100
90
80
70
60
50
40
30
20
10
0
80
85
90
95
100
концентрация серной кислоты,%
14. Лекция 2
15.
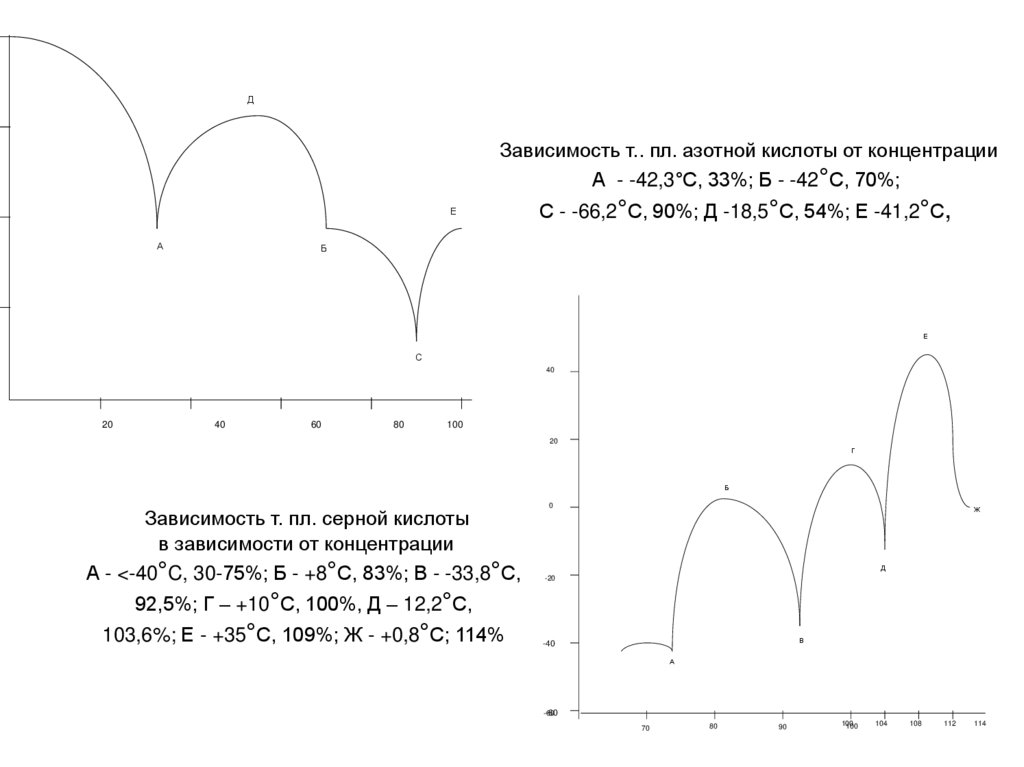
ДЗависимость т.. пл. азотной кислоты от концентрации
А - -42,3°С, 33%; Б - -42°С, 70%;
Е
А
С - -66,2°С, 90%; Д -18,5°С, 54%; Е -41,2°С,
Б
Е
С
40
20
40
60
80
100
20
Г
Б
Зависимость т. пл. серной кислоты
в зависимости от концентрации
А - <-40°C, 30-75%; Б - +8°С, 83%; В - -33,8°С,
0
Ж
Д
-20
92,5%; Г – +10°С, 100%, Д – 12,2°С,
103,6%; Е - +35°С, 109%; Ж - +0,8°С; 114%
В
-40
А
-60
-60
70
80
90
100
100
104
108
112
114
16.
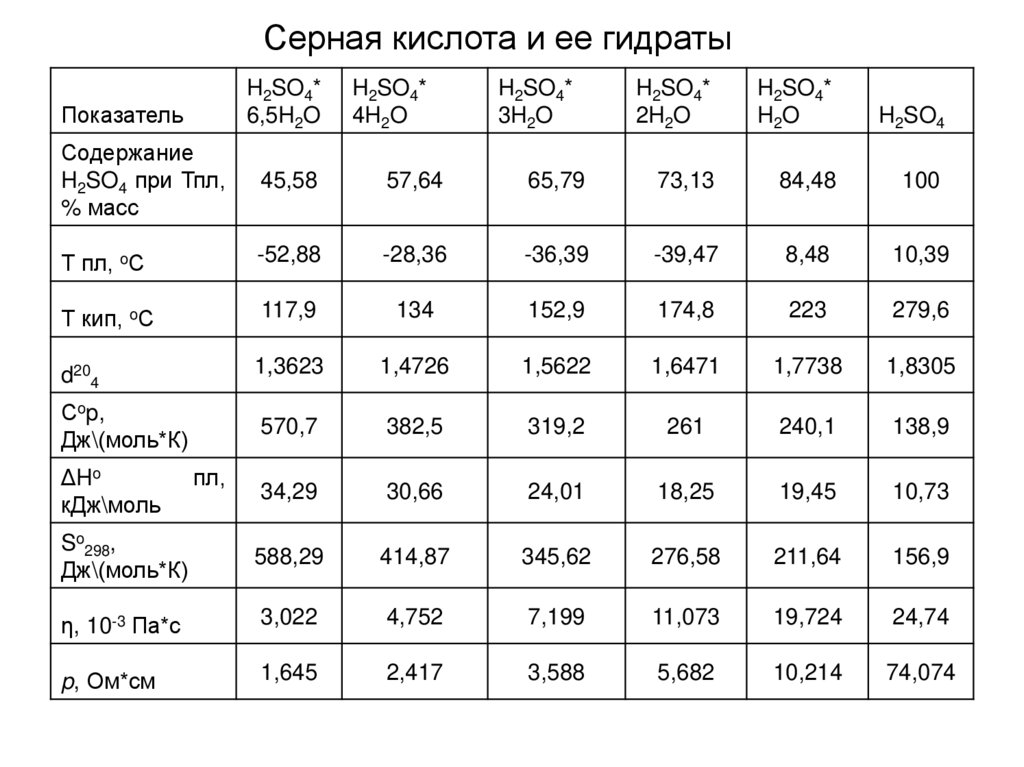
Серная кислота и ее гидратыПоказатель
H2SO4*
6,5H2O
Содержание
H2SO4 при Тпл,
% масс
45,58
57,64
65,79
73,13
84,48
100
Т пл, oС
-52,88
-28,36
-36,39
-39,47
8,48
10,39
Т кип, oС
117,9
134
152,9
174,8
223
279,6
d204
1,3623
1,4726
1,5622
1,6471
1,7738
1,8305
Сop,
Дж\(моль*К)
570,7
382,5
319,2
261
240,1
138,9
34,29
30,66
24,01
18,25
19,45
10,73
So298,
Дж\(моль*К)
588,29
414,87
345,62
276,58
211,64
156,9
η, 10-3 Па*с
3,022
4,752
7,199
11,073
19,724
24,74
p, Ом*см
1,645
2,417
3,588
5,682
10,214
74,074
ΔHo
кДж\моль
пл,
H2SO4*
4H2O
H2SO4*
3H2O
H2SO4*
2H2O
H2SO4*
H2O
H2SO4
17.
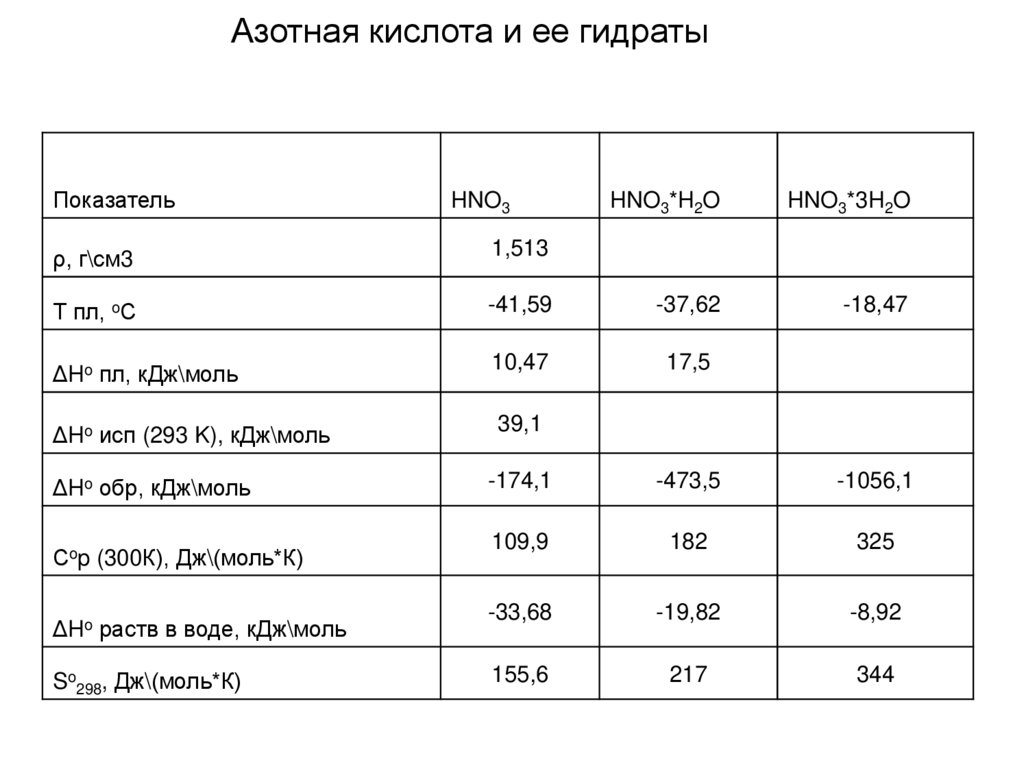
Азотная кислота и ее гидратыПоказатель
HNO3
HNO3*H2O
HNO3*3H2O
-18,47
ρ, г\см3
1,513
Т пл, oС
-41,59
-37,62
ΔHo пл, кДж\моль
10,47
17,5
ΔHo исп (293 K), кДж\моль
39,1
ΔHo обр, кДж\моль
-174,1
-473,5
-1056,1
109,9
182
325
-33,68
-19,82
-8,92
155,6
217
344
Сop (300К), Дж\(моль*К)
ΔHo раств в воде, кДж\моль
So298, Дж\(моль*К)
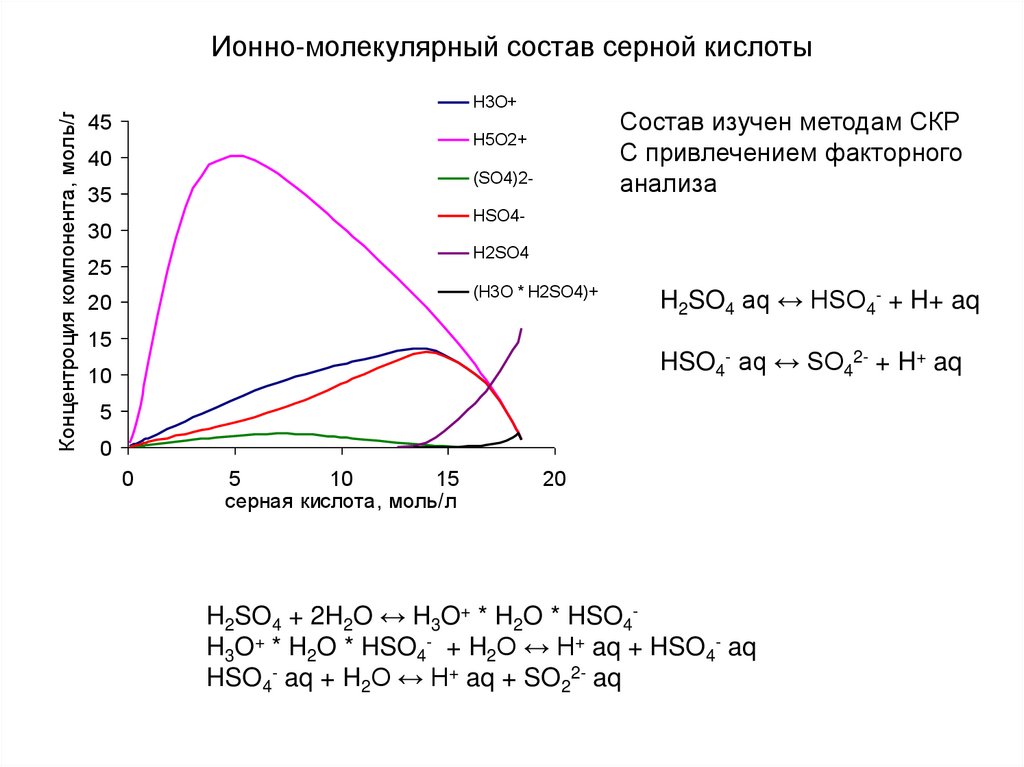
18. Ионно-молекулярный состав серной кислоты
Концентроция компонента, моль/лИонно-молекулярный состав серной кислоты
H3O+
45
Состав изучен методам СКР
С привлечением факторного
анализа
Н5O2+
40
(SO4)2-
35
HSO4-
30
H2SO4
25
(H3O * H2SO4)+
20
15
H2SO4 aq ↔ HSO4- + H+ aq
HSO4- aq ↔ SO42- + H+ aq
10
5
0
0
5
10
15
серная кислота, моль/л
20
H2SO4 + 2H2O ↔ H3O+ * H2O * HSO4H3O+ * H2O * HSO4- + H2O ↔ H+ aq + HSO4- aq
HSO4- aq + H2O ↔ H+ aq + SO22- aq
19. Функции кислотности
Теория Бренстеда – Лоури.
Согласно теории Бренстеда – Лоури кислота рассматривается как вещество, поставляющее
протон, а основание – как вещество, способное присоединять протон.
А ↔ В + Н+
кислота основание
Кислота и отвечающее ей основание образуют сопряженную пару.
Ключевым в теории Бренстеда – Лоури является представление о том, что кислота
взаимодействует при переносе протона с другой сопряженной парой (двойное
протолитическое равновесие):
А1 + В2 ↔ А2 + В1
Можно представить, что двойное протолитическое равновесие является результатом двух
сопряженных равновесий:
НА ↔ Н+ + АВ + Н+ ↔ ВН+
Это уравнение можно считать адекватным процессам, проходящим в газовой фазе
В растворах сначала кислота АН и основание В образуют комплекс АН…В за счет
водородной связи, такой процесс называется “незавершенным” кислотно-основным
равновесием. Далее происходит передача протона от кислоты к основанию. Эта вторая
стадия протолитического процесса называется “завершенным” кислотно-основным
взаимодействием. При этом, образовавшиеся ионы могут находиться в растворе либо в
свободном виде, либо в виде ионных пар.
ВН+А- ↔ ВН+ А- ↔ ВН+ + АРазличают - тесные ионные пары, сольватно – разделенные ионные пары и свободные
ионы.
Более полным отражением кислотно – основного процесса является следующая схема:
а
б
в
+
АН + В ↔ АН…В ↔ А …ВН ↔ А- + ВН+
здесь а – незавершенное кислотно-основное равновесие, б – завершенное и в –
диссоциация на свободные ионы.
20. Физический смысл и меры основности в газовой фазе
Основностью в газовой фазе называют свободную энергию ( ΔG ) равновесия
В + Н+ ↔ ВН+ . Как известно Δ G= Δ Но -Т Δ S. Измерения энтропии равновесия
в газовой фазе показали, что это величина обычно не превышает 9 – 12
Дж/(моль* К). Таким образом изменение энтальпии равновесия (Δ Но) считается
равным Δ Gо.
Изменение энтальпии равновесия переноса протона в газовой фазе, взятое с
обратным знаком, называется сродством к протону и обозначается РА ( Proton
Affinity). Численное значение РА определяется из соотношения:
РА = - Δ НО = Δ НО(Н+) + Δ НО(В) - Δ НО(ВН+)
Где Δ НО(Н+) – энтальпия образования иона Н+; Δ НО(В) и Δ НО(ВН+) – энтальпия
образования основания (В) и его протонированной формы (ВН+)
соответственно.
Ионы в газовой фазе не стабильны. Раз образовавшись, они быстро гибнут в
результате рекомбинации с ионами противоположного знака В жидкой среде
ионы стабилизируются за счет сольватации, энергия которой может превысить
энергию образования иона из молекулы. В этом случае можно ожидать
инверсии основности при сопоставлении данных в газовой фазе и в растворе
21.
Протонирование слабых органических оснований в
водных растворах кислот.
Протонирование многих слабых органических оснований происходит в
достаточно концентрированной серной кислоте, хлорной и фторсульфоновой
кислотах. Очень слабые основания протонируются в олеуме или в так
называемых суперкислотах (смеси HSO3F – SbF5, HF - SbF5 и другие подобные
системы). Для описания процессов протонирования в этих системах,
необходимо учитывать влияние процессов сольватации основания и его
протонированной формы. Также важно учитывать роль сольватирования
“переносимого” протона.
Под сольватацией понимают взаимодействие частиц растворенного вещества и
растворителя.
G O Еисп Еион дип Едисп Еотт Е 'ион дип Ев.с. Ео
где Еисп-теплота испарения молекул воды; Еион-дип , Едисп и Еотт – энергии
электростатического (кулоновского), дисперсионного взаимодействий и энергии
отталкивания между ионом и молекулами воды при образовании гидратного
комплекса; Е’ион-дип - энергия взаимодействия иона с диполями воды вне
первичного сольватного комплекса; Ев.с – энергия образования водородной
связи между молекулами воды, находящимися в растворе, когда комплекс
(например, ВН+ * nН2О) из газовой фазы переходит в раствор; Ео –
характеризует неэлектрический вклад в общую энергию сольватации.
22.
В зависимости от концентрации минеральной кислоты, характер специфической
сольватации непрерывно меняется. Избыточные протоны, имеющиеся в водных
растворах минеральных кислот, не закреплены за определенными молекулами
воды с которыми они образуют ионы Н3О+, а постоянно перемещаются от одной
молекулы к другой, что обуславливает чрезвычайно низкое время жизни (10-13с)
индивидуального иона Н3О+ (протонный газ). Это время значительно меньше,
чем средняя продолжительность жизни гидрата В…Н2О. На этом основании
возникло представление о “протонном газе” в водных растворах кислот.
с увеличением концентрации кислоты все более заметным становится процесс
частичной дегидратации комплексов (В…Н+.nН2О)
В*bН2О + Н+*хН2О ↔ В…Н+*nН2О + (b+x – n)Н2О
В…Н+*nН2О ↔ В…Н+*(n-1)Н2О + Н2О
В…Н+*(n-1)Н2О ↔ В…Н+*(n-2)Н2О + Н2О
В…Н+.Н2О ↔ ВН+ + Н2О
Суммарно
В…Н+*nН2О ↔ В…Н+*mН2О + (n-m)Н2О
Таким образом основание (В) в процессе протонирования получает протон не из
среды, как это предусмотрено схемой Бренстеда, а путем последовательной
дегидратации комплексов основания с гидратированным протоном.
23.
Гаммет и Дейруп: серия органических соединений, обладающие максимально сходной молекулярной
структурой, так называемых кислотно-основных индикаторов.
Протонирование всех членов ряда сопровождалось идентичным характером делокализации
положительного заряда в ионе ВН+. Ииндикаторы были выбраны -замещенные анилины. Для nнитроанилин – в воде величина рК ВН+ :
К In1H
H f In1 CIn1
f In1 H CIn1 H
где КIn H+ - константа основности ; fIn , f In H+ - коэффициенты активности; CIn и C In H+ - концентрация
индикатора и его протонированной. Значение константы основности n-нитроанилина (pK In H+ =1,0)
может быть определено с помощью шкалы рН по уравнению:
pK BH pH lg
CBH
CB
0,505
где m - ионная сила раствора.
Допущение: отношение fIn /f In H+ в уравнение не зависит от строения индикатора и единственным
показателем кислотности среды является величина h0=αH+* f In/f In H+. Величина Н0=-lg h0. получила
название "функция кислотности Гаммета". Затем измеряли значения ионизационных отношений
I=[BH+]/[B] для n-нитроанилина и о-нитроанилина в растворах серной кислоты одной и той же
концентрации. При этой в соответствии с постулатом Гаммета f Iо * f Ip H+ / fIp* f Io H+ =1, где fIo и f Io H+
- кэффициент активности о-нитроанилина и его протонированной формы.
Н0 = pK I H+ - lg I.
Распространив "методику перекрывания" вплоть до концентрированной серной кислоты, авторы
вычислили значения функции кислотности Н0 для интервала 5-100 масс. % H2SO4. Стандартным
состоянием для шкалы Н0 является бесконечно разбавленный водный раствор. Учитывая это, шкалу
Н0 формально можно рассматривать как продолжение шкалы рН в область концентрированных
растворов кислот.
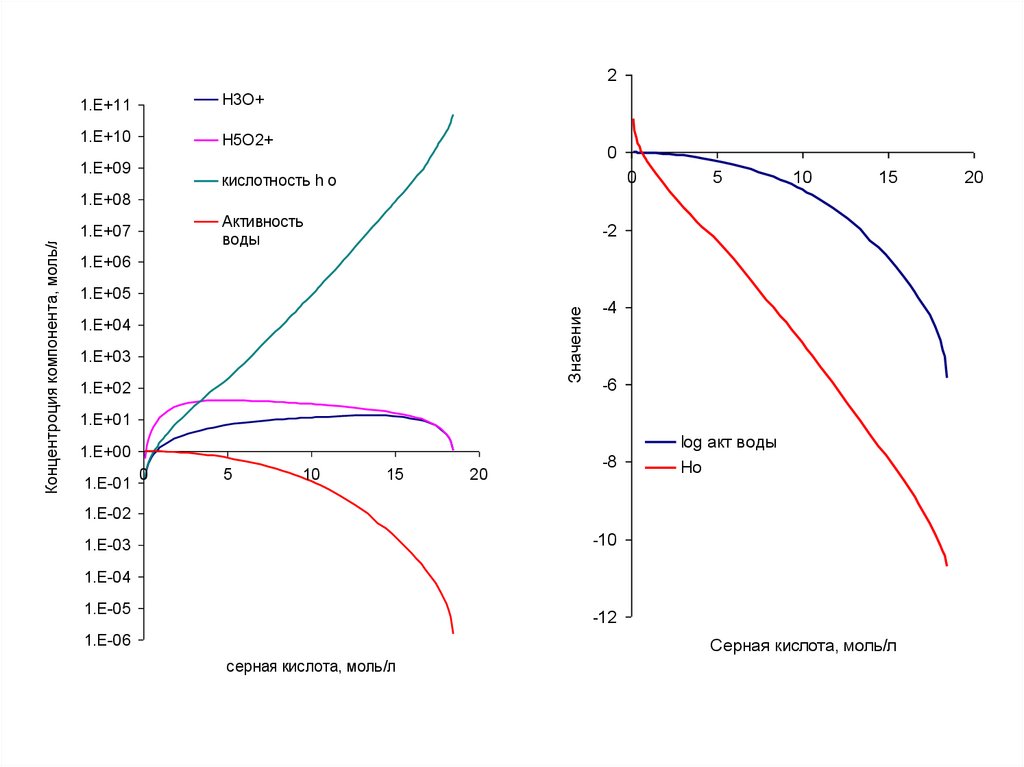
24.
21.E+11
H3O+
1.E+10
Н5O2+
1.E+09
0
0
кислотность h o
5
10
15
Активность
воды
1.E+07
-2
1.E+06
1.E+05
Значение
Концентроция компонента, моль/л
1.E+08
1.E+04
1.E+03
1.E+02
-4
-6
1.E+01
log акт воды
1.E+00
1.E-01
0
5
10
15
20
-8
Ho
1.E-02
-10
1.E-03
1.E-04
1.E-05
-12
1.E-06
Серная кислота, моль/л
серная кислота, моль/л
20
25.
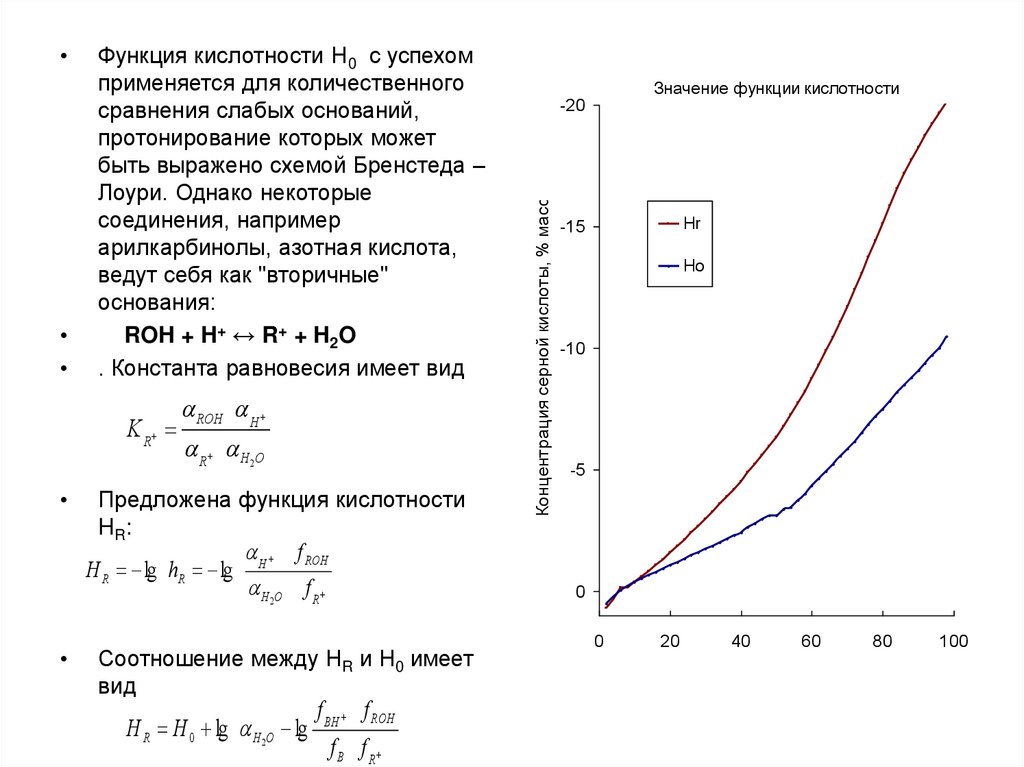
Функция кислотности Н0 с успехом
применяется для количественного
сравнения слабых оснований,
протонирование которых может
быть выражено схемой Бренстеда –
Лоури. Однако некоторые
соединения, например
арилкарбинолы, азотная кислота,
ведут себя как "вторичные"
основания:
ROH + H+ ↔ R+ + H2O
. Константа равновесия имеет вид
K R
ROH H
R H 2O
Предложена функция кислотности
HR:
f ROH
H R lg hR lg H
H 2O f R
Соотношение между НR и Н0 имеет
вид
H R H 0 lg H 2O lg
f BH f ROH
f B f R
Значение функции кислотности
-20
Концентрация серной кислоты, % масс.
Hr
-15
Ho
-10
-5
0
0
20
40
60
80
100
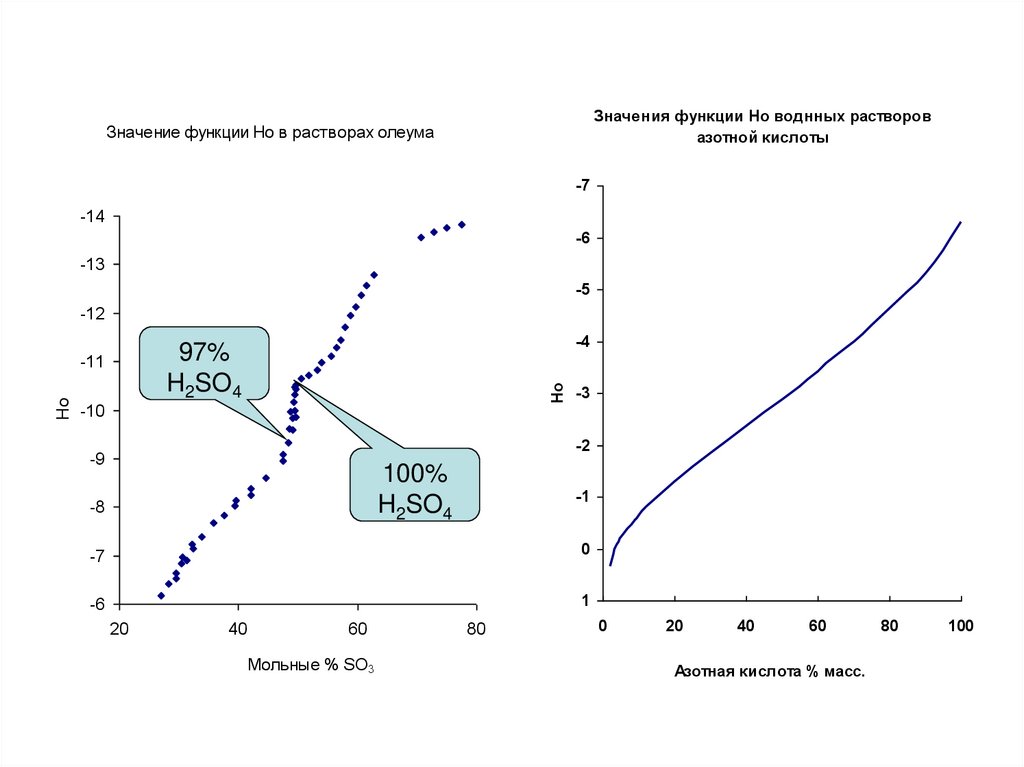
26.
Значения функции Но воднных растворовазотной кислоты
Значение функции Ho в растворах олеума
-7
-14
-6
-13
-5
-12
-10
Ho
Ho
-4
97%
H2SO4
-11
-3
-2
-9
100%
H2SO4
-8
-1
-7
0
-6
1
20
40
60
Мольные % SO3
80
0
20
40
60
Азотная кислота % масс.
80
100
27.
Кроме функций Нo и Hr существуют функции построенные на других
рядах индикаторов: амидах (Ha), индолах и пр.
Марциано с соавторами была предложена универсальная функция Mc
построенная на индикаторах различной природы.
Экспериментальное определение функций кислотности построено на
определение ионизационного отношения I спектральными методами.
Метод Эйтса – МакКлеланда - Нх = m*Н0
Lg I = - mH0 + pK BH+
dHx/dH0
H2SO4
HClO4
HNO3
HCl
dHR/dH0
dHI/dH0
dH0'''/dH0
dHA/dH0
2,0
1,3
1,3
0,6
2,1
1,5
1,35
0,6
2,3
1,3
-
2,0
1,3
0,8
28.
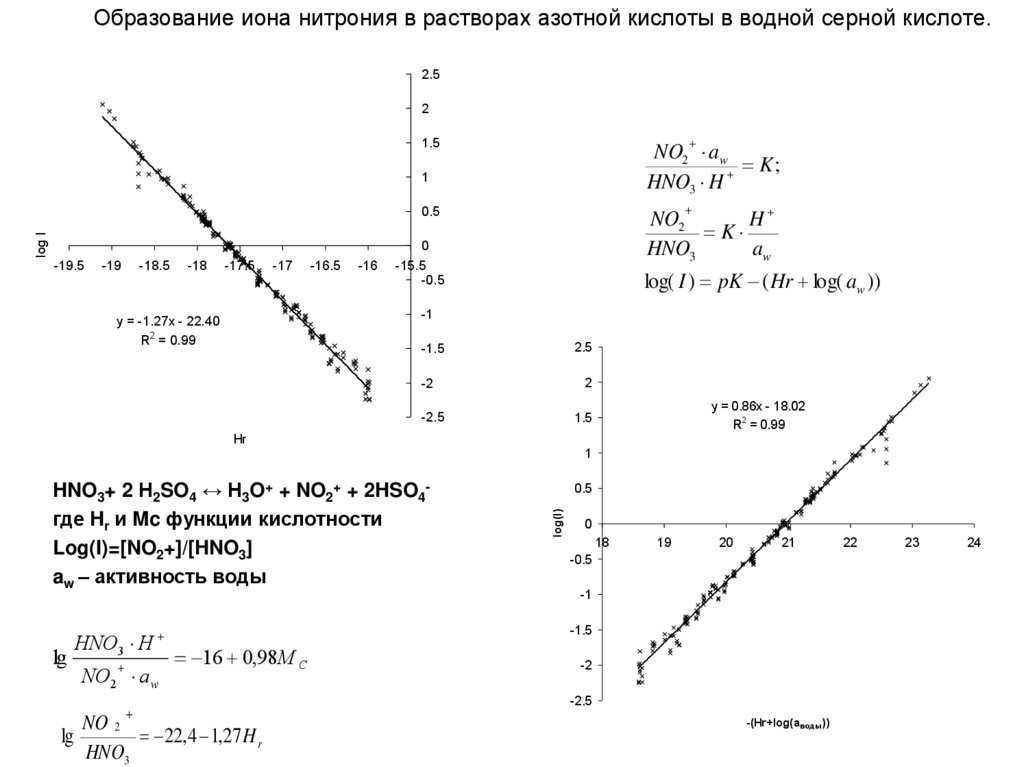
Образование иона нитрония в растворах азотной кислоты в водной серной кислоте.2.5
2
1.5
NO2 aw
K;
HNO3 H
1
NO2
H
K
HNO3
aw
log I
0.5
0
-19.5
-19
-18.5
-18
-17.5
-17
-16.5
-16
-15.5
-0.5
log( I ) pK ( Hr log( aw ))
-1
y = -1.27x - 22.40
R2 = 0.99
-1.5
2.5
-2
2
-2.5
1.5
y = 0.86x - 18.02
R2 = 0.99
Hr
1
lg
HNO3 H
NO2 a w
lg
0.5
log(I)
HNO3+ 2 Н2SO4 ↔ H3O+ + NO2+ + 2HSO4где Hr и Mc функции кислотности
Log(I)=[NO2+]/[HNO3]
aw – активность воды
0
18
19
20
21
-0.5
-1
-1.5
16 0,98M C
NO 2
22,4 1,27 H r
HNO3
-2
-2.5
-(Hr+log(aводы))
22
23
24
29.
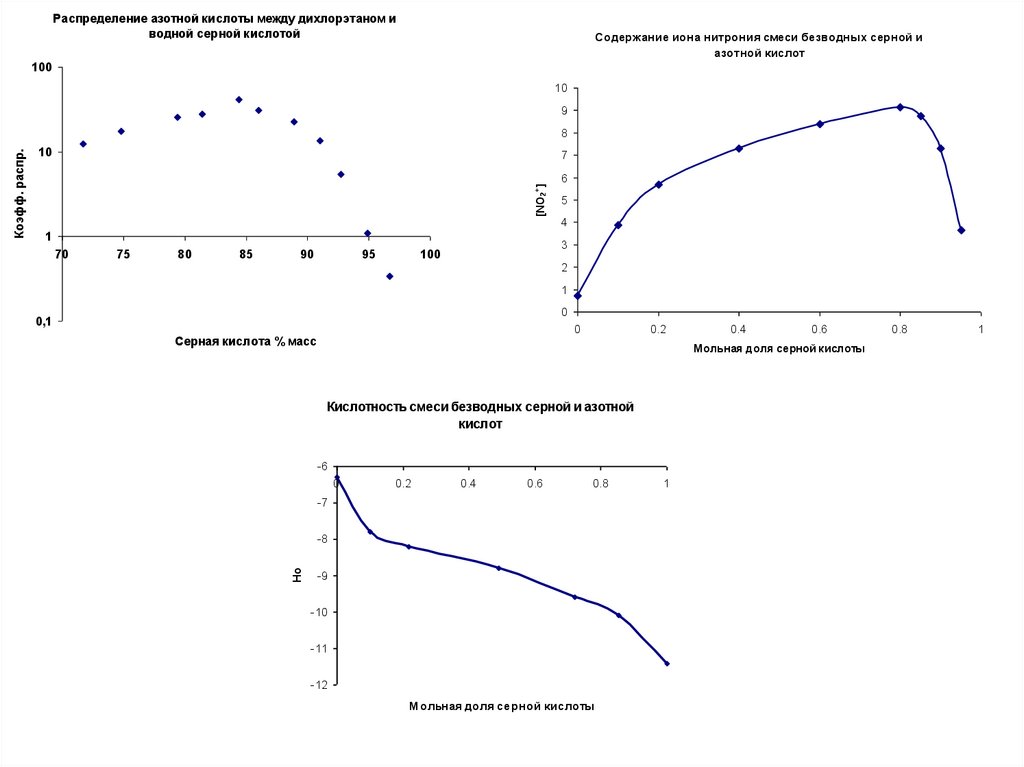
Распределение азотной кислоты между дихлорэтаном иводной серной кислотой
Содержание иона нитрония смеси безводных серной и
азотной кислот
100
10
9
[NO2+]
7
1
70
75
80
85
90
95
6
5
4
3
100
2
1
0
0,1
0
Серная кислота % масс
0.2
0.4
0.6
Мольная доля серной кислоты
Кислотность смеси безводных серной и азотной
кислот
-6
0
0.2
0.4
0.6
0.8
-7
-8
Но
Коэфф. распр.
8
10
-9
-10
-11
-12
Мольная доля серной кислоты
1
0.8
1
30.
• Лекция 331.
32.
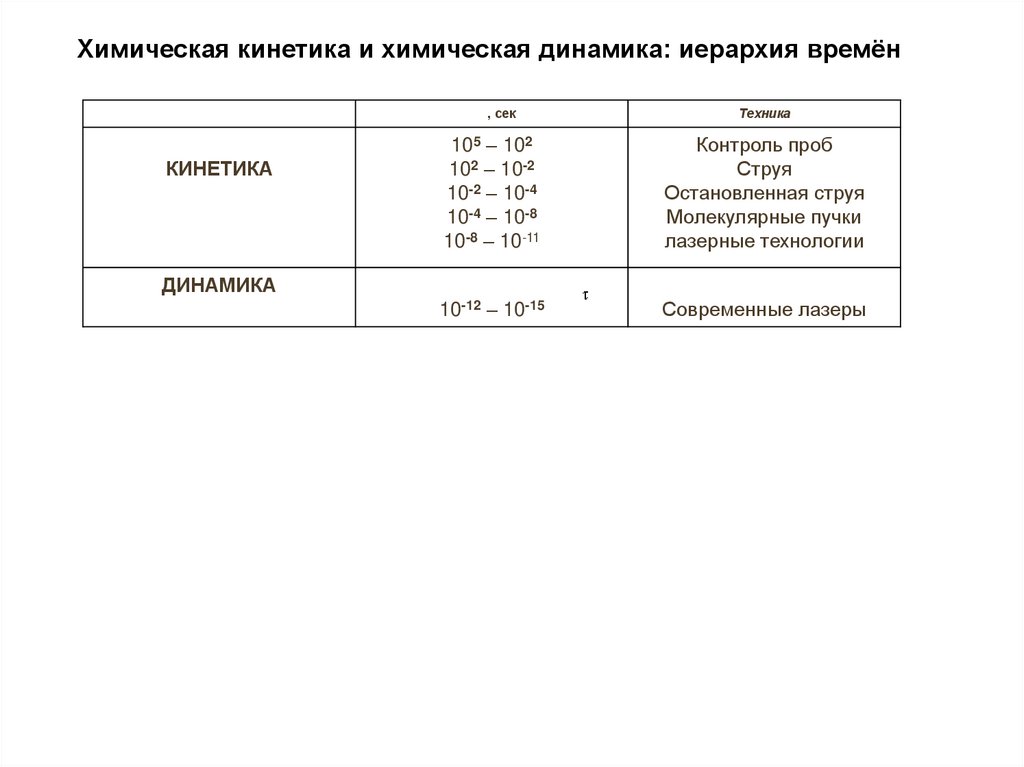
Химическая кинетика и химическая динамика: иерархия времён, сек
КИНЕТИКА
Техника
105 – 102
102 – 10-2
10-2 – 10-4
10-4 – 10-8
10-8 – 10-11
Контроль проб
Струя
Остановленная струя
Молекулярные пучки
лазерные технологии
10-12 – 10-15
Современные лазеры
ДИНАМИКА
33.
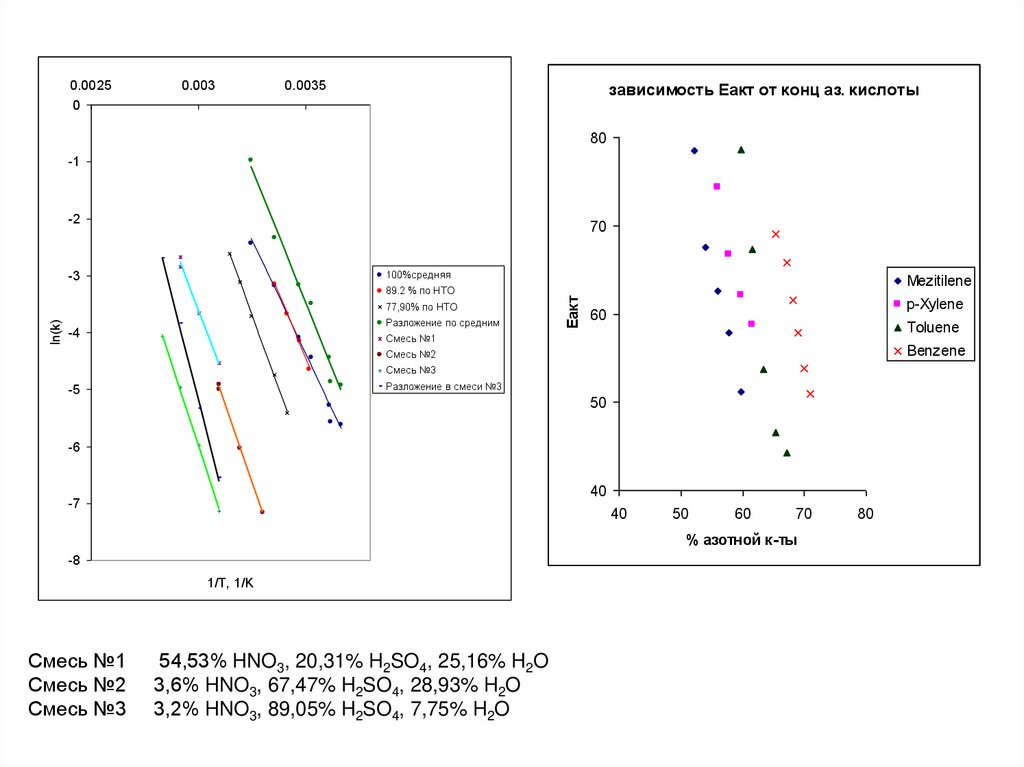
0.00250
0.003
0.0035
зависимость Еакт от конц аз. кислоты
80
-1
-2
70
-3
100%средняя
ln(k)
77,90% по НТО
Разложение по средним
-4
Mezitilene
Еакт
89.2 % по НТО
p-Xylene
60
Toluene
Смесь №1
Benzene
Смесь №2
Смесь №3
Разложение в смеси №3
-5
50
-6
40
-7
40
50
60
70
% азотной к-ты
-8
1/T, 1/K
Смесь №1
Смесь №2
Смесь №3
54,53% HNO3, 20,31% H2SO4, 25,16% H2O
3,6% HNO3, 67,47% H2SO4, 28,93% H2O
3,2% HNO3, 89,05% H2SO4, 7,75% H2O
80
34.
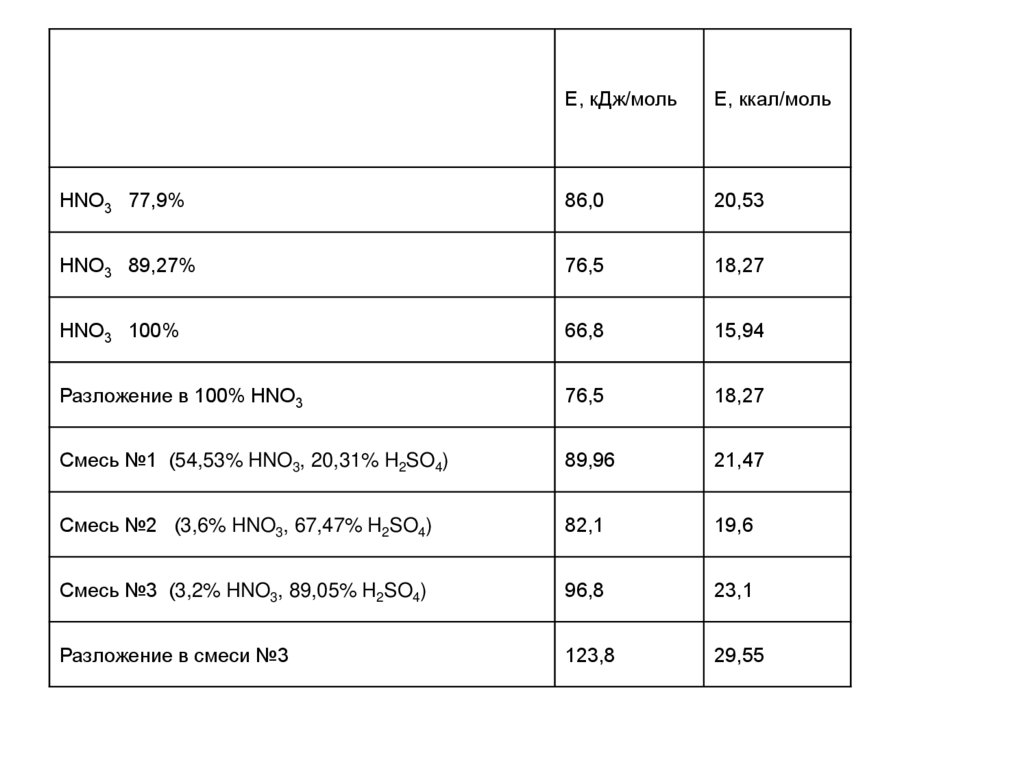
Е, кДж/мольЕ, ккал/моль
HNO3 77,9%
86,0
20,53
HNO3 89,27%
76,5
18,27
HNO3 100%
66,8
15,94
Разложение в 100% HNO3
76,5
18,27
Смесь №1 (54,53% HNO3, 20,31% H2SO4)
89,96
21,47
Смесь №2 (3,6% HNO3, 67,47% H2SO4)
82,1
19,6
Смесь №3 (3,2% HNO3, 89,05% H2SO4)
96,8
23,1
Разложение в смеси №3
123,8
29,55
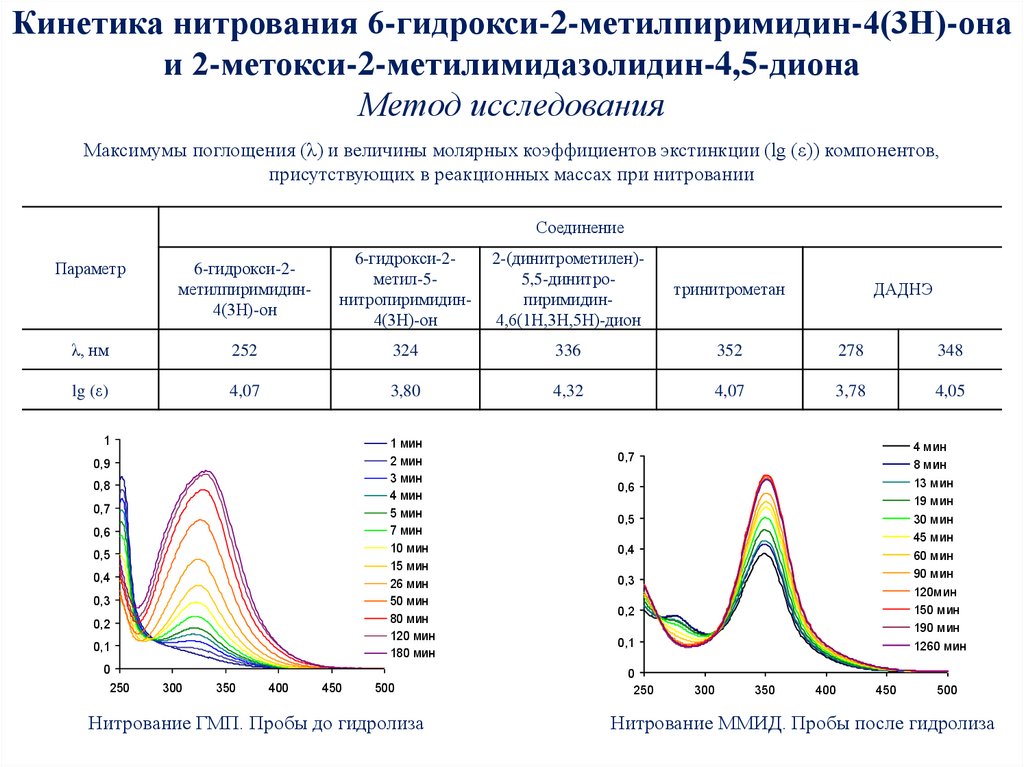
35. Кинетика нитрования 6-гидрокси-2-метилпиримидин-4(3Н)-она и 2-метокси-2-метилимидазолидин-4,5-диона Метод исследования
Максимумы поглощения (λ) и величины молярных коэффициентов экстинкции (lg (ε)) компонентов,присутствующих в реакционных массах при нитровании
Соединение
6-гидрокси-2метилпиримидин4(3Н)-он
6-гидрокси-2метил-5нитропиримидин4(3Н)-он
2-(динитрометилен)5,5-динитропиримидин4,6(1Н,3Н,5Н)-дион
тринитрометан
λ, нм
252
324
336
352
278
348
lg (ε)
4,07
3,80
4,32
4,07
3,78
4,05
Параметр
1
1 мин
2 мин
3 мин
4 мин
5 мин
7 мин
10 мин
15 мин
26 мин
50 мин
80 мин
120 мин
180 мин
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
250
300
350
400
450
500
Нитрование ГМП. Пробы до гидролиза
ДАДНЭ
4 мин
8 мин
13 мин
19 мин
30 мин
45 мин
60 мин
90 мин
120мин
150 мин
190 мин
1260 мин
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
250
300
350
400
450
500
Нитрование ММИД. Пробы после гидролиза
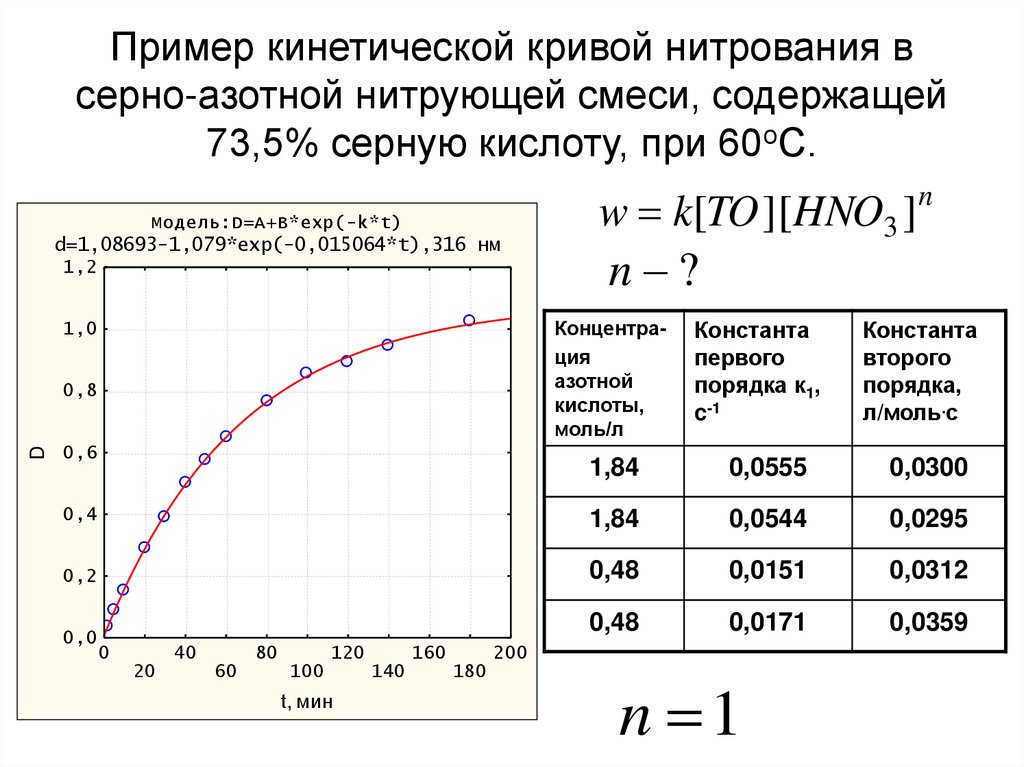
36. Пример кинетической кривой нитрования в серно-азотной нитрующей смеси, содержащей 73,5% серную кислоту, при 60оС.
Модель:D=A+B*exp(-k*t)d=1,08693-1,079*exp(-0,015064*t),316 нм
1,2
n ?
Концентрация
азотной
кислоты,
моль/л
Константа
первого
порядка к1,
c-1
Константа
второго
порядка,
л/моль.с
1,84
0,0555
0,0300
0,4
1,84
0,0544
0,0295
0,2
0,48
0,0151
0,0312
0,48
0,0171
0,0359
1,0
0,8
D
w k[TO ][HNO3 ]n
0,6
0,0
0
40
20
80
60
120
100
t, мин
160
140
200
180
n 1
37.
OH2N
O
N
H
O
+NO2+ k1
H2N
NH2
O
N
H
HN
NH
+
NO2 +H k-2
+H+ k-1
NO2
O
N
H
NH
NO2
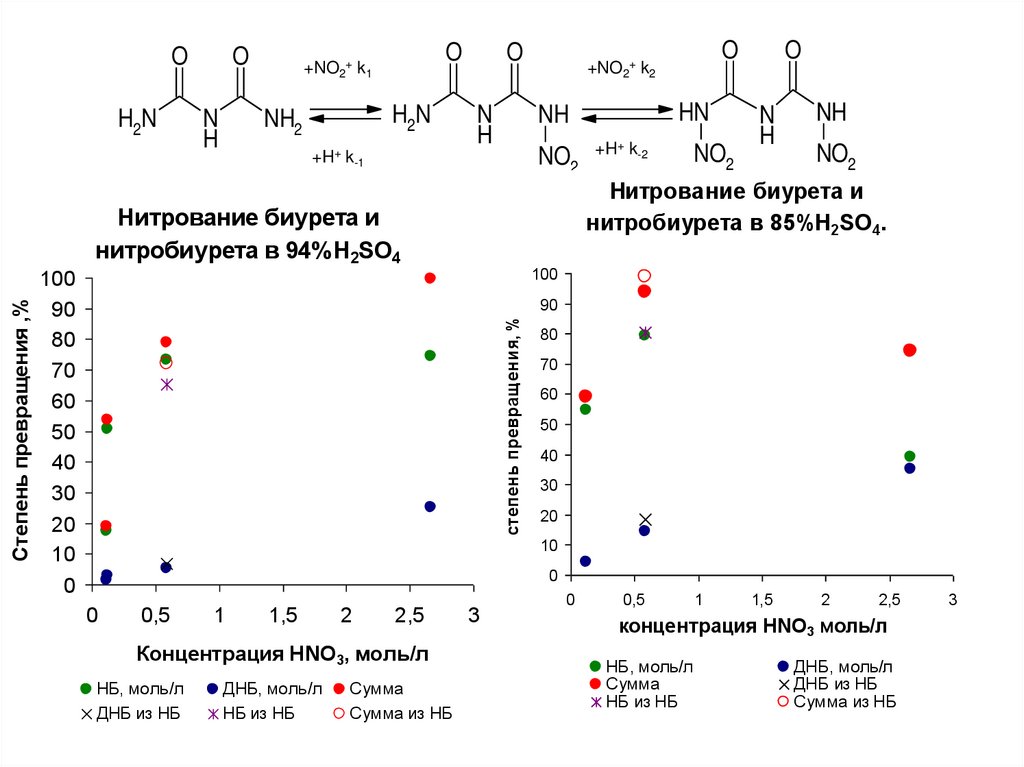
Нитрование биурета и
нитробиурета в 85%H2SO4.
Нитрование биурета и
нитробиурета в 94%H2SO4
100
100
90
80
70
60
50
40
30
20
10
0
90
степень превращения, %
Степень превращения ,%
O
+NO2+ k2
80
70
60
50
40
30
20
10
0
0
0,5
1
1,5
2
2,5
Концентрация HNO3, моль/л
НБ, моль/л
ДНБ из НБ
ДНБ, моль/л
НБ из НБ
Сумма
Сумма из НБ
3
0
0,5
1
1,5
2
2,5
концентрация HNO3 моль/л
НБ, моль/л
Сумма
НБ из НБ
ДНБ, моль/л
ДНБ из НБ
Сумма из НБ
3
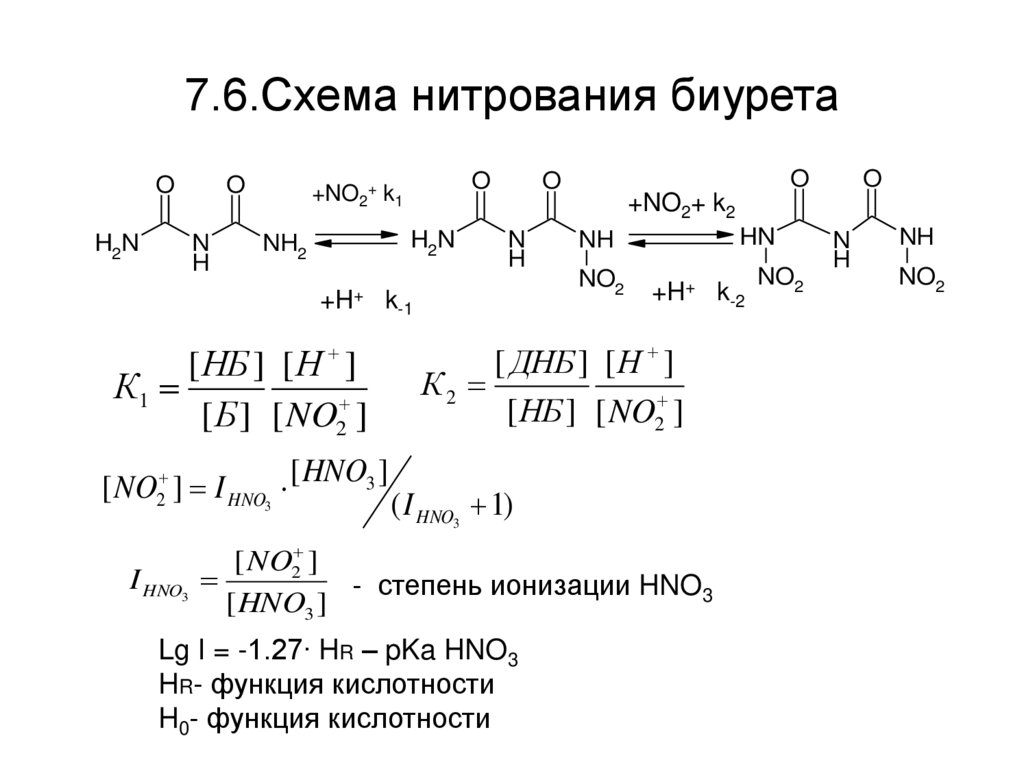
38. 7.6.Схема нитрования биурета
OH2N
O
N
H
O
+NO2+ k1
H2N
NH2
+H+
[ NO2 ] I HNO3
N
H
k-1
[ НБ ] [ Н ]
К1
[ Б ] [ NO2 ]
[ HNO3 ]
O
O
+NO2+ k2
HN
NH
NO2
+H+ k-2
[ ДНБ ] [ Н ]
К2
[ НБ ] [ NO2 ]
( I HNO3 1)
[ NO2 ]
I HNO3
- степень ионизации HNO3
[ HNO3 ]
Lg I = -1.27∙ HR – pKa HNO3
HR- функция кислотности
H0- функция кислотности
O
NO2
N
H
NH
NO2
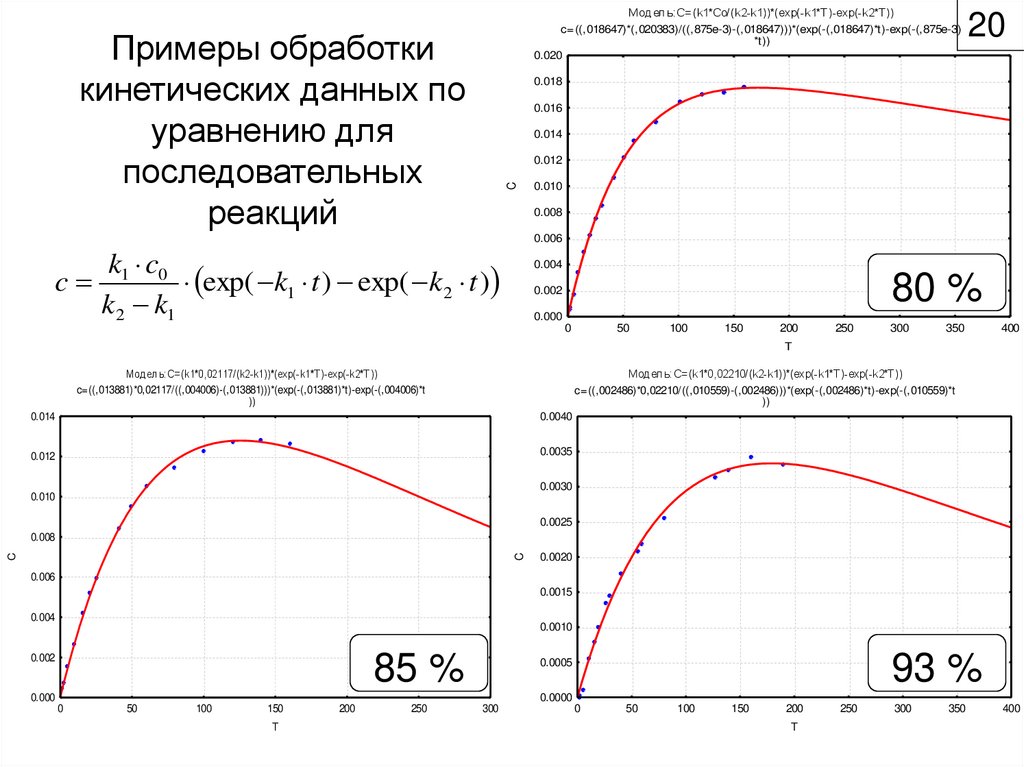
39. Примеры обработки кинетических данных по уравнению для последовательных реакций
Модель:C=(k1*Co/(k2-k1))*(exp(-k1*T)-exp(-k2*T))c=((,018647)*(,020383)/((,875e-3)-(,018647)))*(exp(-(,018647)*t)-exp(-(,875e-3)
*t))
0.020
Примеры обработки
кинетических данных по
уравнению для
последовательных
реакций
20
0.018
0.016
0.014
C
0.012
0.010
0.008
0.006
k c
c 1 0 exp( k1 t ) exp( k 2 t )
k 2 k1
0.004
80 %
0.002
0.000
0
50
100
150
200
250
300
350
400
T
Модель:C=(k1*0,02117/(k2-k1))*(exp(-k1*T)-exp(-k2*T))
c=((,013881)*0,02117/((,004006)-(,013881)))*(exp(-(,013881)*t)-exp(-(,004006)*t
))
Модель:C=(k1*0,02210/(k2-k1))*(exp(-k1*T)-exp(-k2*T))
c=((,002486)*0,02210/((,010559)-(,002486)))*(exp(-(,002486)*t)-exp(-(,010559)*t
))
0.014
0.0040
0.012
0.0035
0.0030
0.010
0.0025
C
C
0.008
0.0020
0.006
0.0015
0.004
0.0010
85 %
0.002
93 %
0.0005
0.0000
0.000
0
50
100
150
T
200
250
300
0
50
100
150
200
T
250
300
350
400
40.
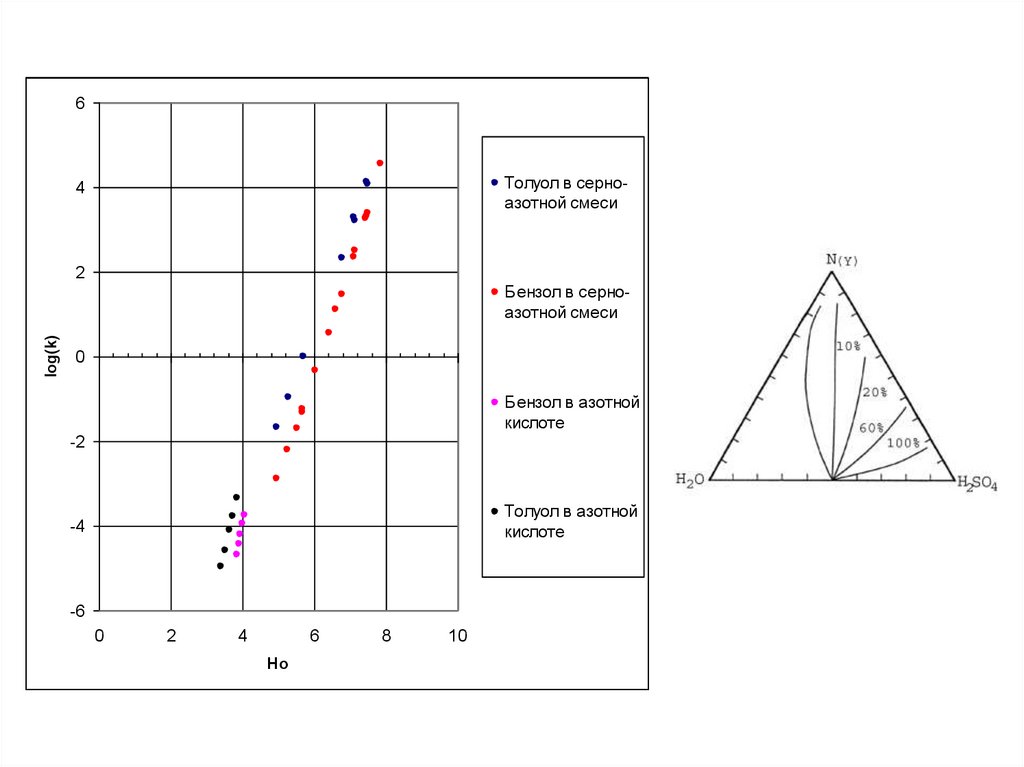
6Толуол в серноазотной смеси
4
2
log(k)
Бензол в серноазотной смеси
0
Бензол в азотной
кислоте
-2
Толуол в азотной
кислоте
-4
-6
0
2
4
6
Ho
8
10
41.
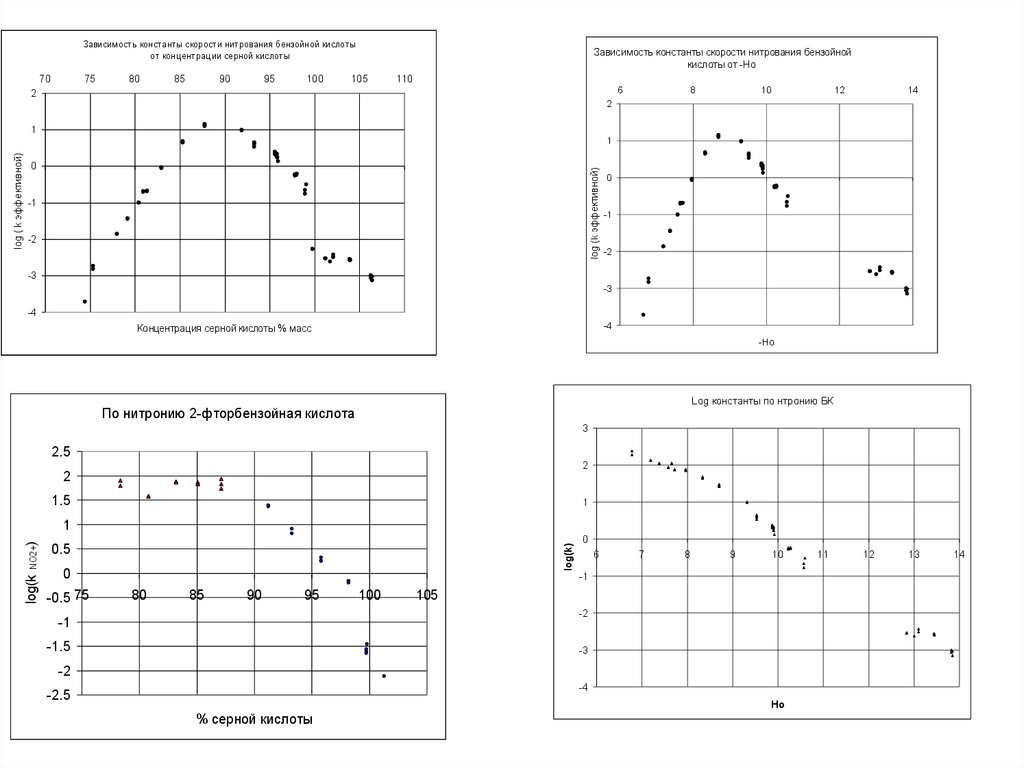
Зависимость константы скорости нитрования бензойной кислотыот концентрации серной кислоты
70
75
80
85
90
95
100
Зависимость константы скорости нитрования бензойной
кислоты от -Но
105
110
6
2
8
10
12
14
2
1
log (k эффективной)
0
-1
-2
0
-1
-2
-3
-3
-4
-4
Концентрация серной кислоты % масс
-Но
Log константы по нтронию БК
По нитронию 2-фторбензойная кислота
3
2.5
2
2
1.5
1
1
0.5
log(k)
log(k NO2+)
log ( k эффективной)
1
0
-0.5 75
80
85
90
95
100
0
6
7
8
9
10
-1
105
-2
-1
-1.5
-3
-2
-4
-2.5
Ho
% серной кислоты
11
12
13
14
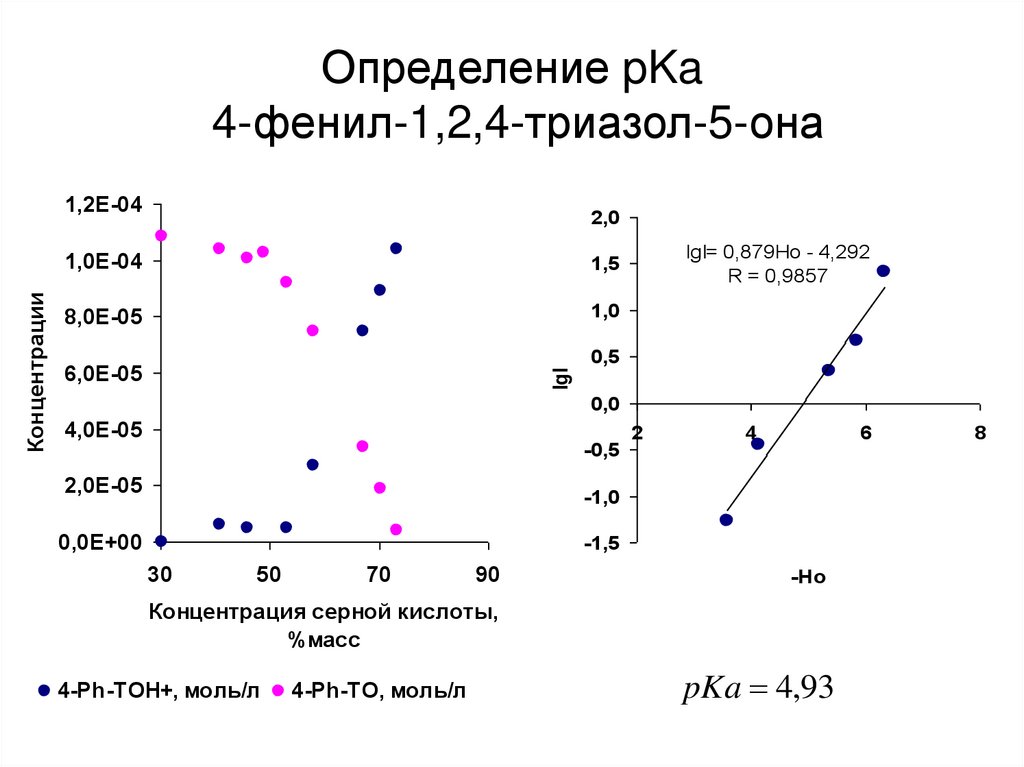
42. Определение pKa 4-фенил-1,2,4-триазол-5-она
2,01,0E-04
1,5
8,0E-05
1,0
lgI= 0,879Ho - 4,292
R = 0,9857
0,5
6,0E-05
lgI
Концентрации
1,2E-04
0,0
4,0E-05
-0,5
2,0E-05
2
4
6
-1,0
0,0E+00
-1,5
30
50
70
90
-Ho
Концентрация серной кислоты,
%масс
4-Ph-ТОН+, моль/л
4-Ph-ТО, моль/л
pKa 4,93
8
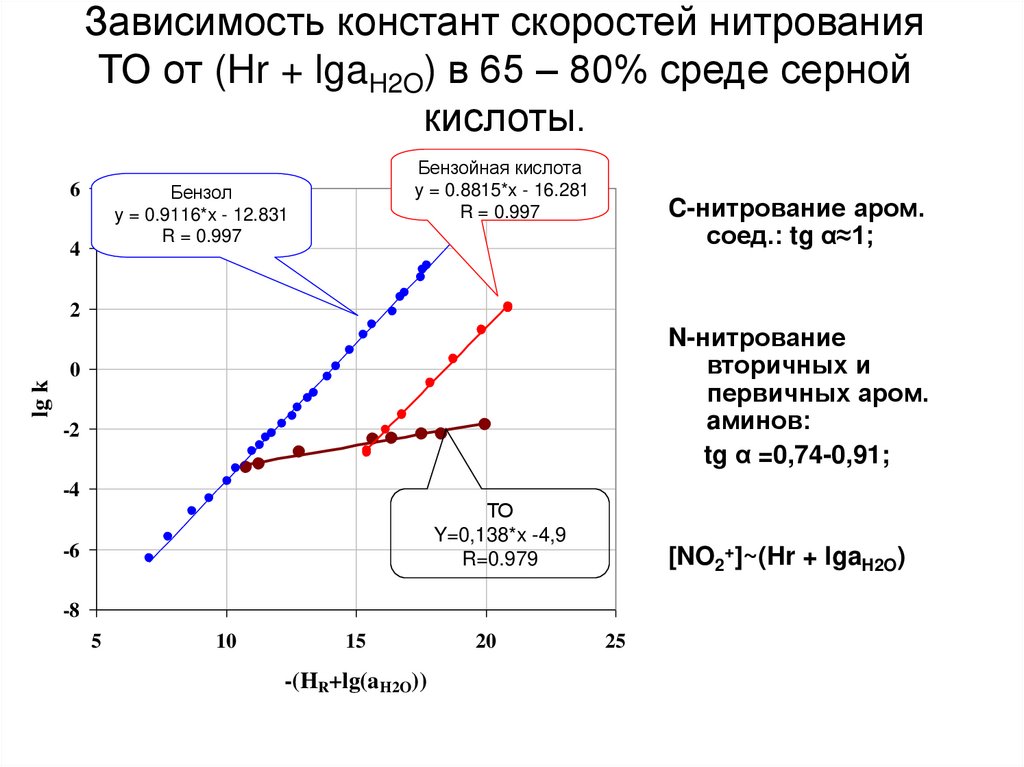
43. Зависимость констант скоростей нитрования ТО от (Hr + lgaH2O) в 65 – 80% среде серной кислоты.
6Бензойная кислота
y = 0.8815*x - 16.281
R = 0.997
Бензол
y = 0.9116*x - 12.831
R = 0.997
4
C-нитрование аром.
соед.: tg α≈1;
lg k
2
N-нитрование
вторичных и
первичных аром.
aминов:
tg α =0,74-0,91;
0
-2
-4
ТО
Y=0,138*x -4,9
R=0.979
-6
[NO2+]~(Hr + lgaH2O)
-8
5
10
15
-(HR+lg(aH2O))
20
25
44.
10log K fb, л/моль*с
8
6
4
с
2
0
-2
-2
-4
Но
-6
-8
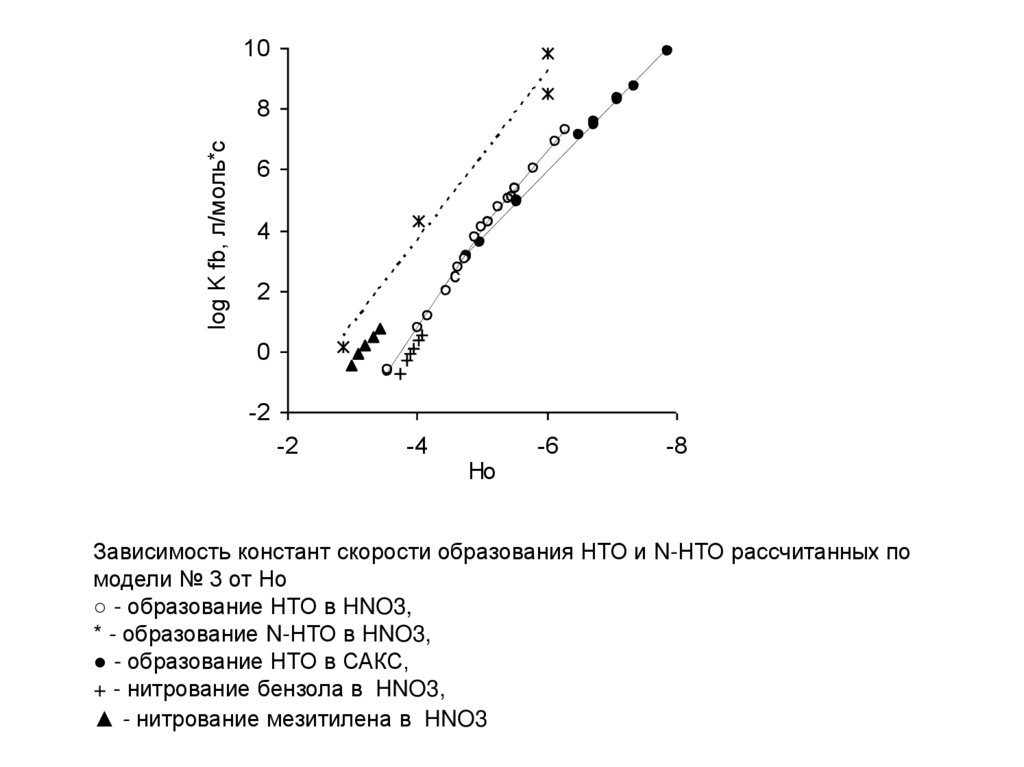
Зависимость констант скорости образования НТО и N-НТО рассчитанных по
модели № 3 от Но
○ - образование НТО в HNO3,
* - образование N-НТО в HNO3,
● - образование НТО в САКС,
+ - нитрование бензола в HNO3,
▲ - нитрование мезитилена в HNO3
45.
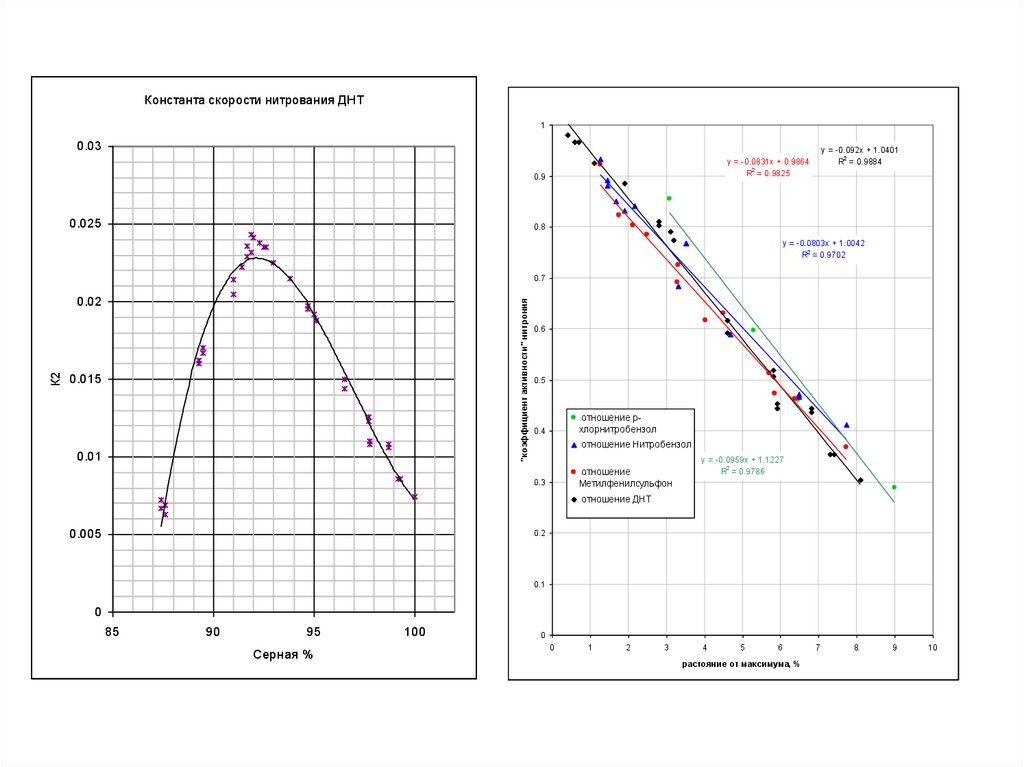
Константа скорости нитрования ДНТ1
0.03
0.9
0.025
y = -0.092x + 1.0401
R2 = 0.9884
y = -0.0831x + 0.9864
R2 = 0.9825
0.8
y = -0.0803x + 1.0042
R2 = 0.9702
0.7
"коэффициент активности" нитрония
К2
0.02
0.015
0.01
0.6
0.5
отношение рхлорнитробензол
0.4
отношение Нитробензол
отношение
Метилфенилсульфон
0.3
y = -0.0959x + 1.1227
R2 = 0.9786
отношение ДНТ
0.005
0.2
0.1
0
85
90
95
Серная %
100
0
0
1
2
3
4
5
6
растояние от максимума, %
7
8
9
10
46.
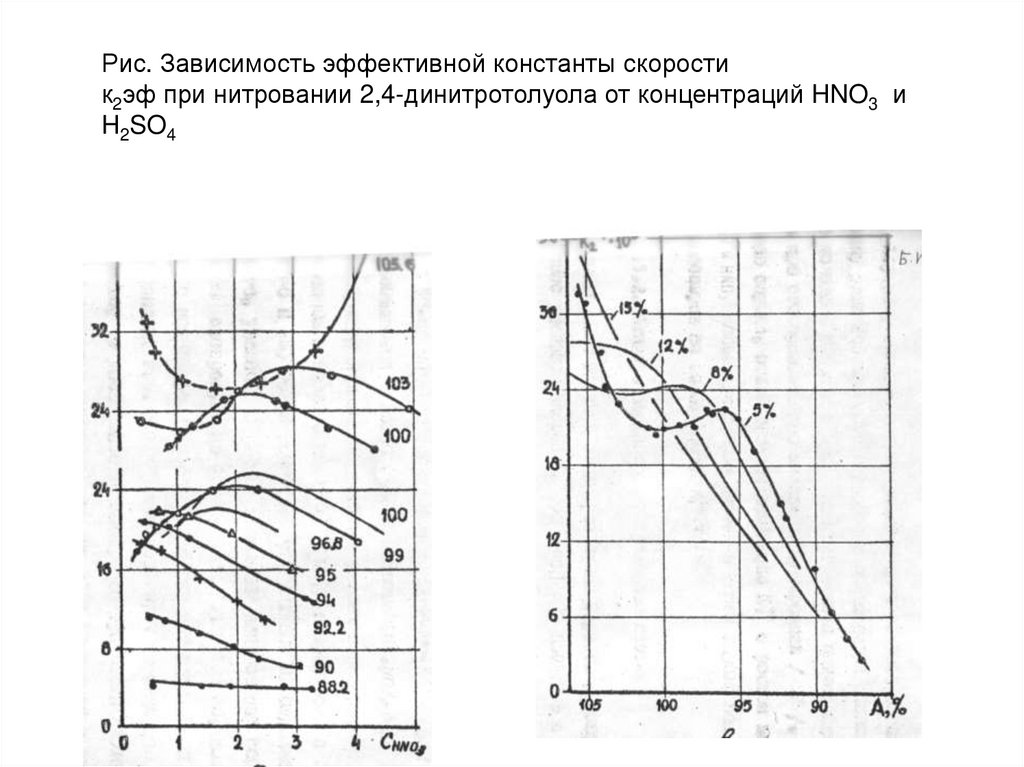
Рис. Зависимость эффективной константы скоростик2эф при нитровании 2,4-динитротолуола от концентраций HNO3 и
H2SO4
47.
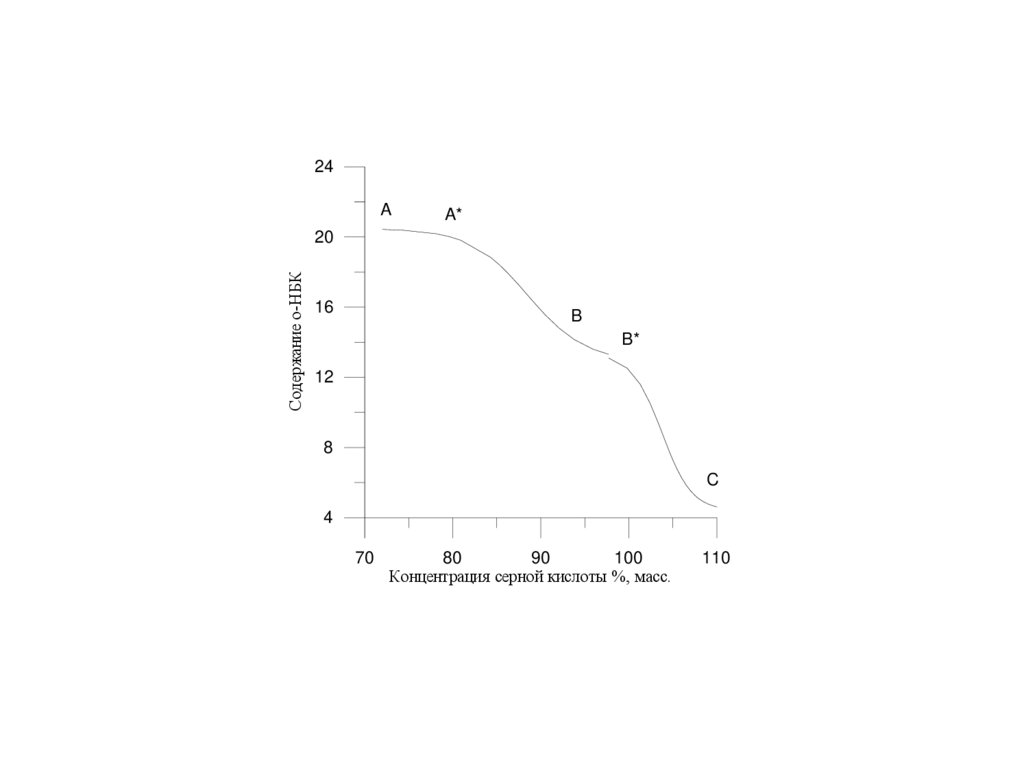
24A
A*
Содержание о-НБК
20
16
B
B*
12
8
C
4
70
80
90
100
Концентрация серной кислоты %, масс.
110
48.
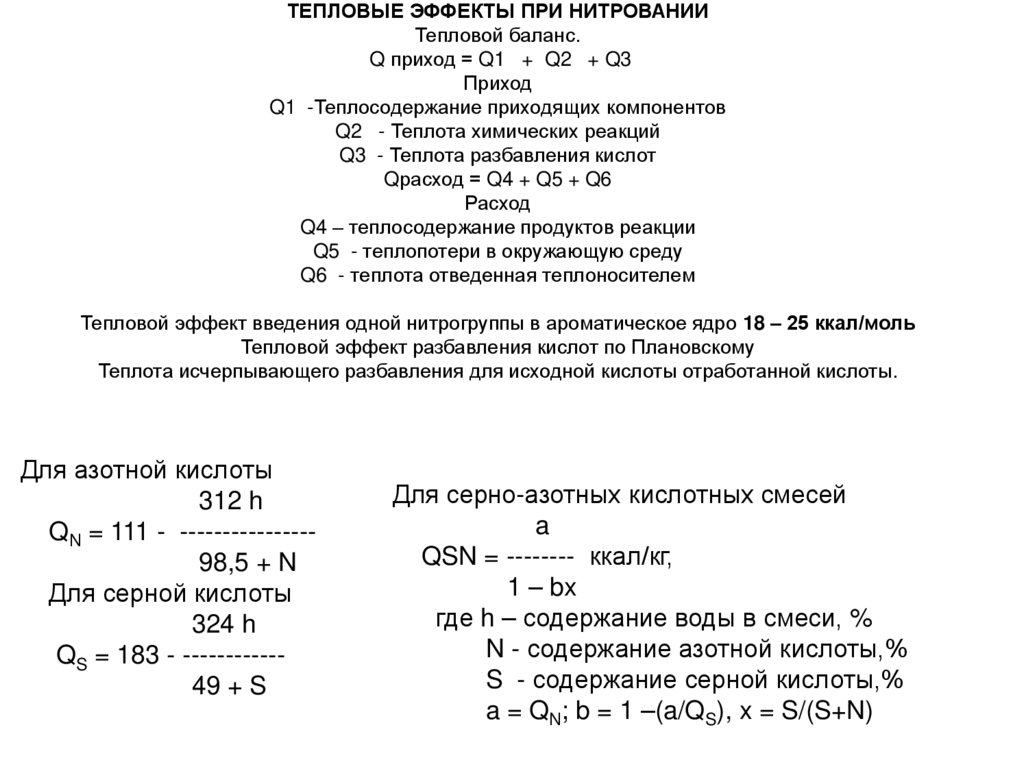
ТЕПЛОВЫЕ ЭФФЕКТЫ ПРИ НИТРОВАНИИТепловой баланс.
Q приход = Q1 + Q2 + Q3
Приход
Q1 -Теплосодержание приходящих компонентов
Q2 - Теплота химических реакций
Q3 - Теплота разбавления кислот
Qрасход = Q4 + Q5 + Q6
Расход
Q4 – теплосодержание продуктов реакции
Q5 - теплопотери в окружающую среду
Q6 - теплота отведенная теплоносителем
Тепловой эффект введения одной нитрогруппы в ароматическое ядро 18 – 25 ккал/моль
Тепловой эффект разбавления кислот по Плановскому
Теплота исчерпывающего разбавления для исходной кислоты отработанной кислоты.
Для азотной кислоты
312 h
QN = 111 - ---------------98,5 + N
Для серной кислоты
324 h
QS = 183 - -----------49 + S
Для серно-азотных кислотных смесей
a
QSN = -------- ккал/кг,
1 – bx
где h – содержание воды в смеси, %
N - содержание азотной кислоты,%
S - содержание серной кислоты,%
a = QN; b = 1 –(a/QS), x = S/(S+N)
49.
• Суммарный тепловой эффектнитрования при получении
• мононитротолуола ~ 123 кДж/мол (29
ккал/моль)
• динитротолуола ~ 139 кДж/моль (33
ккал/моль)
• тринитротолуола ~ 105 кДж/моль (25
ккал/моль)
50.
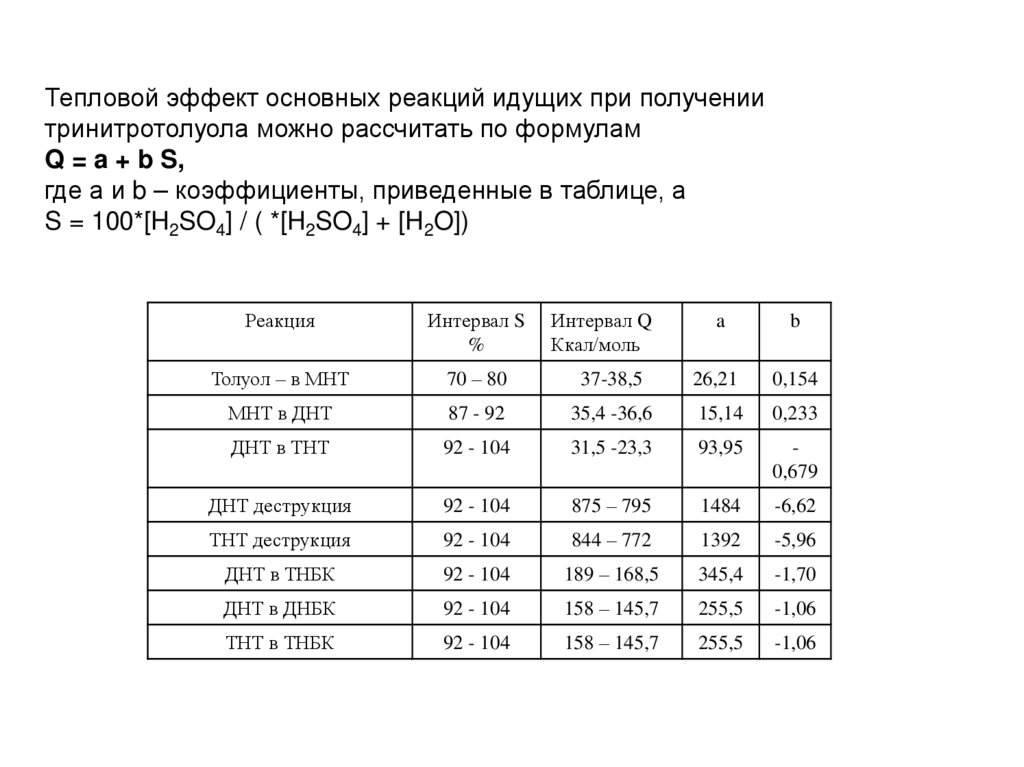
Тепловой эффект основных реакций идущих при получениитринитротолуола можно рассчитать по формулам
Q = a + b S,
где а и b – коэффициенты, приведенные в таблице, а
S = 100*[H2SO4] / ( *[H2SO4] + [H2O])
Реакция
Интервал S
%
Интервал Q
Ккал/моль
a
b
Толуол – в МНТ
70 – 80
37-38,5
26,21
0,154
МНТ в ДНТ
87 - 92
35,4 -36,6
15,14
0,233
ДНТ в ТНТ
92 - 104
31,5 -23,3
93,95
0,679
ДНТ деструкция
92 - 104
875 – 795
1484
-6,62
ТНТ деструкция
92 - 104
844 – 772
1392
-5,96
ДНТ в ТНБК
92 - 104
189 – 168,5
345,4
-1,70
ДНТ в ДНБК
92 - 104
158 – 145,7
255,5
-1,06
ТНТ в ТНБК
92 - 104
158 – 145,7
255,5
-1,06
51.
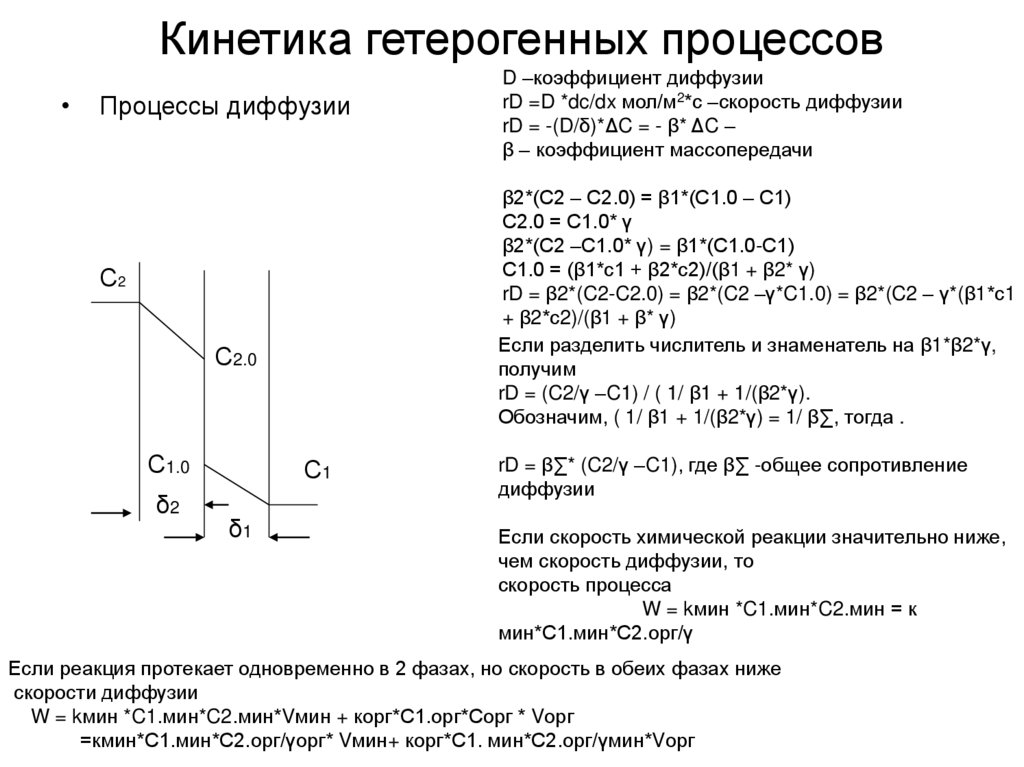
rD = β∑* (C2/γ –C1),где β∑ -общее сопротивление диффузии
Если скорость химической реакции значительно ниже, чем скорость диффузии, то
скорость процесса
W = kмин *C 1.мин*C 2.мин = к мин*С1.мин*С2.орг/γ
Если реакция протекает одновременно в 2 фазах, и скорость в обеих фазах ниже
скорости диффузии
W = kмин *C 1.мин*C 2.мин*Vмин + корг*С1.орг*Сорг * Vорг
=кмин*С1.мин*С2.орг/γорг* Vмин+ корг *С 1. мин *С2.орг/γмин*Vорг
С2
Скорость химической реакции выше скорости диффузии
β2*(С2 –С2.0) = β1*(С1.0 – 0)*δ1/Х = βА*(СА – 0)*δ1/(δ1-Х)
С2.0 = γ*С1.0; Х/δ1 = (С2 –βА*СА/β2)/(С2 + γ*βА*СА/β1)
С2.0
rD = (C2/γ +βA*CA/β1)/(1/β1 + 1/γβ2)
С1.0
СА
δ2
δ1-х
0
rD = β∑* (C2/γ + βА*СА/ β1)
52. Кинетика гетерогенных процессов
Процессы диффузии
β2*(С2 – С2.0) = β1*(С1.0 – С1)
С2.0 = С1.0* γ
β2*(С2 –С1.0* γ) = β1*(С1.0-С1)
С1.0 = (β1*с1 + β2*с2)/(β1 + β2* γ)
rD = β2*(C2-C2.0) = β2*(C2 –γ*C1.0) = β2*(C2 – γ*(β1*с1
+ β2*с2)/(β1 + β* γ)
Если разделить числитель и знаменатель на β1*β2*γ,
получим
rD = (C2/γ –C1) / ( 1/ β1 + 1/(β2*γ).
Обозначим, ( 1/ β1 + 1/(β2*γ) = 1/ β∑, тогда .
С2
С2.0
С1.0
δ2
С1
δ1
D –коэффициент диффузии
rD =D *dc/dx мол/м2*с –скорость диффузии
rD = -(D/δ)*ΔC = - β* ΔC –
β – коэффициент массопередачи
rD = β∑* (C2/γ –C1), где β∑ -общее сопротивление
диффузии
Если скорость химической реакции значительно ниже,
чем скорость диффузии, то
скорость процесса
W = kмин *C1.мин*C2.мин = к
мин*С1.мин*С2.орг/γ
Если реакция протекает одновременно в 2 фазах, но скорость в обеих фазах ниже
скорости диффузии
W = kмин *C1.мин*C2.мин*Vмин + корг*С1.орг*Сорг * Vорг
=кмин*С1.мин*С2.орг/γорг* Vмин+ корг*С1. мин*С2.орг/γмин*Vорг
53. Влияние азотистой кислоты
В водных растворах H2SO4 и HClO4 (с концентрацией менее 50%) HNO2 присутствуетпреимущественно в молекулярной форме, хотя имеется и N2O3. В кислотах с концентрацией 6065% присутствует в основном NO+ , что доказано методом Раман-спектроскопии. В избытке азотной
кислоты HNO2 существует преимущественно как N2O4, который почти полностью ионизирован по
уравнению
N2O4
NO+ + NO3-,
В системах, содержащих органический растворитель и азотную кислоту, N2O4 ионизирован
слабо.
Представления о нитровании высокоактивных ArH разбавленной азотной кислотой
или серно-азотными кислотными смесями с высоким содержанием воды были
наиболее
четко
сформулированы
А.И.
Титовым.
Нитрование
высокореакционноспособных ArH в таких нитрующих системах протекает только в
присутствии азотистой кислоты и электрофильный агент - нитрозоний-ион.
Реакция протекает даже в среде 3% HNO3. Изучение этих процессов в более
концентрированных водных растворах HNO3, проведенное
Ингольдом с
сотрудниками, показало одновременное протекание двух реакций: нитрование NO2+ по
нулевому порядку и каталитический процесс, скорость которого может быть описана
уравнением
W = k2 . [ArH] . [HNO2]
54.
Изучение кинетики каталитического процесса строго доказало первоначальное
нитрозирование с последующим быстрым окислением С-нитрозосоединения и
регенерацией HNO2.
медленно
быстро
ArH + HNO2→ ArNO + H2O
ArNO + HNO3 → ArNO2 + HNO2
Активный нитрозирующий агент - NO+ образуется из HNO2 через H2NO2+ либо при
ионизации N2O4 или N2O3. Следует отметить, что окисление не идет в отсутствие
азотистой кислоты. Если реакцию быстро прервать, то можно зафиксировать образование
п-нитрозофенола. Соотношение о- : п-изомеров (9 : 91) при катализируемой реакции в
водной среде остается таким же, как при получении нитрозофенолов в отсутствие HNO3.
Ингольд назвал нитрование через нитрозирование «специальным» нитрованием. Оно
характерно для замещенных фенолов и анилинов, но для менее активных соединений
строго не доказано.
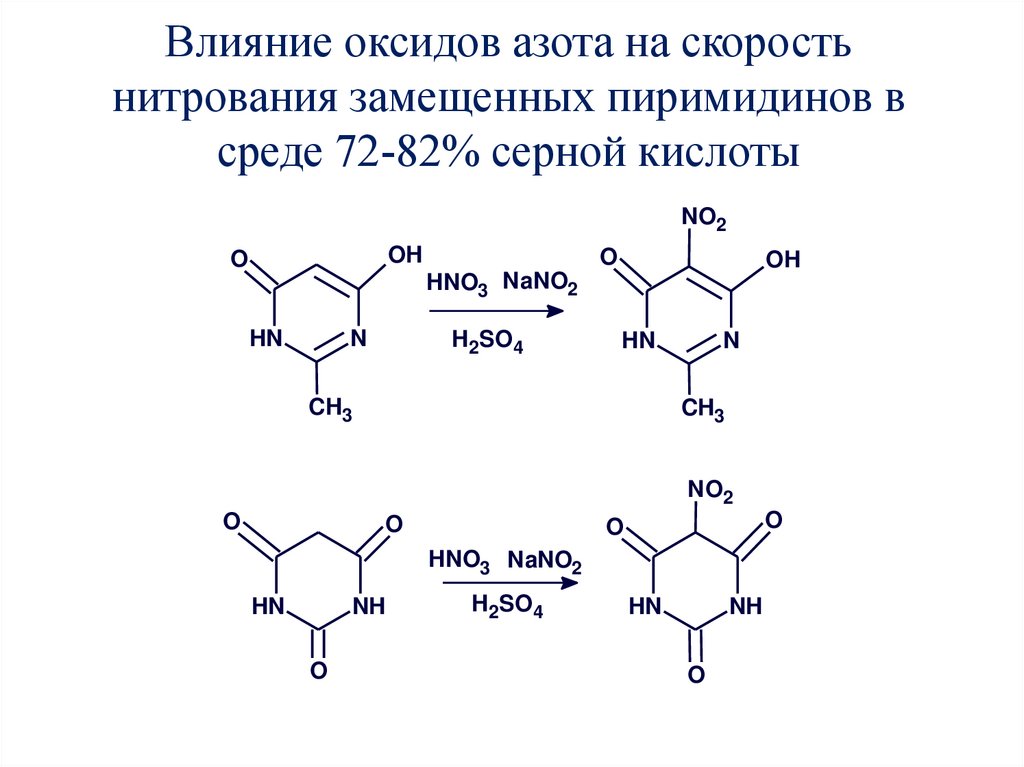
55. Влияние оксидов азота на скорость нитрования замещенных пиримидинов в среде 72-82% серной кислоты
NO2OH
O
O
OH
HNO3 NaNO2
N
HN
H2SO4
N
HN
CH3
CH3
NO2
O
O
O
O
HNO3 NaNO2
NH
HN
O
H2SO4
NH
HN
O
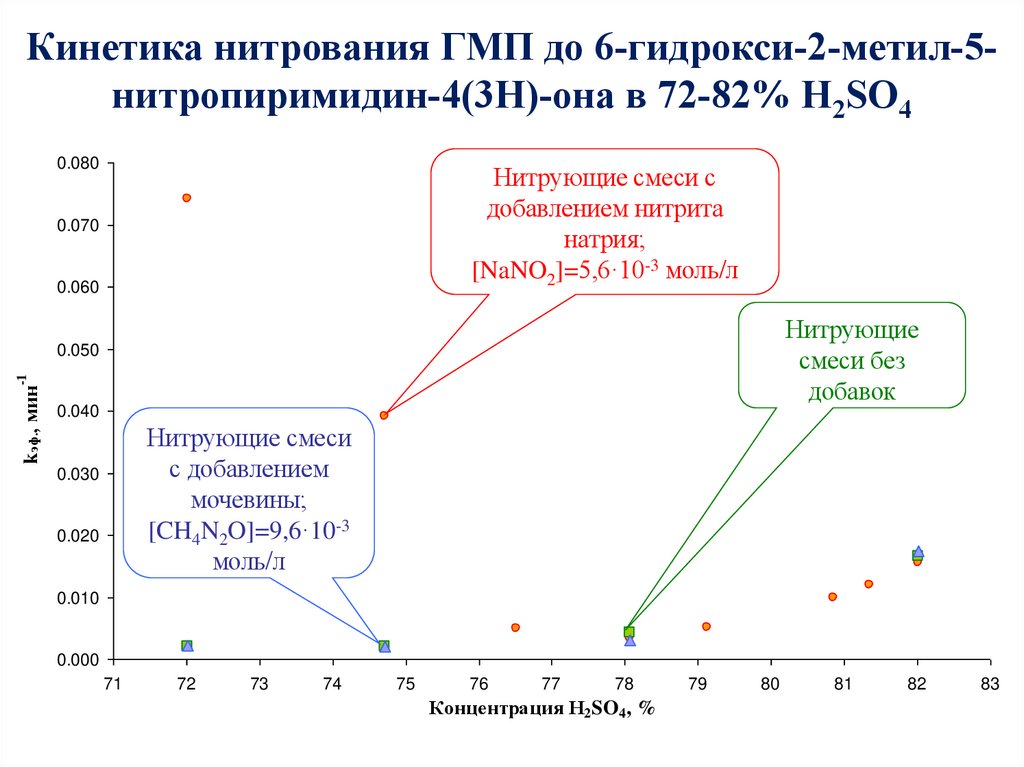
56. Кинетика нитрования ГМП до 6-гидрокси-2-метил-5-нитропиримидин-4(3Н)-она в 72-82% H2SO4
Кинетика нитрования ГМП до 6-гидрокси-2-метил-5нитропиримидин-4(3Н)-она в 72-82% H2SO40.080
Нитрующие смеси с
добавлением нитрита
натрия;
[NaNO2]=5,6·10-3 моль/л
0.070
0.060
Нитрующие
смеси без
добавок
kэф., мин
-1
0.050
0.040
Нитрующие смеси
с добавлением
мочевины;
[CH4N2O]=9,6·10-3
моль/л
0.030
0.020
0.010
0.000
71
72
73
74
75
76
77
78
Концентрация H2SO4, %
79
80
81
82
83
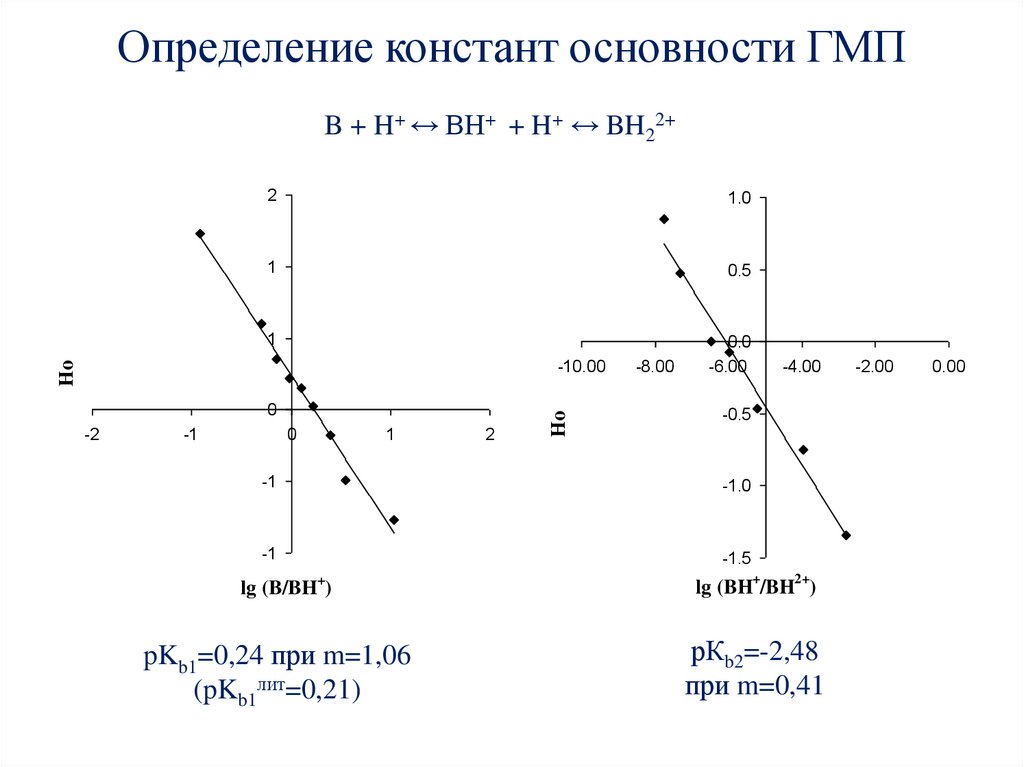
57. Определение констант основности ГМП
B + H+ ↔ BH+ + H+ ↔ BH22+2
1.0
1
0.5
1
0.0
-6.00
0
-2
-1
0
1
-1
2
Ho
Ho
-10.00
-8.00
-4.00
-0.5
-1.0
-1
-1.5
lg (B/BH )
lg (BH+/BH2+)
pKb1=0,24 при m=1,06
(pKb1лит=0,21)
рКb2=-2,48
при m=0,41
+
-2.00
0.00
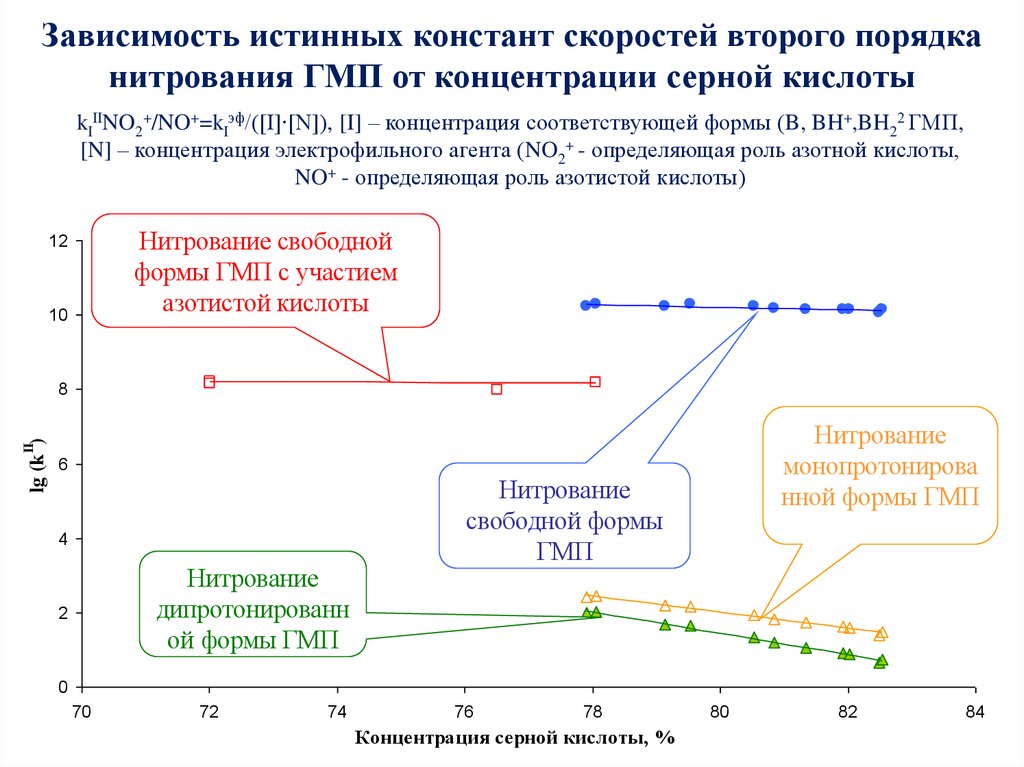
58. Зависимость истинных констант скоростей второго порядка нитрования ГМП от концентрации серной кислоты
kIIINO2+/NO+=kIэф/([I]∙[N]), [I] – концентрация соответствующей формы (B, BH+,BH22 ГМП,[N] – концентрация электрофильного агента (NO2+ - определяющая роль азотной кислоты,
NO+ - определяющая роль азотистой кислоты)
Нитрование свободной
формы ГМП с участием
азотистой кислоты
12
10
Нитрование
монопротонирова
нной формы ГМП
II
lg (k )
8
6
4
Нитрование
дипротонированн
ой формы ГМП
2
Нитрование
свободной формы
ГМП
0
70
72
74
76
78
Концентрация серной кислоты, %
80
82
84
59. Зависимость эффективных констант скоростей процесса нитрования барбитуровой кислоты от концентрации H2SO4 при 25°С, [HNO3]=0,46
моль/л0.23
Нитрующие смеси с
добавлением нитрита
натрия;
[NaNO2]=1,4·10-4
моль/л
0.20
0.18
Нитрующие смеси
без добавок
k эф., мин
-1
0.15
Нитрующие смеси с
добавлением
мочевины;
[CH4N2O]=9,6·10-3
моль/л
0.13
0.10
0.08
0.05
0.03
0.00
71
72
73
74
75
76
77
78
Концентрация H2SO4, %
79
80
81
82
83
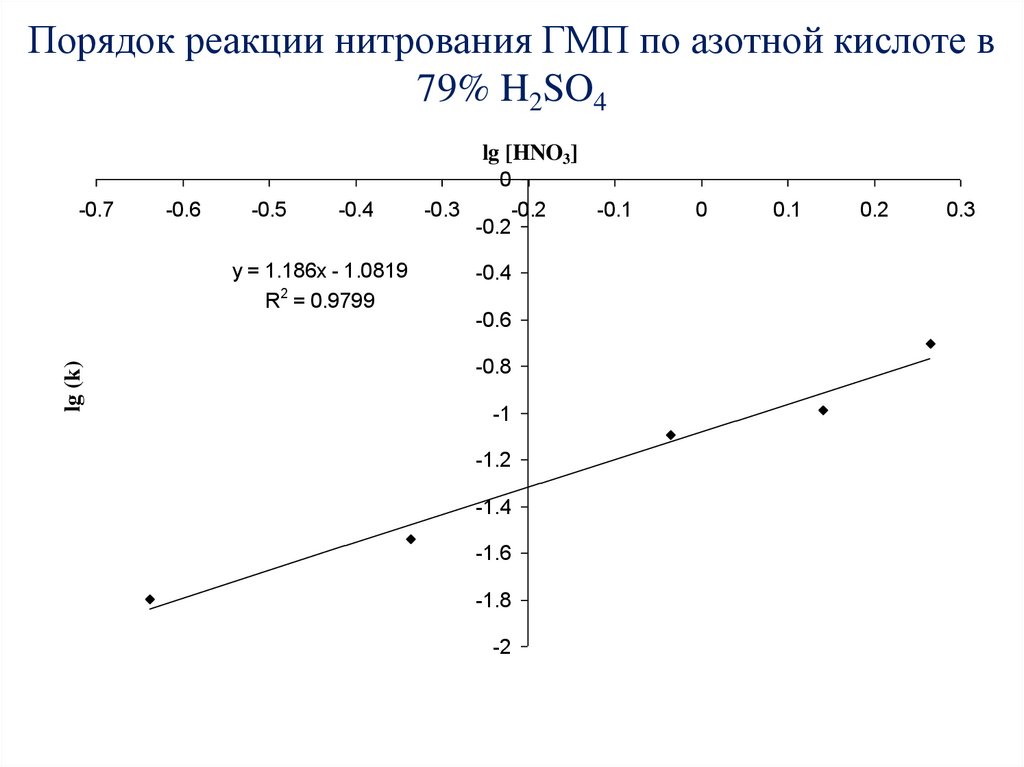
60. Порядок реакции нитрования ГМП по азотной кислоте в 79% H2SO4
lg [HNO3]0
-0.7
-0.6
-0.5
-0.4
lg (k)
y = 1.186x - 1.0819
R2 = 0.9799
-0.3
-0.2
-0.4
-0.6
-0.8
-1
-1.2
-1.4
-1.6
-1.8
-2
-0.2
-0.1
0
0.1
0.2
0.3
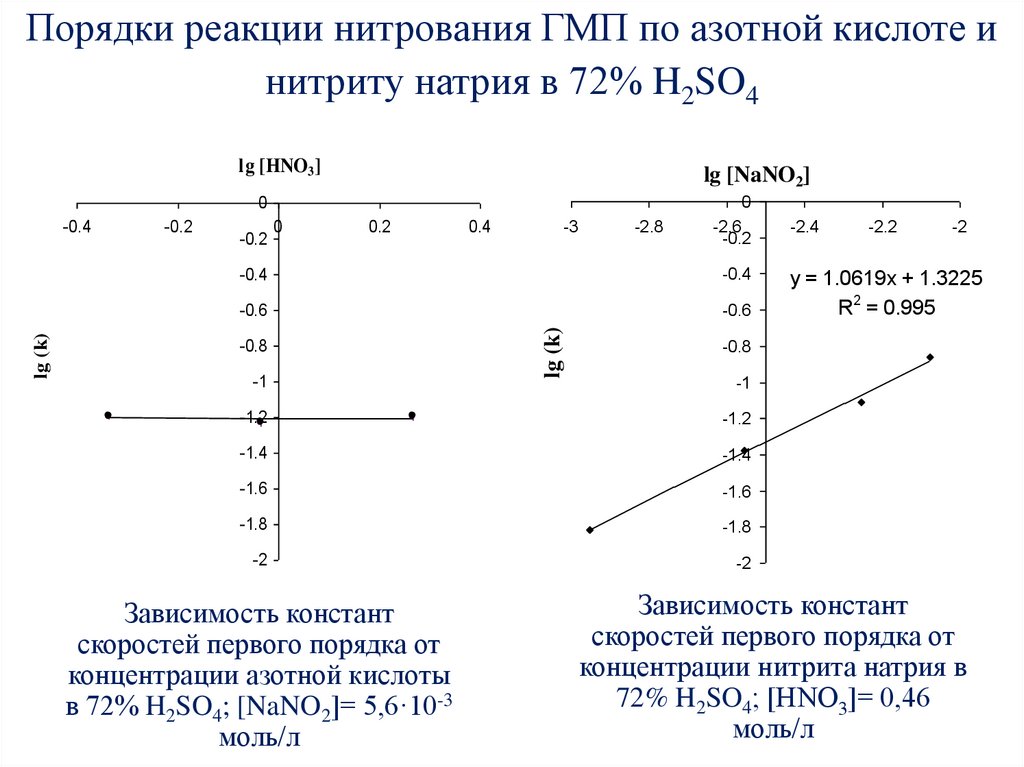
61. Порядки реакции нитрования ГМП по азотной кислоте и нитриту натрия в 72% H2SO4
lg [HNO3]lg [NaNO2]
0
0
-0.2
-2.6
-0.2
-2.4
-0.4
-0.4
-0.6
-0.6
y = 1.0619x + 1.3225
R2 = 0.995
-0.2
0
0.2
-0.8
-1
0.4
-3
lg (k)
lg (k)
-0.4
-2.8
-2
-0.8
-1
-1.2
-1.2
-1.4
-1.4
-1.6
-1.6
-1.8
-1.8
-2
-2
Зависимость констант
скоростей первого порядка от
концентрации азотной кислоты
в 72% H2SO4; [NaNO2]= 5,6·10-3
моль/л
-2.2
Зависимость констант
скоростей первого порядка от
концентрации нитрита натрия в
72% H2SO4; [HNO3]= 0,46
моль/л
62.
Последующие исследования показали, что прикаталитическом
действии низших оксидов азота не всегда происходит нитрозирование. Этот
явление
наблюдали при нитровании таких соединений, как N,Nдиметиланилин, 1,2,3-триметоксинитробензол, нафталин. Добавление
HNO2 в следовых количествах к смеси этих веществ и серно-азотной
кислотной смеси приводило к резкому росту скорости нитрования. При
использовании одной HNO2 нитрозосоединения не образуются.
Возможный механизм нитрования – окисление начального [ArH*NO+]- комплекса в [ArH*NO2+]- - комплекс , который затем изомеризуется в комплекс. Этот механизм объясняет наблюдаемую селективность при
каталитическом нитровании низшими оксидами азота N(III), весьма похожую
на наблюдаемую в случае истинного N(V) нитрования. Возможно, что этот
механизм имеет общий характер и применим для нитрования в среде N2O4.
Предположение о нитровании, протекающем через [ArH*NO+] - -комплекс
может быть использовано для интерпретации образования комплекса с
переносом заряда в схеме Кочи с последующим переносом электрона,
ведущим к катион-радикалу и комплексу последнего с NO2 - [ArH+ NO2 ].
63.
В 70-80-е годы образование относительно стабильных катион-радикалов (КР)
спектральными методами или в форме солей было обнаружено при
электрофильном замещении у ряда активированных ароматических и
гетероциклических соединений (анилинов, фенолов, пиррола). Для
малоактивированного толуола предположительное время жизни составляет
всего 3,3*10-7 с. Косвенным доказательством образования КР при нитровании
ArH является получение диарилов. С высоким выходом нитросоединения
были получены из КР на примере нафталина. Превращение КР в
нитросоединения происходит под действием NO2 или NO2-
ArH . + + NO2 ־
ArH . + + NO2
2 ArH + 3 NO2
Рекомбинация КР с NO2 может протекать и в газовой фазе. Для димерного
КР бензола константа скорости такой рекомбинации равна 2,4*10-11
см3/моль•с.
→
→
→
ArH + NO2
ArNO2 + H+
2 ArNO2 + H2O + NO
При газофазном нитровании ионом нитрония первичным продуктом реакции
является КР, который рекомбинирует с NO2, давая -комплекс.
Для высокоактивных соединений первичный акт образования катион-радикала при
взаимодействии с нитроний - ионом сопровождается вторичным превращением в комплекс (в клетке растворителя, без выхода из нее). Для таких соединений характерно
нитрование, катализируемое оксидами азота.
64.
По ион-радикальному механизму с переносом электрона протекает реакция стетранитрометаном. Ее применяют для нитрования высокореакционноспособных
соединений (фенолов и др) в присутствии оснований. Передача электрона происходит
внутри комплекса с переносом заряда (от ArH к С(NO2)4) и сопровождается
отщеплением от возникающего анион-радикала C(NO2)4-. радикала NO2., последний
рекомбинирует в клетке с катион-радикалом ArH+.. Еще в 1962 г в РХТУ им. Д.И.
Менделеева было показано, что при реакции тетранитрометана с диметиланилином с
выходом, близким к количественному, образуется 4-нитродиметиланилин.
Реакция с участием катион-радикалов протекает и в серной кислоте (выше 82%
H2SO4), где нитрование анилина идет только через анилиний-ион. В 98% H2SO4
соотношение о-:м-:п-изомеров равно 1,5:62:38, в 82% H2SO4 5:36:59. В 98% H2SO4
диметиланилин дает смесь м- : о- = 78 : 22, в 82% H2SO4 образуется 50% 4нитропроизводного, 2% 3-нитрозамещенного и 26% тетраметилбензидина. Константа
скорости каталитической реакции нитрования на порядок больше, чем
некаталитической.

















![Зависимость эффективных констант скоростей процесса нитрования барбитуровой кислоты от концентрации H2SO4 при 25°С, [HNO3]=0,46 Зависимость эффективных констант скоростей процесса нитрования барбитуровой кислоты от концентрации H2SO4 при 25°С, [HNO3]=0,46](https://cf5.ppt-online.org/files5/slide/x/XRsyvekKCPl57VLzxQfIW02MDJYr6N3O9pnjBu/slide-58.jpg)



 chemistry
chemistry








