Similar presentations:
Защита практика ординатура 2 курс 07.11.2025
1. практика по управлению качеством текущей деятельности фармацевтической организации
Министерство здравоохранения Российской ФедерацииФедеральное государственное бюджетное образовательное учреждение высшего образования
«Санкт-Петербургский государственный химико-фармацевтический университет»
Министерства здравоохранения Российской Федерации
Кафедра «управления и экономики фармации»
ПРАКТИКА ПО УПРАВЛЕНИЮ КАЧЕСТВОМ
ТЕКУЩЕЙ ДЕЯТЕЛЬНОСТИ
ФАРМАЦЕВТИЧЕСКОЙ ОРГАНИЗАЦИИ
Выполнил ординатор ФО-3342
Фомичев Евгений Андреевич
Санкт-Петербург 2025
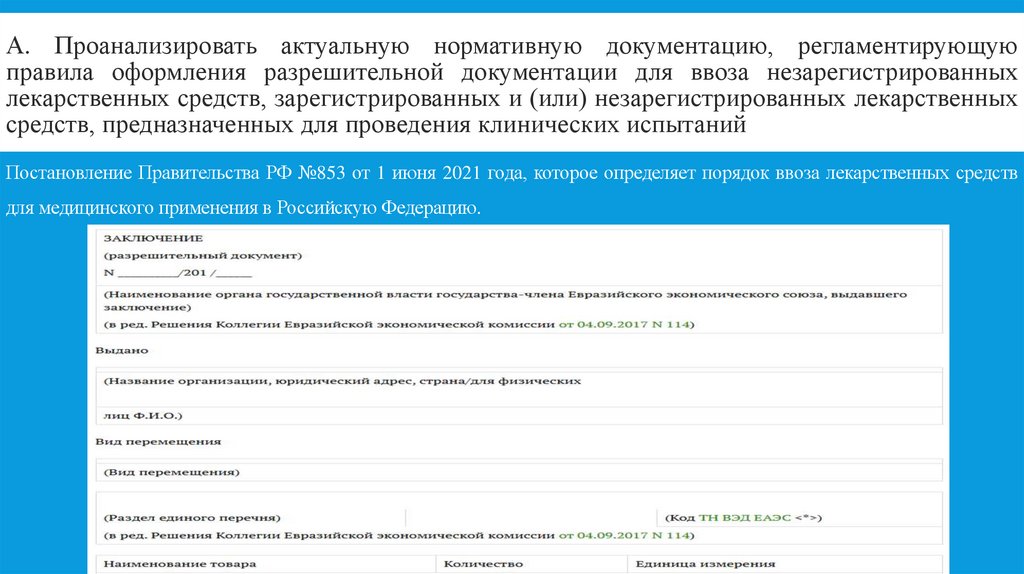
2. А. Проанализировать актуальную нормативную документацию, регламентирующую правила оформления разрешительной документации для
ввоза незарегистрированныхлекарственных средств, зарегистрированных и (или) незарегистрированных лекарственных
средств, предназначенных для проведения клинических испытаний
Постановление Правительства РФ №853 от 1 июня 2021 года, которое определяет порядок ввоза лекарственных средств
для медицинского применения в Российскую Федерацию.
3. Б. Проанализировать актуальную нормативную документацию, регламентирующую правила изъятия из гражданского оборота
фальсифицированных, недоброкачественныхи контрафактных лекарственных средств и других товаров аптечного ассортимента и их
уничтожение
Постановление Правительства РФ №1447 от 15 сентября 2020 года «Об
утверждении Правил уничтожения изъятых фальсифицированных
лекарственных средств, недоброкачественных лекарственных средств и
контрафактных лекарственных средств».
1) Содержание акта об уничтожении
2) Правила составления протокола об изъятии лекарственных средств из
оборота
3) Временные рамки, которые необходимо соблюдать при ведении
документального подтверждения изъятия лекарственных средств
4) Порядок действий уполномоченного лица
5) Необходимые условия для осуществления изъятия
4. В. Изучить правила оформления документации по изъятию из гражданского оборота фальсифицированных, недоброкачественных и
контрафактныхлекарственных средств и других товаров аптечного ассортимента и их
уничтожению
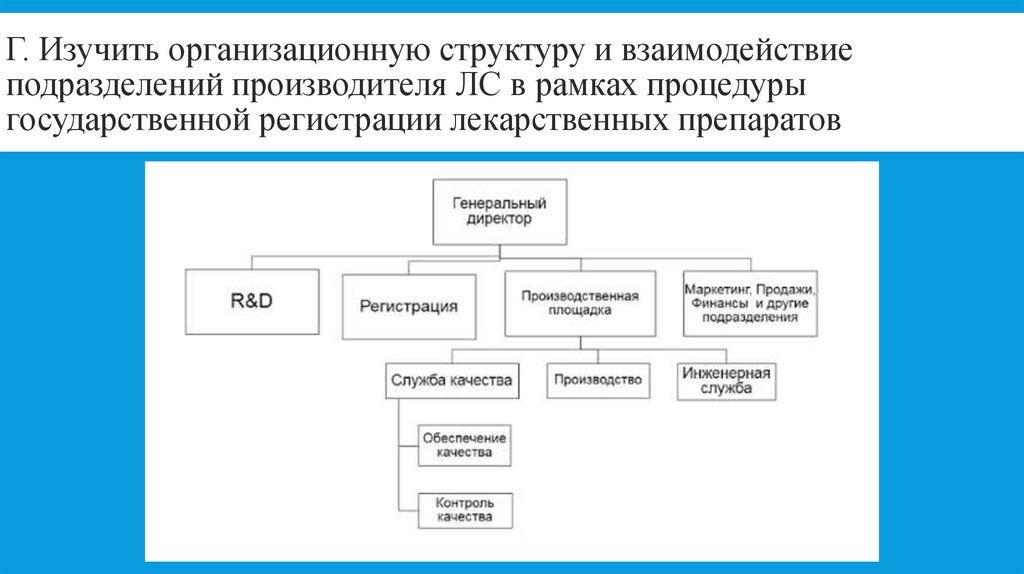
5. Г. Изучить организационную структуру и взаимодействие подразделений производителя ЛС в рамках процедуры государственной
регистрации лекарственных препаратов6. Д. Записать процессы деятельности организации-базы практики. Составить перечень актуальной нормативной документации по
процессам, выделенным вдеятельности организации – базы практики
Хранение лекарственных
препаратов для медицинского
применения, Розничная торговля
лекарственными препаратами для
медицинского применения, Отпуск
лекарственных препаратов для
медицинского применения.
Розничная торговля
лекарственными препаратами,
отпускаемыми по рецепту,
дистанционным способом
7. Е. Разработать стандартные операционные процедуры по закупке, приёмке, хранению лекарственных препаратов и других товаров
аптечного ассортиментаСОП Порядок приемки лекарственных средств в
аптеке
Цель:
1) Стандартизация разгрузки;
2) Контроль за условиями транспортировки
лекарственных средств;
3) Стандартизация последовательности приемки
лекарственных средств.
СОП Порядок хранения лекарственных средств и
изделий медицинского назначения в аптеке
Цель:
1) Регламентация порядка хранения и учета
лекарственных препаратов и изделий
медицинского назначения в аптеке
2) Стандартизация хранения лекарственных
средств
Основная часть СОП
1. Подготовительные операции
2. Разгрузка лекарственных средств
3. Приемка лекарственных средств по количеству
и качеству
4. Нормативно-справочная документация
Основная часть СОП
1. Общие положения
2. Термины и определения, сокращения
3. Процедура
4. Записи по качеству
5. Нормативно-справочная документация
8. Ё. Внедрить стандарты качества деятельности фармацевтической организации. Осуществить получение обратной связи со стороны
персонала по разработаннымстандартам. Собрать и проанализировать информацию по результатам мониторинга.
Анкета обратной связи сотрудников по новым стандартам
Часть I. Общая оценка стандарта
Часть II. Проблемные зоны и предложение улучшений
Часть III. Восприятие руководства и коллег
Часть IV. Уровень комфорта и удовлетворение
Часть V. Дополнительные замечания и пожелания
9. Ж. Составить стандартные операционные процедуры (СОП) при организации контроля качества ЛС в условиях фармацевтической
организации.СОП Контроль качества лекарственных средств
(ЛС) в аптеке
1. Цель процедуры
2. Применяемые нормативные документы
3. Термины и сокращения
4. Ответственность исполнителей
5. Порядок осуществления контроля качества
лекарственных средств
6. Оформление отчетности
7. Документация и архивация
8. Пересмотр и обновление процедуры
10. З. Контролировать соблюдение стандартных операционных процедур (СОП) при осуществлении контроля качества ЛС в условиях
фармацевтическойорганизации
Вывод
По результату опроса было собрано 4 бланка для дальнейшего анализа.
Выводы после мониторинга оказались неоднозначными, часть коллектива
радушно приняла новые стандарты. 50% опрошенных выразились
сомнительно, основные сложности возникли с изучением нового материала и
адаптацией его под уже установленные правила в работе. Также было
высказано мнение о сложности разработанных стандартов для сотрудников.
Выражено пожелание о корректировке приведенных стандартных
операционных процедур.
11. И. Изучить правила организации хранения проб и стандартных образцов, документирования и хранения результатов экспертизы
лекарственных средств.Для большинства фармакопейных стандартных образцов оптимальным
является хранение в защищенном от света месте при температуре (3-5) °C в
упаковках, предохраняющих образцы от проникновения влаги; при этом
следует избегать помещений с повышенной влажностью.
Приказ Минздрава России от 29 апреля 2025 г. № 260н
определяет правила надлежащей практики хранения и
перевозки самих лекарственных препаратов, на основе чего
составляются локальные документы.
12. К. Изучить правила организации контроля за наличием и условиями хранения реактивов и специализированного оборудования,
применяемых для осуществления контроля качествалекарственных средств в условиях фармацевтических организаций.
Основная нормативная база:
Правила надлежащей лабораторной практики (GLP): определяют условия, при
которых проводятся исследования и испытания лекарственных препаратов.
Приказ Минздрава России от 29 апреля 2025 г. № 259н, устанавливающий «Правила
надлежащей аптечной практики»:
Постановление Правительства №815 от 31.05.2025 «О порядке ввода в гражданский
оборот лекарственных средств для медицинского применения»
Руководства и рекомендации ВОЗ: международные стандарты, касающиеся условий
хранения и контроля качества продукции.
Санитарные правила и нормы (СанПиН): устанавливают санитарно-гигиенические
требования к условиям хранения реактивов и оборудования.
Приказ Минздрав РФ от 29.04.2025 N 260н "Об утверждении правил хранения
лекарственных средств для медицинского применения"
13. Список литературы:
1. Управление и экономика фармации [Электронный ресурс] / под ред. И. А. Наркевича. — Электрон. текстовые данные. — Москва :ГЭОТАР-Медиа, 2017. — Режим доступа: http://www.studentlibrary.ru/book/ISBN9785970442265.html
2. Перепелкина, Н. Ю. Управление качеством медицинской помощи [Электронный ресурс] / Н. Ю. Перепелкина, О. Г. Павловская, С.
А. Кузьмин. — Электрон. текстовые данные. — Оренбург : Оренбургская государственная медицинская академия, 2008. — 155 c. —
Режим доступа: http://www.iprbookshop.ru/31844.html
3. Зекунов, А. Г. Обеспечение функционирования системы менеджмента качества [Электронный ресурс] / А. Г. Зекунов, В. Н. Иванов.
— Электрон. Текстовые данные. — Москва. : Академия стандартизации, метрологии и сертификации, 2012. — 176 c. — Режим доступа:
http://www.iprbookshop.ru/44262.html
4. Сатаева, Д. М. Система менеджмента качества : управление документированной информацией [Электронный ресурс] : учебное
пособие / Д. М. Сатаева. — Электрон. текстовые данные. — Саратов : Вузовское образование, 2018. — 108 c. - Режим доступа:
http://www.iprbookshop.ru/76991.html
5. Воробьѐв, А. Л. Планирование и организация эксперимента в управлении качеством [Электронный ресурс] : учебное пособие / А.
Л. Воробьѐв, И. И. Любимов, Д. А. Косых. — Электрон. текстовые данные. — Оренбург : Оренбургский государственный университет,
ЭБС АСВ, 2014. — 344 c.— Режим доступа: http://www.iprbookshop.ru/33648.html
6. Евстропов, Н. А. Методика разработки и оценка эффективности системы менеджмента качества в организациях
фармацевтической и медицинской промышленности [Электронный ресурс] : учебное пособие / Н. А. Евстропов, Р. И. Кудияров. —
Электрон. текстовые данные. — Москва. : Академия стандартизации, метрологии и сертификации, 2009. — 140 c. — Режим доступа:
http://www.iprbookshop.ru/44248.html