Similar presentations:
Разработка СОП: Порядок приемки лекарственных препаратов и других товаров аптечного ассортимента в аптеке. Приемочный контроль
1. Разработка СОП: Порядок приемки лекарственных препаратов и других товаров аптечного ассортимента в аптеке. Приемочный контроль
доцент кафедры фармакологии ифармации СЗГМУ
им. И.И Мечникова
Лариса Ивановна Гарбузова
е-mail: larisa.garbuzova02@gmail.com
2.
37. Все процессы деятельности субъекта розничной торговли,влияющие на качество, эффективность и безопасность ТАА,
осуществляются в соответствии с утвержденными стандартными
операционными процедурами (Правила НАП, утвержденные
приказом МЗ от 31.08.2016 г № 647н)
3. Руководитель субъекта обращения ЛП обеспечивает реализацию
комплекса мер, направленных на соблюдение его работниками
настоящих Правил при хранении и (или) перевозке лекарственных
препаратов (далее - система качества), посредством утверждения
документов, в которых регламентируются в том числе… прием,
транспортировка, размещение лекарственных препаратов (далее стандартные операционные процедуры), и организации контроля за
соблюдением стандартных операционных процедур.
(Правила Надлежащей практики хранения и перевозки ЛП,
утвержденные приказом МЗ от 31.08.2016 г № 646н)
3. Требования к СОП
Стандартные операционные процедуры (СОП)пошаговые инструкции для выполнения
определенного действия
Фактически каждый СОП должен содержать ответы на 3 вопроса:
1. кто? - участвует в реализации, выполняет его требования и
необходимы для его реализации;
2.
что? - какие ресурсы
где? - в каком подразделении, организации следует выполнять требования СОПа;
3. когда? - в какой временной промежуток необходимо уложиться, выполняя
требования СОПа, в какой последовательности и при каких обстоятельствах.
В целом СОПы должны быть краткими, четкими, конкретными,
желательно их представление в табличной форме или в виде схем и
алгоритмов с минимальным объемом текстовой части.
4.
СОППорядок приемки в
аптечной организации
лекарственных
средств/препаратов и
других товаров аптечного
ассортимента,
осуществление
приемочного контроля
Структура СОП
Приложения к СОП
Подготовительные операции
Разгрузка товаров АА из автотранспорта. Контроль за условиями
транспортировки. Приемка по количеству мест или товарных
единиц
Приемочный контроль товаров аптечного ассортимента по
количеству и качеству. Оформление документов.
Приемочный контроль лекарственных препаратов/средств
Приемочный контроль медицинских изделий
Приемочный контроль пищевой продукции аптечного
ассортимента
Приемочный контроль парфюмерно-косметической продукции
Приемочный контроль предметов и средств по уходу за
новорожденными и детьми, не достигшими возраста 3-х лет
Приемочный контроль других товаров АА (предметов и средств
личной гигиены, дезинфицирующих средств и т.д.).
Порядок возврата товаров, не прошедших приемочный контроль
поставщику
5.
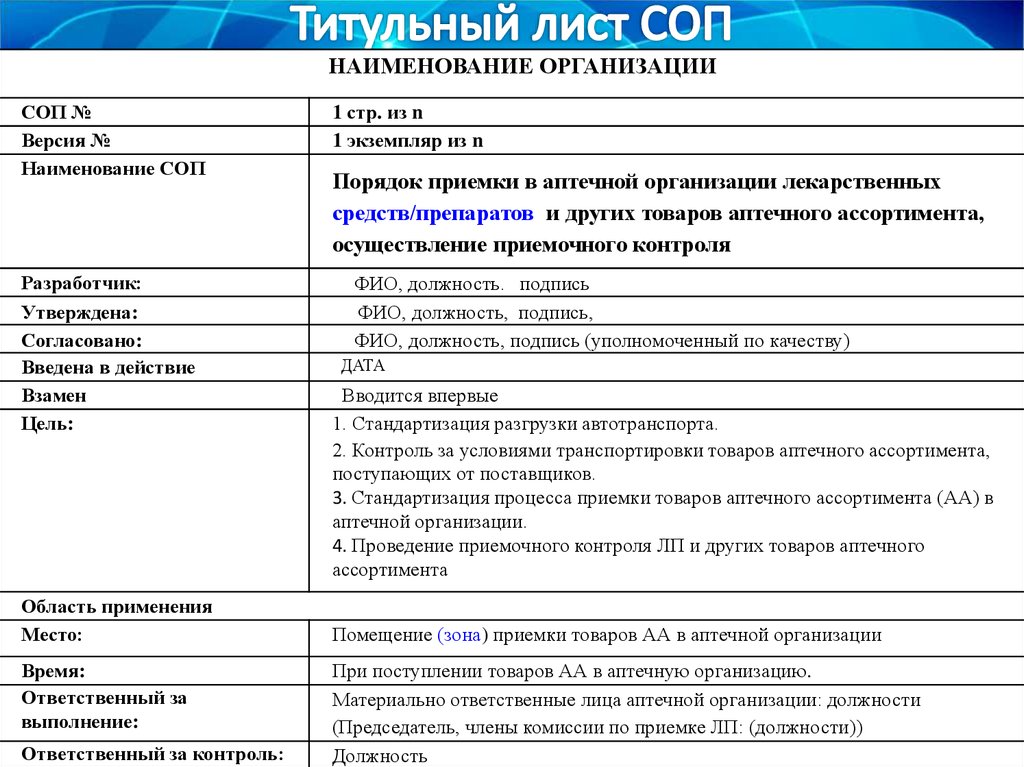
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИСОП №
Версия №
Наименование СОП
Разработчик:
Утверждена:
Согласовано:
Введена в действие
Взамен
Цель:
Область применения
Место:
Время:
Ответственный за
выполнение:
Ответственный за контроль:
1 стр. из n
1 экземпляр из n
Порядок приемки в аптечной организации лекарственных
средств/препаратов и других товаров аптечного ассортимента,
осуществление приемочного контроля
ФИО, должность. подпись
ФИО, должность, подпись,
ФИО, должность, подпись (уполномоченный по качеству)
ДАТА
Вводится впервые
1. Стандартизация разгрузки автотранспорта.
2. Контроль за условиями транспортировки товаров аптечного ассортимента,
поступающих от поставщиков.
3. Стандартизация процесса приемки товаров аптечного ассортимента (АА) в
аптечной организации.
4. Проведение приемочного контроля ЛП и других товаров аптечного
ассортимента
Помещение (зона) приемки товаров АА в аптечной организации
При поступлении товаров АА в аптечную организацию.
Материально ответственные лица аптечной организации: должности
(Председатель, члены комиссии по приемке ЛП: (должности))
Должность
6.
Нормативныеправовые ссылки:
Закон РФ № 61-ФЗ «Об обращении лекарственных средств»; Закон РФ
№ 184-ФЗ от 15.12.2002 «О техническом регулировании»; Закон РФ от
21.11.2011 «Об основах охраны здоровья граждан в Российской
Федерации» № 323-ФЗ; Постановление Правительства РФ от 19.01.1998
№ 55 «Об утверждении Правил продажи…»; Постановление
Правительства от 01.12.2009 № 982 «Об утверждении единого перечня
продукции, подлежащей обязательной сертификации, и единого перечня
продукции, подтверждение соответствия которой осуществляется в форме
принятия декларации о соответствии»; Технический регламент
Таможенного союза ТР ТС 021/2011; Технический регламент
Таможенного союза 022/2011 «Пищевая продукция в части ее
маркировки»; Технический регламента Таможенного союза 005/2011 «О
безопасности упаковки»; СанПиН 2.3.2.1290-03; Технический регламент
Таможенного союза ТР ТС 009/2011; Технический регламент
Таможенного союза ТР ТС 007/2011; Решение Комиссии таможенного
союза от 28.05.2010 года № 299; Приказ Минздрава России от 31.08.2016
№ 647н «Об утверждении Правил надлежащей аптечной практики
лекарственных препаратов для медицинского применения»; Приказ
Минздрава России от 31.08.2016 № 646н "Об утверждении Правил
надлежащей практики хранения и перевозки лекарственных препаратов
для медицинского применения"
7.
Список сокращенийЛП
ЛС
ТАА
РЗН
МИ
БАД
ПКП
лекарственные препараты
лекарственные средства
товары аптечного ассортимента
Росздравнадзор
медицинские изделия
биологически активные добавки
парфюмерно-косметическая продукция
8.
1. Подготовительные операции1.1. Подготовить места для размещения поступающих лекарственных средств и других
товаров аптечного ассортимента:
для иммунобиологических ЛП – холодильники/холодильное оборудование № _, _ ,
расположенные в (указать, где);
для других ЛП, требующих защиты от повышенной температуры,
холодильники/холодильное оборудование № _, _ , расположенные в (указать, где)
для ЛП, подлежащих предметно-количественному учету – сейфы/ металлические
шкафы/деревянные шкафы, холодильник № _ (для спирта);
для фармацевтических субстанций – шкафы/стеллажи/ящики и др., расположенные в
(указать, где);
для остальных ЛП и других товаров АА – шкафы, стеллажи, ящики и др.,
расположенные в (указать, где)
1.2. Подготовить поддоны (подтоварники/столы) для размещения товаров АА.
1.3. Подготовить средства малой механизации для перемещения товара (если
используются).
1.4. Подготовить многооборотную тару к отгрузке (если используется в работе).
1.5. Подготовить товар, подлежащий возврату поставщику (при наличии).
9. Приемка товара
10.
2. Разгрузка товаров АА из автотранспорта. Контроль за условиямитранспортировки. Приемка по количеству мест или товарных единиц
2.1. Проконтролировать разгрузку товаров АА из автотранспорта водителем (экспедитором)
фирмы-поставщика (произвести разгрузку товаров АА из автотранспорта), разместить товары
АА в транспортной таре в помещении (зоне) приемки на поддонах (подтоварниках или
столах).
2.2. При поступлении товаров АА в аптечную организацию материально ответственному
лицу (указать, кому) проверить соответствие условий транспортировки требованиям,
указанным в инструкциях по медицинскому применению ЛП (на упаковке ЛП), на упаковках
других товаров АА: наличие распечатки показаний терморегистратора или показания
термоиндикаторов (при транспортировки в авторефрижераторе, при использовании
термоконтейнеров), др. варианты. Зафиксировать факт соблюдения/несоблюдения условий
транспортировки (указать, каким образом).
2.3. При несоответствии температурного режима транспортировки термолабильных товаров
АА (при несоответствии других условий) товары не подлежат приемке, в этом случае
необходимо:
- уведомить поставщика о выявленном несоответствии условий транспортировки;
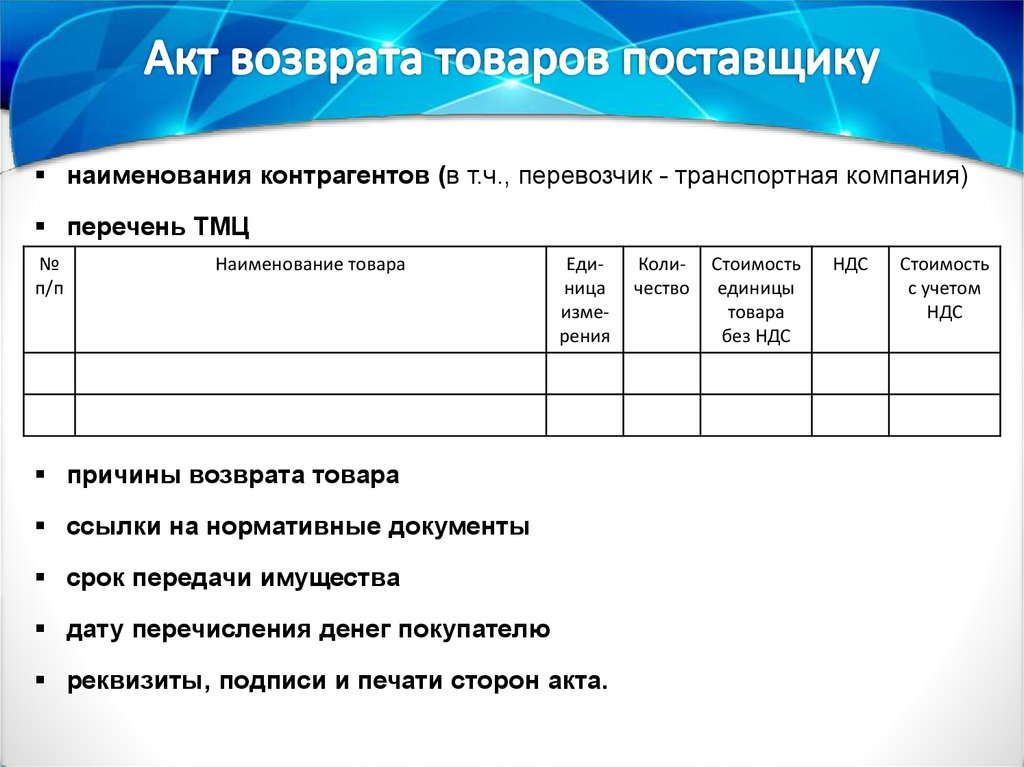
- комиссией по приемке товаров АА аптечной организации составить акт в 2-х экземплярах
– «Акт возврата товаров поставщику» (Приложение 3) (можно - «Акт об установленном
расхождении по качеству при приемке товарно-материальных ценностей»);
- осуществить возврат поставщику товаров АА согласно прописанным в договоре условиям.
11.
наименования контрагентов (в т.ч., перевозчик - транспортная компания)перечень ТМЦ
№
п/п
Наименование товара
Единица
измерения
причины возврата товара
ссылки на нормативные документы
срок передачи имущества
дату перечисления денег покупателю
реквизиты, подписи и печати сторон акта.
Количество
Стоимость
единицы
товара
без НДС
НДС
Стоимость
с учетом
НДС
12.
2. Разгрузка товаров АА из автотранспорта. Контроль за условиямитранспортировки. Приемка по количеству мест или товарных единиц.
2.4. Произвести осмотр внешнего вида транспортной тары на отсутствие повреждений.
В случае целостности транспортной тары принять товар по количеству мест или
количеству товарных единиц. При соответствии количества мест или количества
товарных единиц данным, указанным в товарно-сопроводительных документах и при
наличии полного комплекта товарно-сопроводительных документов, материальноответственное лицо:
- делает отметку (ставит штамп) на экземпляре товарно-сопроводительных
документов поставщика (накладная, товарно-транспортная накладная, лист доставки) о
принятии товара по количеству мест или количеству товарных единиц,
- ставит свою подпись и печать организации (при наличии), дату приемки товара,
- передает экземпляр товарно-сопроводительных документов экспедитору (водителю),
- передает экспедитору (водителю) возвратную тару (при наличии).
Далее осуществляется приемочный контроль товаров АА в соответствии с разделом 3
данного СОПа.
Приемка товара по количеству
Штамп
мест/товарных единиц без
вскрытия транспортной тары
13.
2. Разгрузка товаров АА из автотранспорта. Контроль за условиямитранспортировки. Приемка по количеству мест или товарных единиц.
2.5. В случае нарушения целостности транспортной тары в присутствии экспедитора
(водителя) транспортная тара вскрывается и осуществляется оценка соответствия
принимаемых товаров АА товаросопроводительной документации по ассортименту и
количеству. При соответствии наименований и количества товаров, указанных в товарносопроводительных документах, и при наличии полного комплекта товарносопроводительных документов материально-ответственное лицо:
- ставит штамп приемки*, подтверждающий факт соответствия принятых товаров,
данным, указанным в сопроводительных документах, на экземпляре товарносопроводительных документов поставщика,
- ставит свою подпись и печать организации (при наличии), дату приемки товара,
- передает экземпляр товарно-сопроводительных документов экспедитору (водителю).
АП-1 (Приказ МЗ СССР от 08.01.1988 г. N 14)
А-1.1 (МР для практических и научных
работников от 13.05.1998 г. № 98/124)
14.
2. Разгрузка товаров АА из автотранспорта. Контроль за условиямитранспортировки. Приемка по количеству мест или товарных единиц.
2.6. При несоответствии наименований, количества товаров АА данным
сопроводительных документов, при отсутствии товарно- сопроводительных документов
(неполный комплект):
ТОРГ-2
- комиссия по приемке товаров АА аптечной организации составляет акт в
Постановление
Госкомстата РФ от
2-х экземплярах – «Акт об установленном расхождении по количеству и
25.12.1998 N 132
качеству при приемке товарно-материальных ценностей» (акт другой формы)
(Приложение 4);
- товары АА размещаются в карантинные зоны в соответствии с условиями хранения
(термолабильные - в карантинные зоны в холодильниках №__, __ (холодильных
камерах)): ЛП перемещаются в карантинные зоны ЛП, другие товары АА в
карантинные зоны для товаров АА с маркировкой «забраковано при приемке» до
устранения выявленных несоответствий или возврата поставщику;
- председатель комиссии по приемке товаров уведомляет поставщика о выявленных
несоответствиях, передает 1 экземпляр акта («Акт об установленном расхождении по
количеству и качеству при приемке товарно-материальных ценностей или акт другой
формы).
15.
2. Разгрузка товаров АА из автотранспорта. Контроль за условиямитранспортировки. Приемка по количеству мест или товарных единиц.
2.7. При несоответствии качества товаров АА (поврежденная упаковка, порча, бой и
т.д.):
- комиссия по приемке товаров АА аптечной организации составляет акт в 2-х
экземплярах – «Акт об установленном расхождении по количеству и качеству ТОРГ-15
Постановление
при приемке товарно-материальных ценностей» /«Акт о порче, бое
Госкомстата РФ от
25.12.1998 N 132
товарно-материальных ценностей» (другая форма акта) (Приложение 5);
- председатель комиссии по приемке товаров уведомляет поставщика о выявленных
несоответствиях;
- испорченный товар возвращается поставщику с приложением 1 экземпляра «Акта о
порче, бое товарно-материальных ценностей»/ «Акт об установленном расхождении по
количеству и качеству при приемке товарно-материальных ценностей» (другой формы
акта).
16.
3. Приемочный контроль товаров аптечного ассортимента по количеству икачеству. Оформление документов.
3.1. В первую очередь в течение 10 минут провести приемочный контроль и
переместить в холодильное оборудование термолабильные товары АА.
3.2. Товары освободить от групповой упаковки и разложить по наименованиям.
3.3. Ответственным за приемку посчитать фактическое количество упаковок и сравнить
с количеством, указанным в товарно-сопроводительных документах, с указанием серии
(партии), сроков годности. Ответственным за приемку проверить правильность
оформления товарно-транспортных накладных, отметить проверенное наименование
товаров АА, их количество по сопроводительным документам.
3.5. Осуществлять проверку качества поступивших товаров с учетом особенностей
приемки и предпродажной проверки разных групп товаров АА (п. 4, 5, 6, 7, 8, 9 СОП).
3.6. Ответственным по приемке заполнить сопроводительные и транспортные
документы: поставить на товарно-транспортных накладных печать аптеки, дату приемки,
подпись, ФИО, должность лица, принявшего товар.
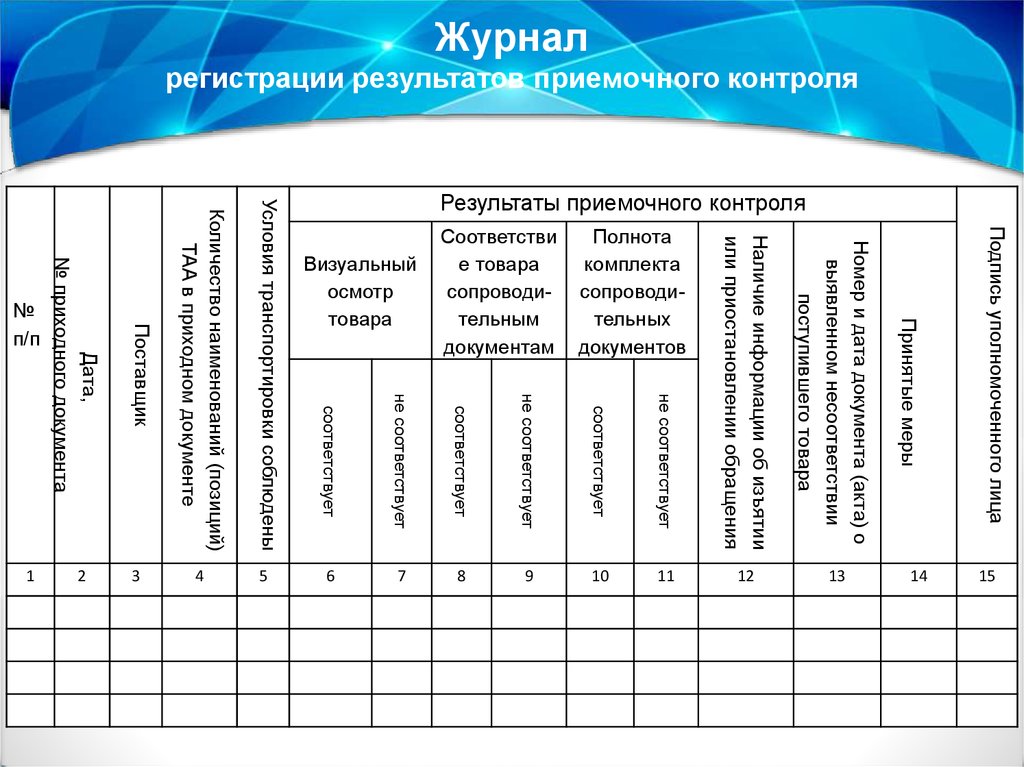
3.7. Заполнить Журнал регистрации результатов приемочного контроля* (приложение 6).
3.8. Документы, подтверждающие приход товара, ценообразование, соответствие (копии
ТТН, протокол согласования цен, реестр (список) документов, подтверждающих качество
ТАА) подшить в соответствующую папку.
3.9. Хранить документы в течение 5 лет.
17.
3. Приемочный контроль товаров аптечного ассортимента по количеству икачеству. Оформление документов.
3.10. При соответствии товаров АА количеству и качеству, правильности
оформления сопроводительных документов материально-ответственное лицо вводит
информацию о поступивших товарах АА в учетную программу организации, для ЛС и
биологически активных добавок распечатывает стеллажные карты, на которых указаны:
наименование ЛП, форма выпуска и дозировка, серия, срок годности, наименование
производителя (или коды при использовании электронной системы обработки данных).
3.11. Разместить товары АА по местам хранения.
3.12. Вынести многооборотную тару и картонные коробки в предназначенное для
этого помещение (зону).
18.
Журналрегистрации результатов приемочного контроля
Подпись уполномоченного лица
соответствует
не соответствует
соответствует
не соответствует
соответствует
не соответствует
10
11
Номер и дата документа (акта) о
выявленном несоответствии
поступившего товара
Визуальный
осмотр
товара
Дата,
№ приходного документа
Поставщик
Количество наименований (позиций)
ТАА в приходном документе
Условия транспортировки соблюдены
9
Наличие информации об изъятии
или приостановлении обращения
Принятые меры
15
14
8
13
7
12
6
5
4
3
Полнота
комплекта
сопроводительных
документов
Соответстви
е товара
сопроводительным
документам
№
п/п
2
1
Результаты приемочного контроля
19.
4. Приемочный контроль лекарственных препаратов/средств.4.1. При одновременном поступлении с другими лекарственными препаратами
наркотические и психотропные ЛП, иные ЛП, подлежащие предметно-количественному
учету, в первую очередь подлежат приемочному контролю и перемещению в основные
помещения хранения.
4.2. Сверить соответствие наименования ЛС, производителя, серию и срок годности
в сопроводительных документах и на упаковке ЛС.
4.3. Проверить наличие (отсутствие) принимаемых ЛС в базе данных Росздравнадзоа
(РЗН) о приостановленных или изъятых из обращения лекарственных препаратов:
электронный сервис «Поиск изъятых из обращения лекарственных средств». Если в базе
данных РЗН имеется информация, что обращение данной серии ЛС приостановлено, то
ЛС перемещается в зону карантинного хранения ЛП (термолабильные ЛС перемещаются
в зоны карантинного хранения ЛП в холодильниках) с оформлением «Акта об
установленном расхождении по количеству и качеству при приемке товарноматериальных ценностей» (акт другой формы) с последующим возвратом поставщику.
Если в базе данных РЗН есть информация, что данная серия ЛС подлежит
изъятию из обращения, то ЛС перемещается в зону хранения выявленных
фальсифицированных, недоброкачественных, контрафактных ЛС, а также ЛС с истекшим
сроком годности (зона изъятых из обращения ЛС) с оформлением «Акта об
установленном расхождении по количеству и качеству при приемке товарноматериальных ценностей» (акт другой формы) с последующим возвратом поставщику.
20.
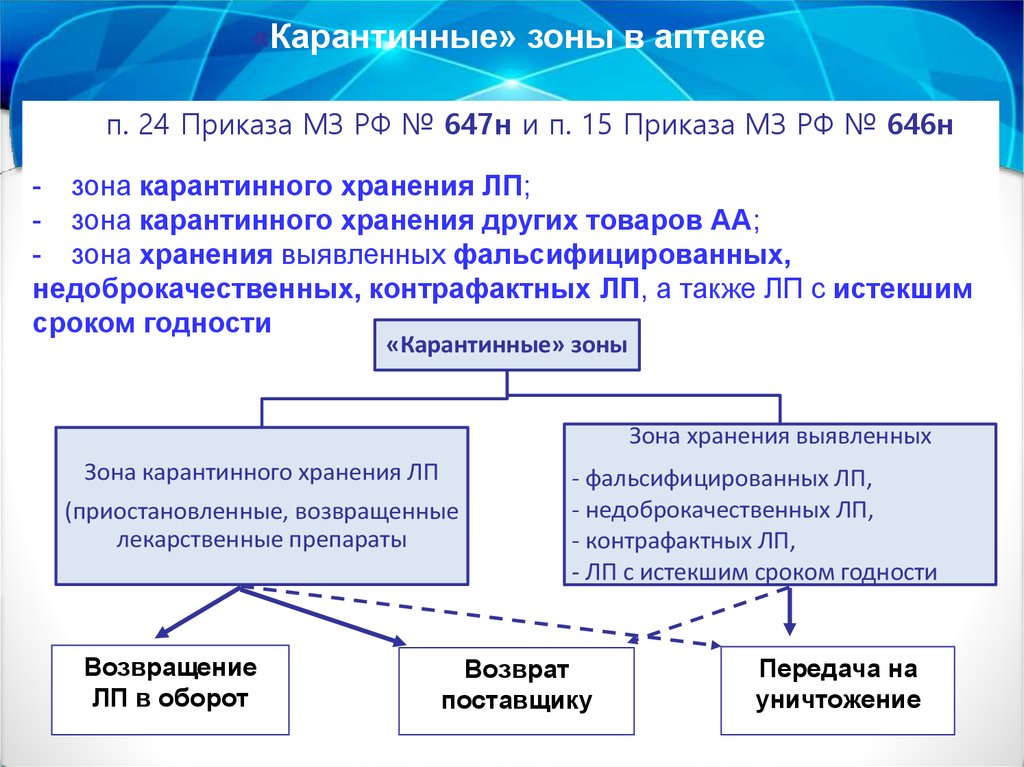
«Карантинные» зоны в аптекеп. 24 Приказа МЗ РФ № 647н и п. 15 Приказа МЗ РФ № 646н
- зона карантинного хранения ЛП;
- зона карантинного хранения других товаров АА;
- зона хранения выявленных фальсифицированных,
недоброкачественных, контрафактных ЛП, а также ЛП с истекшим
сроком годности
«Карантинные» зоны
Зона хранения выявленных
Зона карантинного хранения ЛП
(приостановленные, возвращенные
лекарственные препараты
Возвращение
ЛП в оборот
- фальсифицированных ЛП,
- недоброкачественных ЛП,
- контрафактных ЛП,
- ЛП с истекшим сроком годности
Возврат
поставщику
Передача на
уничтожение
21. Уведомление надзорных органов
Федеральный закон № 184-ФЗСтатья 37. Информация о несоответствии продукции требованиям
технических регламентов
1. Изготовитель (исполнитель, продавец, лицо, выполняющее функции
иностранного изготовителя), которому стало известно о
несоответствии выпущенной в обращение продукции требованиям
технических регламентов, обязан сообщить об этом в орган
государственного контроля (надзора) в соответствии с его
компетенцией в течение десяти дней с момента получения указанной
информации.
Продавец (исполнитель, лицо, выполняющее функции иностранного
изготовителя), получивший указанную информацию, в течение десяти дней
обязан довести ее до изготовителя.
22.
4. Приемочный контроль лекарственных препаратов/средств (продолжение)Информировать территориальное Управление Росздравнадзора, а также поставщика
ЛС о факте выявления при приемочном контроле серий (партий) ЛС, обращение которых
приостановлено или которые изъяты из обращения, в соответствии с информационными
письмам Росздравнадзора.
Информацию в территориальное управление Росздравнадзора предоставить в
соответствии с (указать № письма территориального управления РЗН)
Если в базе данных РЗН отсутствует информация, что обращение данной серии ЛС
приостановлено, или что данная серия изъята из обращения, то продолжается
приемочный контроль.
23.
4. Приемочный контроль лекарственных препаратов/средств (продолжение).4.4. Ответственным за приемку осуществить контроль лекарственного средства по
показателям «Описание», «Упаковка», «Маркировка», проверить наличие инструкций по
применению и их соответствие количеству упаковок.
По показателю «Описание» проверить соответствия внешнего вида, цвета (возможно
– запаха).
По показателю «Упаковка» проверить целостность вторичных и при необходимости
первичных упаковок ЛП.
По показателю «Маркировка» проверить соответствие оформления ЛС требованиям
ст. 46 Закона «Об обращении лекарственных средств» (приложение 7).
4.5. Проверить наличие и правильность оформления всех необходимых
товаросопроводительных документов. В том числе протоколов согласования цен на
жизненно важные и необходимые ЛП.
4.6. Проверить наличие сведений о декларациях о соответствии или о сертификатах
соответствия поступивших ЛП в реестре (другом документе) поставщика (Приложение
8). При необходимости провести идентификацию деклараций о соответствии или сертификатов
соответствия на ЛП на сайтах: Федеральной службы по аккредитации (Росаккредитация) - fsa.gov.ru
или на сайтах органов по сертификации, зарегистрировавших декларации или оформивших
сертификаты соответствия.
4.7. Проверить наличие копий документов, подтверждающих качество
фармацевтических субстанций (Приложение 8).
24.
На вторичной (потребительской) упаковке:наименование ЛП (МНН, или группировочное,
или химическое и торговое),
наименование производителя ЛП,
номер серии,
номер регистрационного удостоверения,
срок годности,
способ применения,
дозировка,
лекарственная форма,
условия отпуска,
условия хранения,
предупредительные надписи.
штриховой код
ЛП, полученные из крови, плазмы крови, органов
и тканей человека - надпись: "Антитела к ВИЧ-1,
ВИЧ-2, к вирусу гепатита C и поверхностный
антиген вируса гепатита B отсутствуют".
На первичной упаковке:
наименование ЛП (МНН, или
группировочное/химическое/
торговое),
номер серии,
срок годности,
дозировка,
25.
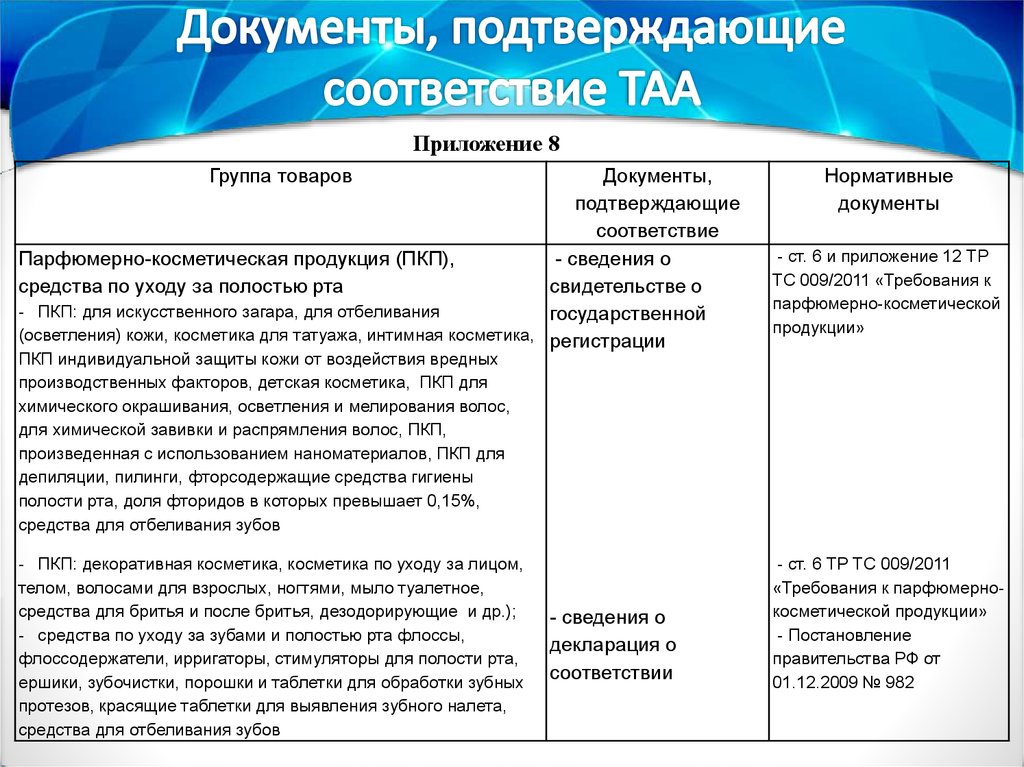
Приложение 8Группа товаров
Документы, подтверждающие
соответствие
Нормативные документы
Лекарственные средства:
- лекарственные препараты
- сведения о декларации о
соответствии
- вакцины, сыворотки, иммуно- и
гаммаглобулины, препараты из
крови прочие и полученные
- сведения о сертификате
методом генетической инженерии
соответствия
и других биологических
субстратов, анатоксины и
токсины, применяемые в
медицине
- фармацевтические субстанции
- копия паспорта
(сертификата качества) от
производителя;
- копия протокола анализа
Постановление правительства РФ от
01.12.2009 № 982 "Об утверждении
единого перечня продукции, подлежащей
обязательной сертификации, и единого
перечня продукции, подтверждение
соответствия которой осуществляется в
форме принятия декларации о
соответствии" (с изменениями и
дополнениями)
Ст. 56 и Ч.2 ст. 33 федерального закона
от 12.04.2010 № 61-ФЗ (с изм. и
дополнениями)
П. 22 ст. 4 федерального закона от
12.04.2010 № 61-ФЗ (с изм. и
дополнениями)
26.
4. Приемочный контроль лекарственных препаратов/средств (продолжение).4.8. В случае несоответствия ЛС показателям приемочного контроля «Описание»,
«Упаковка», «Маркировка» данные ЛС разместить в «зоне изъятых из обращения ЛС»,
промаркировать «забраковано при приемочном контроле», хранить до возврата
поставщику. Комиссии по приемке ТАА составить «Акт об установленном расхождении
по количеству и качеству при приемке товарно-материальных ценностей» (акт другой
формы).
О факте выявления недоброкачественных ЛС необходимо уведомить поставщика
ЛС и территориальное Управление Росздравнадзора.
4.9. В случае сомнения в качестве поступивших ЛС или отсутствия документов,
подтверждающих их качество комиссии по приемке ТАА составить «Акт об
установленном расхождении по количеству и качеству при приемке товарноматериальных ценностей» (акт другой формы). Данные ЛС разместить в зоне
«Карантинное хранение ЛС» и промаркировать «забраковано при приемочном
контроле», хранить до возврата их поставщику или устранения несоответствия.
Необходимо также уведомить поставщика о выявленных несоответствиях ЛС.
4.10. При соответствии ЛС количеству и качеству, правильности оформления
сопроводительных документов разместить товары ЛС по местам хранения с
прикреплением стеллажных карт (кодов).
27.
Ввод в гражданский оборот ЛП длямедицинского применения
ФЕДЕРАЛЬНЫЙ ЗАКОН от 28.11.2018 № 449-ФЗ
О ВНЕСЕНИИ ИЗМЕНЕНИЙ
В ОТДЕЛЬНЫЕ ЗАКОНОДАТЕЛЬНЫЕ АКТЫ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПО ВОПРОСУ ВВОДА В ГРАЖДАНСКИЙ ОБОРОТ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
Начало действия с 29.11.2019
-отменяется обязательное подтверждение соответствия ЛП в форме
обязательной сертификации/декларирования соответствия (п.4 ст. 1
закона от 27.12. 2002 года N 184-ФЗ "О техническом регулировании»)
-ввод в гражданский оборот ЛП для медицинского применения после
представления сведений о качестве серии (партии) ЛП в Росздравнадзор
(ст. 52.1 закона от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных
средств», п. 2 ст. 12 закона от 17.09.1998 г N 157-ФЗ "Об
иммунопрофилактике инфекционных болезней")
-порядок представления сведений о качестве серии (партии) ЛП в
Росздравнадзор устанавливается Постановлением Правительства
28.
5. Приемочный контроль медицинских изделий.5.1. Сверить соответствие наименования МИ, производителя, серию и срок годности в
сопроводительных документах и на упаковке МИ.
5.2. Убедиться в факте государственной регистрации поступивших МИ на сайте РЗН
в электронном сервисе «Государственный реестр медицинских изделий и организаций
(ИП), осуществляющих производство и изготовление медицинских изделий». В случае
отсутствия данных о факте государственной регистрации данных МИ разместить их в
зоне карантинного хранения (термолабильные МИ в зоне карантинного хранения в
холодильнике №__), составить «Акт об установленном расхождении по количеству и
качеству при приемке товарно-материальных ценностей» (акт другой формы). Уведомить
поставщика о выявленном несоответствии. Уведомить территориальное Управление
Росздравнадзора о поступлении незарегистрированных МИ.
5.3. Проверить наличие (отсутствие) поступивших МИ в базе данных РЗН о
незарегистрированных, приостановленных или изъятых из обращения медицинских
изделиях: электронный сервис «Информационные письма о медицинских изделиях» (в
других официальных информационных базах). При наличии в базе данных РЗН
информации о том, что обращение данного МИ приостановлено, или данное МИ
незарегистрировано/изъято из обращения, то МИ разместить в зоне карантинного
хранения в соответствии с условиями хранения с оформлением «Акта об установленном
расхождении по количеству и качеству при приемке товарно-материальных ценностей»
(акт другой формы). Уведомить поставщика о выявленном несоответствии. Уведомить
территориальное Управление Росздравнадзора о поступлении незарегистрированных МИ.
29.
5. Приемочный контроль медицинских изделий (продолжение).Если в базе данных Росздравнадзора отсутствует информация, что обращение
данного МИ приостановлено, или что данное МИ изъято из обращения или
незарегистрировано, то продолжается приемочный контроль.
5.4. Осуществить визуальный осмотр МИ, проверить целостность вторичных и при
необходимости первичных упаковок МИ, проверить комплектность МИ.
5.5. Проверить соответствие маркировки поступивших МИ требованиям,
установленным в разделе 18 Единых санитарно-эпидемиологических и гигиенических
требований к продукции (товарам), подлежащей санитарно-эпидемиологическому
надзору (контролю), утвержденных Решением Комиссии таможенного союза от
28.05.2010 года № 299 (приложение 7).
5.6. Проверить наличие необходимой информации о МИ в соответствии с
требованиями п. 72 Постановление Правительства РФ от 19.01.1998 № 55:
- сведения о номере и дате регистрационного удостоверения на МИ, выданного РЗН;
- сведения о назначении товара, способе и условиях применения;
сведения о действии и оказываемом эффекте, ограничениях (противопоказаниях) для
применения.
5.7. Проверить соответствие технической и эксплуатационной документации на
МИ требованиям, утвержденным Приказом МЗ РФ от 19.01.2017 № 11н «Об утверждении
требований к содержанию технической и эксплуатационной документации производителя
(изготовителя) медицинского изделия».
30.
Маркировка МИ(раздел 18 Решения комиссии ТС № 299)
Маркировка, наносимая
непосредственно на изделие, должна
содержать:
наименование изготовителя и/или его
товарный знак;
наименование изделия;
габариты, массу, электропитание,
заводской номер (при необходимости),
дату (год) изготовления (для ИМТ),
срок годности или дату окончания срока
годности,
нормативный документ, требованиям
которого соответствует изделие,
знак обращения;
другую информацию в соответствии с
технической документацией изготовителя.
Маркировка, наносимая на упаковку
изделия, должна содержать:
наименование страны-изготовителя,
наименование, юридический адрес и
торговую марку изготовителя,
наименование изделия,
нормативный документ, требованиям
которого соответствует изделие,
габариты, массу (при необходимости),
способы ухода за изделием,
год изготовления (для ИМТ), срок
годности или дату окончания срока
годности (для ИМН),
знак обращения,
другую информацию в соответствии с
документацией изготовителя.
31.
5. Приемочный контроль медицинских изделий (продолжение).5.8. Проверить наличие и правильность оформления всех необходимых
товаросопроводительных документов на поступившие МИ.
5.9. Проверить наличие сведений о декларациях о соответствии или о сертификатах
соответствия на поступившие МИ в реестре (другом документе) поставщика
(Приложение 8).
5.10. При необходимости провести идентификацию деклараций о соответствии или
сертификатов соответствия на МИ на сайте Федеральной службы по аккредитации
(Росаккредитация) - fsa.gov.ru
5.11. В случае сомнения в качестве МИ, несоответствия сведений о МИ, указанных в
регистрационном удостоверении, на самом МИ и в товарно-сопроводительных
документах, отсутствия документов, подтверждающих их качество, или поставке МИ с
остаточным сроком годности меньше прописанного в договорах (контрактах) комиссии по
приемке товаров АА аптечной организации составить «Акт об установленном
расхождении по количеству и качеству при приемке товарно-материальных ценностей»
(акт другой формы). Забракованные МИ разместить в зоне карантинного хранение в
соответствии с условиями хранения МИ и промаркировать «забраковано при приемочном
контроле». В этих зонах МИ хранятся до возврата их поставщику или устранения
несоответствия. Необходимо также уведомить территориальное управление РЗН и
поставщика о выявленных несоответствиях МИ.
5.12. При соответствии МИ количеству и качеству, правильности оформления
сопроводительных документов ввести информацию о приходе МИ в учетную программу.
5.13. Разместить МИ по местам хранения.
32.
Приложение 8Группа товаров
Медицинские изделия:
Документы,
подтверждающие
соответствие
- сведения о регистрации
Росздравнадзором
МИ: приборы, аппараты, инструменты,
устройства, средства измерения, перевязочные - сведения о декларация о
и шовные средства, стоматологические
соответствии
материалы, наборы реагентов, изделия из
полимерных, резиновых и иных материалов, из
латексов), изделия протезно-ортопедические,
диагностикумы, антигены, тест-системы,
применяемые в медицине; очковая оптика (очки,
оправы, линзы очковые
МИ: презервативы резиновые
- сведения о сертификате
соответствия
Нормативные документы
Ч. 4 ст. 38 федерального закона от
21.11.2011 № 323-ФЗ "Об основах
охраны здоровья граждан в РФ» (с
изм. и дополнениями)
Постановление правительства РФ
от 01.12.2009 № 982 (с
изменениями и дополнениями)
33.
6. Приемочный контроль пищевой продукции аптечного ассортимента:лечебного, детского и диетического питания, минеральных вод, биологически
активных добавок к пище.
6.1. Сверить соответствие наименования поступившей пищевой продукции,
наименования производителей, сроки годности, номер партии (если есть) в
сопроводительных документах и на упаковках.
6.2. Проверить наличие (отсутствие) информации о несоответствии принимаемой
пищевой продукции на сайте Роспотребнадзора http://rospotrebnadzor.ru/
Если в базе данных Роспотребнадзора (другой информационной базе) имеется
информация, что обращение данной продукции приостановлено, то продукция
перемещается в зону карантинного хранения (термолабильная продукция перемещается в
зону карантинного хранения в холодильнике №__) с оформлением «Акта об
установленном расхождении по количеству и качеству при приемке товарноматериальных ценностей» (акт другой формы). Уведомить территориальное Управление
Роспотребнадзора о поступлении данной пищевой продукции. а также уведомить
поставщика.
Если в базе данных Роспотребнадзора отсутствует информация, что обращение данной
продукции приостановлено, или что данная продукция изъята из обращения, то продолжается
приемочный контроль.
6.3. Убедиться в факте государственной регистрации пищевой продукции аптечного
ассортимента на поисковом сервере по реестрам Роспотребнадзора : http://fp.crc.ru или на
сайте Евразийской Экономической Комиссии: http://www.eurasiancommission.org/ru в
Едином реестре Свидетельств о государственной регистрации Таможенного Союза.
34.
6. Приемочный контроль пищевой продукции аптечного ассортимента(продолжение).
6.4. Проверить соответствие маркировки пищевой продукции (лечебного, детского и
диетического питания, минеральных вод, БАД) требованиям статьи 4 Технического
регламента Таможенного союза 022/2011 «Пищевая продукция в части ее маркировки» и
статьи 6 Технического регламента Таможенного союза 005/2011 «О безопасности
упаковки», для БАД проверить также соответствие маркировки требованиям СанПиН
2.3.2.1290-03 (Приложение 7).
6.5. Проверить соответствие информации, нанесенной на этикетку, данным,
указанным в соответствующем разделе свидетельства о государственной регистрации.
6.6. Проверить наличие сведений о свидетельстве о государственной регистрации в
реестре (другом документе) поставщика.
6.7. Проверить правильность оформления товарно-сопроводительных документов.
6.8. При соответствии пищевой продукции по количеству и качеству, правильности
оформления сопроводительных документов ввести информацию о приходе товаров в
учетную программу, распечатать стеллажные карты для БАД с указанием наименования
БАД, партии (серии), срока годности, количества единиц хранения.
6.9. Разместить товары по местам хранения.
35. Требования к маркировке пищевой продукции
наименование пищевой продукции;
состав пищевой продукции;
количество пищевой продукции;
дата изготовления пищевой продукции;
срок годности пищевой продукции;
условия хранения пищевой продукции;
наименование и место нахождения изготовителя/уполномоченного лица/
импортера;
рекомендации и (или) ограничения по использованию;
показатели пищевой ценности;
сведения о наличии в пищевой продукции компонентов, полученных с
применением генно-модифицированных организмов (далее - ГМО);
единый знак обращения продукции на рынке государств - членов
Таможенного союза
36.
Требования к маркировке упаковки пищевой продукцииМаркировка упаковки (укупорочных средств) должна содержать:
• цифровое обозначение и (или) буквенное обозначение
(аббревиатуру) материала, из которого изготавливается упаковка
(укупорочные средства), в соответствии с приложением 3 к TP ТС
005/2011
• пиктограммы и символы в соответствии с приложением 4
к TP ТС 005/2011
Рисунок 1
для пищевой продукции
Рисунок 4
возможность утилизации использованной упаковки
(укупорочных средств) - петля Мебиуса
37.
6. Приемочный контроль пищевой продукции аптечного ассортимента(продолжение).
6.10. В случае отсутствия данных о факте государственной регистрации поступившей
пищевой продукции, несоответствия требований по маркировке, отсутствие сведений о
свидетельстве о государственной регистрации в товарно-сопроводительных документах,
сомнения в качестве или поставки пищевой продукции с остаточным сроком годности
меньше прописанного в договорах (контрактах) комиссии по приемке товаров АА
аптечной организации составить «Акт об установленном расхождении по количеству и
качеству при приемке товарно-материальных ценностей» (акт другой формы).
Разместить данную пищевую продукцию в зоне «Карантинное хранение товаров АА» в
соответствии с условиями хранения и промаркировать «забраковано при приемочном
контроле». В этой зоне указанная пищевая продукция хранится до возврата их
поставщику или устранения несоответствия. Уведомить поставщика о выявленном
несоответствии.
6.11. Уведомить территориальное Управление Роспотребнадзора о поступлении
недоброкачественной пищевой продукции.
38.
7. Приемочный контроль парфюмерно-косметической продукции (ПКП).7.1. Сверить соответствие наименования поступившей ПКП, наименования
производителей, сроки годности, номер партии (если есть) в сопроводительных
документах и на упаковках.
7.2. Проверить наличие (отсутствие) информации о несоответствии принимаемой
ПКП на сайте Роспотребнадзора http://rospotrebnadzor.ru/
Если в базе данных Роспотребнадзора (другой информационной базе) имеется
информация, что обращение данной продукции приостановлено, то ПКП разместить в
зоне карантинного хранения (термолабильную ПКП разместить в зоне карантинного
хранения в холодильнике №__) с оформлением «Акта об установленном расхождении по
количеству и качеству при приемке товарно-материальных ценностей» (акт другой
формы). Уведомить территориальное Управление Роспотребнадзора о поступлении
данной ПКП, а также уведомить поставщика.
Если в базе данных Роспотребнадзора отсутствует информация, что обращение
данной продукции приостановлено, или что данная продукция изъята из обращения, то
продолжается приемочный контроль.
7.3. Убедиться в факте государственной регистрации на поисковом сервере по
реестрам Роспотребнадзора : http://fp.crc.ru или на сайте Евразийской Экономической
Комиссии: http://www.eurasiancommission.org/ru в Едином реестре Свидетельств о
государственной регистрации Таможенного Союза следующей ПКП:
39.
Парфюмерно-косметическая продукция,подлежащая государственной регистрации
1. Парфюмерно-косметическая продукция для искусственного загара
2. Парфюмерно-косметическая продукция для отбеливания (осветления) кожи
3. Косметика для татуажа
4. Интимная косметика
5. ПКП индивидуальной защиты кожи от воздействия вредных производственных
факторов
6. Детская косметика
7. ПКП для химического окрашивания, осветления и мелирования волос
8. Парфюмерно-косметическая продукция для химической завивки и распрямления волос
9. ПКП, произведенная с использованием наноматериалов
10. Парфюмерно-косметическая продукция для депиляции
11. Пилинги
12 Фторсодержащие средства гигиены полости рта, массовая доля фторидов в которых
превышает 0,15% (для жидких средств гигиены полости рта - 0,05%)
13. Средства для отбеливания зубов, содержащие перекись водорода или другие
компоненты, выделяющие перекись водорода, включая перекись карбамида и перекись
цинка, с концентрацией перекиси водорода (в качестве ингредиента или выделяемой)
0,1% - 6,0%.
40.
7. Приемочный контроль парфюмерно-косметической продукции(продолжение).
7.4. Проверить наличие сведений о декларации о соответствии в реестре (другом
документе) поставщика (Приложение 8) следующих групп ПКП:
- декоративная косметика,
- косметика по уходу за лицом, телом, волосами, ногтями для взрослых,
- мыло туалетное,
- средства для бритья,
- дезодорирующие средства,
- средства по уходу за зубами и полостью рта (кроме тех, которые подлежат
государственной регистрации)
7.5. При необходимости провести идентификацию деклараций о соответствии на
сайте Федеральной службы по аккредитации (Росаккредитация) - fsa.gov.ru.
7.6. Проверить соответствие маркировки ПКП требованиям статьи 5 Технического
регламента Таможенного союза 009/2011 «Требования к парфюмерно-косметической
продукции» и статьи 6 Технического регламента Таможенного союза 005/2011 «О
безопасности упаковки» (приложение 7).
7.7. При соответствии ПКП по количеству и качеству, правильности оформления
сопроводительных документов ввести информацию о приходе товаров в учетную
программу.
7.8. Разместить товары по местам хранения.
41.
Приложение 8Группа товаров
Документы,
подтверждающие
соответствие
Парфюмерно-косметическая продукция (ПКП),
- сведения о
средства по уходу за полостью рта
свидетельстве о
- ПКП: для искусственного загара, для отбеливания
государственной
(осветления) кожи, косметика для татуажа, интимная косметика, регистрации
Нормативные
документы
- ст. 6 и приложение 12 ТР
ТС 009/2011 «Требования к
парфюмерно-косметической
продукции»
ПКП индивидуальной защиты кожи от воздействия вредных
производственных факторов, детская косметика, ПКП для
химического окрашивания, осветления и мелирования волос,
для химической завивки и распрямления волос, ПКП,
произведенная с использованием наноматериалов, ПКП для
депиляции, пилинги, фторсодержащие средства гигиены
полости рта, доля фторидов в которых превышает 0,15%,
средства для отбеливания зубов
- ПКП: декоративная косметика, косметика по уходу за лицом,
телом, волосами для взрослых, ногтями, мыло туалетное,
средства для бритья и после бритья, дезодорирующие и др.);
- средства по уходу за зубами и полостью рта флоссы,
флоссодержатели, ирригаторы, стимуляторы для полости рта,
ершики, зубочистки, порошки и таблетки для обработки зубных
протезов, красящие таблетки для выявления зубного налета,
средства для отбеливания зубов
- сведения о
декларация о
соответствии
- ст. 6 ТР ТС 009/2011
«Требования к парфюмернокосметической продукции»
- Постановление
правительства РФ от
01.12.2009 № 982
42. Требования по маркировке ПКП
--
наименование, название (при наличии);
назначение ПКП, если это не следует из наименования продукции;
косметика, предназначенная для детей, должна иметь соответствующую
информацию в маркировке;
список ингредиентов;
наименование изготовителя и его местонахождение/ уполномоченного
представителя (юридический адрес, включая страну);
страна происхождения ПКП (если страна, где расположено производство
продукции, не совпадает с юр. адресом изготовителя);
номинальное количество (объем или масса) продукции в потребительской
таре;
цвет и/или тон (для декоративной косметики и окрашивающих средств);
массовую долю фторида в пересчете на молярную массу фтора (%, или
мг/кг, или ppm) для средств гигиены полости рта, содержащих соединения
фтора;
срок годности:
описание условий хранения в случае, если эти условия отличаются от
стандартных;
особые меры предосторожности (при необходимости) при применении
продукции, в том числе информация о предупреждениях, изложенных в
приложениях 2 - 5 настоящего технического регламента;
номер партии или специальный код, позволяющие идентифицировать
партию парфюмерно-косметической продукции;
сведения о способах применения ПКП, отсутствие которых может привести
к неправильному использованию потребителем ПКП;
единый знак обращения на рынке ТС
43.
Требования к маркировке упаковки ПКПМаркировка упаковки (укупорочных средств) должна содержать:
• цифровое обозначение и (или) буквенное обозначение
(аббревиатуру) материала, из которого изготавливается упаковка
(укупорочные средства), в соответствии с приложением 3 к TP ТС
005/2011
• пиктограммы и символы в соответствии с приложением 4
к TP ТС 005/2011
Рисунок 2
для парфюмернокосметической продукции
до 21.05.2017
Рисунок 4
возможность утилизации использованной упаковки
(укупорочных средств) - петля Мебиуса
44.
7. Приемочный контроль парфюмерно-косметической продукции(продолжение).
7.9. В случае отсутствия данных о факте государственной регистрации ПКП,
подлежащей государственной регистрации, несоответствия требований по маркировке,
отсутствие сведений о свидетельстве о государственной регистрации или о декларации в
товарно-сопроводительных документах, сомнения в качестве или поставки ПКП с
остаточным сроком годности меньше прописанного в договорах (контрактах) комиссии по
приемке товаров АА аптечной организации составить «Акт об установленном
расхождении по количеству и качеству при приемке товарно-материальных ценностей»
(акт другой формы). Разместить данную ПКП в зоне «Карантинное хранение товаров АА»
в соответствии с условиями хранения и промаркировать «забраковано при приемочном
контроле». В этой зоне указанная ПКП хранится до возврата поставщику или устранения
несоответствия. Уведомить поставщика о выявленном несоответствии.
7.10. Уведомить территориальное Управление Роспотребнадзора о поступлении
недоброкачественной пищевой продукции.
45.
8. Приемочный контроль предметов и средств по уходу за новорожденными идетьми, не достигшими возраста 3-х лет (детские товары).
8.1. Сверить соответствие наименования поступивших детских товаров,
наименования производителей, сроки годности, номер партии (если есть) в
сопроводительных документах и на упаковках.
8.2. Проверить наличие (отсутствие) информации о несоответствии принимаемых
детских товаров на сайте Роспотребнадзора http://rospotrebnadzor.ru/
Если в базе данных Роспотребнадзора (другой информационной базе) имеется
информация, что обращение данной продукции приостановлено, то детские товары
разместить в зоне карантинного хранения (термолабильные разместить в зоне
карантинного хранения в холодильнике №__) с оформлением «Акта об установленном
расхождении по количеству и качеству при приемке товарно-материальных ценностей»
(акт другой формы). Уведомить территориальное Управление Роспотребнадзора о
поступлении данной продукции для детей, а также уведомить поставщика.
Если в базе данных Роспотребнадзора отсутствует информация, что обращение
данной продукции приостановлено, или что данная продукция изъята из обращения, то
продолжается приемочный контроль.
46.
8. Приемочный контроль предметов и средств по уходу за новорожденными идетьми, не достигшими возраста 3-х лет (детские товары) (продолжение).
8.3. Убедиться в факте государственной регистрации на поисковом сервере по
реестрам Роспотребнадзора : http://fp.crc.ru или на сайте Евразийской Экономической
Комиссии: http://www.eurasiancommission.org/ru в Едином реестре Свидетельств о
государственной регистрации Таможенного Союза следующих товаров для детей: соски
молочные, соски-пустышки из латекса, резины или силиконовые; посуда, столовые
приборы для детей до 3-х лет (чашки, блюдца, поильники, тарелки, миски, ложки, вилки,
бутылочки и другие аналогичные изделия для пищевых продуктов); изделия санитарно –
гигиенические разового пользования (подгузники, трусы, пеленки, гигиенические ватные
палочки); щетки зубные, щетки зубные электрические с питанием от химических
источников тока, массажеры для десен и другие аналогичные изделия для детей до 3-х
лет.
8.4. Проверить соответствие маркировки предметов и средств, предназначенных для
ухода за новорожденными и детьми, не достигшими возраста трех лет требованиям
статьи 9 Технического регламента Таможенного союза 007/2011 «О безопасности
продукции, предназначенной для детей и подростков» и статьи 6 Технического
регламента Таможенного союза 005/2011 «О безопасности упаковки» (Приложение 7).
8.5. Проверить наличие сведений о декларациях о соответствии или о сертификатах
соответствия на детские товары в реестре (другом документе) поставщика (Приложение 8).
8.6. При соответствии детской продукции по количеству и качеству, правильности
оформления сопроводительных документов ввести информацию о приходе товаров в учетную
47. Требования к маркировке детской продукции
наименование страны, где изготовлена продукция;наименование и местонахождение изготовителя (уполномоченного
изготовителем лица), импортера, дистрибьютора;
наименование и вид (назначение) изделия;
дата изготовления;
единый знак обращения на рынке;
срок службы продукции (при необходимости) (обязательно – для детских
колясок);
гарантийный срок службы (при необходимости);
товарный знак (при наличии);
маркировка сосок молочных и сосок-пустышек должна наноситься на закрытую
упаковку и содержать гарантийный срок службы, инструкцию по использованию,
хранению, гигиеническому уходу за изделием;
изделия санитарно-гигиенические разового использования для ухода за детьми
должны иметь инструкцию, содержащую информацию с указанием назначения,
размера, рекомендаций по правильному выбору вида и размера изделия,
способов ухода за изделием и его утилизации (при необходимости);
маркировка посуды и изделий санитарно-гигиенических должна содержать
обозначение материала, из которого изготовлено изделие, и инструкцию по
эксплуатации и уходу.
48.
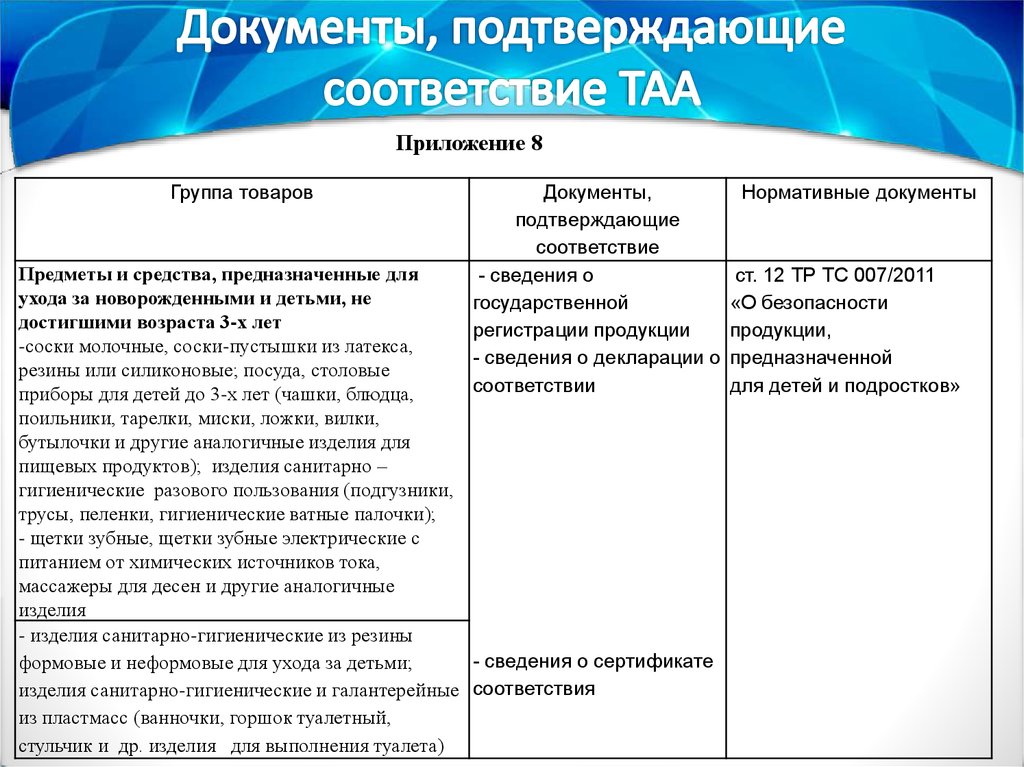
Приложение 8Группа товаров
Документы,
подтверждающие
соответствие
- сведения о
государственной
регистрации продукции
- сведения о декларации о
соответствии
Предметы и средства, предназначенные для
ухода за новорожденными и детьми, не
достигшими возраста 3-х лет
-соски молочные, соски-пустышки из латекса,
резины или силиконовые; посуда, столовые
приборы для детей до 3-х лет (чашки, блюдца,
поильники, тарелки, миски, ложки, вилки,
бутылочки и другие аналогичные изделия для
пищевых продуктов); изделия санитарно –
гигиенические разового пользования (подгузники,
трусы, пеленки, гигиенические ватные палочки);
- щетки зубные, щетки зубные электрические с
питанием от химических источников тока,
массажеры для десен и другие аналогичные
изделия
- изделия санитарно-гигиенические из резины
- сведения о сертификате
формовые и неформовые для ухода за детьми;
изделия санитарно-гигиенические и галантерейные соответствия
из пластмасс (ванночки, горшок туалетный,
стульчик и др. изделия для выполнения туалета)
Нормативные документы
ст. 12 ТР ТС 007/2011
«О безопасности
продукции,
предназначенной
для детей и подростков»
49.
8. Приемочный контроль предметов и средств по уходу за новорожденными идетьми, не достигшими возраста 3-х лет (детские товары) (продолжение).
8.8. В случае отсутствия данных о факте государственной регистрации товаров для
детей, подлежащих государственной регистрации, несоответствия требований по
маркировке, отсутствие сведений о свидетельстве о государственной регистрации, о
декларации или сертификате в товарно-сопроводительных документах, сомнения в
качестве или поставки детских товаров с остаточным сроком годности меньше
прописанного в договорах (контрактах) комиссии по приемке товаров АА аптечной
организации составить «Акт об установленном расхождении по количеству и качеству
при приемке товарно-материальных ценностей» (акт другой формы). Разместить данные
товары в зоне «Карантинное хранение товаров АА» в соответствии с условиями хранения
и промаркировать «забраковано при приемочном контроле». В этой зоне указанная
продукция для детей хранится до возврата поставщику или устранения несоответствия.
Уведомить поставщика о выявленном несоответствии.
8.9. Уведомить территориальное Управление Роспотребнадзора о поступлении
недоброкачественной продукции для детей.
50.
9. Приемочный контроль других товаров аптечного ассортимента:дезинфицирующих средств, изделий санитарно-гигиенического и медицинского
назначения разового пользования, предметов и средств по уходу за больными.
9.1. Сверить соответствие наименования поступивших товаров, наименования
производителей, сроки годности, номер партии (если есть) в сопроводительных
документах и на упаковках.
9.2. Проверить наличие (отсутствие) информации о несоответствии принимаемых
товаров на сайте Роспотребнадзора http://rospotrebnadzor.ru/
Если в базе данных Роспотребнадзора (другой информационной базе) имеется
информация, что обращение данной продукции приостановлено, то товары разместить в
зоне карантинного хранения (термолабильные разместить в зоне карантинного хранения
в холодильнике №__) с оформлением «Акта об установленном расхождении по
количеству и качеству при приемке товарно-материальных ценностей» (акт другой
формы). Уведомить территориальное Управление Роспотребнадзора о поступлении
данных товаров, а также уведомить поставщика.
Если в базе данных Роспотребнадзора отсутствует информация, что обращение
данной продукции приостановлено, или что данная продукция изъята из обращения, то
продолжается приемочный контроль.
51.
9. Приемочный контроль других товаров аптечного ассортимента:дезинфицирующих средств, изделий санитарно-гигиенического и медицинского
назначения разового пользования, предметов и средств по уходу за больными
(продолжение).
9.3. Убедиться в факте государственной регистрации на поисковом сервере по
реестрам Роспотребнадзора : http://fp.crc.ru или на сайте Евразийской Экономической
Комиссии: http://www.eurasiancommission.org/ru в Едином реестре Свидетельств о
государственной регистрации Таможенного Союза следующих товаров:
дезинфицирующих средств, предметов и средств личной гигиены.
9.4. Проверить соответствие маркировки и упаковки (тары) дезинфицирующих
средств требованиям пункта 5 раздела 20 «Основные требования к дезинфицирующим,
дезинсекционным и дератизационным средствам» Единых санитарноэпидемиологических и гигиенических требований к продукции (товарам), подлежащей
санитарно-эпидемиологическому надзору (контролю), утвержденных Решением
Комиссии таможенного союза от 28.05.2010 года № 299:
- транспортная маркировка наносится непосредственно на тару печатными
машинами, по трафарету или наклейкой этикеток. Она должна содержать:
манипуляционные знаки, классификационный шифр, информацию для потребителя с
обязательным указанием номера партии, даты изготовления (месяц, год) и гарантийного
срока хранения;
- тара для упаковки агрессивных дезсредств (pH менее 2,0 ед. и более 11,5 ед.)
52.
9. Приемочный контроль других товаров аптечного ассортимента:дезинфицирующих средств, изделий санитарно-гигиенического и медицинского
назначения разового пользования, предметов и средств по уходу за больными
(продолжение).
9.5. Проверить соответствие маркировки предметов и средств личной гигиены
требованиям пункта 4 раздела 12 «Требования к средствам личной гигиены» Единых
санитарно-эпидемиологических и гигиенических требований к продукции (товарам),
подлежащей санитарно-эпидемиологическому надзору (контролю), утвержденных
Решением Комиссии таможенного союза от 28.05.2010 года № 299 (Приложение 7).
9.6. Проверить наличие сведений о декларациях о соответствии на товары АА в
реестре (другом документе) поставщика (Приложение 8).
9.7. При необходимости провести идентификацию деклараций о соответствии или
сертификатов соответствия на товары АА на сайте Федеральной службы по аккредитации
(Росаккредитация) - fsa.gov.ru.
9.8. При соответствии товаров АА по количеству и качеству, правильности
оформления сопроводительных документов ввести информацию о приходе товаров в
учетную программу.
9.9. Разместить товары по местам хранения.
53.
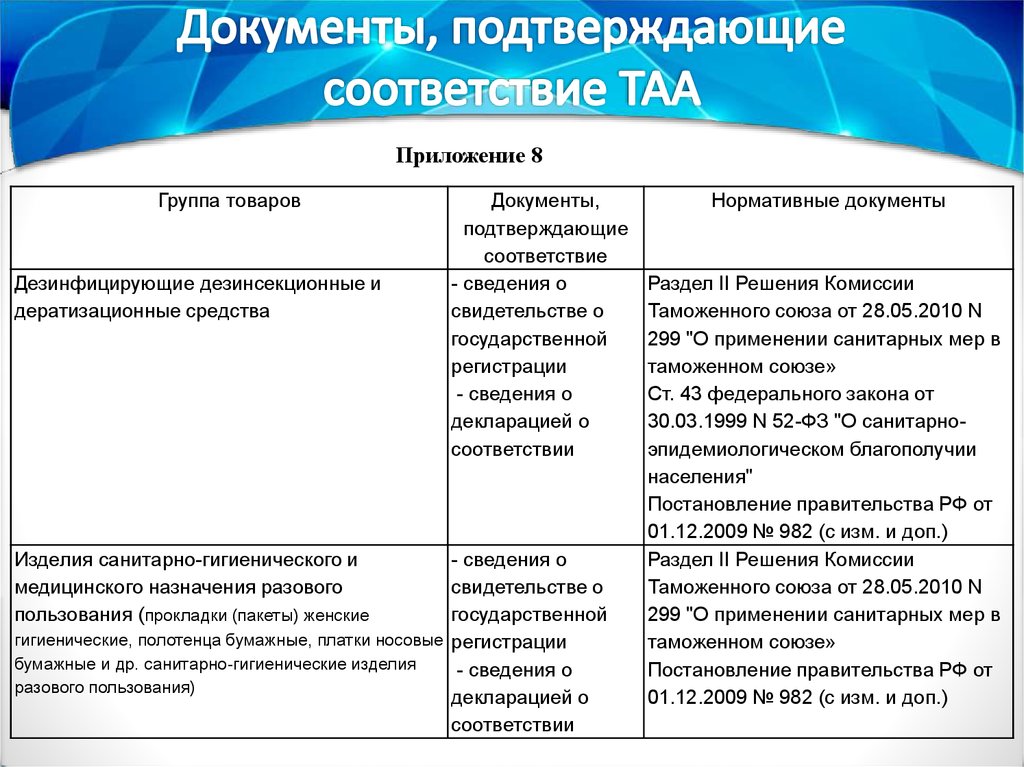
Приложение 8Группа товаров
Дезинфицирующие дезинсекционные и
дератизационные средства
Изделия санитарно-гигиенического и
медицинского назначения разового
пользования (прокладки (пакеты) женские
Документы,
подтверждающие
соответствие
- сведения о
свидетельстве о
государственной
регистрации
- сведения о
декларацией о
соответствии
- сведения о
свидетельстве о
государственной
гигиенические, полотенца бумажные, платки носовые регистрации
бумажные и др. санитарно-гигиенические изделия
- сведения о
разового пользования)
декларацией о
соответствии
Нормативные документы
Раздел II Решения Комиссии
Таможенного союза от 28.05.2010 N
299 "О применении санитарных мер в
таможенном союзе»
Ст. 43 федерального закона от
30.03.1999 N 52-ФЗ "О санитарноэпидемиологическом благополучии
населения"
Постановление правительства РФ от
01.12.2009 № 982 (с изм. и доп.)
Раздел II Решения Комиссии
Таможенного союза от 28.05.2010 N
299 "О применении санитарных мер в
таможенном союзе»
Постановление правительства РФ от
01.12.2009 № 982 (с изм. и доп.)
54.
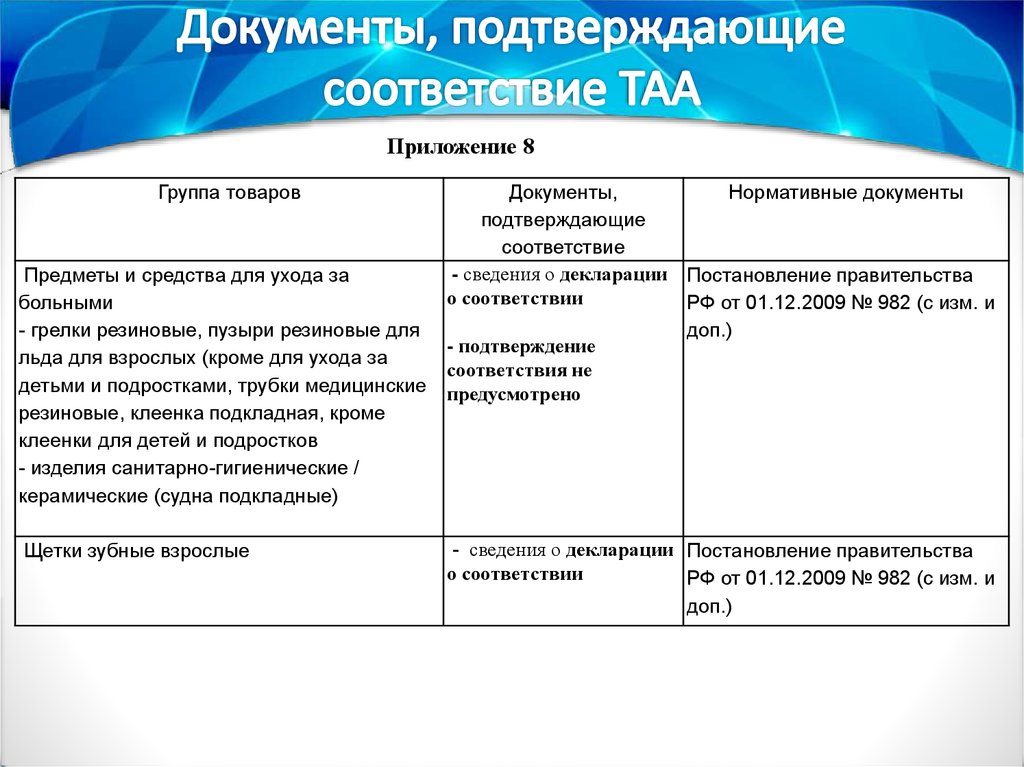
Приложение 8Группа товаров
Документы,
Нормативные документы
подтверждающие
соответствие
- сведения о декларации Постановление правительства
Предметы и средства для ухода за
о соответствии
больными
РФ от 01.12.2009 № 982 (с изм. и
- грелки резиновые, пузыри резиновые для
доп.)
- подтверждение
льда для взрослых (кроме для ухода за
соответствия не
детьми и подростками, трубки медицинские предусмотрено
резиновые, клеенка подкладная, кроме
клеенки для детей и подростков
- изделия санитарно-гигиенические /
керамические (судна подкладные)
Щетки зубные взрослые
- сведения о декларации Постановление правительства
о соответствии
РФ от 01.12.2009 № 982 (с изм. и
доп.)
55.
9. Приемочный контроль других товаров аптечного ассортимента:дезинфицирующих средств, изделий санитарно-гигиенического и медицинского
назначения разового пользования, предметов и средств по уходу за больными
(продолжение).
9.10. В случае отсутствия данных о факте государственной регистрации товаров АА,
подлежащих государственной регистрации, несоответствия требований по маркировке,
отсутствие сведений о свидетельстве о государственной регистрации, о декларации или
сертификате в товарно-сопроводительных документах, сомнения в качестве или поставки
товаров с остаточным сроком годности меньше прописанного в договорах (контрактах)
комиссии по приемке товаров АА аптечной организации составить «Акт об
установленном расхождении по количеству и качеству при приемке товарноматериальных ценностей» (акт другой формы). Разместить данные товары в зоне
«Карантинное хранение товаров АА» в соответствии с условиями хранения и
промаркировать «забраковано при приемочном контроле». В этой зоне указанные товары
хранятся до возврата поставщику или устранения несоответствия. Уведомить
поставщика о выявленном несоответствии.
8.9. Уведомить территориальное Управление Роспотребнадзора о поступлении
недоброкачественных товаров АА.
56.
Основания для возврата товара• нарушены условия о количестве или об ассортименте товара (ст.
466, 468 ГК РФ);
• передан товар ненадлежащего качества или некомплектный
товар (ст. 475, 480 ГК РФ);
• передан товар без тары и/или упаковки (ст. 482 ГК РФ)
Покупатель обязан известить продавца о нарушении
условий договора купли-продажи о количестве, об ассортименте, о
качестве, комплектности, таре и (или) об упаковке товара в срок,
предусмотренный законом, иными правовыми актами или
договором, а если такой срок не установлен, в разумный срок
после того, как нарушение соответствующего условия договора
должно было быть обнаружено исходя из характера и назначения
товара (ст. 482 ГК РФ).
57.
10. Порядок возврата товаров, не прошедших приемочный контрольпоставщику.
10.1. В случае несоблюдения условий хранения при транспортировке, обнаружения
несоответствия товаров по количеству и качеству в присутствии представителя
поставщика /транспортной компании (водителя, экспедитора):
комиссия по приемке ТАА составляет в 2 экземплярах «Акт возврата товара
поставщику» (при несоблюдении условий транспортировки), «Акт об установленном
расхождении по количеству и качеству при приемке товарно-материальных ценностей»
или «Акт о порче, бое товарно-материальных ценностей» (другая форма акта);
уведомляет поставщика (по телефону, по эл. почте, другим способом) о выявлении
несоответствия и о возврате товара;
товар и 1 экземпляр акта возвращаются поставщику.
10.2. В случае обнаружения несоответствия поступивших товаров после ухода
представителя поставщика/транспортной компании:
- комиссия по приемке ТАА составляет в 2 экземплярах «Акт об установленном
расхождении по количеству и качеству при приемке товарно-материальных ценностей»
или «Акт о порче, бое товарно-материальных ценностей» (другая форма акта);
- уведомляет поставщика (по телефону, по эл. почте, другим способом) о выявлении
несоответствия и о необходимости возврата товара);
58.
10. Порядок возврата товаров, не прошедших приемочный контроль поставщику(продолжение).
- процедура возврата осуществляется в соответствии с условиями договора с
поставщиком (при наличии таких условий): копия акта высылается поставщику по эл.
почте, возвращаемый товар и 1 экземпляр акта передаются поставщику при
следующей поставке товаров и т.д.;
- при отказе поставщика осуществить возврат непринятых в результате приемочного
контроля товаров, спор рассматривается в арбитражном суде.
59.
Приложения к СОП :Приложение 1 Состав комиссии по приемке товара
Приложение 2 Алгоритм приемки товара.
Приложение 3 Акт возврата товаров поставщику
Приложение 4 Акт об установленном расхождении по количеству и
качеству при приемке товарно-материальных ценностей
Приложение 5 Акт о порче, бое товарно-материальных ценностей
Приложение 6 Журнал регистрации результатов приемочного
контроля.
Приложение 7 Требования по маркировка разных товарных групп.
Приложение 8 Перечень документов подтверждающих
соответствие товаров аптечного ассортимента.
60.
Успехов, вдохновения иудачи!!!
доцент кафедры фармакологии и фармации
СЗГМУ им. И.И Мечникова
Лариса Ивановна Гарбузова
е-mail: larisa.garbuzova02@gmail.com




















































 law
law








