Similar presentations:
Л2 Карбоновые кислоты
1.
Основные терминыХимические реакции
in vitro
in vivo
вне организма,
в организме
в колбе
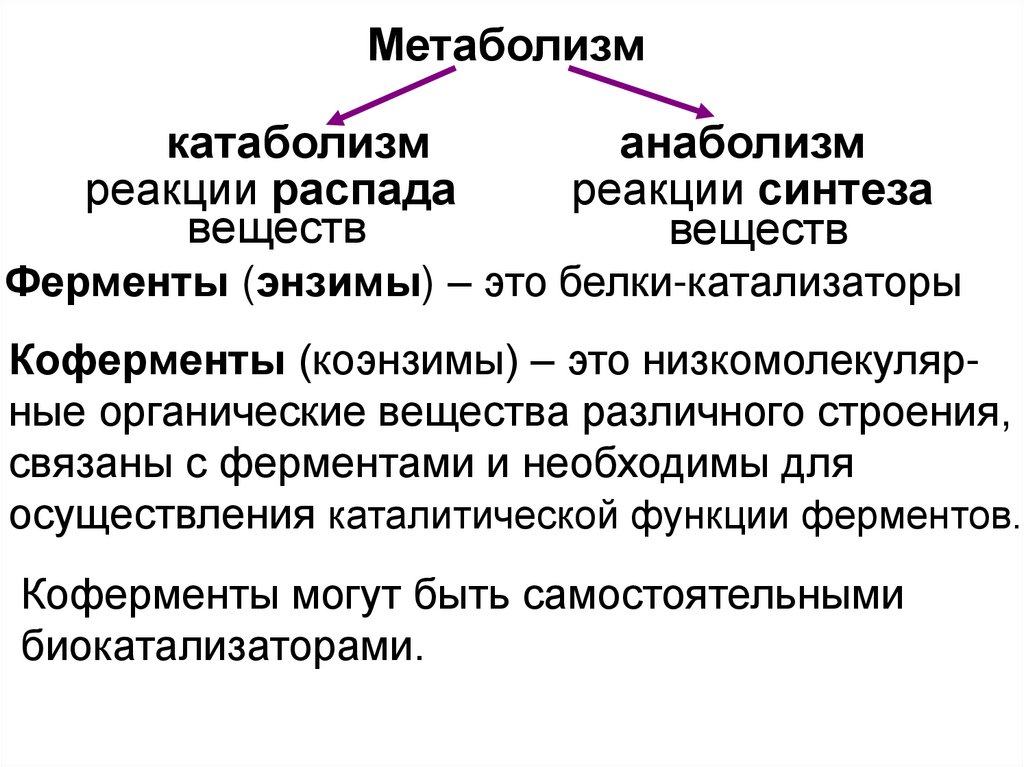
Метаболизм (обмен веществ) – совокупность
химических реакций в живом организме.
Метаболиты – вещества, образующиеся в
процессе метаболизма.
Ксенобиотики – чужеродные для организма
вещества, вызывающие нарушение
биологических процессов.
2.
Метаболизмкатаболизм
реакции распада
веществ
анаболизм
реакции синтеза
веществ
Ферменты (энзимы) – это белки-катализаторы
Коферменты (коэнзимы) – это низкомолекулярные органические вещества различного строения,
связаны с ферментами и необходимы для
осуществления каталитической функции ферментов.
Коферменты могут быть самостоятельными
биокатализаторами.
3.
КАРБОНОВЫЕ КИСЛОТЫсодержат функциональную карбоксильную
группу -СООН
4.
Классификация. НоменклатураМонокарбоновые кислоты
алифатические
насыщенные
HCOOH
метановая (муравьиная)
H3C-COOH
этановая (уксусная)
H3C-CH2-COOH
пропановая (пропионовая)
H3C-CH2-CH2-COOH
бутановая (масляная)
H3C-CH2-CH2-CH2-COOH
пентановая (валериановая)
ненасыщенные
H2C=CH-COOH
пропеновая (акриловая)
акрилат*
H2C C
COOH
CH3
метилпропеновая
(метакриловая)
метакрилат*
H3C HC CH COOH
бутен-2-овая (кротоновая)
кротонат*
* - названия кислотных остатков
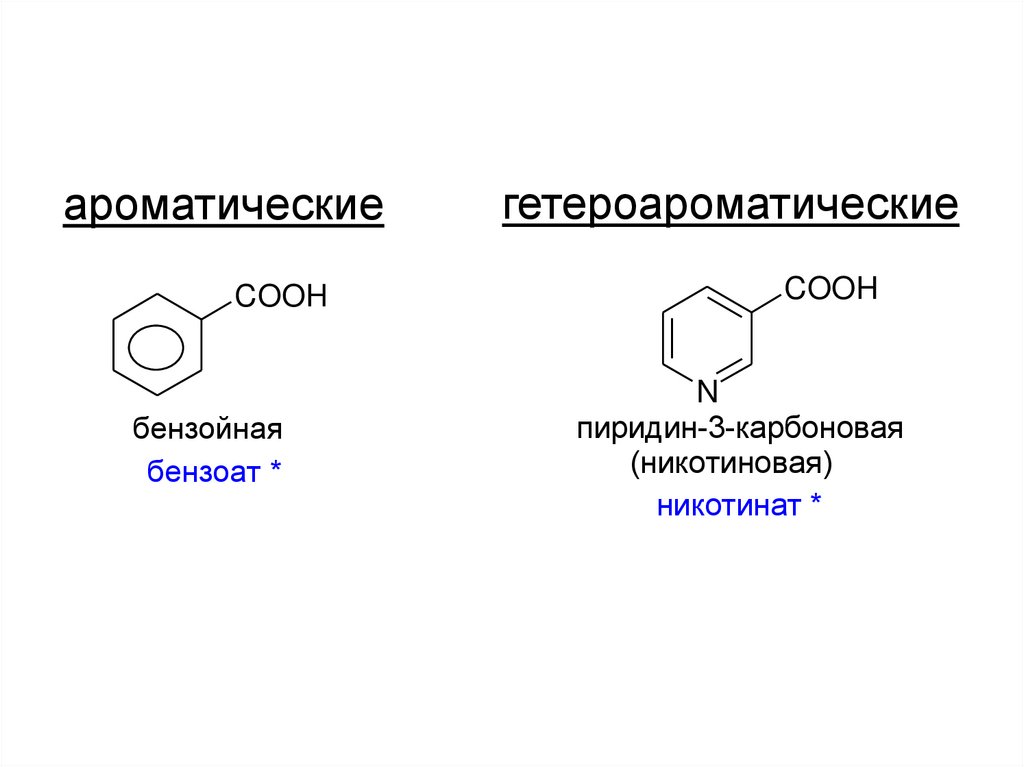
5.
ароматическиеCOOH
бензойная
бензоат *
гетероароматические
COOH
N
пиридин-3-карбоновая
(никотиновая)
никотинат *
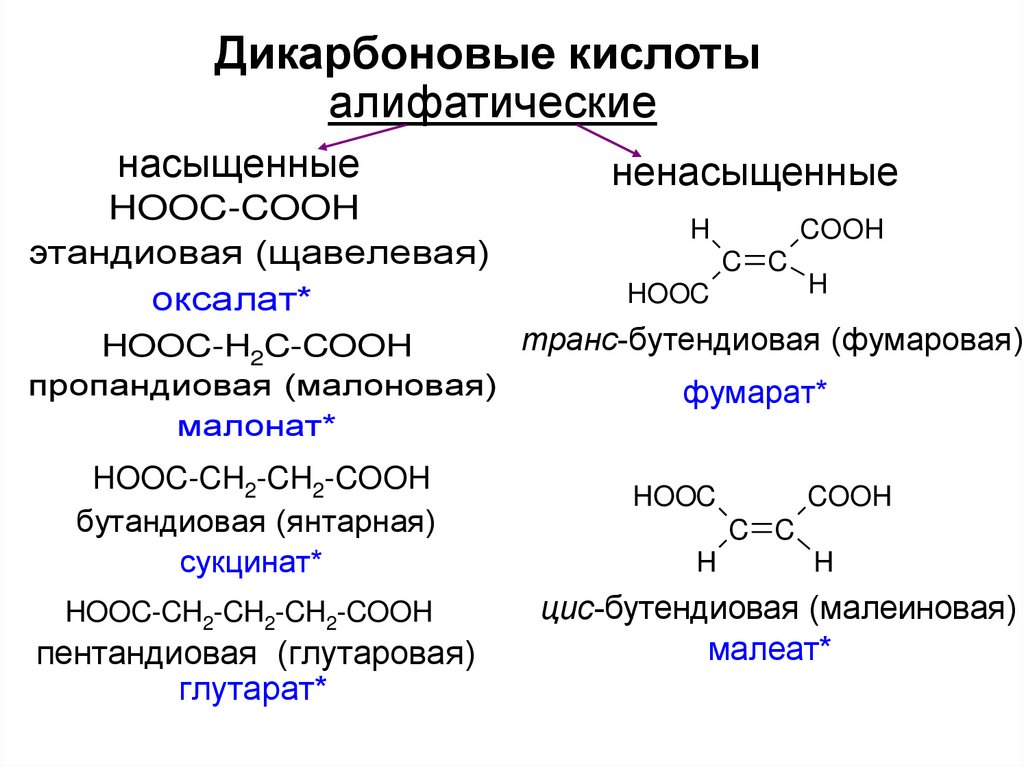
6.
Дикарбоновые кислотыалифатические
насыщенные
HOOC-COOH
этандиовая (щавелевая)
оксалат*
ненасыщенные
H
COOH
C C
HOOC
H
транс-бутендиовая (фумаровая)
HOOC-H2C-COOH
пропандиовая (малоновая)
фумарат*
малонат*
HOOC-CH2-CH2-COOH
бутандиовая (янтарная)
сукцинат*
HOOC-CH2-CH2-CH2-COOH
пентандиовая (глутаровая)
глутарат*
HOOC
COOH
C C
H
H
цис-бутендиовая (малеиновая)
малеат*
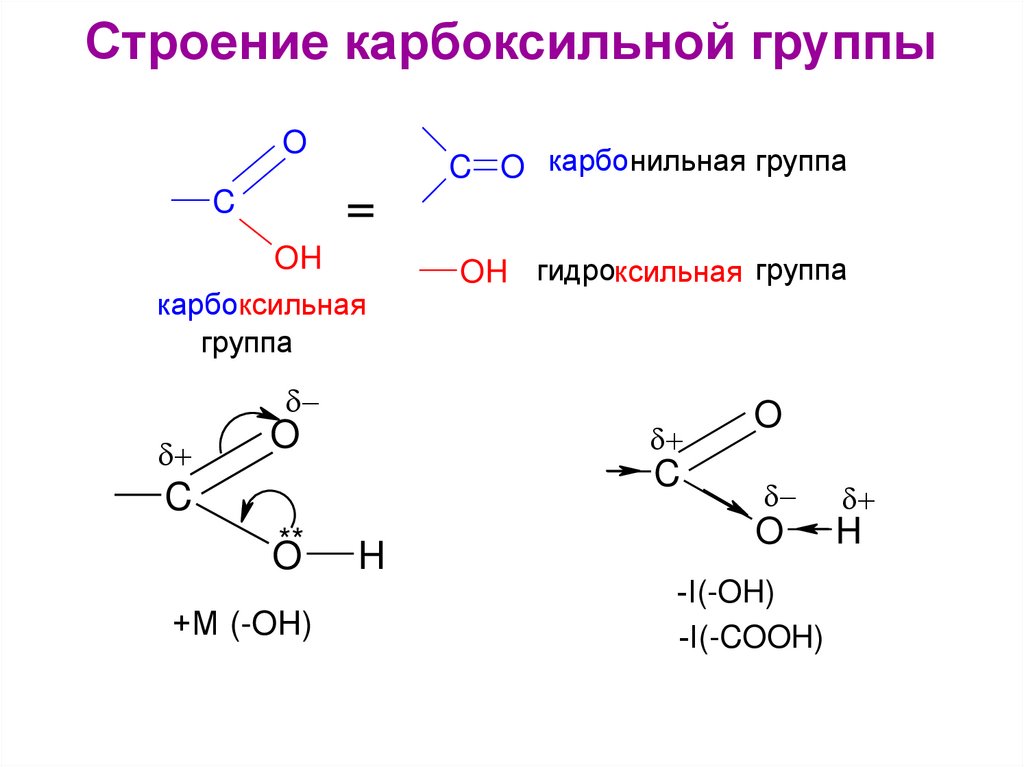
7.
Строение карбоксильной группыO
C O карбонильная группа
=
C
OH
карбоксильная
группа
OH гидроксильная группа
O
C
C
**
O
+М (-OH)
H
O
O
H
-I(-OH)
-I(-COOH)
8.
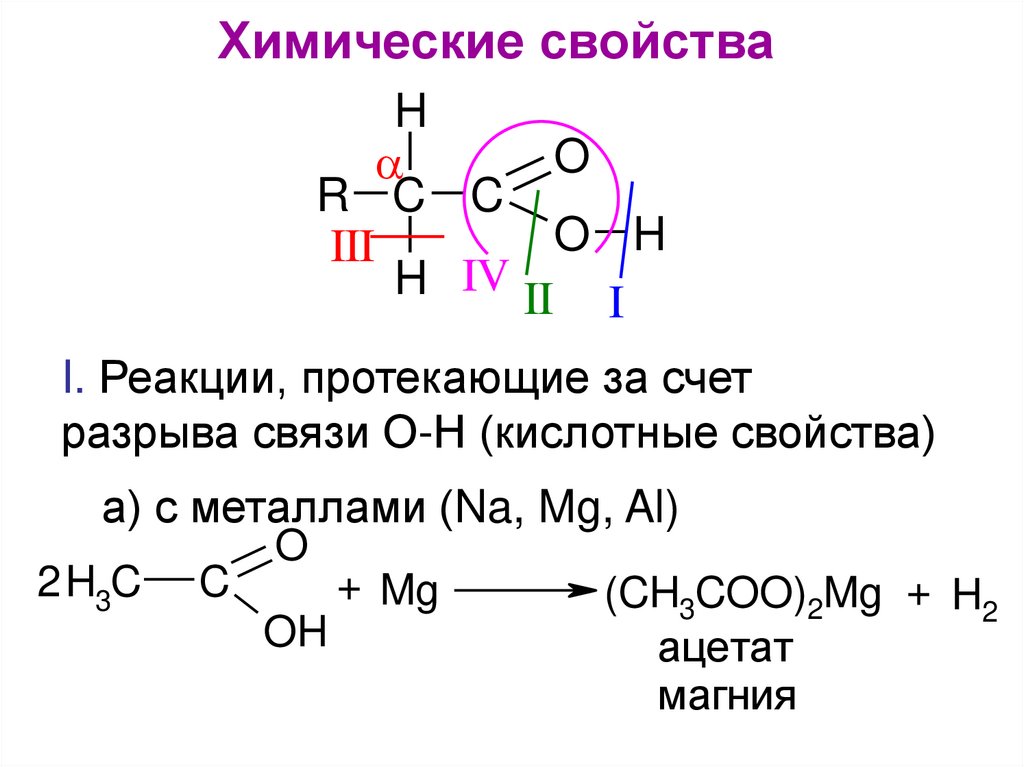
Химические свойстваH
O
R C C
O H
III
H IV II I
I. Реакции, протекающие за счет
разрыва связи О-Н (кислотные свойства)
а) с металлами (Na, Mg, Al)
2 H3C
C
O
OH
+ Mg
(CH3COO)2Mg + H2
ацетат
магния
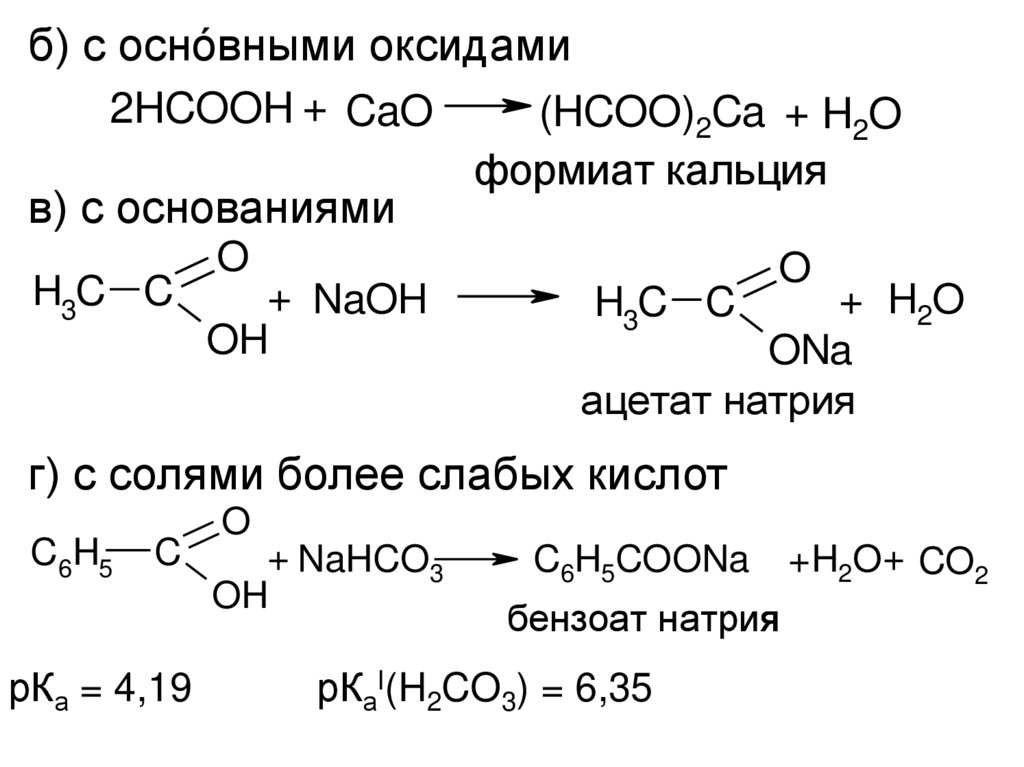
9.
б) с оснóвными оксидами2HCOOH + CaO
в) с основаниями
H3C C
(HCOO)2Ca + H2O
формиат кальция
O
+ NaOH
OH
O
+ H2O
ONa
ацетат натрия
H3C C
г) с солями более слабых кислот
C6H5
C
рКа = 4,19
O
+ NaHCO3
OH
C6H5COONa
бензоат натрия
я
рКаI(H2CO3) = 6,35
+H2O+ CO2
10.
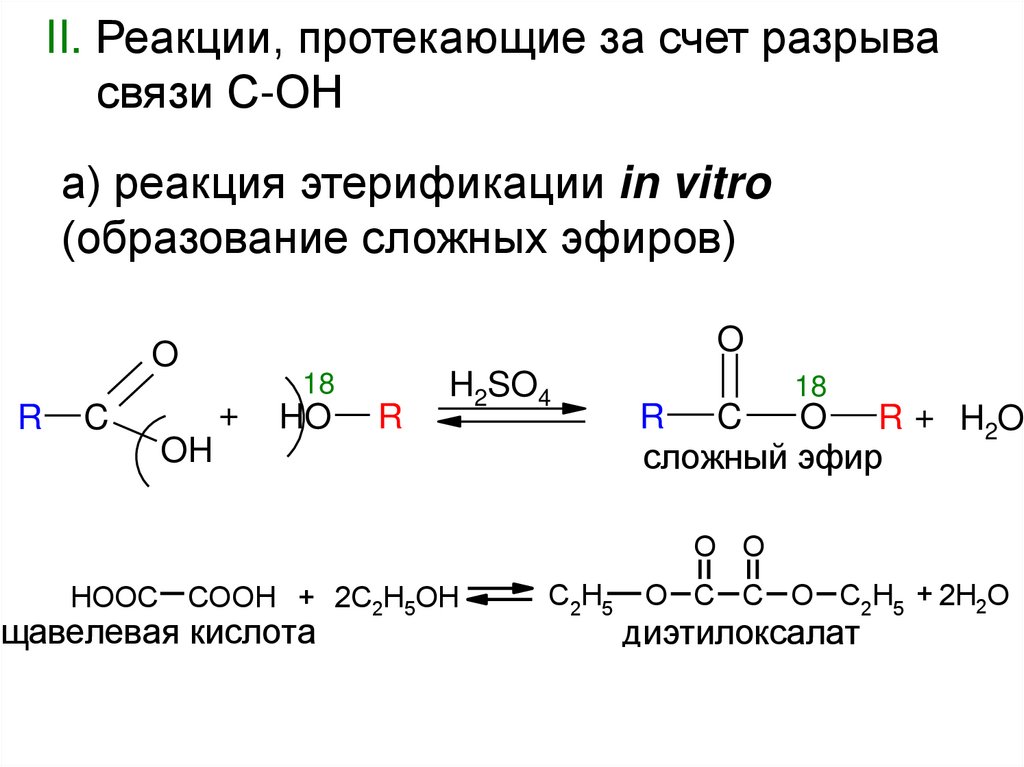
II. Реакции, протекающие за счет разрывасвязи С-ОН
а) реакция этерификации in vitro
(образование сложных эфиров)
O
O
R
18
+
C
HO
R
H2SO4
OH
18
R C
O R + H2O
сложный эфир
O O
HOOC COOH + 2C2H5OH
щавелевая кислота
C2H5
O C C O C2H5 + 2H2O
диэтилоксалат
11.
б) образование сложных тиоэфиров (in vivo)O
R CH2 C
+ KoA-SH
OH
кофермент А
+ АТФ
-АМФ; -2Н3РО4
O
R CH2 C
~ SKoA
ацилкоферменты А
(ацил-КoA)
Кофермент А (КоА-SH) – полифункциональное
органическое вещество, которое в организме
функционирует в качестве тиоспирта.
Ацил-КoA – это сложные тиоэфиры, содержащие
макроэргические связи.
O
- служит переносчиком ацильной группы,
CH3 C
т.е. используется для создания новых
SKoA
С,С-связей, что приводит к удлинению
ацетилкофермент А
углеродной цепи.
(ацетил-КoA)
~
12.
в) реакция этерификации in vivoсложные эфиры в организме образуются при
взаимодействии спиртов с активированными
формами карбоновых кислот - ацилкоферментами А
O
CH3 C
~
+
+ HO CH2 CH2 N(CH3)3
SKoA
ацетил-КоA
(активированная
форма кислоты)
холин
(аминоспирт)
O
CH3 C
+ HSKoA
+
O CH2 CH2 N(CH3)3
ацетилхолин
(сложный эфир)
Ацетилхолин – нейромедиатор - посредник при
передаче нервного возбуждения в нервных клетках
13.
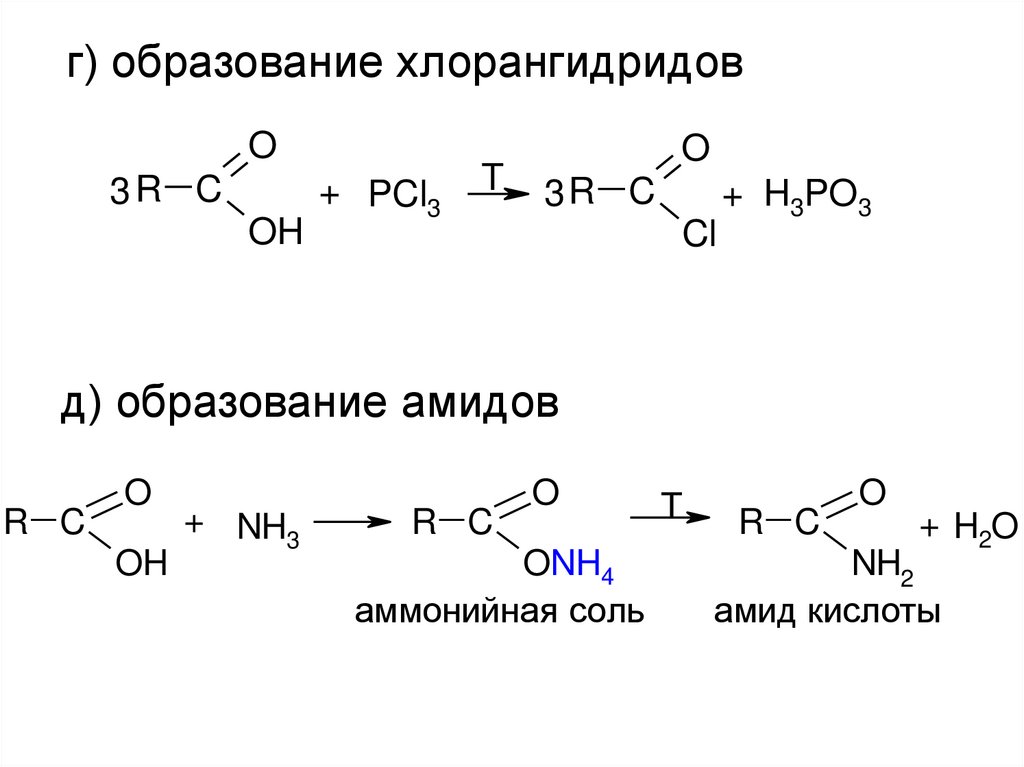
г) образование хлорангидридовO
3R C
OH
+ PCl3
T
O
3R C
Cl
+ H3PO3
д) образование амидов
R C
O
OH
+ NH3
R C
O
ONH4
аммонийная соль
T
R C
O
+ H2O
NH2
амид кислоты
14.
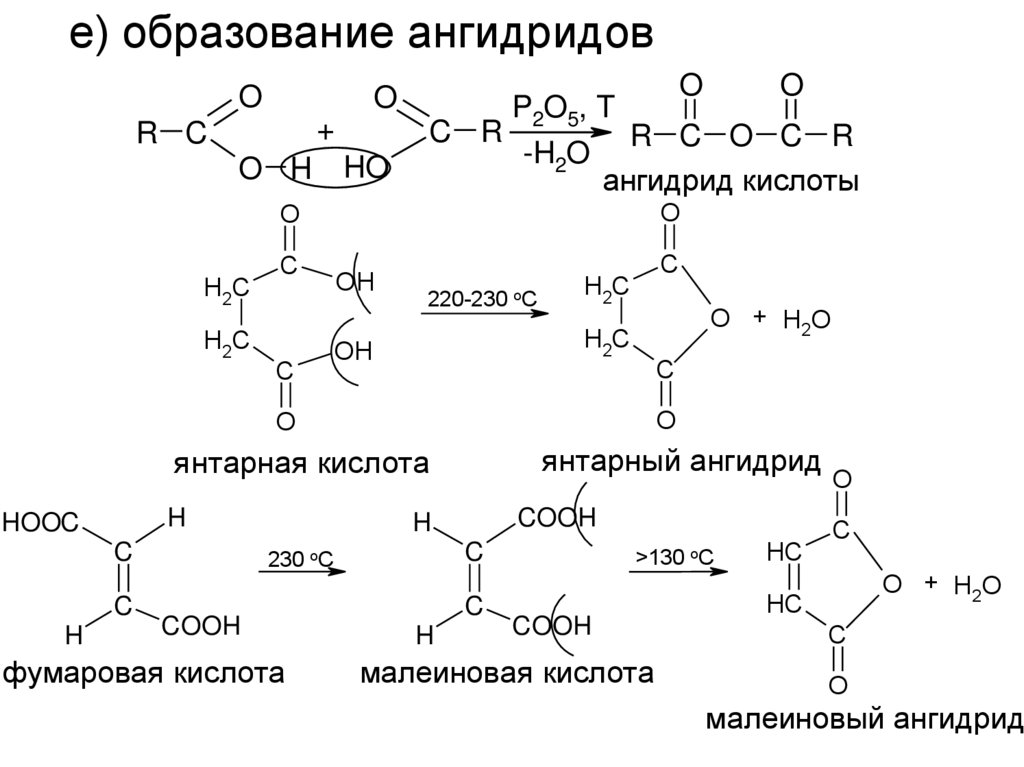
е) образование ангидридовO
O
+
R C
O H
HO
O
O
P2O5, T
C R
R C O C R
-H2O
ангидрид кислоты
O
O
H2C
H2C
C
220-230 oC
C
H2C
O + H2O
H2C
OH
C
O
янтарная кислота
янтарный ангидрид
C
C
OH
O
H
HOOC
H
C
COOH
H
C
230 oC
COOH
фумаровая кислота
C
H
>130 oC
COOH
малеиновая кислота
HC
O
C
O + H2O
HC
C
O
малеиновый ангидрид
15.
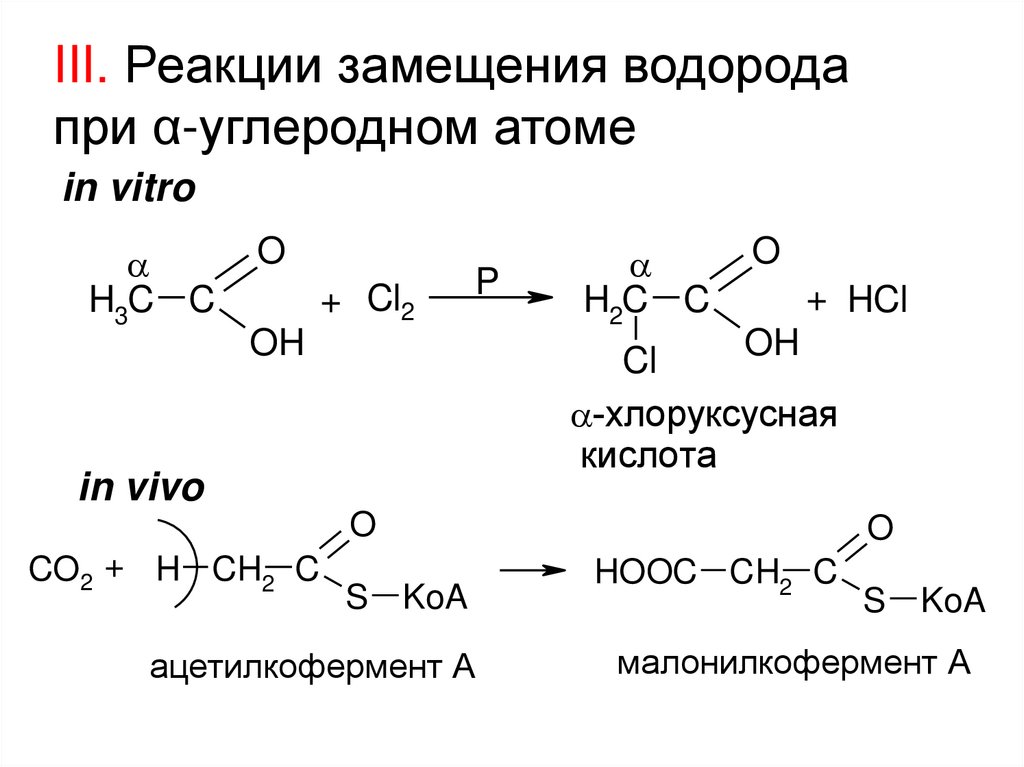
III. Реакции замещения водородапри α-углеродном атоме
in vitro
H3C C
O
+ Cl2
P
OH
H2C C
O
+ HCl
OH
Cl
-хлоруксусная
кислота
in vivo
O
CO2 + H CH2 C
S KoA
ацетилкофермент А
O
HOOC CH2 C
S KoA
малонилкофермент А
16.
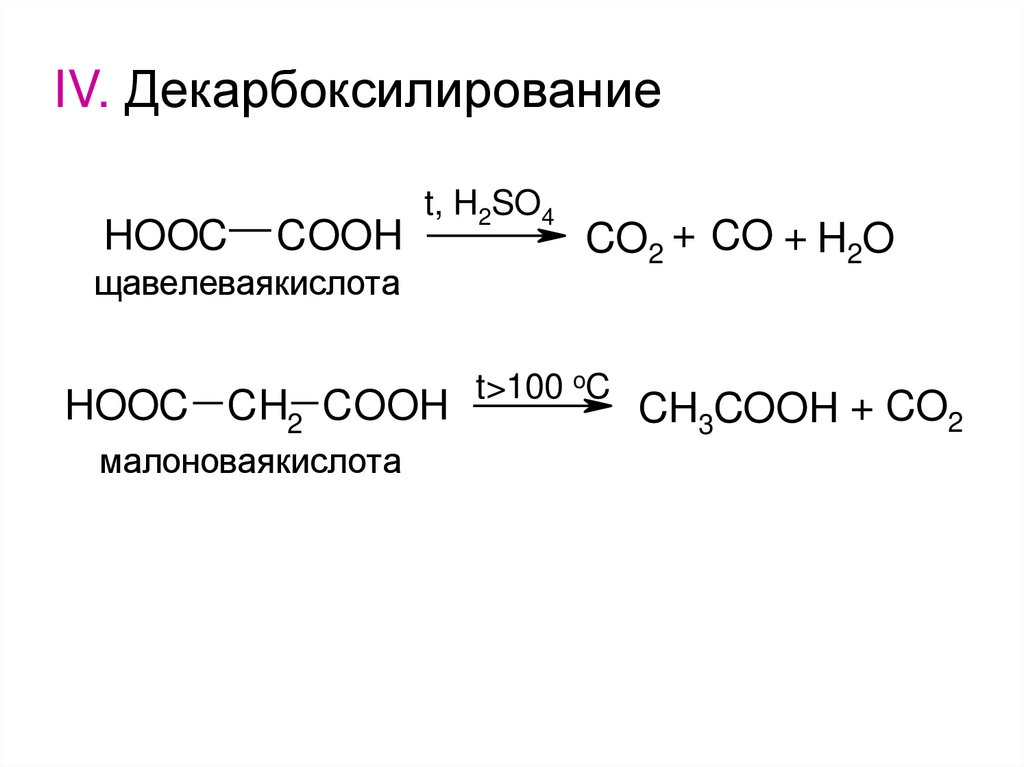
IV. ДекарбоксилированиеHOOC
COOH
t, H2SO4
щавелеваякислота
HOOC CH2 COOH
малоноваякислота
CO2 + CO + H2O
t>100 oC
CH3COOH + CO2
17.
Биологическое значениекарбоновых кислот
Муравьиную кислоту применяют как консервант,
так же для получения лекарств: раствор (ω=1,4%)
муравьиной кислоты в 70 % этаноле -муравьиный спирт.
Уксусную кислоту применяют как консервант
и вкусовую приправу.
Производные кислоты: эфиры (ацетилсалициловая
кислота), амиды (парацетамол) применяют в
качестве лекарств.
Тиоэфир уксусной кислоты - ацетил-КоА центральный клеточный метаболит.
Бензойную кислоту применяют как консервант,
cоль (бензоат Na) – отхаркивающее средство.
18.
Валериановая и изовалериановая кислотысодержатся в корнях валерианы.
Кислоты применяют для получения лекарств
(валидол, валокордин, корвалол).
Акриловая, метакриловая кислоты и их эфиры
в виде полимеров входят в состав
стоматологических материалов.
Щавелевая кислота токсичный метаболит - вызывает
образование оксалатных камней в почках.
Янтарная и фумаровая – метаболиты цикла Кребса;
входят в состав лекарственных препаратов
Малеиновая кислота in vivo не образуется.
19.
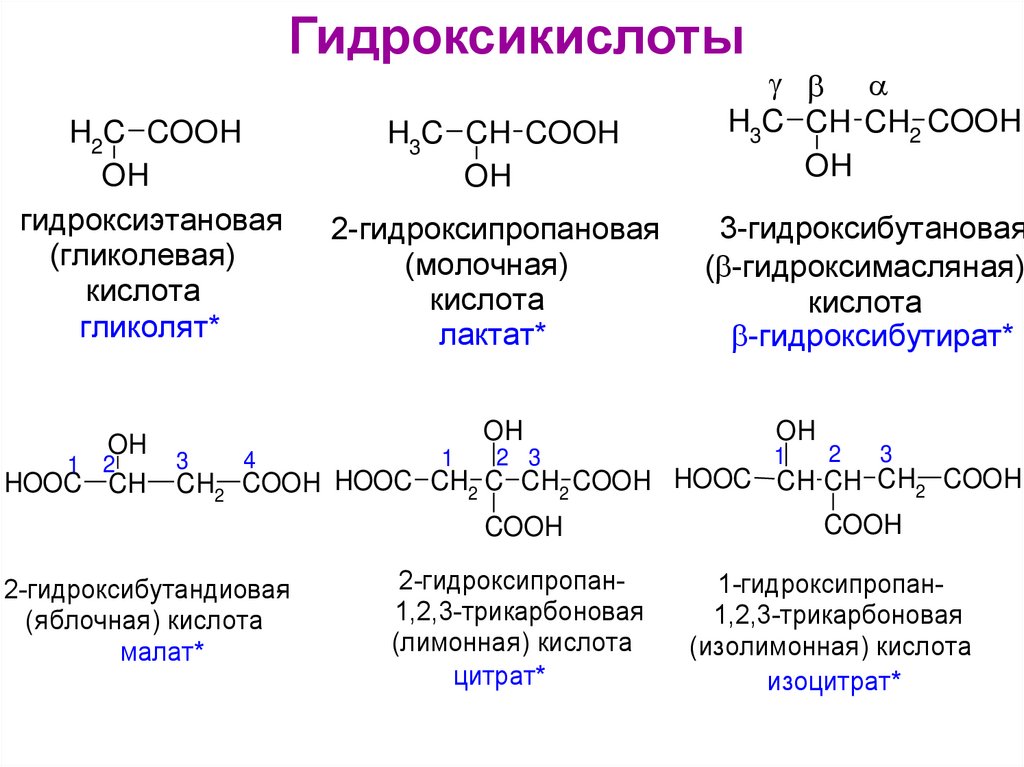
ГидроксикислотыH2C COOH
OH
гидроксиэтановая
(гликолевая)
кислота
гликолят*
OH
1 2
HOOC CH
3
4
H3C CH COOH
OH
H3C CH CH2 COOH
OH
2-гидроксипропановая
(молочная)
кислота
лактат*
3-гидроксибутановая
( -гидроксимасляная)
кислота
-гидроксибутират*
1
OH
OH
2 3
1
2
3
CH2 COOH HOOC CH2 C CH2 COOH HOOC CH CH CH2 COOH
COOH
2-гидроксибутандиовая
(яблочная) кислота
малат*
2-гидроксипропан1,2,3-трикарбоновая
(лимонная) кислота
цитрат*
COOH
1-гидроксипропан1,2,3-трикарбоновая
(изолимонная) кислота
изоцитрат*
20.
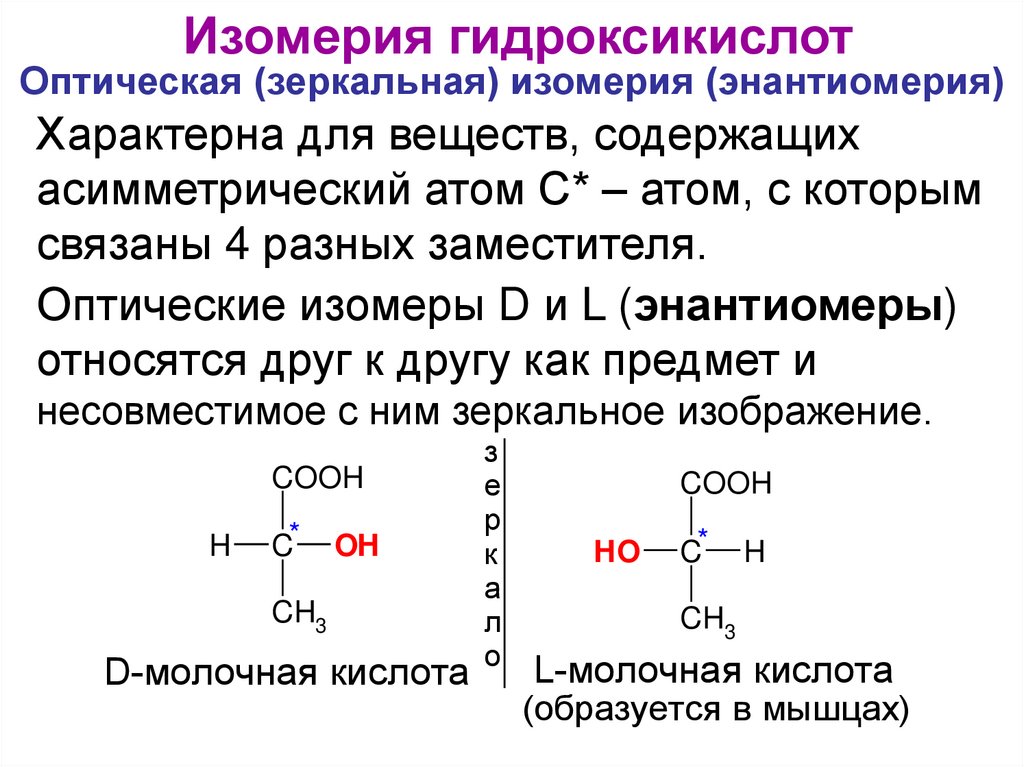
Изомерия гидроксикислотОптическая (зеркальная) изомерия (энантиомерия)
Характерна для веществ, содержащих
асимметрический атом С* – атом, с которым
связаны 4 разных заместителя.
Оптические изомеры D и L (энантиомеры)
относятся друг к другу как предмет и
несовместимое с ним зеркальное изображение.
COOH
H
C*
OH
CH3
D-молочная
я кислота
з
е
р
к
а
л
о
COOH
HO
C*
H
CH3
L-молочная
я кислота
(образуется в мышцах)
21.
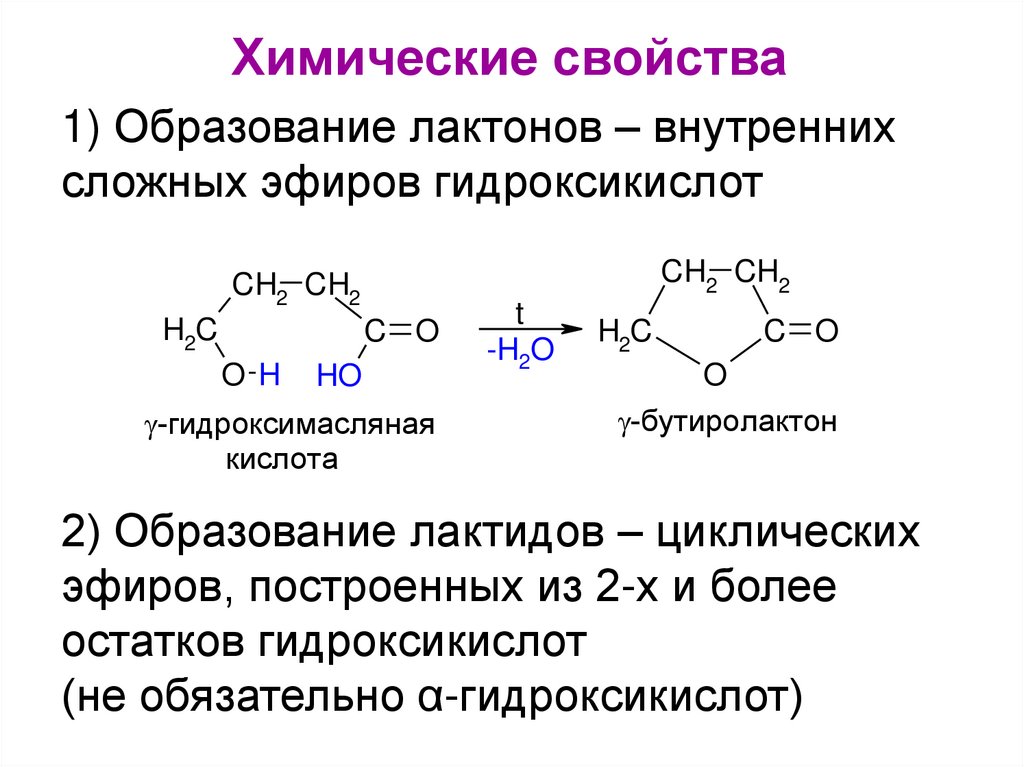
Химические свойства1) Образование лактонов – внутренних
сложных эфиров гидроксикислот
CH2 CH2
CH2 CH2
H2C
C O
O H
HO
-гидроксимасляная
кислота
t
-H2O
H2C
C O
O
-бутиролактон
2) Образование лактидов – циклических
эфиров, построенных из 2-х и более
остатков гидроксикислот
(не обязательно α-гидроксикислот)
22.
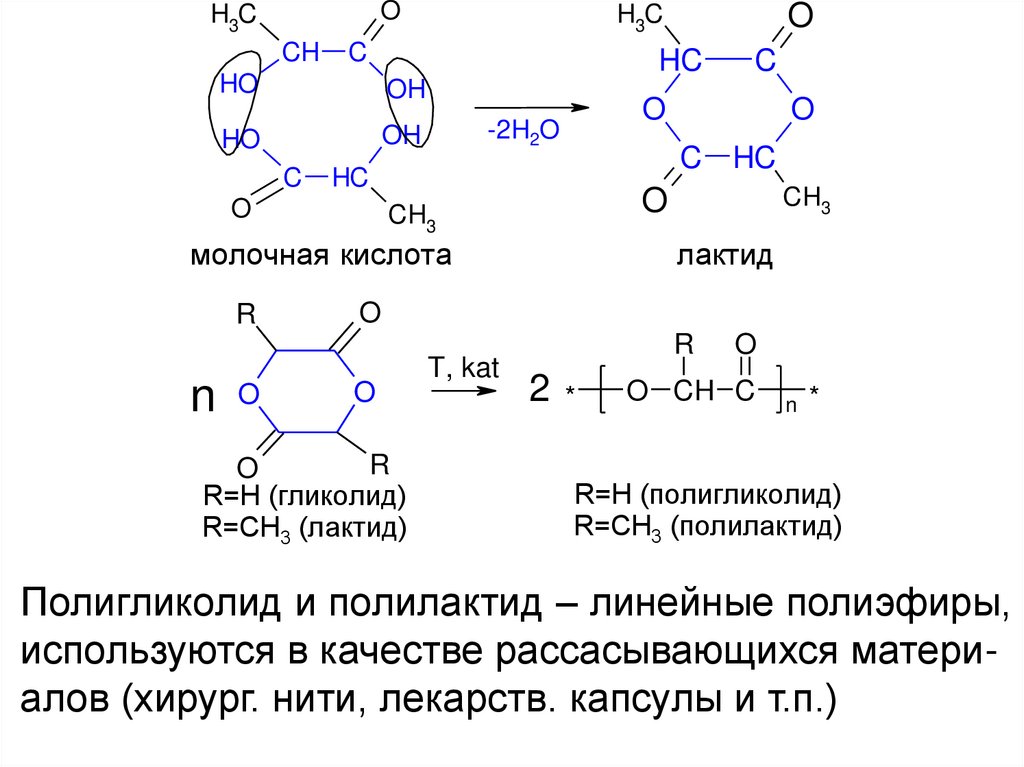
OH3C
CH
C
HO
HC
OH
C
n O
CH3
O
CH3
лактид
молочная кислота
R
O
C HC
HC
O
C
O
-2H2O
OH
HO
O
H3C
O
O
R
O
R=H (гликолид)
R=CH3 (лактид)
T, kat
R
2*
O
O CH C
n *
R=H (полигликолид)
R=CH3 (полилактид)
Полигликолид и полилактид – линейные полиэфиры,
используются в качестве рассасывающихся материалов (хирург. нити, лекарств. капсулы и т.п.)
23.
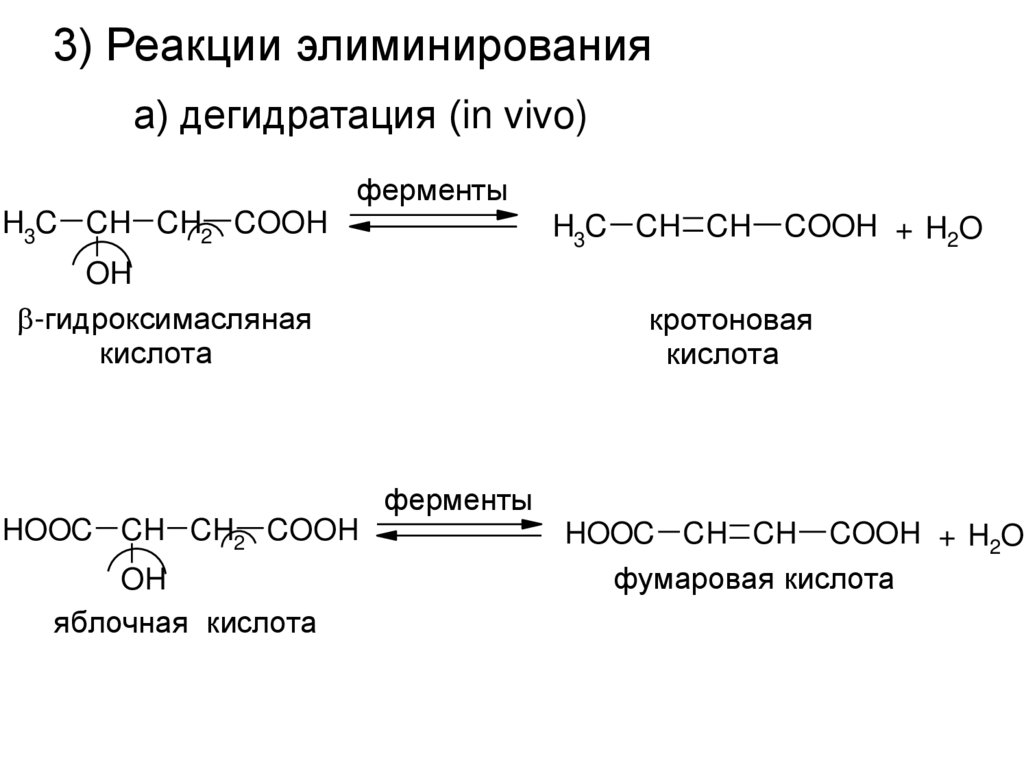
3) Реакции элиминированияа) дегидратация (in vivo)
ферменты
H3C CH CH2 COOH
H3C CH CH
OH
-гидроксимасляная
кислота
COOH + H2O
кротоновая
кислота
ферменты
HOOC CH CH2 COOH
OH
яблочная кислота
HOOC CH CH COOH + H2O
фумаровая кислота
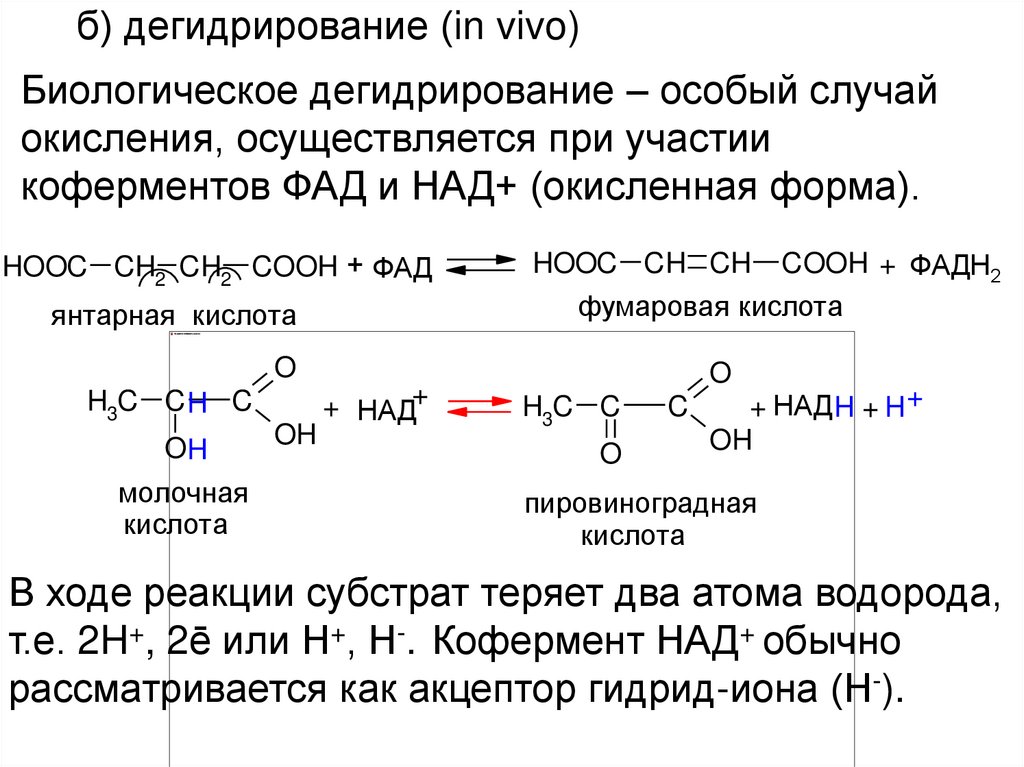
24.
б) дегидрирование (in vivo)Биологическое дегидрирование – особый случай
окисления, осуществляется при участии
коферментов ФАД и НАД+ (окисленная форма).
HOOC CH2 CH2 COOH + ФАД
янтарная кислота
HOOC CH CH COOH + ФАДН2
фумаровая кислота
O
H3C C H C
OH
молочная
кислота
OH
+ НАД+
O
H3C C
O
C
+ НАД H + H +
OH
пировиноградная
кислота
В ходе реакции субстрат теряет два атома водорода,
т.е. 2H+, 2ē или Н+, Н-. Кофермент НАД+ обычно
рассматривается как акцептор гидрид-иона (Н-).
25.
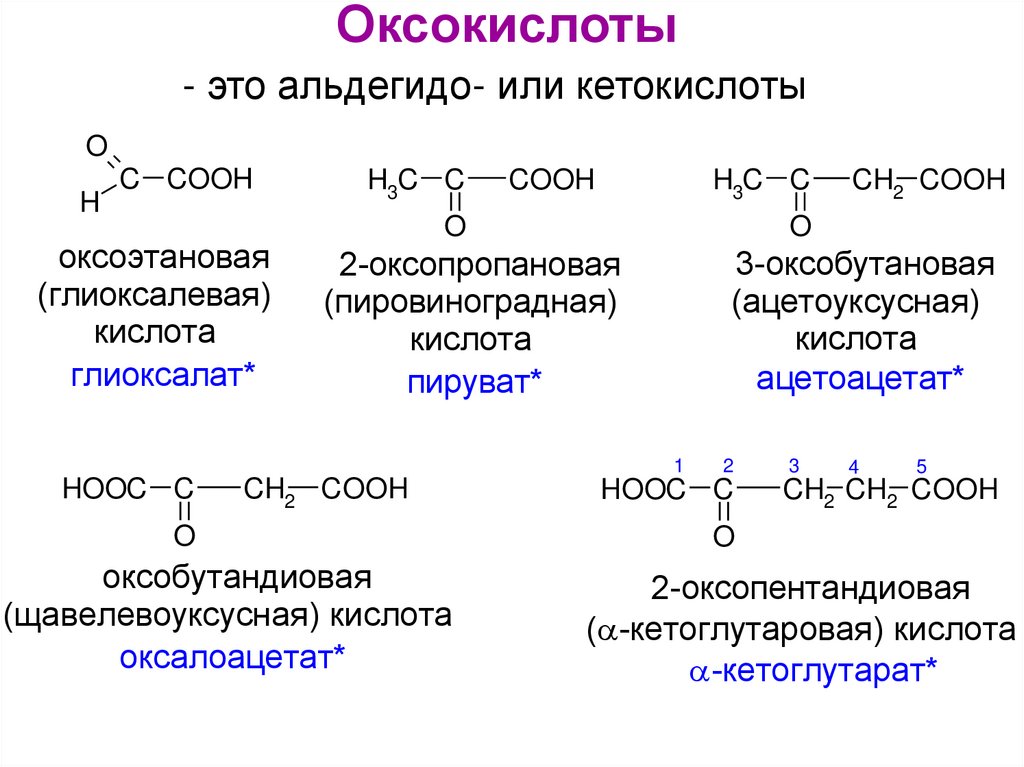
Оксокислоты- это альдегидо- или кетокислоты
O
H
C COOH
оксоэтановая
(глиоксалевая)
кислота
глиоксалат*
H3C C
COOH
H3C C
O
O
3-оксобутановая
(ацетоуксусная)
кислота
ацетоацетат*
2-оксопропановая
(пировиноградная)
кислота
пируват*
1
HOOC C
CH2 COOH
O
оксобутандиовая
(щавелевоуксусная) кислота
оксалоацетат*
CH2 COOH
2
HOOC C
3
4
5
CH2 CH2 COOH
O
2-оксопентандиовая
( -кетоглутаровая) кислота
-кетоглутарат*
26.
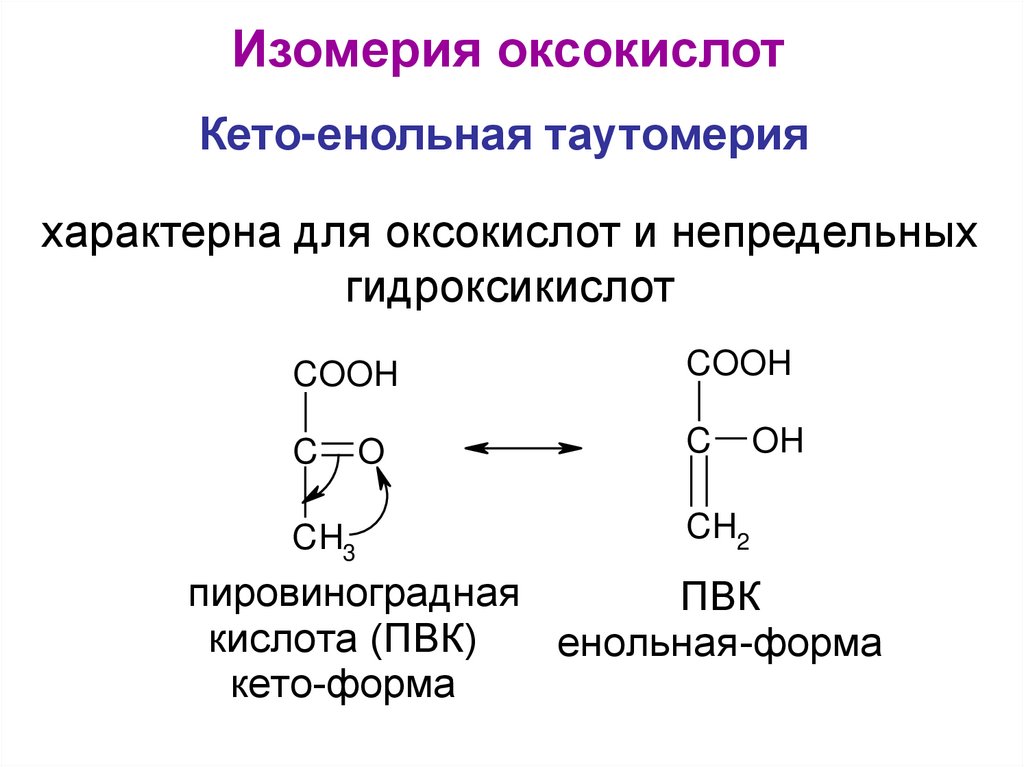
Изомерия оксокислотКето-енольная таутомерия
характерна для оксокислот и непредельных
гидроксикислот
COOH
COOH
C
C
CH3
O
OH
CH2
пировиноградная
ПВК
кислота (ПВК)
енольная -форма
кето-форма
27.
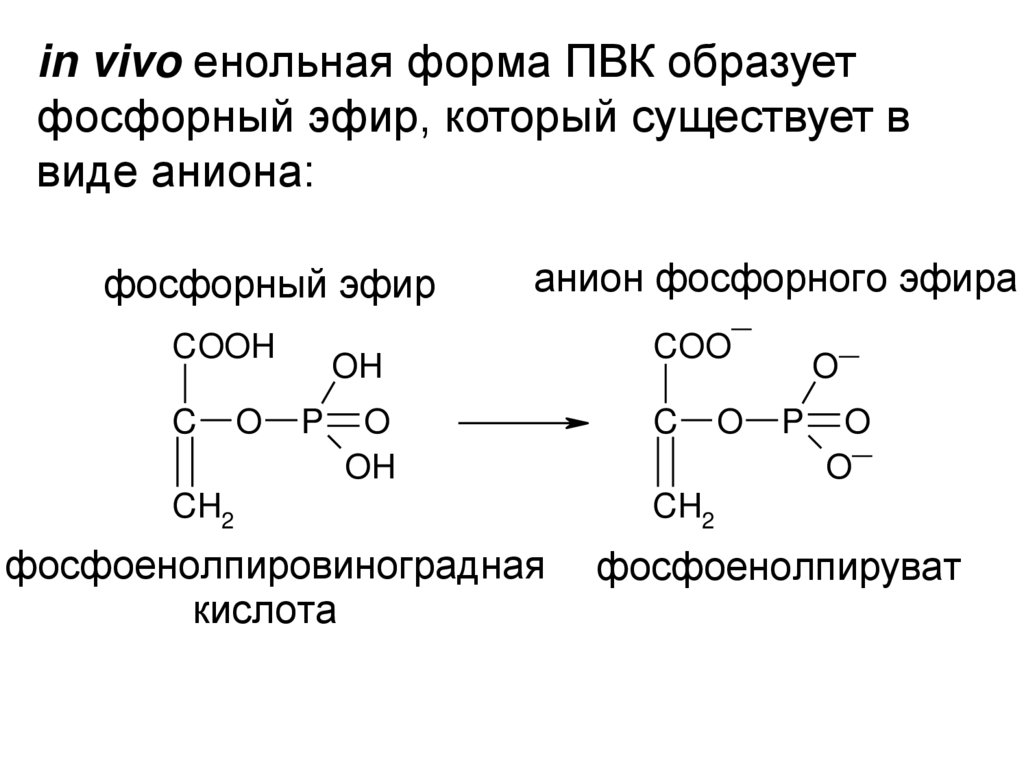
in vivo енольная форма ПВК образуетфосфорный эфир, который существует в
виде аниона:
фосфорный эфир
COOH
C
O
анион фосфорного эфира
OH
P
O
OH
CH2
фосфоенолпировиноградная
кислота
_
COO
C
O
O
P
_
O
_
O
CH2
фосфоенолпируват
28.
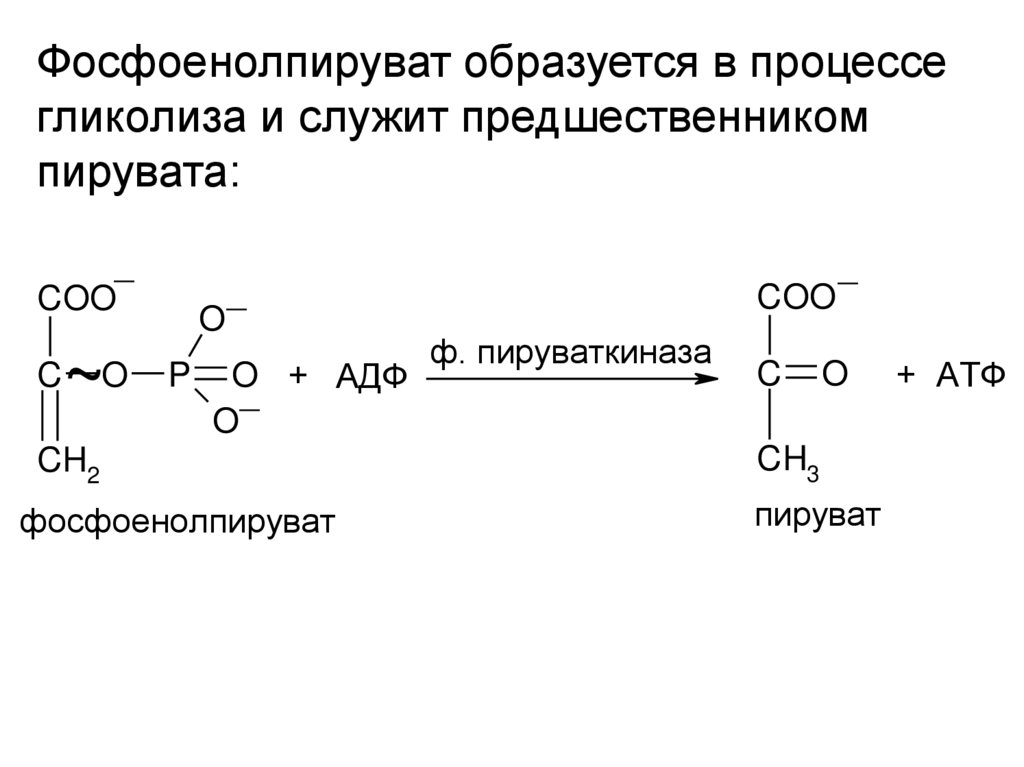
Фосфоенолпируват образуется в процессегликолиза и служит предшественником
пирувата:
_
COO
C
O
_
~O P OO_ + АДФ
COO
ф. пируваткиназа
C
_
O
CH2
CH3
фосфоенолпируват
пируват
+ АТФ
29.
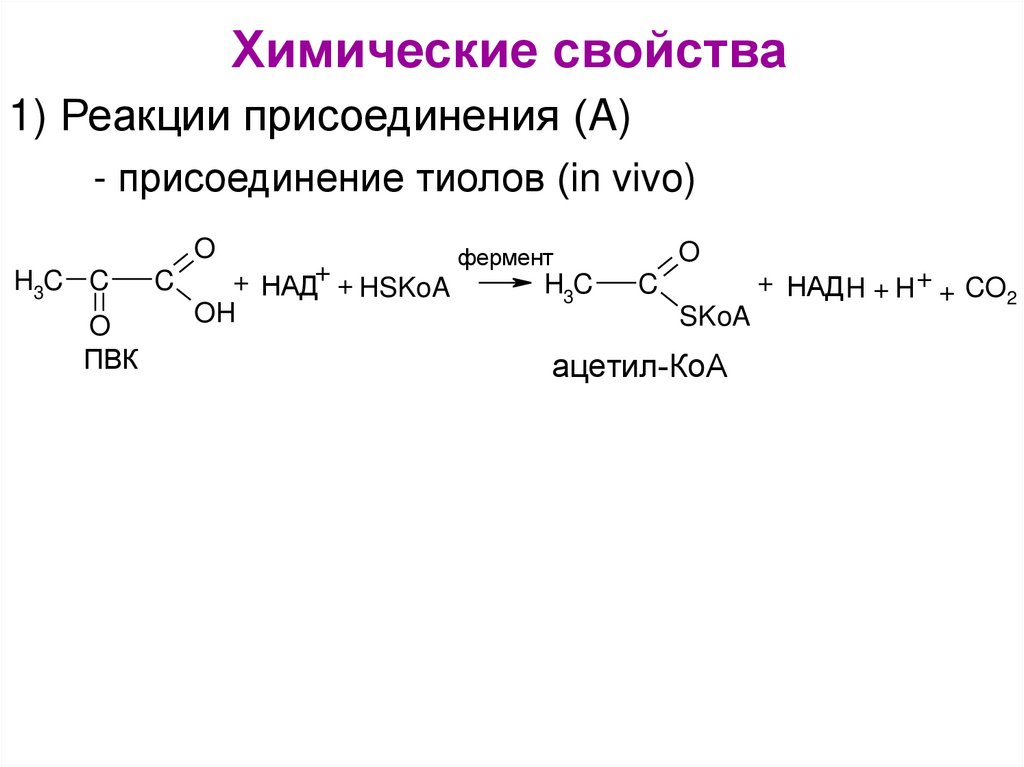
Химические свойства1) Реакции присоединения (A)
- присоединение тиолов (in vivo)
O
H3C C
O
ПВК
C
+ НАД+ + HSKoA
OH
O
фермент
H3C
C
SKoA
ацетил-КоА
+ НАД H + H + + CO
2
30.
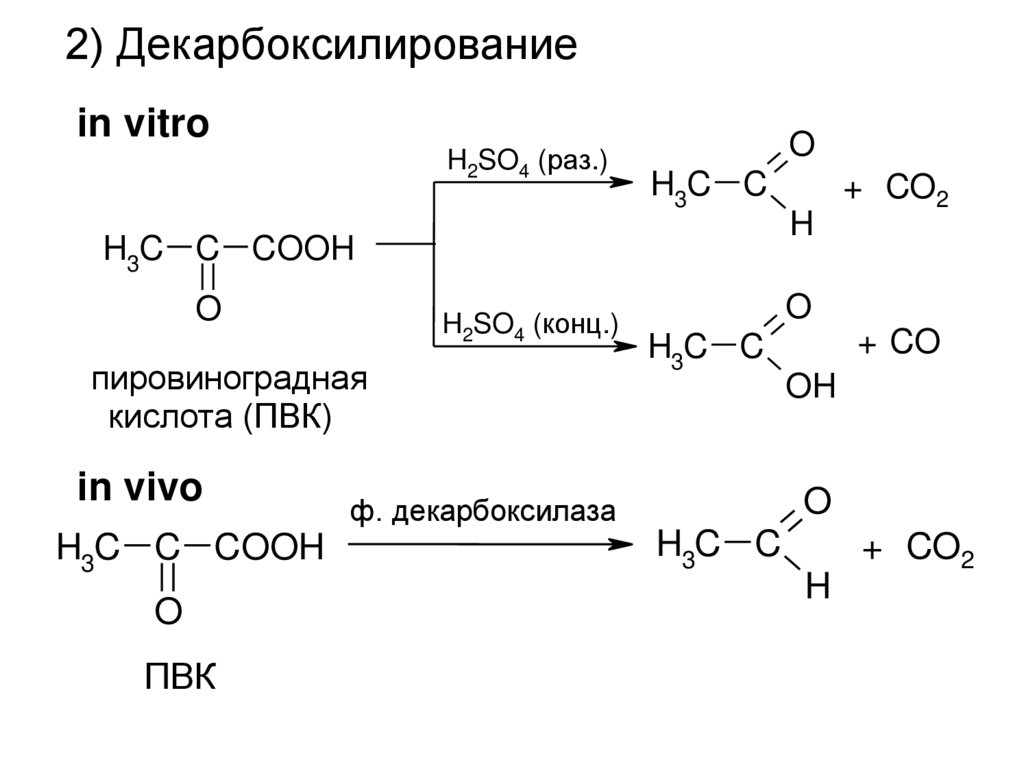
2) Декарбоксилированиеin vitro
H2SO4 (раз.)
O
H3C C
H3C C COOH
O
H2SO4 (конц.)
пировиноградная
кислота (ПВК)
in vivo
H3C C COOH
O
ПВК
H
+ CO2
O
H3C C
+ CO
OH
O
ф. декарбоксилаза
H3C C
H
+ CO2
31.
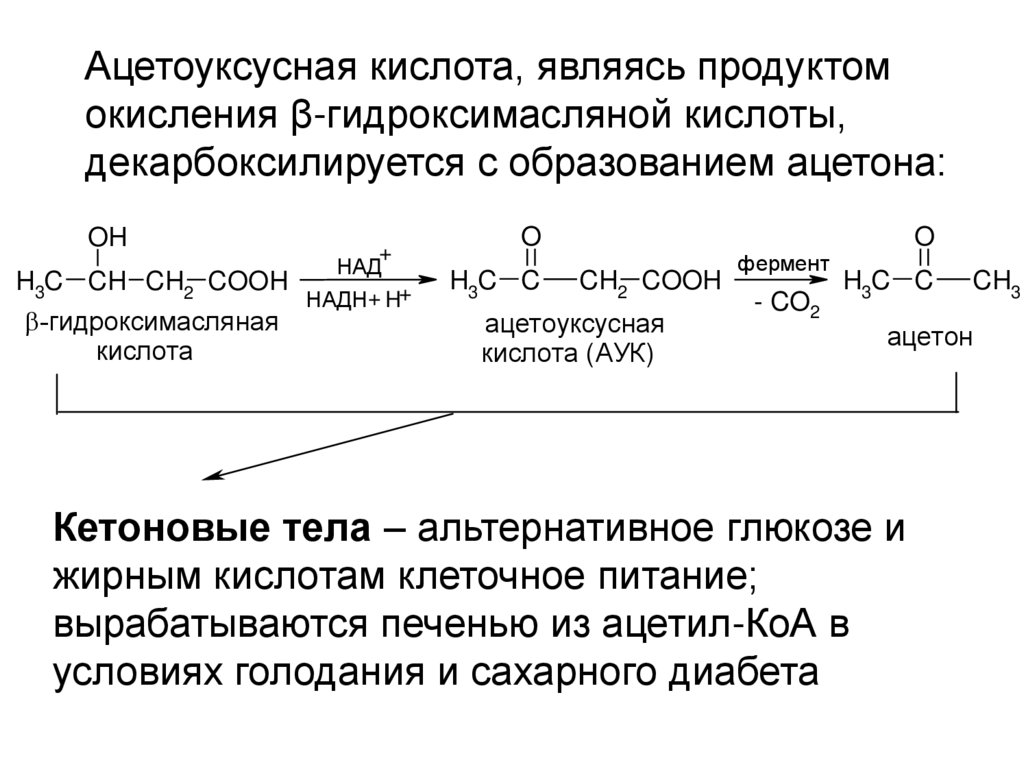
Ацетоуксусная кислота, являясь продуктомокисления β-гидроксимасляной кислоты,
декарбоксилируется с образованием ацетона:
OH
H3C
+
НАД
CH CH2 COOH
НАДН + H+
-гидроксимасляная
кислота
O
H3C C
CH2 COOH
ацетоуксусная
кислота (АУК)
фермент
- CO2
O
H3C C
CH3
ацетон
Кетоновые тела – альтернативное глюкозе и
жирным кислотам клеточное питание;
вырабатываются печенью из ацетил-КоА в
условиях голодания и сахарного диабета
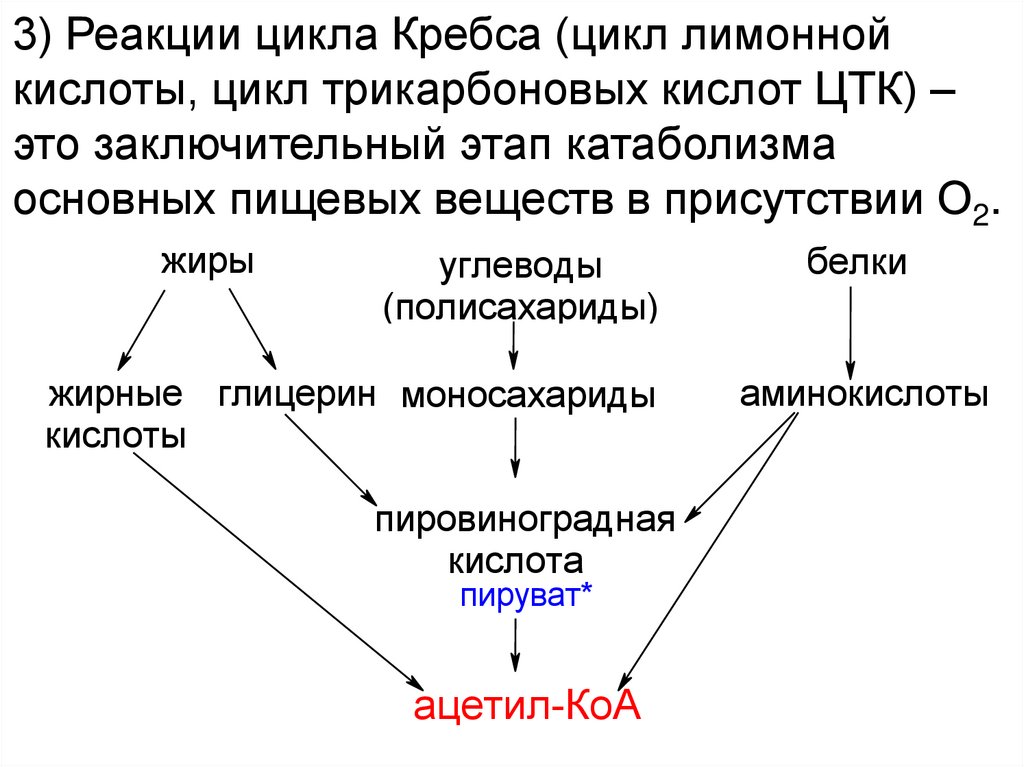
32.
3) Реакции цикла Кребса (цикл лимоннойкислоты, цикл трикарбоновых кислот ЦТК) –
это заключительный этап катаболизма
основных пищевых веществ в присутствии О2.
жиры
углеводы
(полисахариды)
жирные глицерин моносахариды
кислоты
пировиноградная
кислота
пируват*
ацетил-КоА
белки
аминокислоты
33.
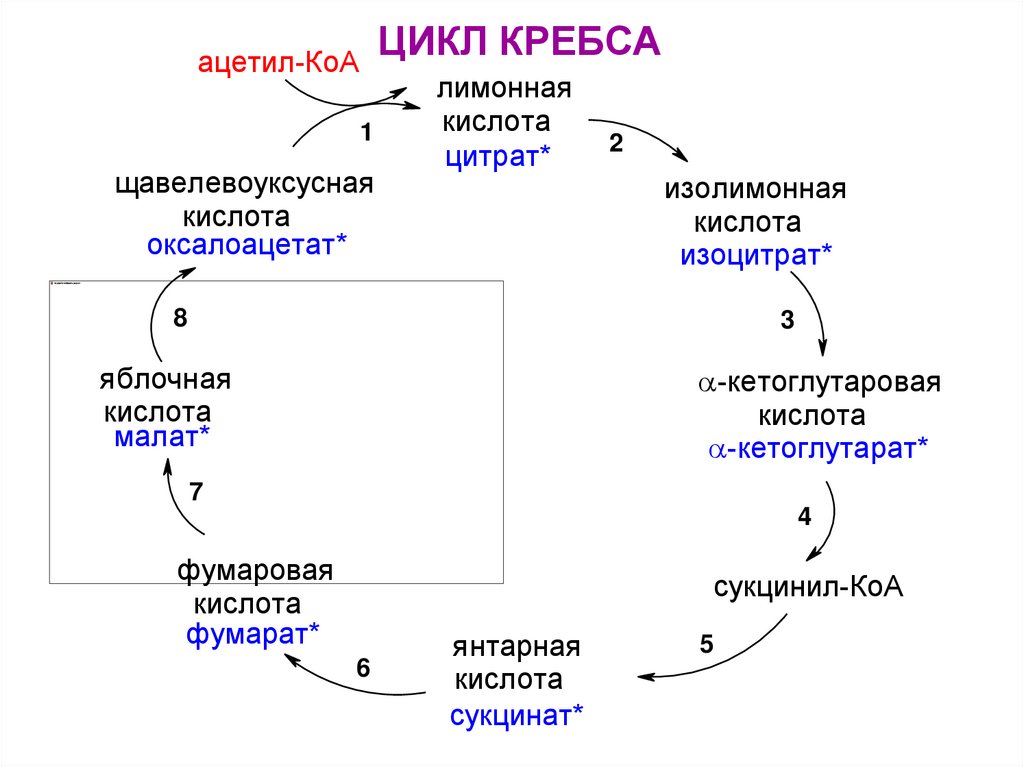
ЦИКЛ КРЕБСАацетил-КоА
1
щавелевоуксусная
кислота
оксалоацетат*
лимонная
кислота
цитрат*
2
изолимонная
кислота
изоцитрат*
8
3
-кетоглутаровая
кислота
-кетоглутарат*
яблочная
кислота
малат*
7
4
фумаровая
кислота
фумарат*
сукцинил-КоА
6
янтарная
кислота
сукцинат*
5
34.
Качественные реакциикарбоновых кислот
1.Все растворимые кислоты реагируют с
водным NaHCO3:
RCOOH + NaHCO3 → RCOO-Na + CO2↑ + H2O
2. Щавелевая кислота осаждается
ионами кальция:
Са2+ + Н2С2О4 → СаС2О4↓+ 2Н+
3. Молочная кислота образуют окрашенный
комплекс с солями железа (III)








 chemistry
chemistry








