Similar presentations:
Карбоновые кислоты и их функциональные производные
1.
КАРБОНОВЫЕ КИСЛОТЫ И ИХ Ф УНКЦИОНАЛЬНЫЕПРОИЗВОДНЫЕ
ЦЕЛИ ЛЕК ЦИИ
Обучающая – Формирование знаний о классификации, номенклатуре, изомерии
карбоновых кислот и их производных, их реакционной способности, роли в организме и
применении в медицинской практике.
Развивающая – Расширение кругозора обучающихся на основе интеграции знаний;
развитие логическое мышление.
Воспитательная – Содействие формированию у обучающихся устойчивого
интереса к изучению дисциплины «Биоорганическая химия».
ПЛАН ЛЕК ЦИИ
1. Классификация карбоновых кислот и их функциональных производных.
2. Химические свойства кабоновых кислот и их функциональных производных.
3. Фарм. препараты на основе салициловой кислоты.
С ОДЕР ЖАНИЕ ЛЕКЦИИ
Карбоновые кислоты - это вещества, которые в своем составе содержат
карбоксильную группу и отвечают общей формуле R-COOH.
I. Карбоновые кислоты классифицируют по количеству карбоксильных
групп на две группы:
1. Одноосновные или монокарбоновые кислоты, содержащую одну
карбоксильную группу.
Предельные одноосновные кислоты:
НСООН – муравьиная (метановая) кислота (соли – формиаты),
СН3СООН – уксусная (этановая) кислота (соли – ацетаты),
СН3СН2СООН – пропионовая (пропановая) кислота (соли – пропионаты),
СН3(СН2)2СООН – масляная (бутановая) кислота (соли – бутираты),
СН3(СН2)3СООН – валериановая (пентановая) кислота (соли – валераты),
СН3(СН2)4СООН - капроновая (гексановая) кислота (соли – гексаноаты).
2. Поликарбоновые кислоты, содержащие две или более карбоксильные группы.
Предельные дикарбоновые кислоты:
HOOC COOH
щавелевая (этандиовая) кислота (соли – оксалаты),
HOOC
CH2 COOH
малоновая (пропандиовая) кислота (соли – малонаты),
HOOC (CH2)2 COOH
янтарная (бутандиовая) кислота (соли – сукцинаты),
2.
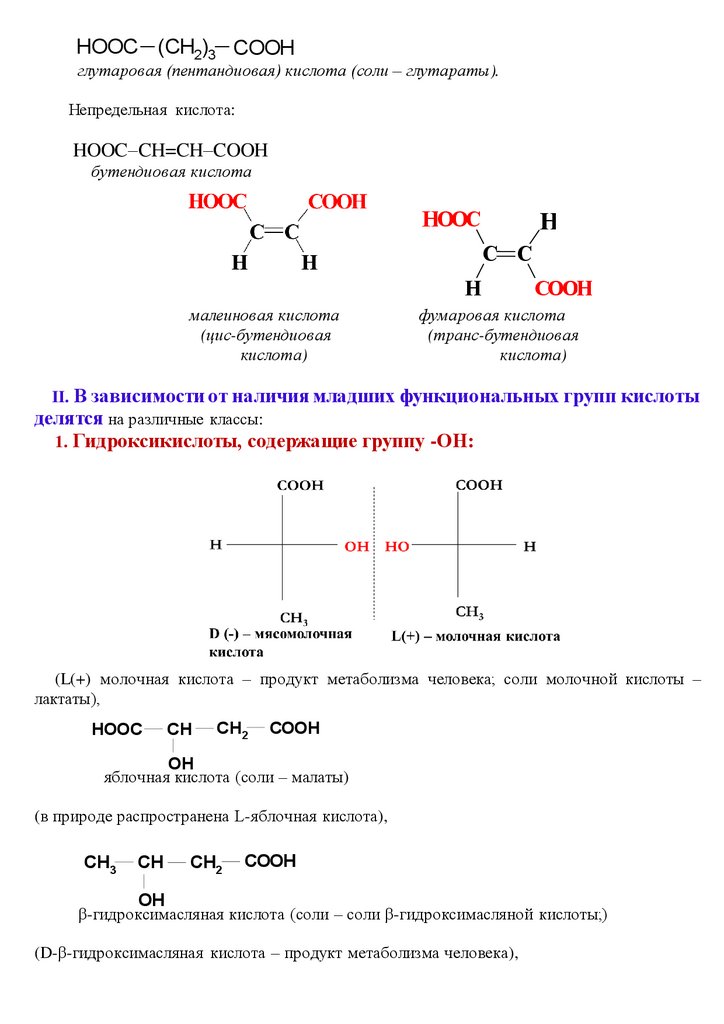
HOOC (CH2)3 COOHглутаровая (пентандиовая) кислота (соли – глутараты).
Непредельная кислота:
HOOC–CH=CH–COOH
бутендиовая кислота
HOOC
H
C C
H
малеиновая кислота
(цис-бутендиовая
кислота)
COOH
фумаровая кислота
(транс-бутендиовая
кислота)
II. В зависимости от наличия младших функциональных групп кислоты
делятся на различные классы:
1. Гидроксикислоты, содержащие группу -ОН:
(L(+) молочная кислота – продукт метаболизма человека; соли молочной кислоты –
лактаты),
HOOC
CH
CH2
COOH
OH
яблочная кислота (соли – малаты)
(в природе распространена L-яблочная кислота),
CH3
CH
CH2
COOH
OH
β-гидроксимасляная кислота (соли – соли β-гидроксимасляной кислоты;)
(D-β-гидроксимасляная кислота – продукт метаболизма человека),
3.
CH2HO
C
COOH
COOH
CH2
COOH
лимонная кислота (соли – цитраты)
(лимонная кислота – ключевое звено важнейшего метаболического цикла высших
организмов (эукариотов) – цикла Трикарбоновых кислот, реализующее энергетический
механизм клетки),
COOH
OH
салициловая кислота (соли – салицилаты).
2. Кетонокислоты – это кислоты, содержащие карбонильную группу >С=О:
CH3 C COOH
O
пировиноградная кислота (ПВК) (соли – пируваты),
HOOC – СO – СН2 – СООН
щавелево-уксусная кислота (ЩУК) (соли – соли ЩУК),
СН3 – СO – CН2 – СООН
ацетоуксусная кислота (соли – соли ацетоуксусной кислоты).
Особо выделяют группу высших жирных карбоновых кислот (ВЖК),
входящих в состав липидов.
1. Предельные высшие жирные кислоты:
С17Н35СООН стеариновая кислота;
С15Н31СООН пальмитиновая кислота;
С23Н47СООН лигноцериновая кислота;
С23Н46 (ОН)СООН цереброновая кислота.
2. Непредельные высшие жирные кислоты:
С17Н33СООН олеиновая кислота;
С17Н31СООН линолевая кислота;
С17Н29СООН линоленовая кислота;
С23Н45СООН нервоновая кислота.
Некоторые карбоновые кислоты и их производные имеют физиологическое значение и
находят применение в фармакологии.
НСООН – при попадании на кожу вызывает ожог – в медицинской практике
используется наружно в виде спиртовых растворов при ревматических болях.
4.
СН3СООК – ацетат калия применяется для лечения отеков.(CH3COO)2Pb·3H2O – тригидрат ацетата свинца и CH3COOPbOH – основный ацетат
свинца – препараты применяются наружно в качестве вяжущих средств при
воспалительных процессах кожи и слизистых оболочек.
Изовалериановая кислота – содержится в корнях валерианы, входит в состав валидола.
Янтарная и глутаровая кислоты – метаболиты.
Молочная кислота содержится в кисломолочных продуктах, квашеной капусте, соленых
овощах. Эта кислота in vivo образуется в результате молочнокислого брожения углеводов,
например, глюкозы. Молочная обнаруживается в желудочном содержимом при
пониженной его кислотности. Соль молочной кислоты – лактат кальция – в медицинской
практике используется при аллергических, кожных заболеваниях, воспалениях, переломах,
кровотечениях, а также в качестве противоядия при отравлении щавелевой кислотой и
другими веществами.
Яблочная кислота содержится в яблоках, рябине, фруктовых соках; in vivo участвует в
обменных процессах. Лимонная кислота содержится в цитрусовых, винограде,
крыжовнике. Еѐ соль – цитрат натрия – используется в медицине как консервант крови.
Строение карбоксильной группы
Карбоксильная группа представляет собой плоскую сопряженную систему, в которой
возникает р, -сопряжение при взаимодействии р z-орбитали атома кислорода
гидроксогруппы с -связью. Наличие р, -сопряжения в карбоксильной группе карбоновых
кислот способствует равномерному распределению отрицательного заряда в ацилат-ионе,
образующемся при отщеплении протона.
Наличие р, -сопряжения в карбоксильной группе карбоновых кислот значительно
повышает кислотные свойства карбоновых кислот по сравнению со спиртами:
рКа С2Н5ОН = 18, рКа СН3СООН = 4,76.
В карбоновых кислотах частичный положительный заряд на карбонильном атоме
углерода меньше, чем в альдегидах и кетонах, поэтому кислота менее активна к
восприятию атаки нуклеофильного реагента. Соответственно, реакции нуклеофильного
присоединения более характерны для альдегидов и кетонов.
В молекуле R-СООН выделяют две части: R-гидрофобная часть молекулы, -СООH –
гидрофильная часть молекулы. С увеличением длины углеводородного радикала
понижается растворимость кислот, степень гидратированности и стабильность ацилатаниона. Это приводит к уменьшению силы карбоновых кислот.
В карбоновых кислотах выделяют следующие реакционные центры:
1. основный нуклеофильный центр;
2. электрофильный центр;
3. ОН-кислотный центр;
4. СН-кислотный центр.
5.
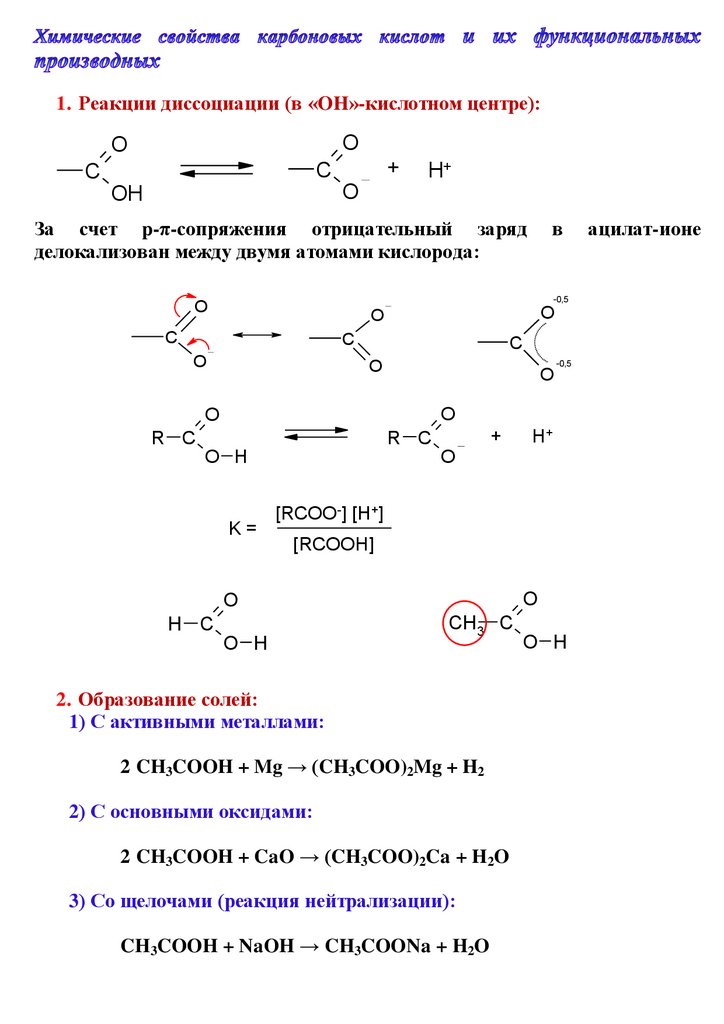
1. Реакции диссоциации (в «OH»-кислотном центре):O
O
+
C
C
H+
O
OH
За счет p-π-сопряжения отрицательный заряд
делокализован между двумя атомами кислорода:
в
-0,5
O
O
O
C
C
O
C
O
O
-0,5
O
O
+
R C
R C
O
O H
K=
H+
[RCOO-] [H+]
[RCOOH]
O
O
H C
O H
CH3 C
2. Образование солей:
1) С активными металлами:
2 CH3COOH + Mg → (CH3COO)2Mg + H2
2) С основными оксидами:
2 CH3COOH + CaO → (CH3COO)2Ca + H2O
3) Со щелочами (реакция нейтрализации):
CH3COOH + NaOH → CH3COONa + H2O
O H
ацилат-ионе
6.
4) С солями более слабых кислот:CH3COOH + NaHCO3 → CH3COONa + CO2 ↑+ H2O
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 ↑+ H2O
Эти реакции используются как качественные на карбоксильную группу (по
выделению газа CO2).
Образование солей дикарбоновыми кислотами:
оксалат кальция
Около 80% почечных камней образуется из оксалата кальция.
Рис. Почечные камни
Образование солей гидроксикислотами:
молочная кислота
лактат кальция
Лактат кальция используется в медицине как кальциевый препарат.
3. Реакции галогенирования (реакции в СН-кислотном центре):
CH3 – CH2 – COOH + Br2 → CH3 – CH(Br) – COOH + HBr
α-бромпропионовая кислота
7.
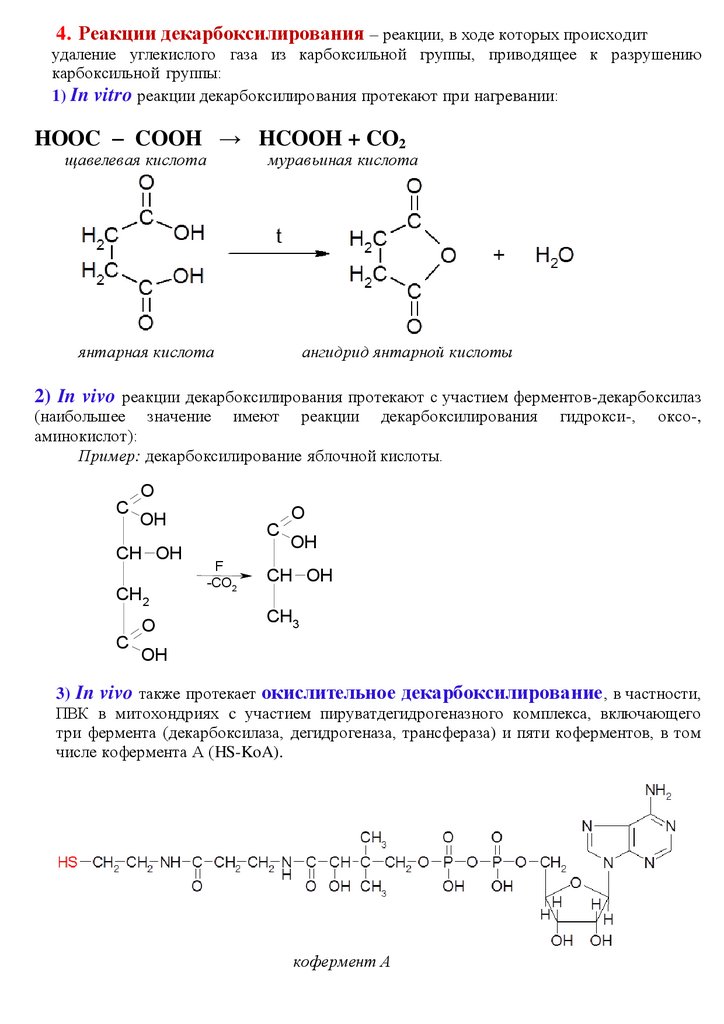
4. Реакции декарбоксилирования – реакции, в ходе которых происходитудаление углекислого газа из карбоксильной группы, приводящее к разрушению
карбоксильной группы:
1) In vitro реакции декарбоксилирования протекают при нагревании:
HOOC – COOH → HCOOH + CO2
щавелевая кислота
муравьиная кислота
янтарная кислота
ангидрид янтарной кислоты
2) In vivo реакции декарбоксилирования протекают с участием ферментов-декарбоксилаз
(наибольшее значение имеют реакции декарбоксилирования
аминокислот):
Пример: декарбоксилирование яблочной кислоты.
гидрокси-,
оксо-,
O
C
CH OH
CH 2
O
C
O
OH
C
F
-CO2
OH
CH OH
CH3
OH
3) In vivo также протекает окислительное декарбоксилирование , в частности,
ПВК в митохондриях c участием пируватдегидрогеназного комплекса, включающего
три фермента (декарбоксилаза, дегидрогеназа, трансфераза) и пяти коферментов, в том
числе кофермента А (HS-KoA).
кофермент А
8.
Суммарную реакцию можно представить следующим образом:H3C – CO – COOH + НАД+ + HS-KoA –> H3 – CO~SКоА + НАДН + Н++ СO2
ацетил-КоА
Ацетил-КоА, будучи активным соединением, вовлекается в цикл Кребса.
5.
2
Реакции
этерификации
–
нуклеофильного
замещения
sр -гибридизованного атома углерода:
H2SO4
O
CH3 C
у
O
CH3 C
O H +
(SN)
H O C2H5
O C2H5 +
H O H
6. Межмолекулярная дегидратация с образованием ангидридов (при
пропускании паров кислот над водоотнимающими средствами
P 2O5, H2SO4конц:
O
O
2 H3C
C
OH
P 2O 5
-H2O
H3C
C
H3C
C
O + 2 HPO3
O
уксусный ангидрид
Ангидрид” (an – отрицающая частица, греч. udor – вода) означает “лишѐнный воды”.
7. Реакции окисления
1) Окисление дикарбоновых кислот in vivo:
янтарная кислота
фумаровая кислота
2) Окисление гидроксикислот in vivo протекает аналогично окислению
вторичных спиртов с участием ферментов-дегидрогеназ.
9.
а) Окисление молочной кислоты до пировиноградной кислоты:CH3 CH COOH
OH
-2e, -2H+
+2e, +2H+
CH3 C COOH
O
б) Окисление яблочной кислоты до щавелевоуксусной кислоты:
в) Окисление β-гидроксимасляной кислоты до ацетоуксусной кислоты:
СН3 – СH(OH) – CН2 – СООН (НАД+) → СН3 – СO – CН2 – СООН + НАДН + Н+
Таким образом, при окислении гидроксикислот с участием ферментовдегидрогеназ образуются кетонокислоты.
В норме ацетоуксусная подвергается гидролитическому расщеплению с участием
фермента гидролазы, при этом образуются 2 молекулы уксусной кислоты:
СН3 – СO – CН2 – СООН + H2O → 2H3C – COOH
При патологии ацетоуксусная
образованием ацетона:
H3C
кислота
O
C
O
CH2 C
OH
подвергается
декарбоксилированию
H3C
CH3
F
-CO2
C
с
O
Кетоновые тела (β-гидроксимасляная кислота, ацетоуксусная кислота и ацетон)
накапливаются в крови больных сахарным диабетом, обнаруживаются в моче, они
токсичны, особенно для нервной системы.
.
Салициловая кислота и фармпрепараты на ее основе в медицинской практике
используются наружно при кожных заболеваниях
в качестве отвлекающего и
антисептического средства:
COOH
OH
10.
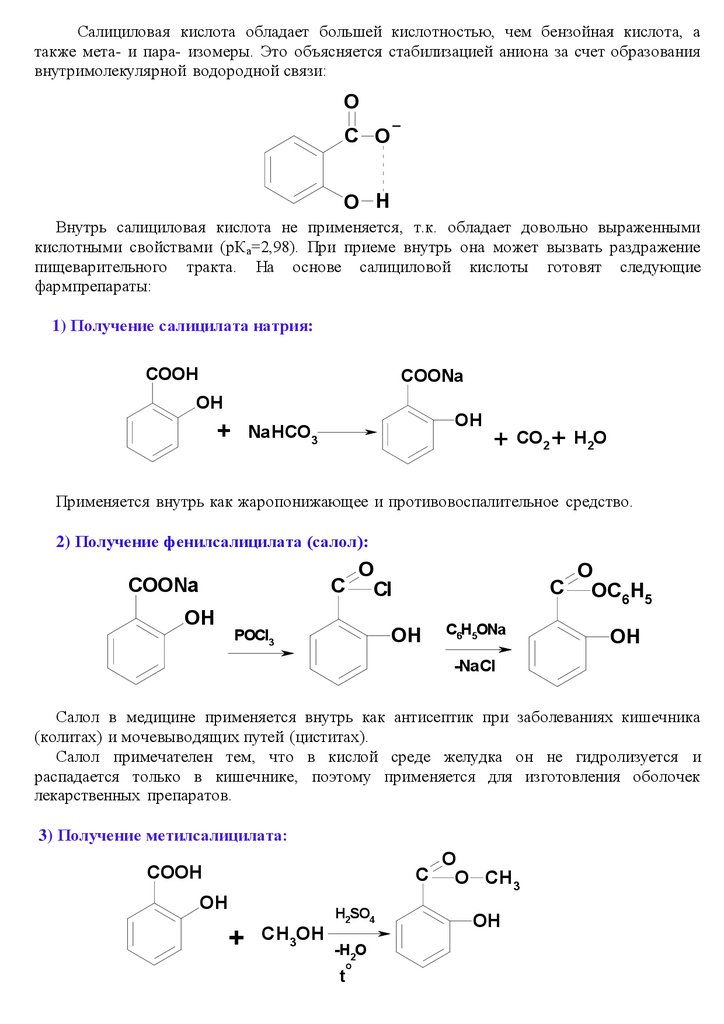
Салициловая кислота обладает большей кислотностью, чем бензойная кислота, атакже мета- и пара- изомеры. Это объясняется стабилизацией аниона за счет образования
внутримолекулярной водородной связи:
O
C O
O H
Внутрь салициловая кислота не применяется, т.к. обладает довольно выраженными
кислотными свойствами (рКа=2,98). При приеме внутрь она может вызвать раздражение
пищеварительного тракта. На основе салициловой кислоты готовят следующие
фармпрепараты:
1) Получение салицилата натрия:
COOH
COONa
OH
OH
+ NaHCO3
+ CO2 + H2O
Применяется внутрь как жаропонижающее и противовоспалительное средство.
2) Получение фенилсалицилата (салол):
COONa
C
O
Cl
OH
O
C OC H
6 5
OH
POCl3
C6H5ONa
OH
-NaCl
Салол в медицине применяется внутрь как антисептик при заболеваниях кишечника
(колитах) и мочевыводящих путей (циститах).
Салол примечателен тем, что в кислой среде желудка он не гидролизуется и
распадается только в кишечнике, поэтому применяется для изготовления оболочек
лекарственных препаратов.
3) Получение метилсалицилата:
O
C O CH
3
COOH
OH
H2SO4
+
CH3OH
-H2O
t
O
OH
11.
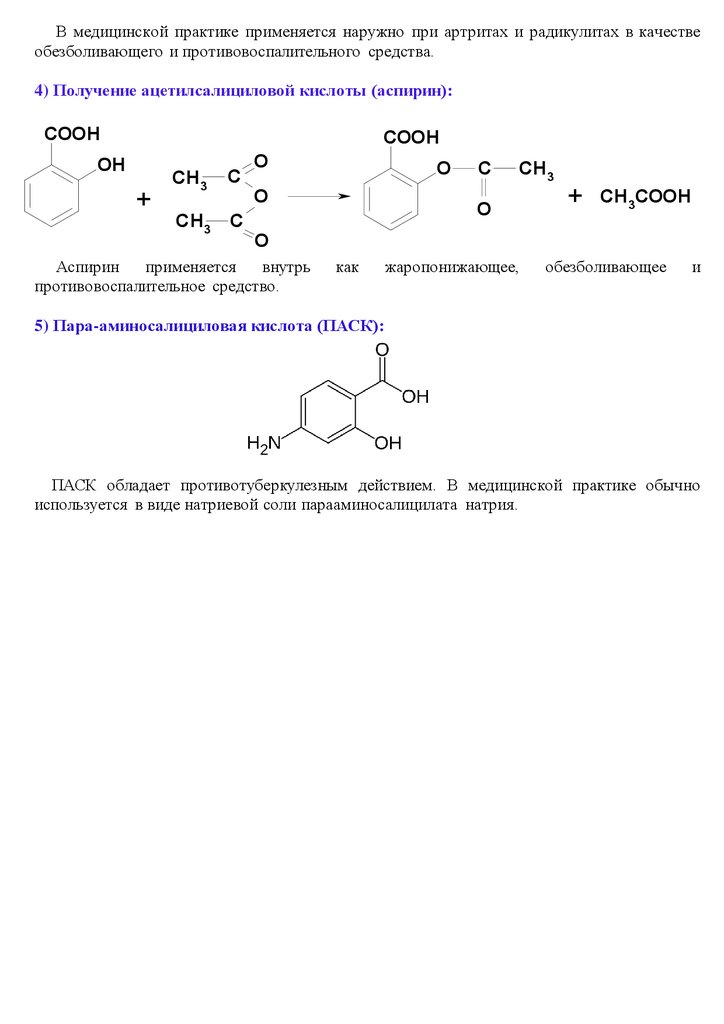
В медицинской практике применяется наружно при артритах и радикулитах в качествеобезболивающего и противовоспалительного средства.
4) Получение ацетилсалициловой кислоты (аспирин):
COOH
COOH
OH
+
CH3
CH3
C
O
O
O
C
CH3
O
C
+ CH3COOH
O
Аспирин
применяется
внутрь
противовоспалительное средство.
как
жаропонижающее,
обезболивающее
и
5) Пара-аминосалициловая кислота (ПАСК):
ПАСК обладает противотуберкулезным действием. В медицинской практике обычно
используется в виде натриевой соли парааминосалицилата натрия.






 chemistry
chemistry








