Similar presentations:
Карбоновые кислоты и их функциональные производные
1.
КАРБОНОВЫЕ КИСЛОТЫ И ИХФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
2.
Якоб Йорданс «Пир Клеопатры» 1653“Она … опустила
жемчужину в уксус…
Когда от нее не
осталось и следа,
Клеопатра подняла
кубок, и выпила весь
до последней капли”
(химическая реконструкция)
3.
4.
КлассификацияКарбоновыми кислотами называются
соединения, содержащие карбоксильную
группу —СООН.
O
R C
OH
5.
Классификация6.
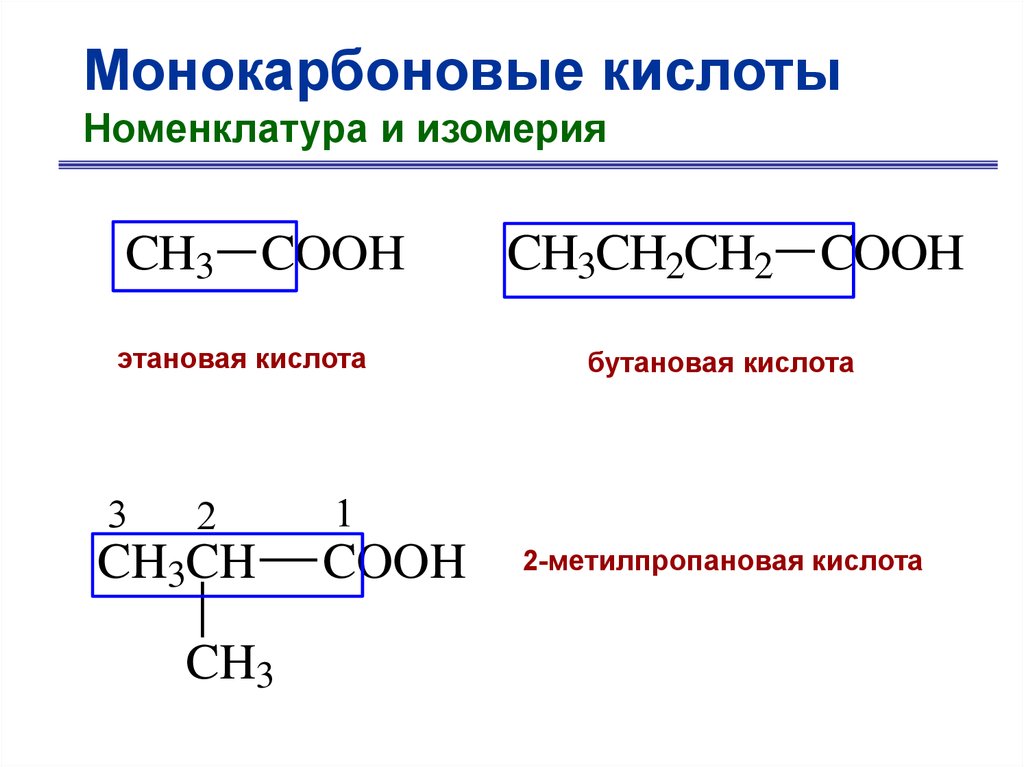
Монокарбоновые кислотыНоменклатура и изомерия
7.
Монокарбоновые кислотыНоменклатура и изомерия
CH3 COOH
этановая кислота
3
2
CH3CH
CH3
CH3CH2CH2 COOH
бутановая кислота
1
COOH
2-метилпропановая кислота
8.
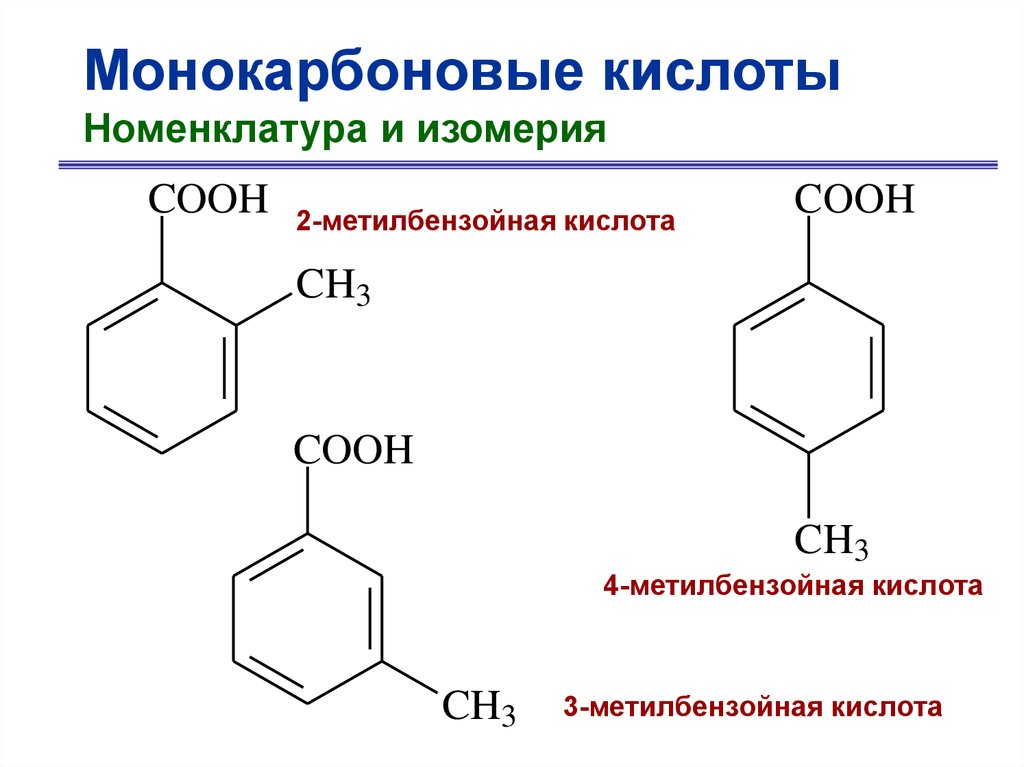
Монокарбоновые кислотыНоменклатура и изомерия
COOH
2-метилбензойная кислота
COOH
CH3
COOH
CH3
4-метилбензойная кислота
CH3
3-метилбензойная кислота
9.
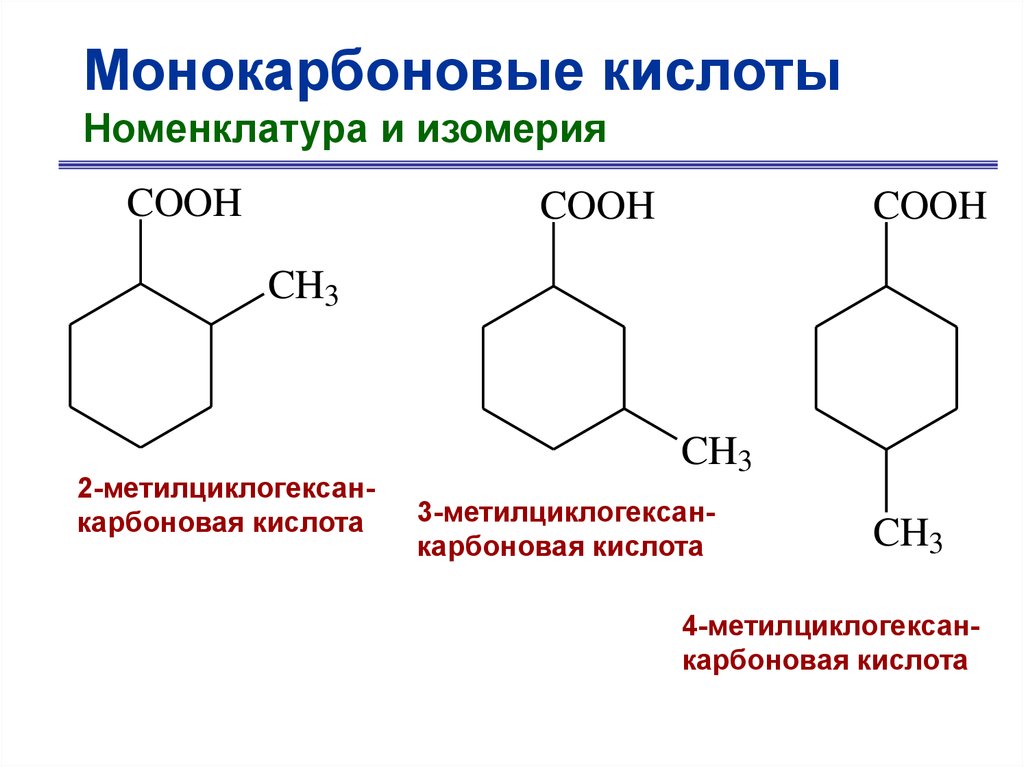
Монокарбоновые кислотыНоменклатура и изомерия
COOH
COOH
COOH
CH3
2-метилциклогексанкарбоновая кислота
CH3
3-метилциклогексанкарбоновая кислота
CH3
4-метилциклогексанкарбоновая кислота
10.
Монокарбоновые кислотыНоменклатура и изомерия
Систематические и тривиальные названия монокарбоновых кислот С1Формула
Систематическое
название
Тривиальное название
HCOOH
метановая кислота
муравьиная кислота
CH3COOH
этановая кислота
уксусная кислота
CH3CH2COOH
пропановая кислота
пропионовая кислота
CH3(CH2)2COOH
бутановая кислота
масляная кислота
CH3(CH2)3COOH
пентановая кислота
валериановая кислота
CH3(CH2)4COOH
гексановая кислота
капроновая кислота
CH3(CH2)5COOH
гептановая кислота
энантовая кислота
CH3(CH2)6COOH
октановая кислота
каприловая кислота
CH3(CH2)7COOH
нонановая кислота
пеларгоновая кислота
CH3(CH2)8COOH
декановая кислота
каприновая кислота
11.
Монокарбоновые кислотыСпособы получения
Получение из первичных спиртов и альдегидов
O
R
CH2 OH
R
C
R
H
первичный спирт
CH3CH2CH2CH2OH
пентанол-1
O
альдегид
KMnO4, NaOH
C
OH
карбоновая кислота
CH3CH2CH2COOH
валериановая кислота
12.
Монокарбоновые кислотыСпособы получения
Получение из гомологов бензола
CH3
COOH
KMnO4, KOH, 100°C
толуол
бензойная кислота
13.
Монокарбоновые кислотыСпособы получения
Получение из алканов
R
CH2 CH2 R'
O2
R
COOH + R'
COOH
Получение из нитрилов (цианидов)
R
Br + NaCN
R
C
N + NaBr
O
R
C
N + 2H2O
R
C
+ NH3
OH
14.
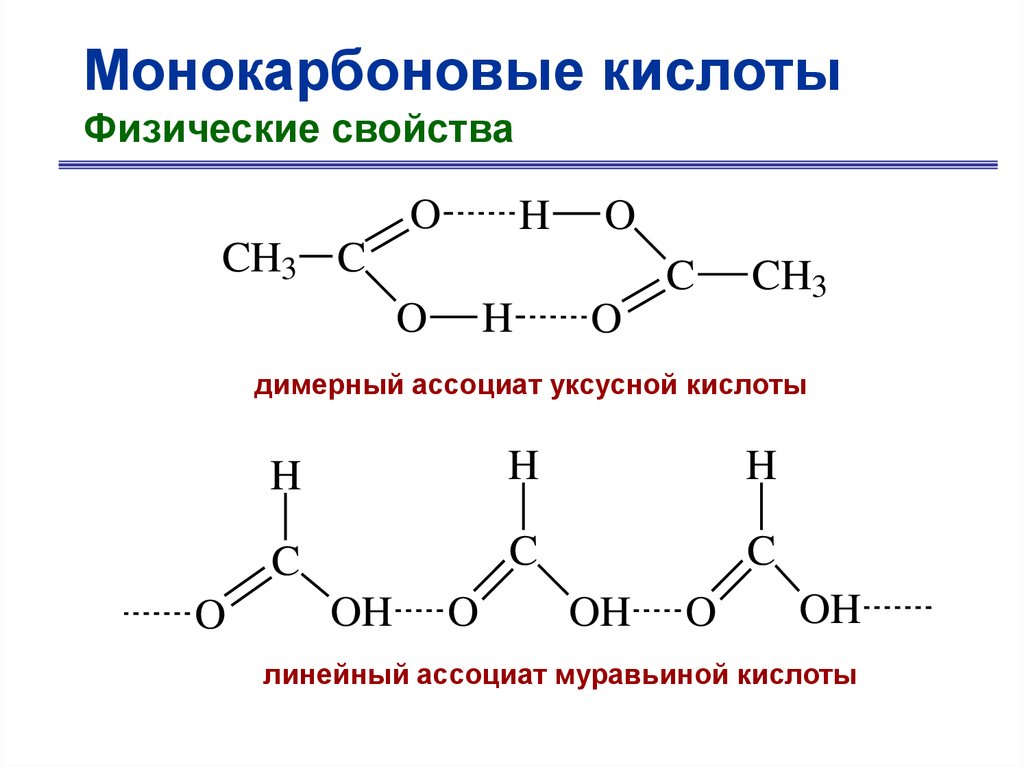
Монокарбоновые кислотыФизические свойства
15.
Монокарбоновые кислотыФизические свойства
O
H
O
CH3 C
C
O
H
O
CH3
димерный ассоциат уксусной кислоты
O
H
H
H
C
C
C
OH
O
OH
O
OH
линейный ассоциат муравьиной кислоты
16.
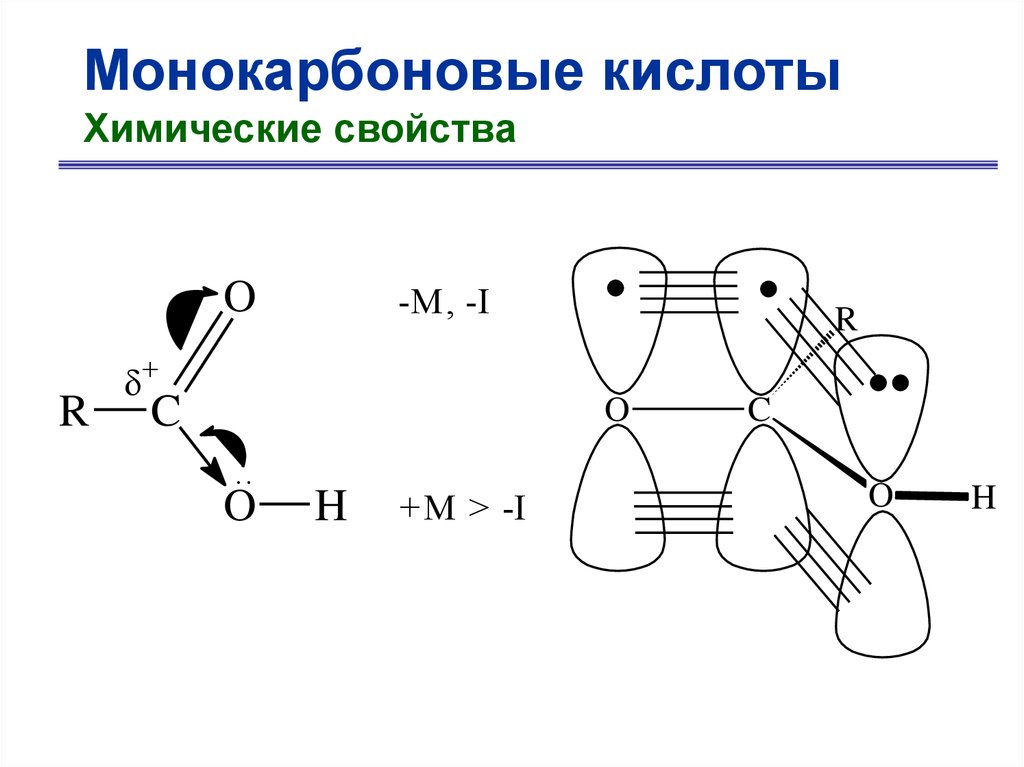
Монокарбоновые кислотыХимические свойства
В карбоновых кислотах выделяют следующие
реакционные центры:
O
R CH C
O H
H
4
2
1
3
1 – основный, нуклеофильный центр,
2 – электрофильный центр,
3 – «OH» - кислотный центр,
4 – «CH» - кислотный центр.
17.
Монокарбоновые кислотыХимические свойства
O
R
-M , -I
+
C
R
O
..
O
H
+ M > -I
C
O
H
18.
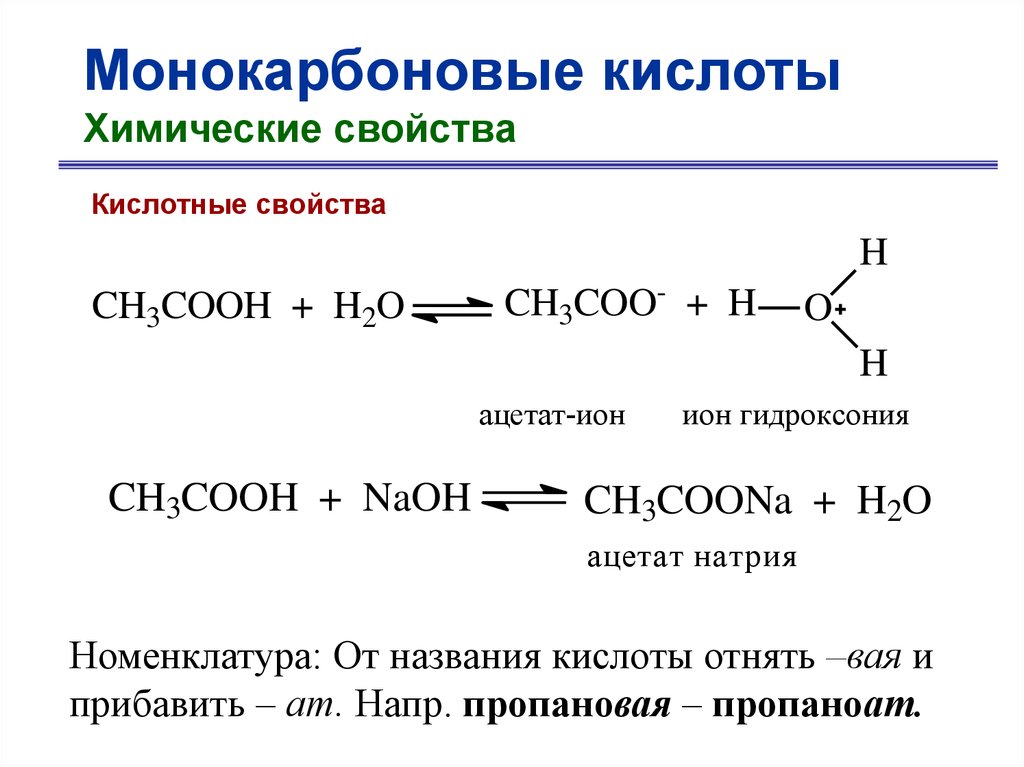
Монокарбоновые кислотыХимические свойства
Кислотные свойства
O
O
R
C
-H+
..
O
H
R
O-
C
R
O-
O
карбоновая кислота
O
R
C
-1/2
C
O -1/2
карбоксилат-ион
19.
Монокарбоновые кислотыХимические свойства
Кислотные свойства
pKa
уксусная кислота
4,76
Cl
CH2COOH
монохлоруксусная кислота
2,85
Cl
CHCOOH
дихлоруксусная кислота
1,25
трихлоруксусная кислота
0,66
Cl
Cl
Cl
CCOOH
Cl
Увеличение кислотности
CH3COOH
20.
Монокарбоновые кислотыХимические свойства
Кислотные свойства
pKa
-хлормасляная кислота
2,84
Cl
CH3CHCH2COOH
-хлормасляная кислота
4,06
-хлормасляная кислота
4,52
масляная кислота
4,82
Cl
CH2CH2CH2COOH
Cl
CH3CH2CH2COOH
Уменьшение кислотности
CH3CH2CHCOOH
21.
Монокарбоновые кислотыХимические свойства
Кислотные свойства
H
CH3COOH + H2O
CH3COO- + H
O
H
ацетат-ион
CH3COOH + NaOH
ион гидроксония
CH3COONa + H2O
ацетат натрия
Номенклатура: От названия кислоты отнять –вая и
прибавить – ат. Напр. пропановая – пропаноат.
22.
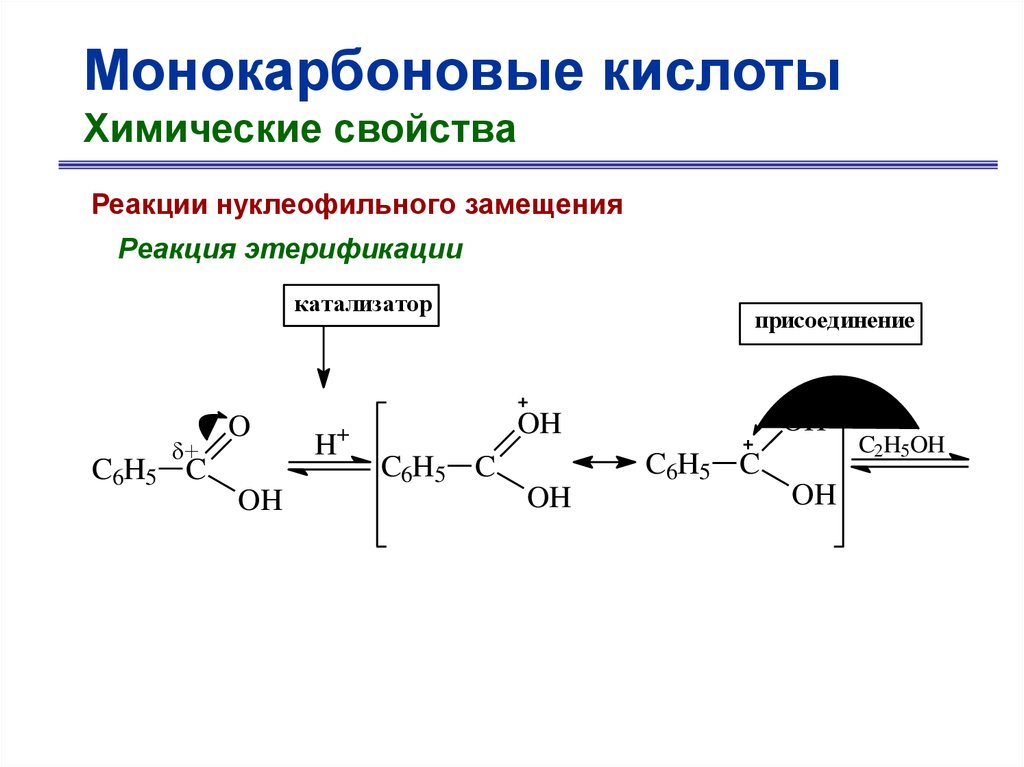
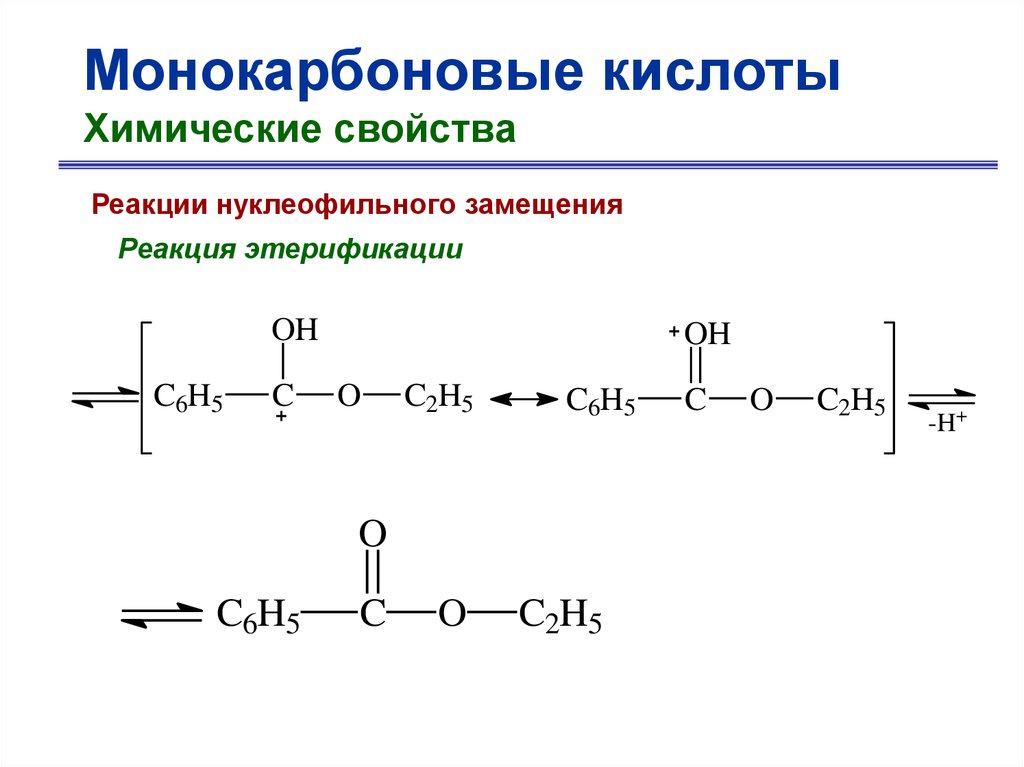
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Реакция этерификации
O
O
C6H5 C
+ C2H5OH
OH
бензойная кислота
C6H5 C
+ H2O
OC2H5
этилбензоат
23.
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Реакция этерификации
катализатор
+
C6H5 C
O
OH
OH
OH
+
H
присоединение
C6H5 C
C6H5 C
OH
OH
C2H5OH
24.
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Реакция этерификации
OH
C6H5
H
OH
C
O
O
H
C2H5
C6H5
C
O
O
H
H
C2H5
-H2O
25.
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Реакция этерификации
OH
C6H5
C
OH
O
C2H5
C6H5
O
C6H5
C
O
C2H5
C
O
C2H5
-H+
26.
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Образование галогенангидридов
O
COOH
C
Cl
+ PCl5
бензойная
кислота
+ POCl3 + HCl
фосфорилхлорид
бензоилхлорид
O
CH3COOH + SOCl2
уксусная
кислота
тионилхлорид
CH3 C
Cl
ацетилхлорид
+ SO2 + HCl
27.
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Образование ангидридов кислот
O
CH3 C
OH
OH
CH3 C
O
O
P2O5
-2HPO3
CH3 C
O
CH3 C
O
уксусный ангидрид
28.
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Образование ангидридов кислот
O
+
O
O
CH3 C
C
+
Cl
ацетилхлорид
CH3 C
O + NaCl
CH3
Na+-O
ацетат натрия
(нуклеофил)
CH3 C
O
уксусный
ангидрид
29.
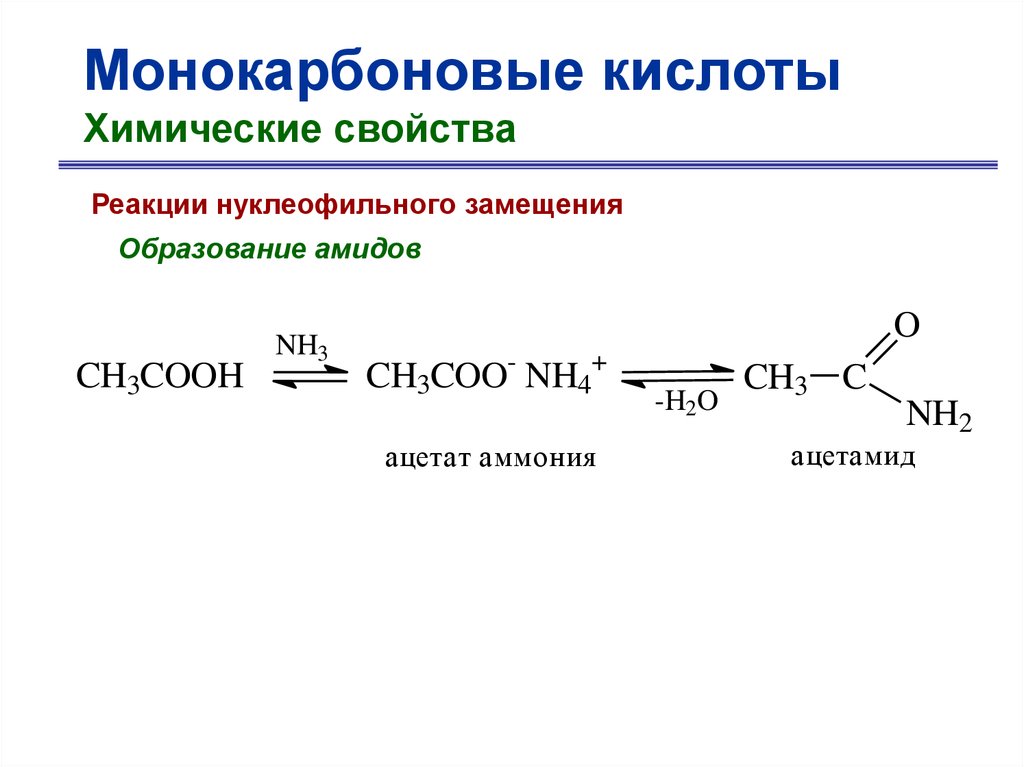
Монокарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
Образование амидов
CH3COOH
NH3
O
CH3COO- NH4+
ацетат аммония
-H2O
CH3 C
NH2
ацетамид
30.
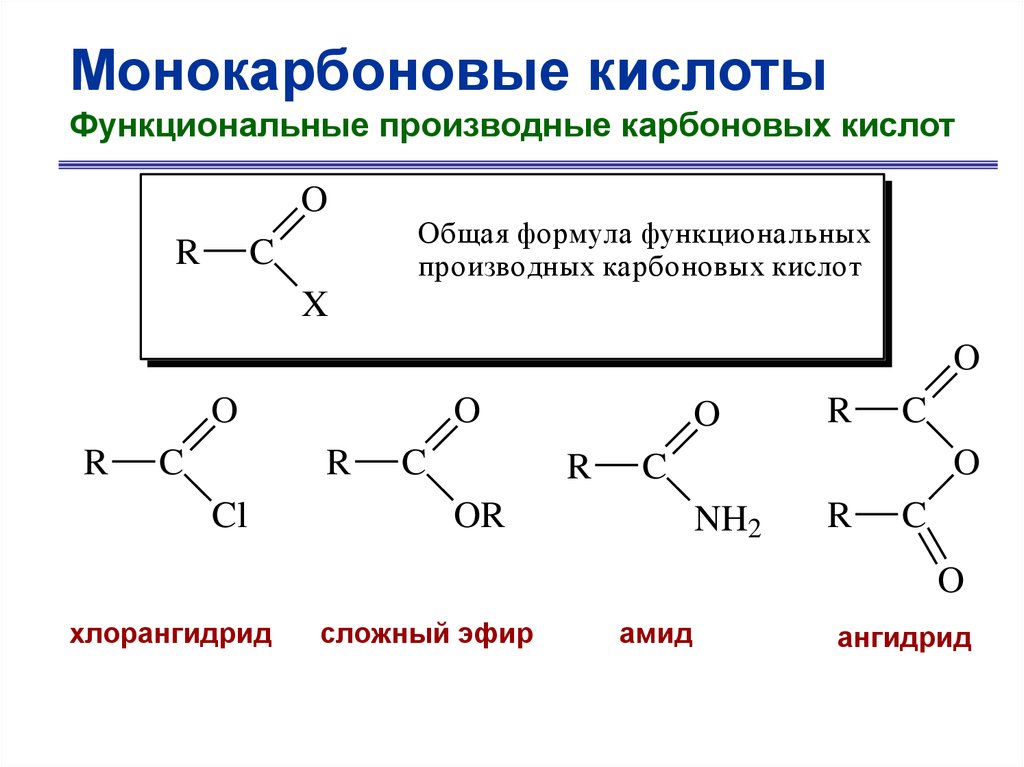
Монокарбоновые кислотыФункциональные производные карбоновых кислот
O
R
C
Общая формула функциональных
производных карбоновых кислот
X
O
O
R
C
O
R
Cl
C
O
R
R
C
O
C
OR
NH2
R
C
O
хлорангидрид
сложный эфир
амид
ангидрид
31.
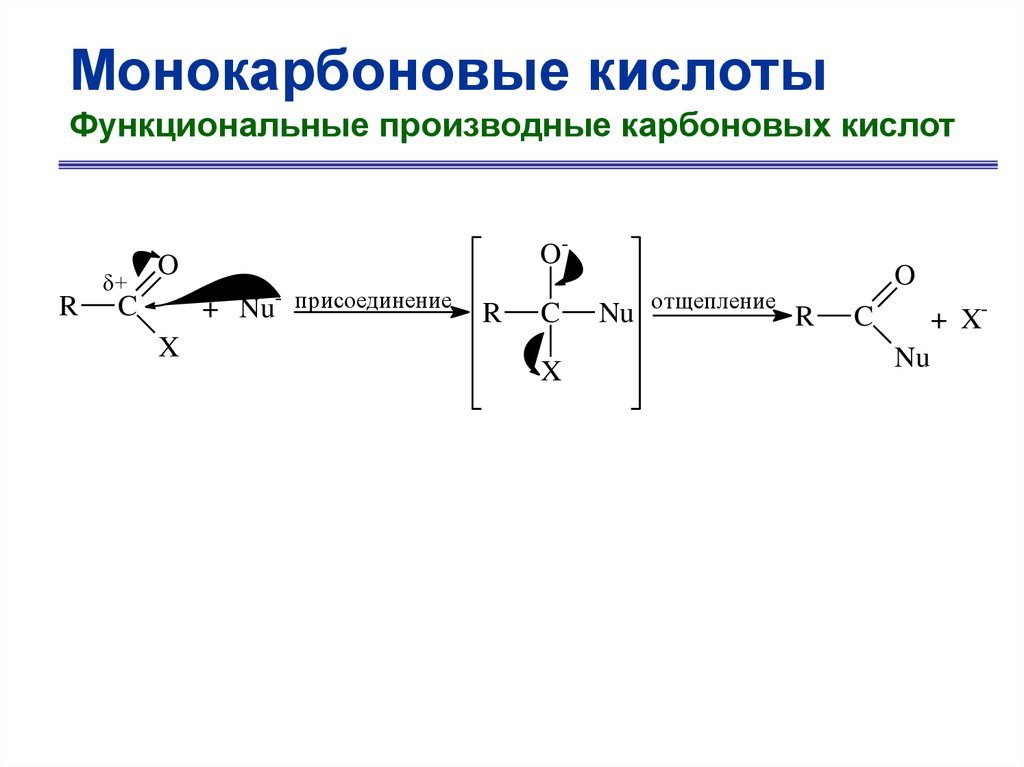
Монокарбоновые кислотыФункциональные производные карбоновых кислот
R
+
O-
O
C
+
X
Nu- присоединение
R
C
X
Nu
отщепление
O
R
+ X-
C
Nu
32.
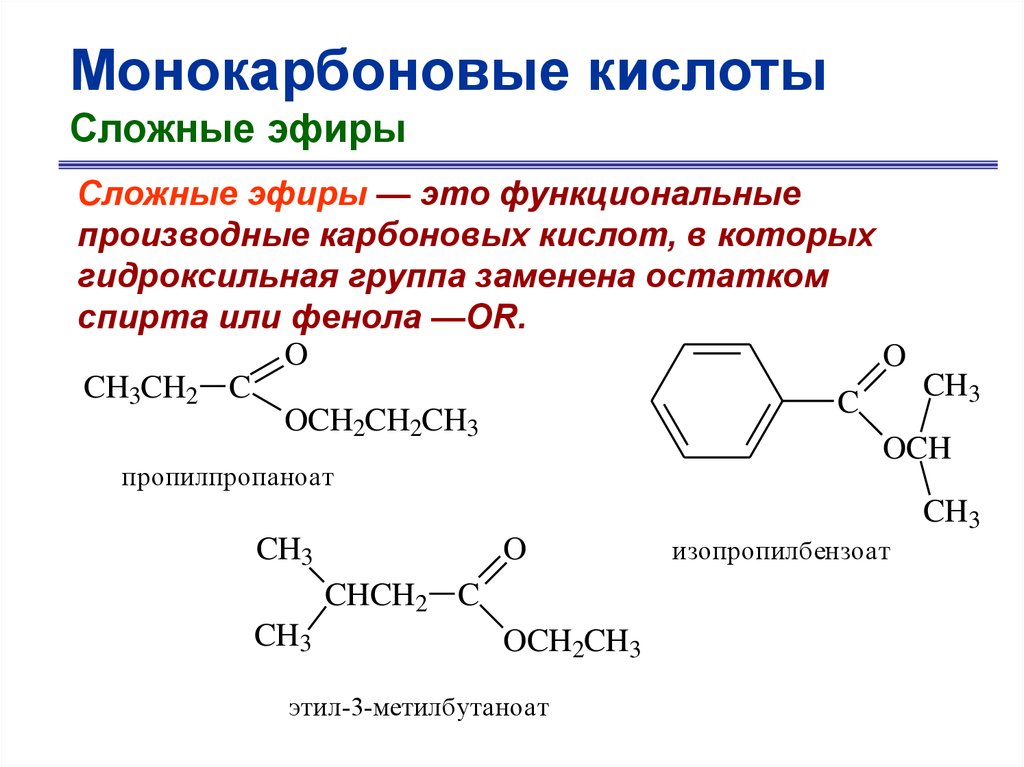
Монокарбоновые кислотыСложные эфиры
Сложные эфиры — это функциональные
производные карбоновых кислот, в которых
гидроксильная группа заменена остатком
спирта или фенола —OR.
O
O
CH3
CH3CH2 C
C
OCH2CH2CH3
OCH
пропилпропаноат
CH3
CH3
O
CHCH2 C
CH3
OCH2CH3
этил-3-метилбутаноат
изопропилбензоат
33.
Монокарбоновые кислотыСложные эфиры
O
CH3 C
Cl
CH3CH2OH
-HCl
ацетилхлорид
O
CH3 C
O
CH3 C
O
CH3 C
O
уксусный
ангидрид
OCH2CH3
CH3CH2OH
-CH3COOH
34.
Монокарбоновые кислотыСложные эфиры
O
ONa + CH3 C
феноксид натрия
Cl
ацетилхлорид
O
CH3 C
+ NaCl
O
фенилацетат
35.
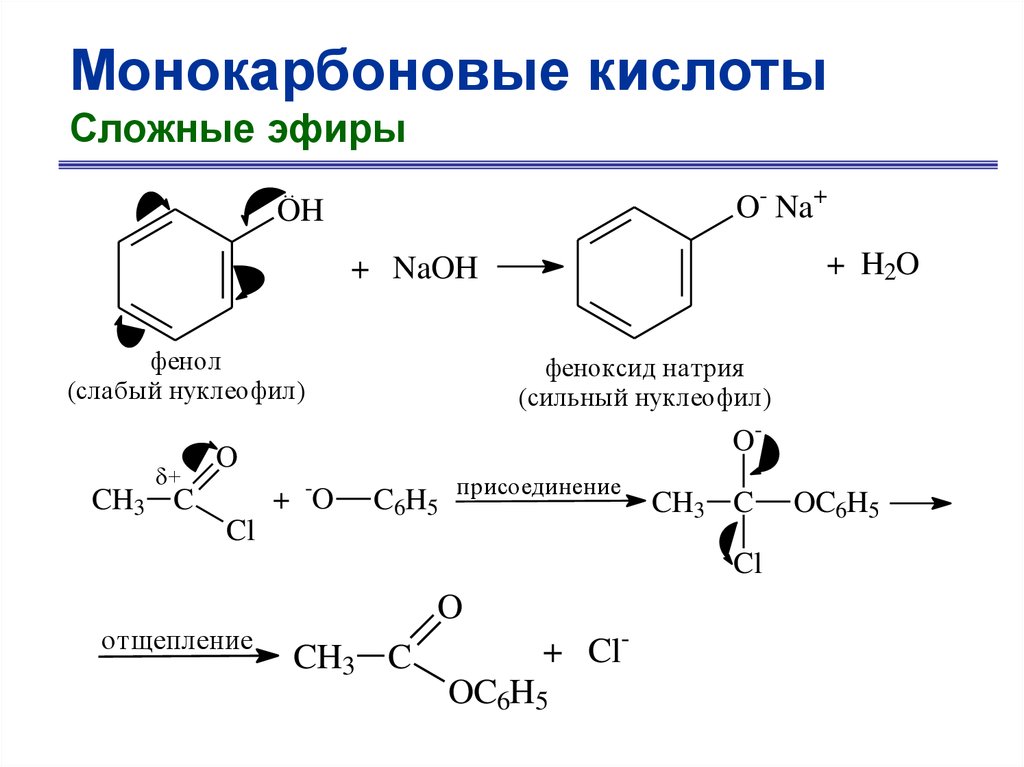
Монокарбоновые кислотыСложные эфиры
..
O- Na+
OH
+ H2O
+ NaOH
фенол
(слабый нуклеофил)
+
CH3 C
феноксид натрия
(сильный нуклеофил)
O-
O
+ -O
Cl
C6H5
присоединение
CH3 C
Cl
отщепление
O
CH3 C
+ ClOC6H5
OC6H5
36.
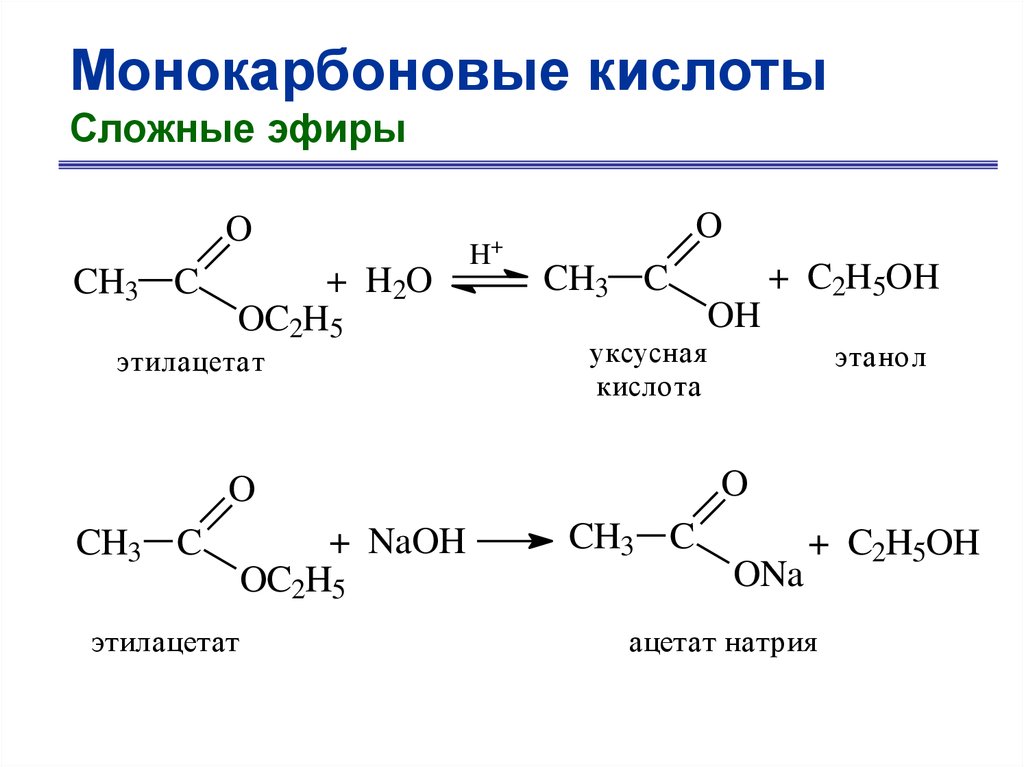
Монокарбоновые кислотыСложные эфиры
O
CH3 C
+ H2O
OC2H5
этилацетат
O
+
H
CH3 C
этилацетат
+ NaOH
OC2H5
OH
уксусная
кислота
этанол
O
O
CH3 C
+ C2H5OH
CH3 C
ONa
+ C2H5OH
ацетат натрия
37.
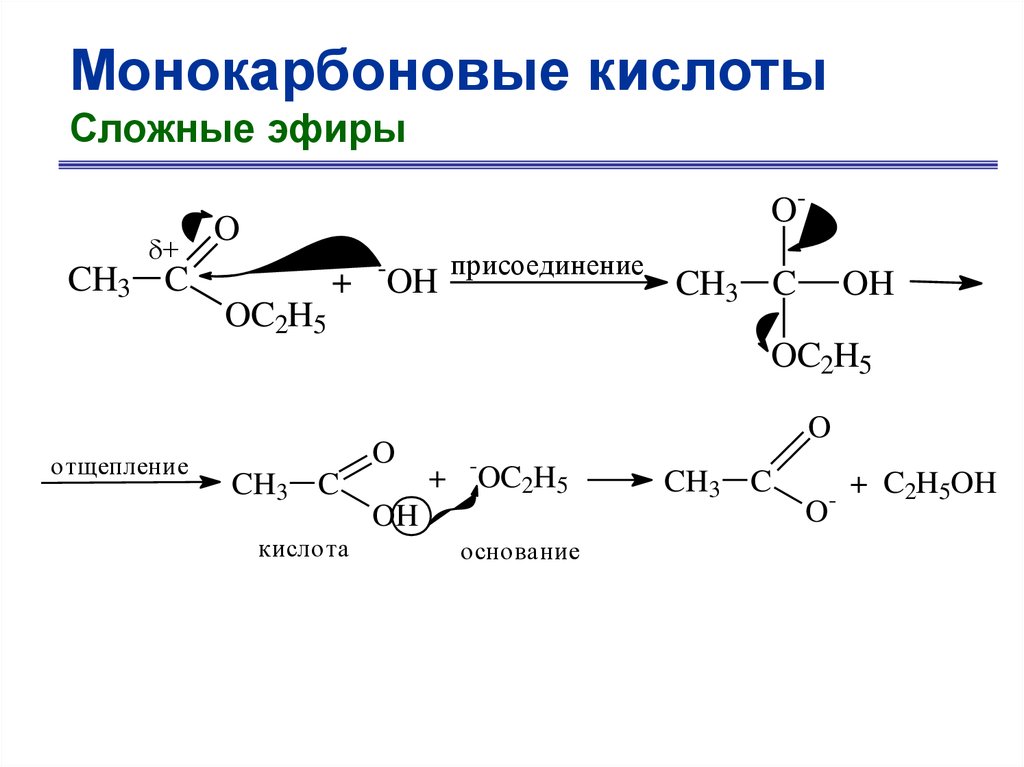
Монокарбоновые кислотыСложные эфиры
+
CH3 C
O-
O
+ -OH
присоединение
OC2H5
CH3 C
OH
OC2H5
отщепление
O
CH3 C
кислота
O
+ -OC2H5
OH
основание
CH3 C
O
-
+ C2H5OH
38.
Монокарбоновые кислотыАмиды
Амиды — это функциональные производные
карбоновых кислот, в которых гидроксильная
группа заменена на аминогруппу
O
O
+
C
Cl
C
+ 2NH3
NH2
+ NH4Cl
бензоилхлорид
бензамид
39.
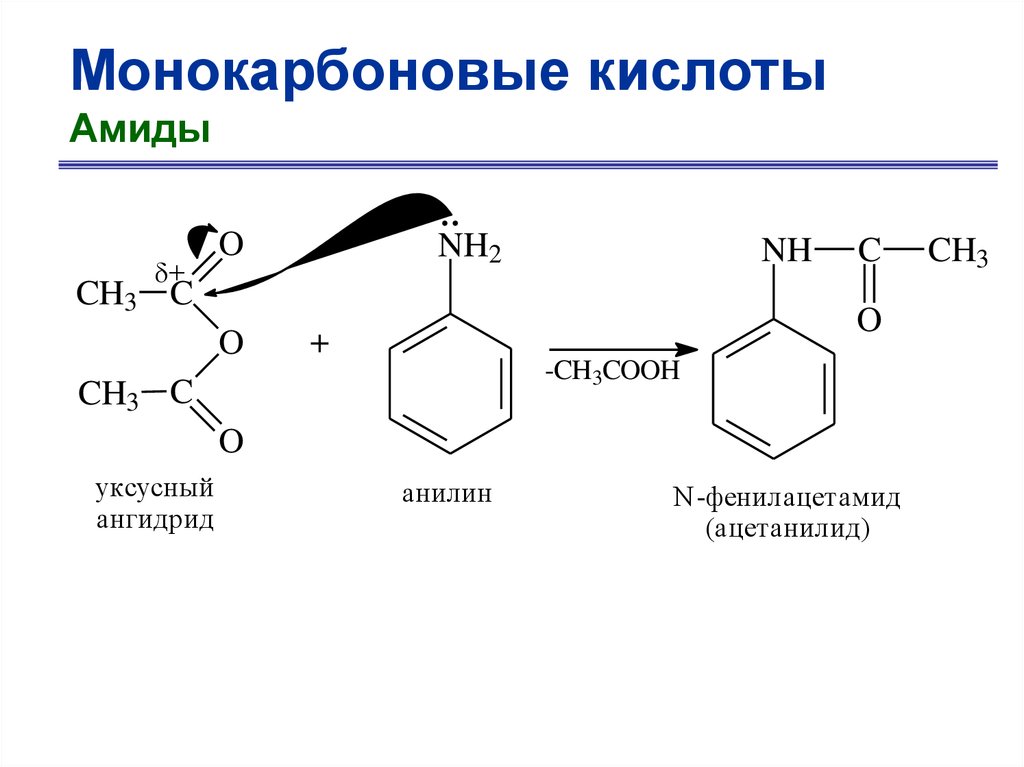
Монокарбоновые кислотыАмиды
+
O
NH2
NH
CH3 C
O
C
O
+
-CH3COOH
CH3 C
O
уксусный
ангидрид
анилин
N-фенилацетамид
(ацетанилид)
CH3
40.
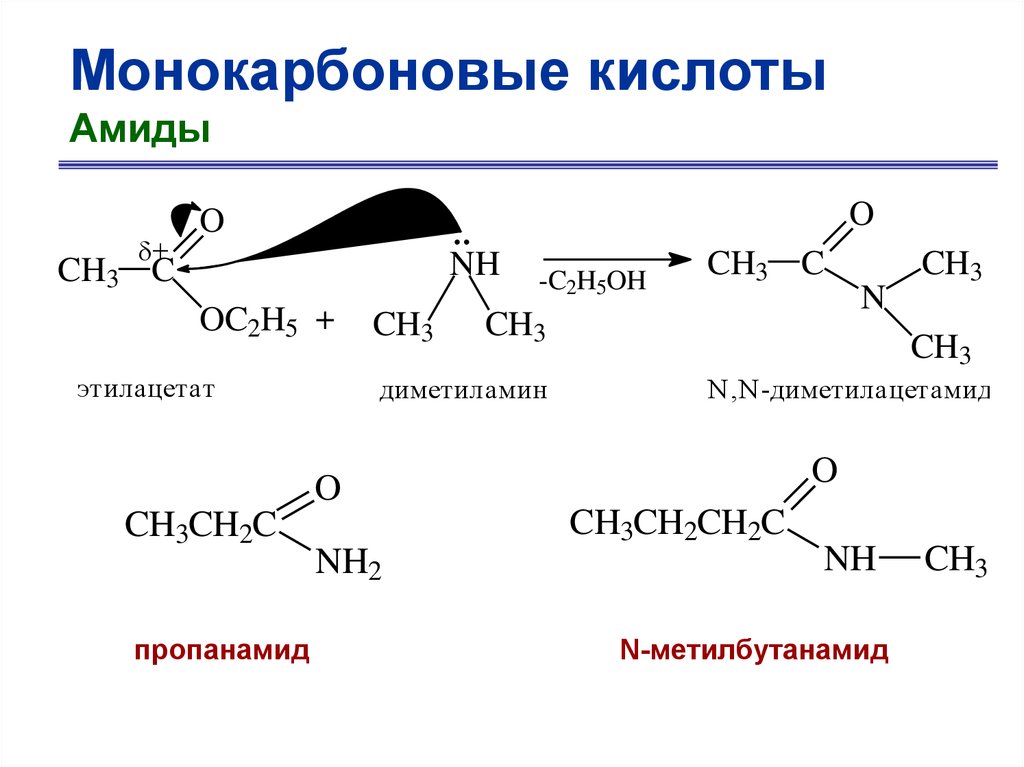
Монокарбоновые кислотыАмиды
+
O
O
NH
CH3 C
OC2H5 +
этилацетат
CH3
-C2H5OH
CH3 C
CH3
диметиламин
CH3
N,N -диметилацетамид
O
O
CH3CH2C
пропанамид
CH3CH2CH2C
NH2
N
CH3
NH
N-метилбутанамид
CH3
41.
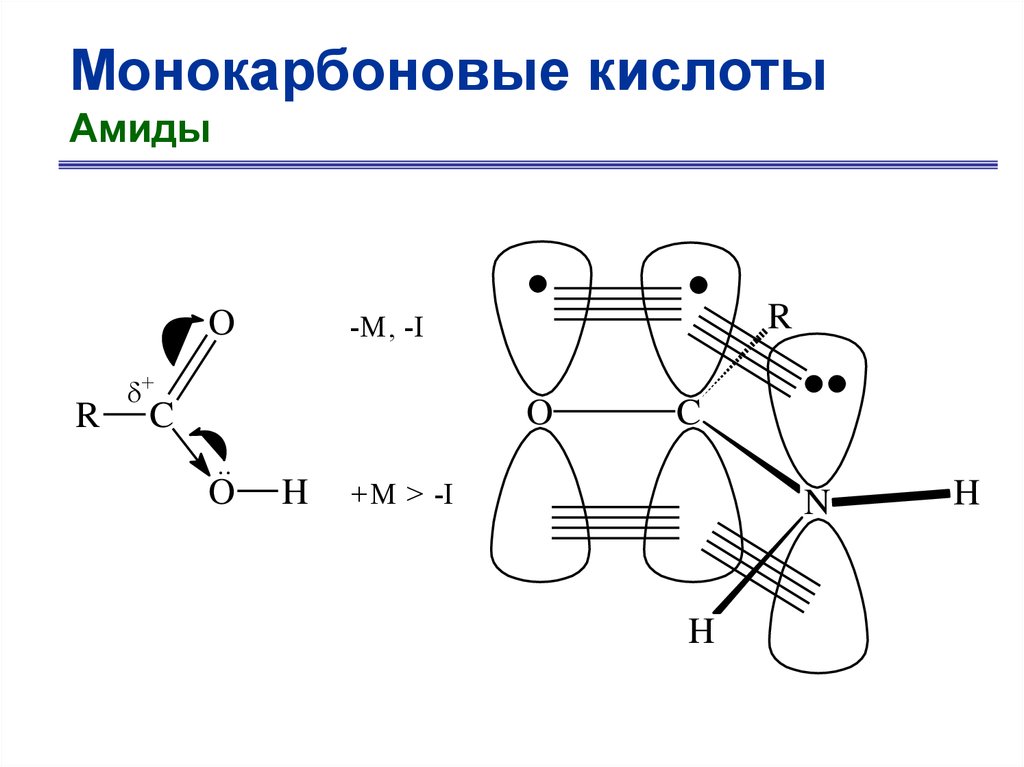
Монокарбоновые кислотыАмиды
O
R
R
-M, -I
+
O
C
..
O
H
C
+M > -I
N
H
H
42.
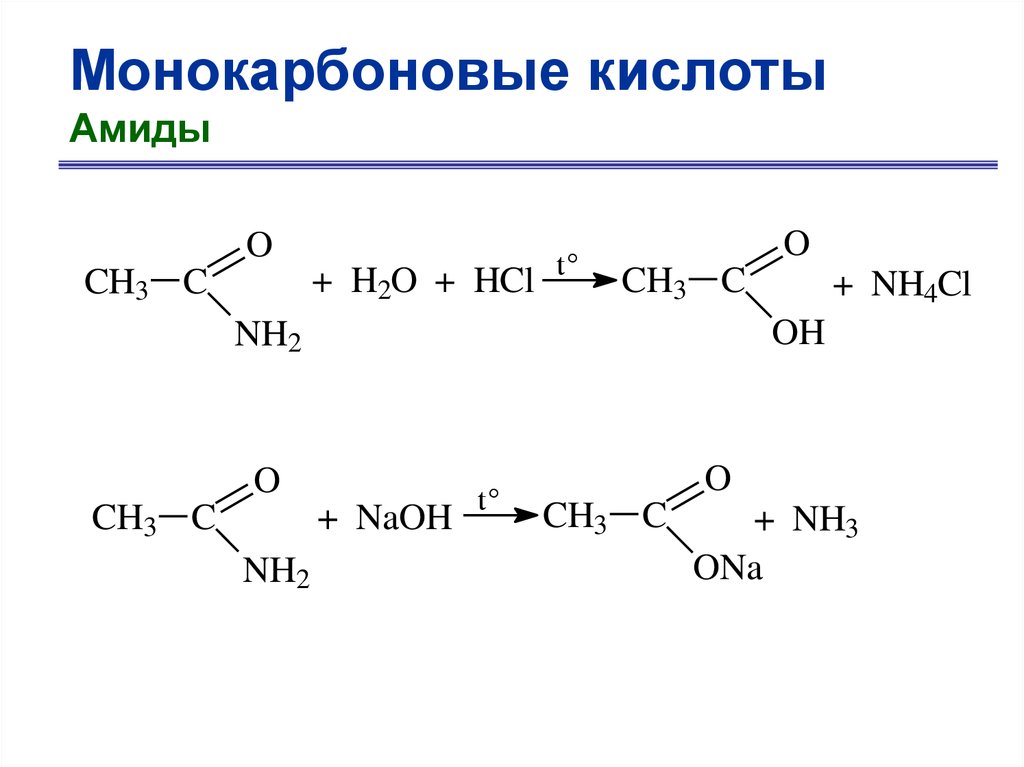
Монокарбоновые кислотыАмиды
O
+ H2O + HCl
CH3 C
t°
O
CH3 C
OH
NH2
O
CH3 C
+ NaOH
NH2
+ NH4Cl
t°
O
CH3 C
+ NH3
ONa
43.
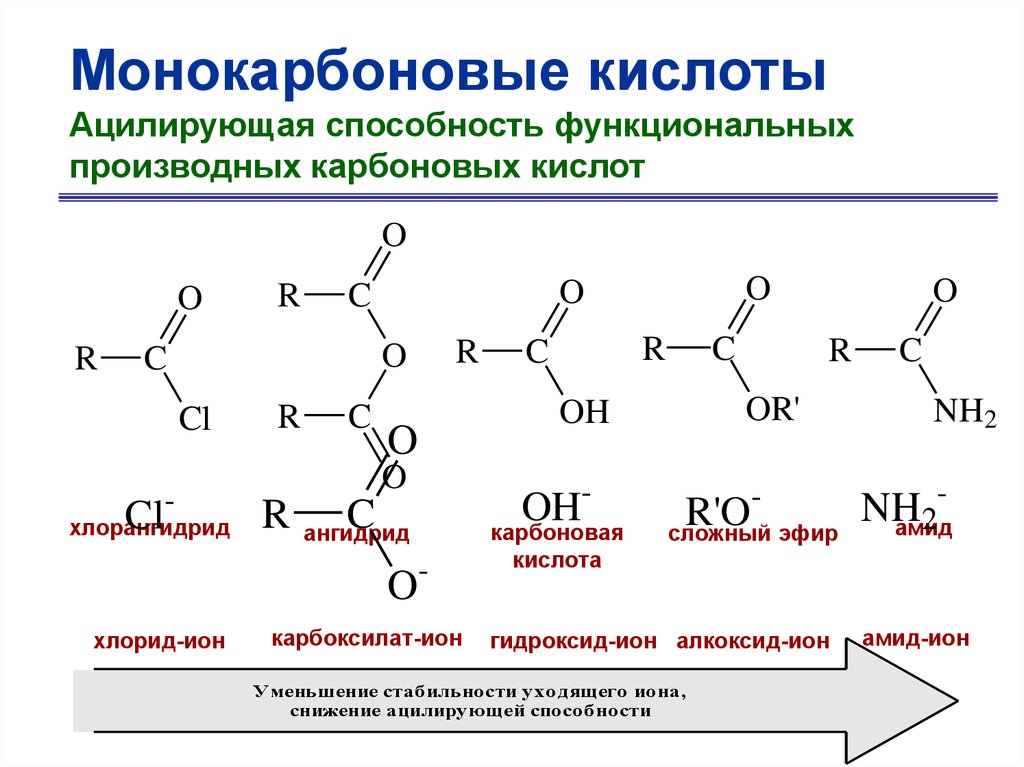
Монокарбоновые кислотыАцилирующая способность функциональных
производных карбоновых кислот
O
O
R
R
Cl
Cl
R
O
C
-
хлорангидрид
R
C
O
O
R
R
C
C
ангидрид
O
карбоксилат-ион
C
O
R
OR'
OH
OH
карбоновая
-
хлорид-ион
O
O
C
R'O
-
сложный эфир
C
NH2
NH
2
амид
кислота
гидроксид-ион алкоксид-ион
Уменьшение стабильности уходящего иона,
снижение ацилирующей способности
амид-ион
44.
Монокарбоновые кислотыАцилирующая способность функциональных
производных карбоновых кислот
45.
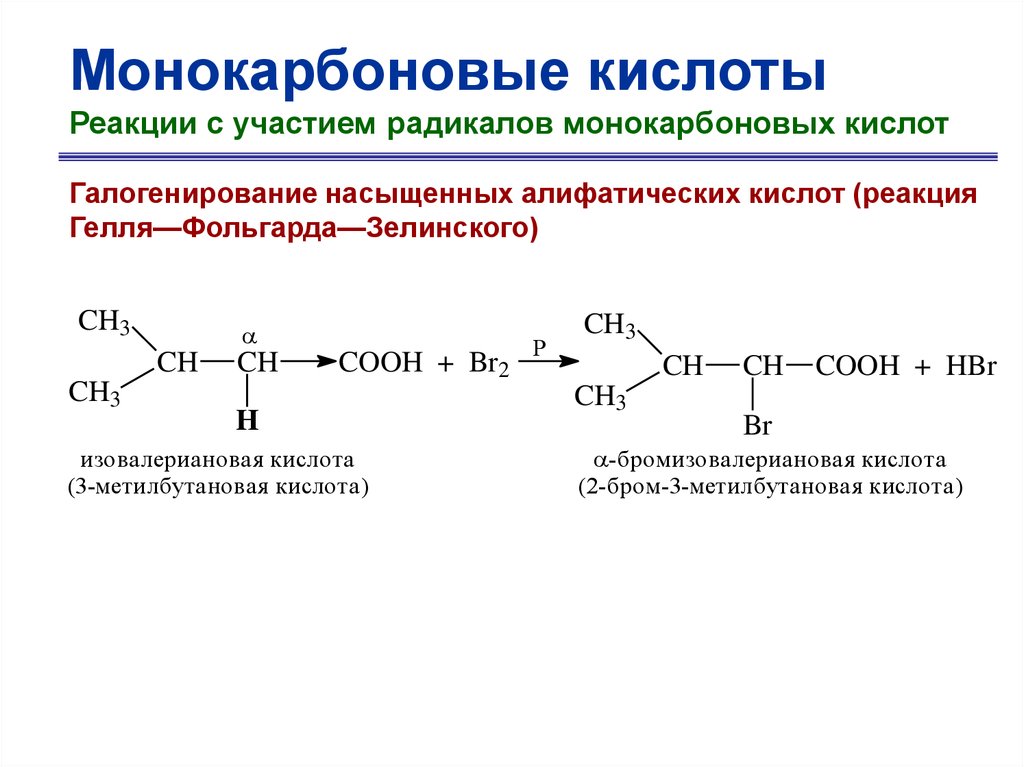
Монокарбоновые кислотыРеакции с участием радикалов монокарбоновых кислот
Галогенирование насыщенных алифатических кислот (реакция
Гелля—Фольгарда—Зелинского)
CH3
CH
CH3
CH
COOH + Br2
H
изовалериановая кислота
(3-метилбутановая кислота)
P
CH3
CH
CH3
CH
COOH + HBr
Br
-бромизовалериановая кислота
(2-бром-3-метилбутановая кислота)
46.
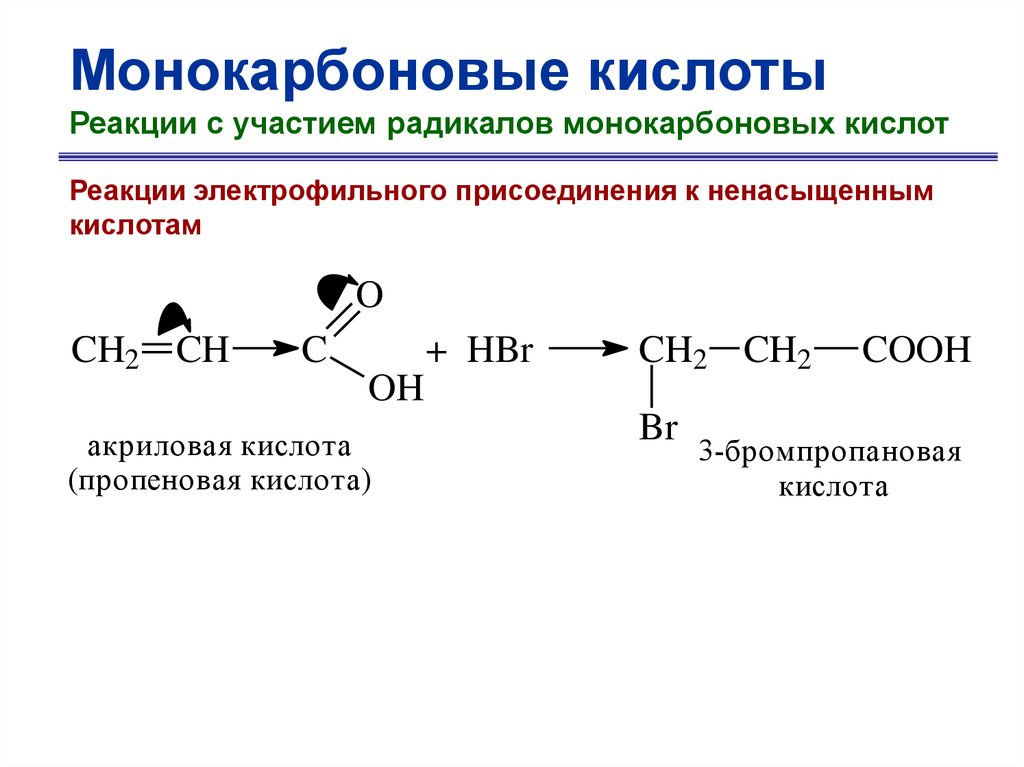
Монокарбоновые кислотыРеакции с участием радикалов монокарбоновых кислот
Реакции электрофильного присоединения к ненасыщенным
кислотам
O
CH2 CH
C
+ HBr
OH
акриловая кислота
(пропеновая кислота)
CH2 CH2
Br
COOH
3-бромпропановая
кислота
47.
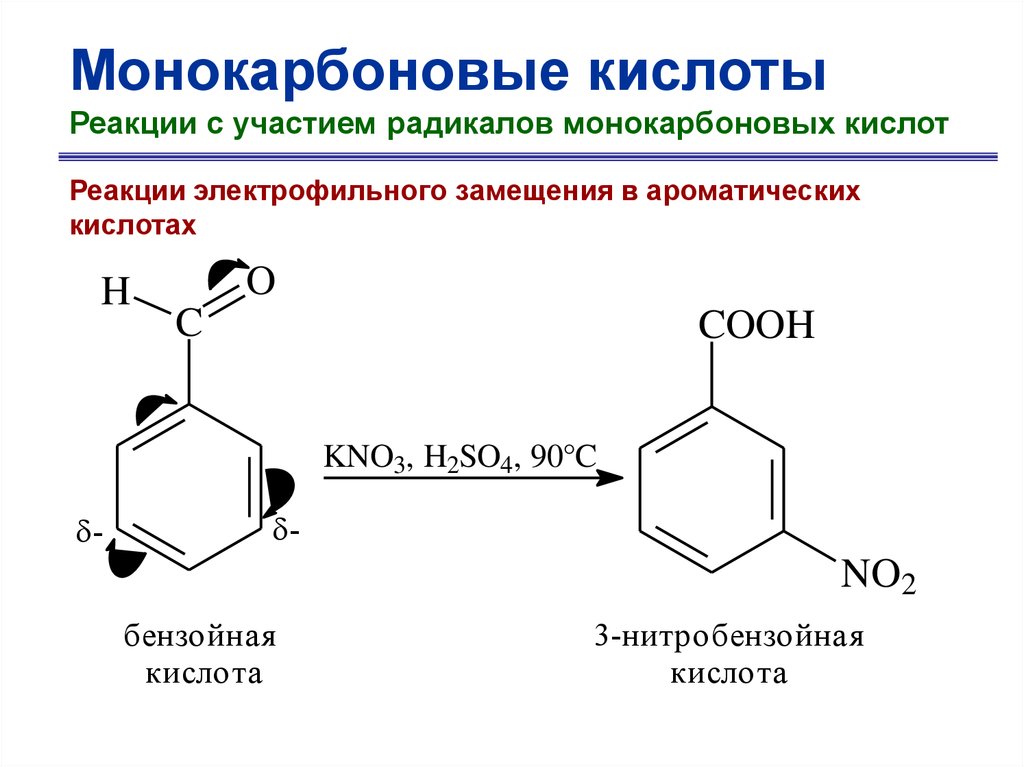
Монокарбоновые кислотыРеакции с участием радикалов монокарбоновых кислот
Реакции электрофильного замещения в ароматических
кислотах
H
O
C
COOH
KNO3, H2SO4, 90°C
-
-
NO2
бензойная
кислота
3-нитробензойная
кислота
48.
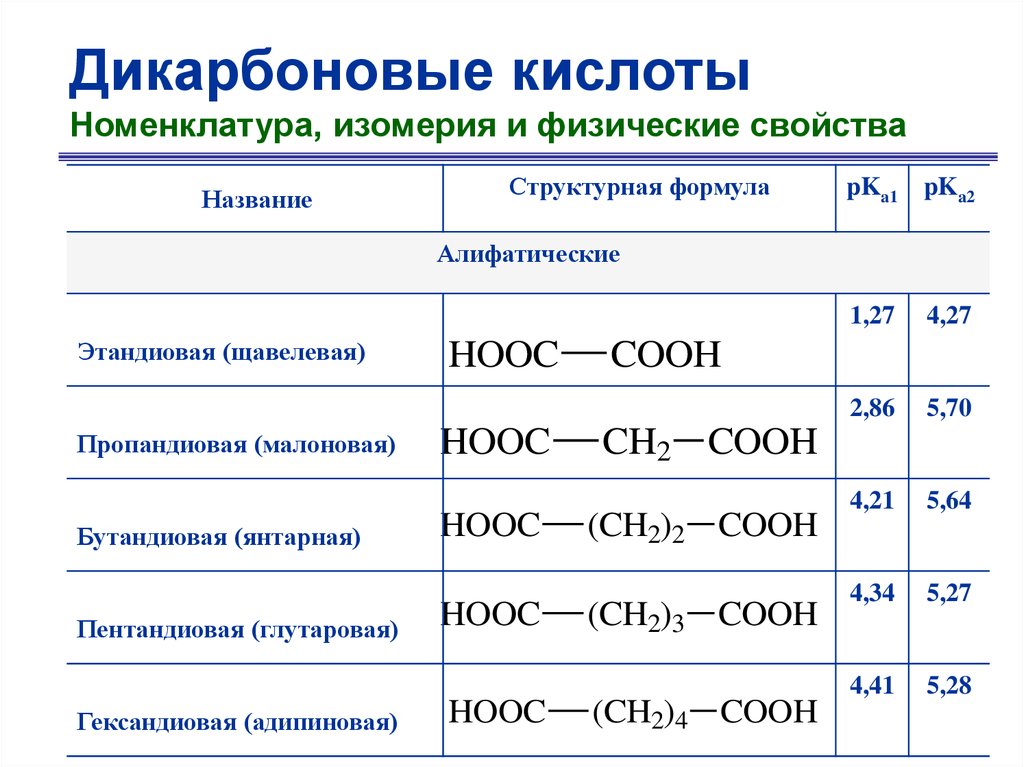
Дикарбоновые кислотыНоменклатура, изомерия и физические свойства
Название
Структурная формула
pKa1 pKa2
Алифатические
Этандиовая (щавелевая)
Пропандиовая (малоновая)
Бутандиовая (янтарная)
Пентандиовая (глутаровая)
Гександиовая (адипиновая)
HOOC
HOOC
HOOC
HOOC
HOOC
1,27
4,27
2,86
5,70
4,21
5,64
4,34
5,27
4,41
5,28
COOH
CH2 COOH
(CH2)2 COOH
(CH2)3 COOH
(CH2)4 COOH
49.
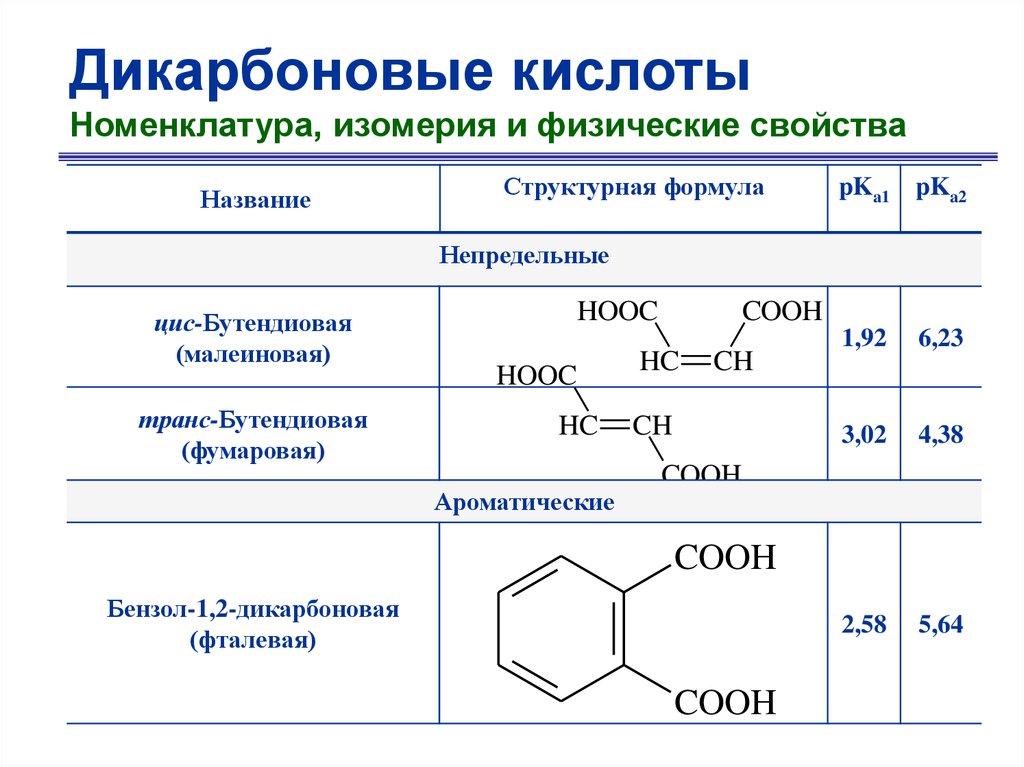
Дикарбоновые кислотыНоменклатура, изомерия и физические свойства
Название
Структурная формула
pKa1 pKa2
Непредельные
цис-Бутендиовая
(малеиновая)
транс-Бутендиовая
(фумаровая)
HOOC
HOOC
HC
Ароматические
COOH
HC
CH
CH
1,92
6,23
3,02
4,38
2,58
5,64
COOH
COOH
Бензол-1,2-дикарбоновая
(фталевая)
COOH
50.
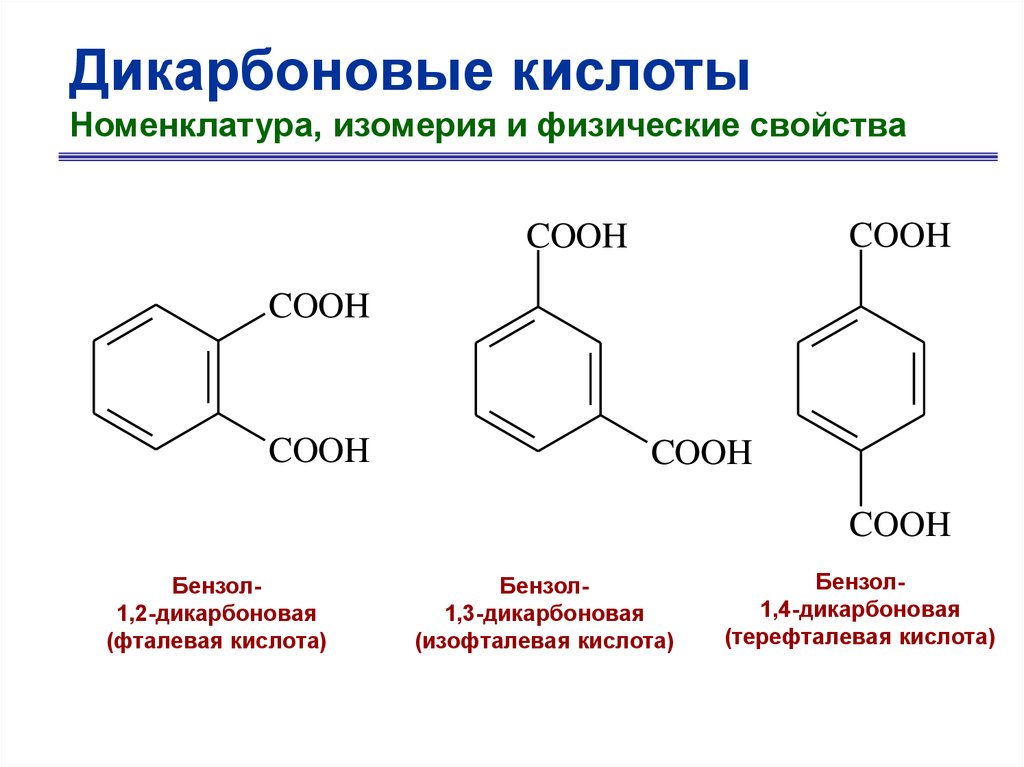
Дикарбоновые кислотыНоменклатура, изомерия и физические свойства
COOH
COOH
COOH
COOH
COOH
COOH
Бензол1,2-дикарбоновая
(фталевая кислота)
Бензол1,3-дикарбоновая
(изофталевая кислота)
Бензол1,4-дикарбоновая
(терефталевая кислота)
51.
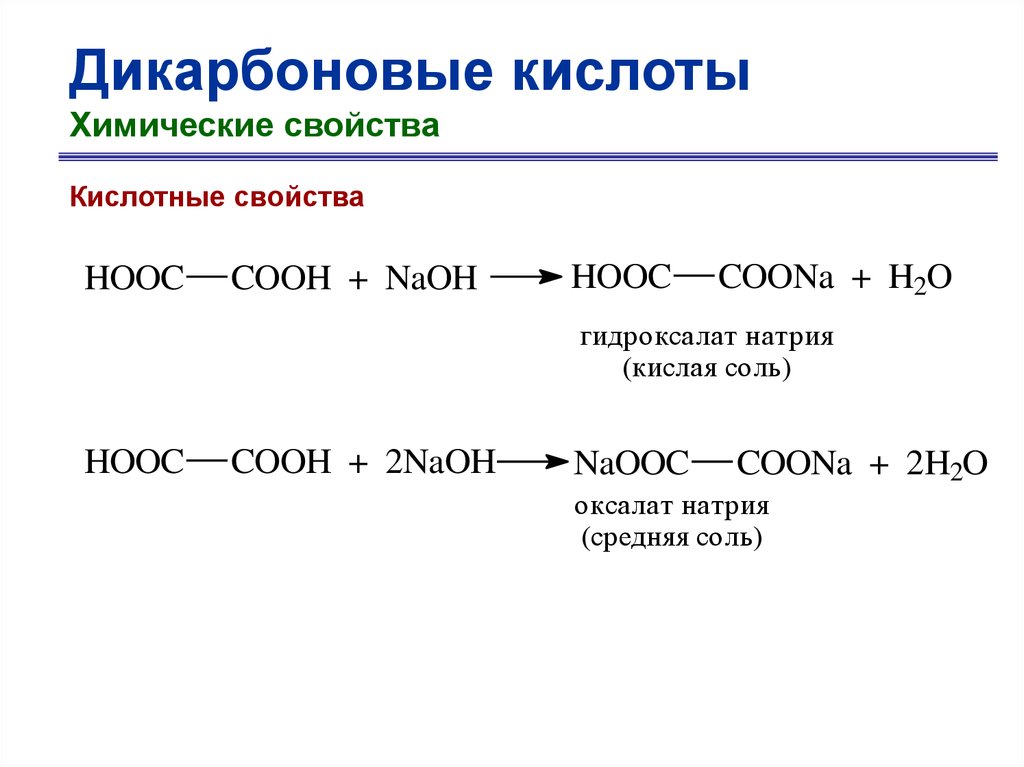
Дикарбоновые кислотыХимические свойства
Кислотные свойства
O
O
HOOC
C
OH
щавелевая кислота
-H
+
HOOC
C
-
O
гидроксалат-ион
52.
Дикарбоновые кислотыХимические свойства
Кислотные свойства
HOOC
COOH + NaOH
HOOC
COONa + H2O
гидроксалат натрия
(кислая соль)
HOOC
COOH + 2NaOH
NaOOC
COONa + 2H2O
оксалат натрия
(средняя соль)
53.
Дикарбоновые кислотыХимические свойства
Реакции нуклеофильного замещения
O
C2H5OH
-H2O
O
C
C
HO
OC2H5
этилгидроксалат
HOOC
COOH
O
2C2H5OH
-2H2O
O
C
C2H5O
C
OC2H5
диэтилгидроксалат
54.
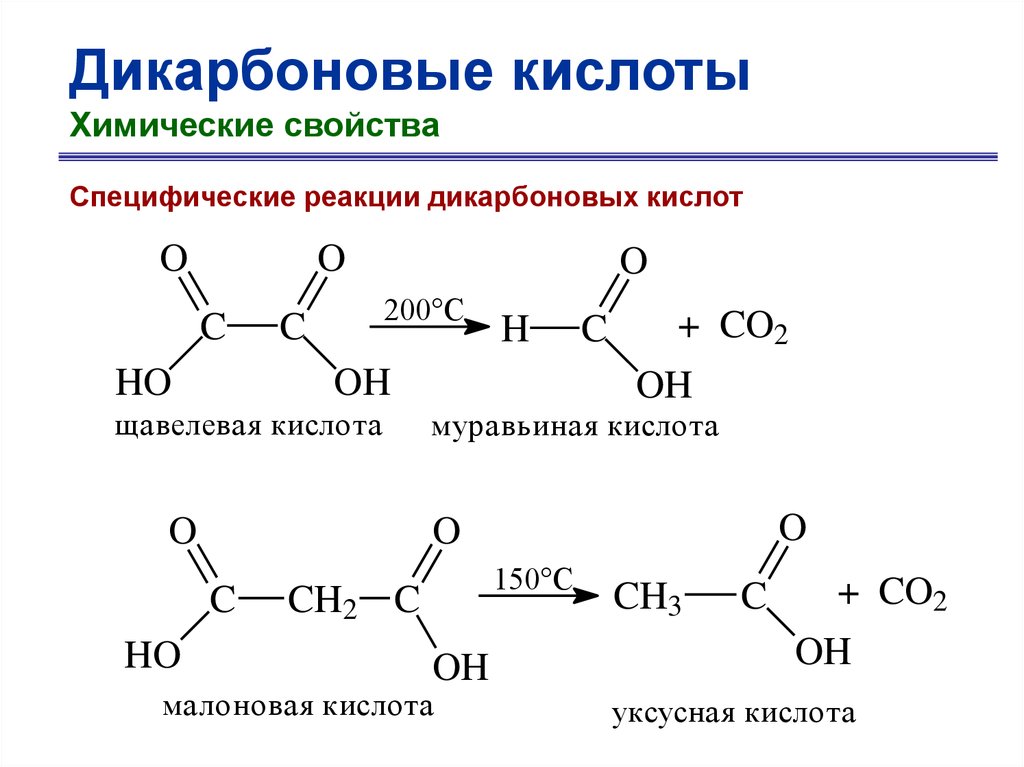
Дикарбоновые кислотыХимические свойства
Специфические реакции дикарбоновых кислот
O
O
C
HO
O
200°С
C
OH
щавелевая кислота
O
C
+ CO2
OH
муравьиная кислота
O
O
C
HO
H
150°С
CH2 C
OH
малоновая кислота
CH3
C
+ CO2
OH
уксусная кислота
55.
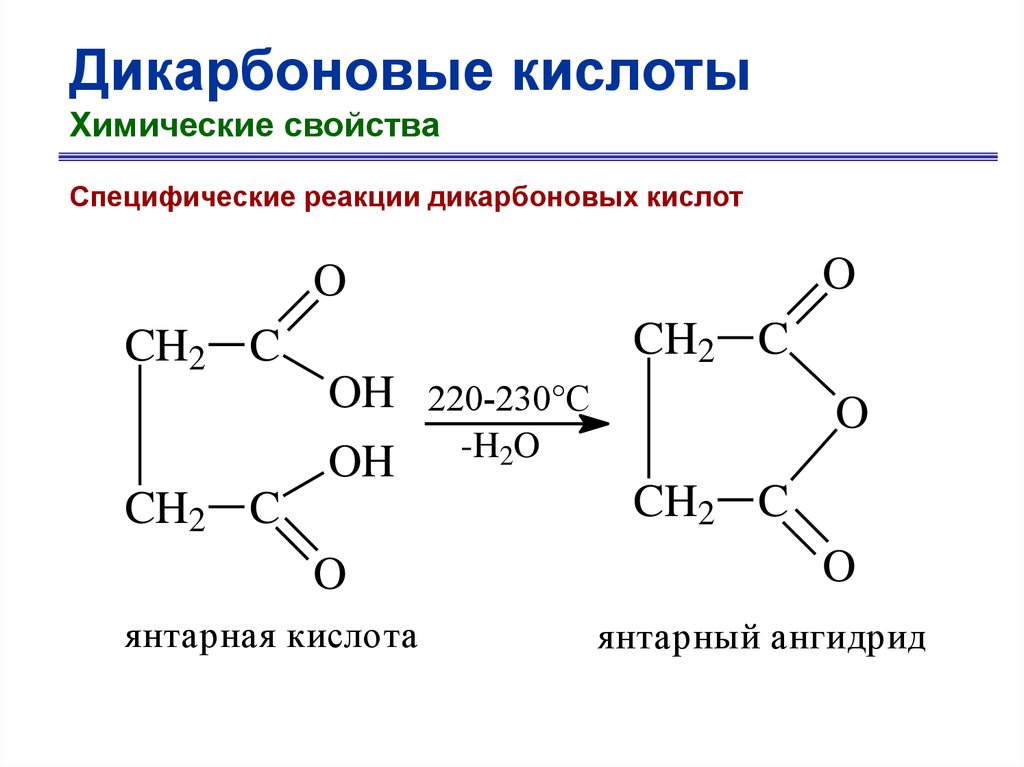
Дикарбоновые кислотыХимические свойства
Специфические реакции дикарбоновых кислот
O
O
CH2 C
CH2 C
OH
OH
CH2 C
O
янтарная кислота
220-230°C
-H2O
O
CH2 C
O
янтарный ангидрид
56.
ГидроксикислотыКлассификация
Гидроксикислоты содержат в молекуле
одновременно карбоксильную и гидроксильную
группы
В зависимости от природы углеводородного радикала
гидроксикислоты могут быть алифатическими и
ароматическими (фенолокислоты).
57.
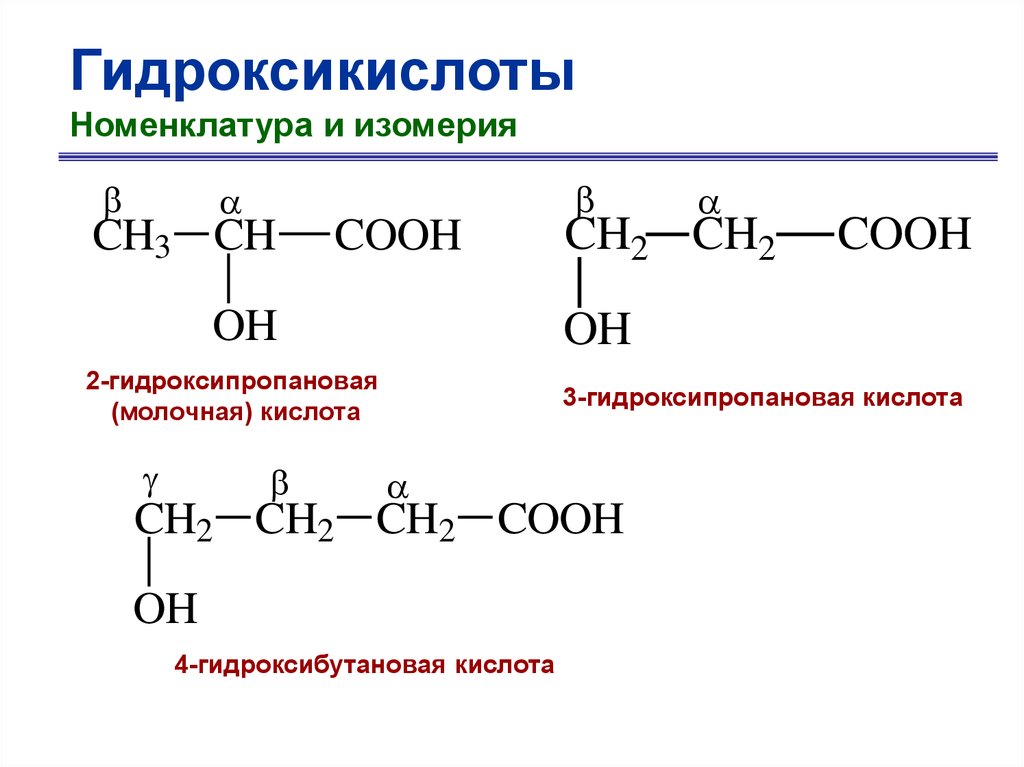
ГидроксикислотыНоменклатура и изомерия
CH3 CH
COOH
OH
CH2 CH2
COOH
OH
2-гидроксипропановая
(молочная) кислота
3-гидроксипропановая кислота
CH2 CH2 CH2 COOH
OH
4-гидроксибутановая кислота
58.
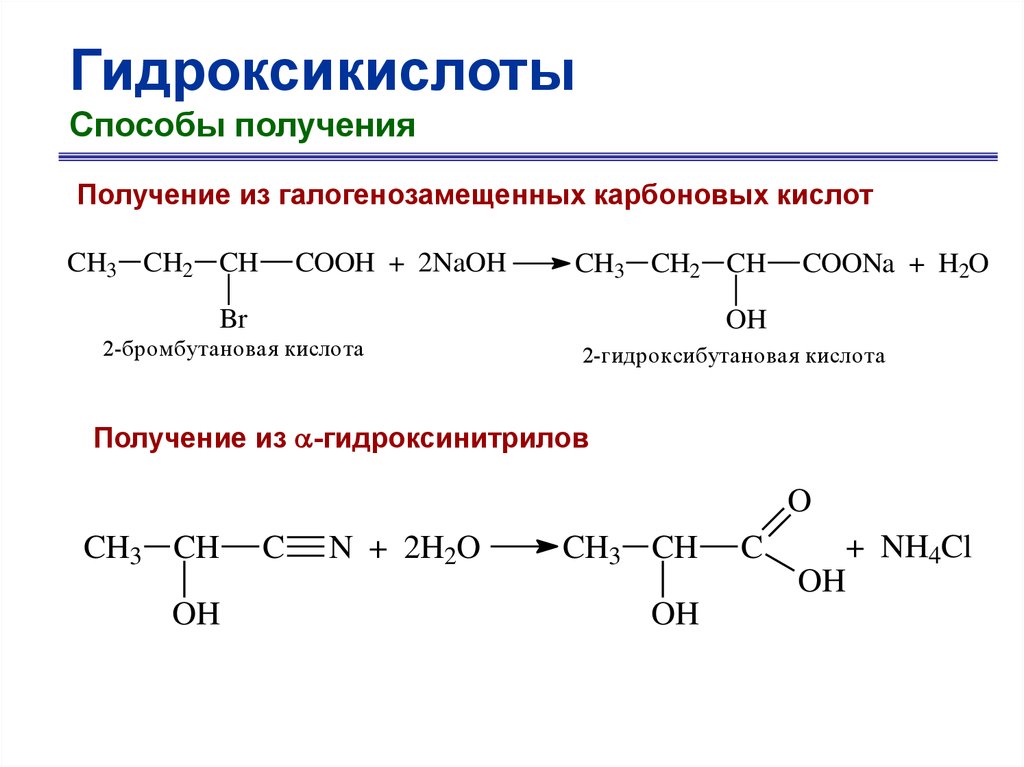
ГидроксикислотыСпособы получения
Получение из галогенозамещенных карбоновых кислот
CH3 CH2 CH
COOH + 2NaOH
CH3 CH2 CH
Br
COONa + H2O
OH
2-бромбутановая кислота
2-гидроксибутановая кислота
Получение из -гидроксинитрилов
O
CH3 CH
OH
C
N + 2H2O
CH3 CH
OH
+ NH4Cl
C
OH
59.
ГидроксикислотыХимические свойства
Взаимодействие со щелочами
CH3 CH CH2
COOH + NaOH
CH3 CH CH2
OH
COONa + H2O
OH
3-гидроксибутаноат
натрия
3-гидроксибутановая
кислота
Взаимодействие со спиртами
O
CH3 CH
OH
C
+ CH3OH
OH
H2SO4
O
CH3 CH
OH
C
+ H2O
OCH3
60.
ГидроксикислотыХимические свойства
Взаимодействие с галогенидами фосфора
O
CH2 CH2 C
OH
O
+ 2PCl5
OH
3-гидроксипропановая
кислота
CH2 CH2 C
Cl
+ 2POCl3 + 2HCl
Cl
хлорангидрид
3-хлорпропановой
кислоты
61.
ГидроксикислотыХимические свойства
Ацилирование
O
CH2 COOH + CH3 C
OH
гидроксиуксусная
кислота
CH3 C
O
CH2COOH + HCl
Cl
O
ацетилхлорид
О-ацетилгликолевая кислота
62.
ГидроксикислотыХимические свойства
Взаимодействие с галогенводородами
CH3CHCOOH + HBr
OH
2-гидроксипропановая
кислота
CH3CHCOOH + H2O
Br
2-бромпропановая
кислота
63.
ГидроксикислотыХимические свойства
Окисление
H
HO
C
O
C
OH
H
[O]
O
O
C
H
C
OH
64.
ГидроксикислотыХимические свойства
Специфические свойства
O
C
O
H
OH
CH3 CH
O
+
O
H
C
CH CH3
HO
C
O
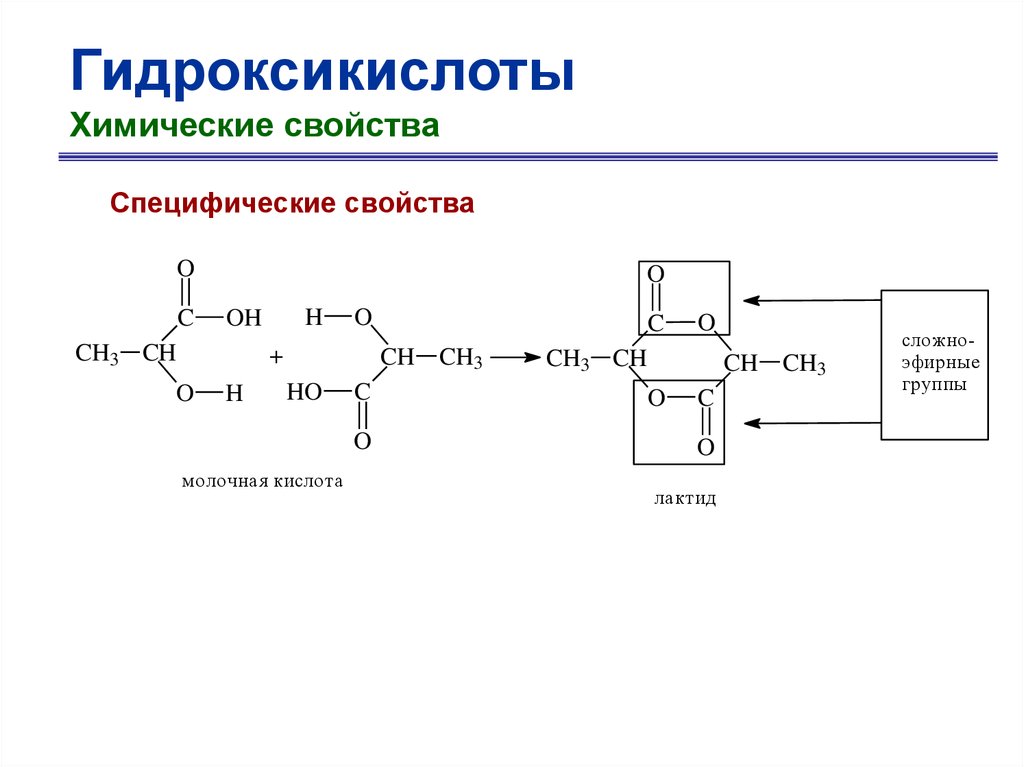
молочная кислота
O
CH3 CH
CH CH3
O
C
O
лактид
сложноэфирные
группы
65.
ГидроксикислотыХимические свойства
Специфические свойства
O
CH3 CH
OH
CH
C
H
H
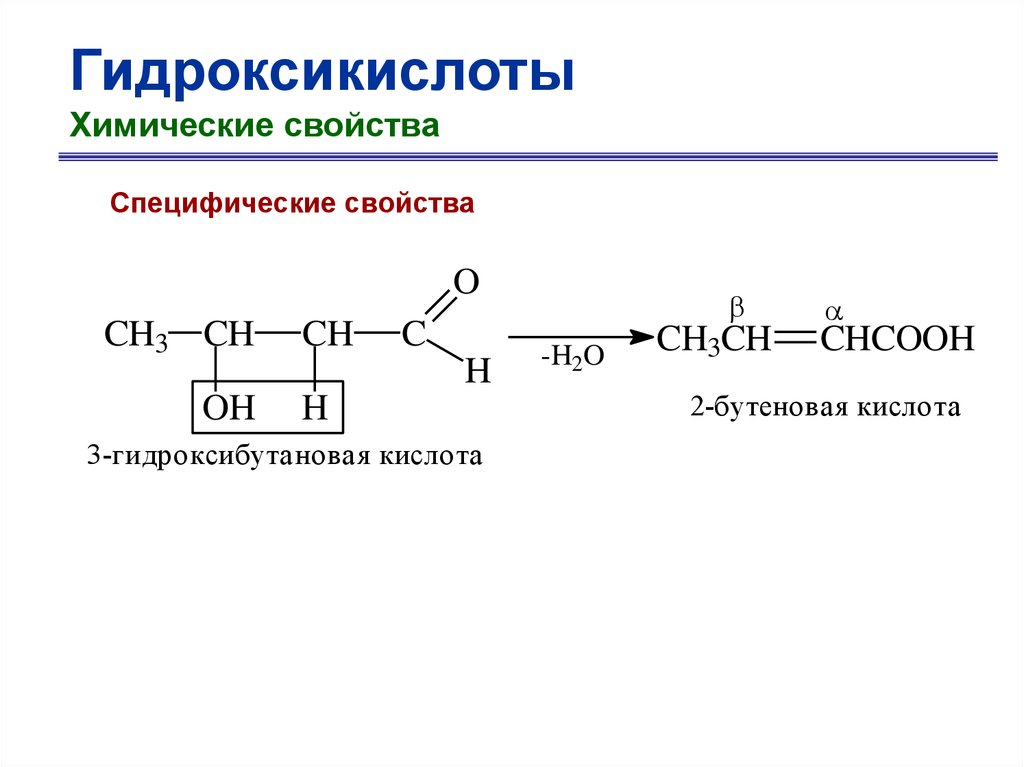
3-гидроксибутановая кислота
-H2O
CH3CH
CHCOOH
2-бутеновая кислота
66.
ГидроксикислотыХимические свойства
Специфические свойства
+
CH2
O
O
C
H2C
CH2 O
CH2
OH
H
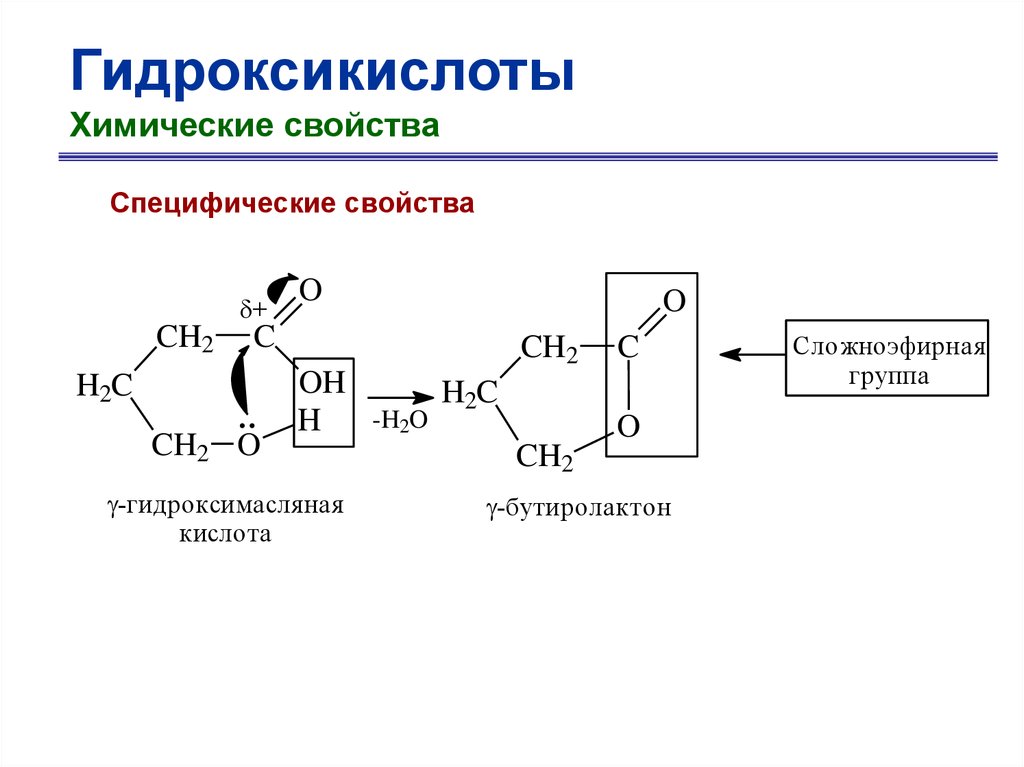
-гидроксимасляная
кислота
-H2O
C
H2C
O
CH2
-бутиролактон
Сложноэфирная
группа
67.
ГидроксикислотыХимические свойства
Специфические свойства
H
H
H
HH
C
O
C
C
H
H
H
+
C
H
C
COOH
H
зигзагообразная конформация
H
H
H
C
H
O
+
OH
C
O
клешевидная
конформация
68.
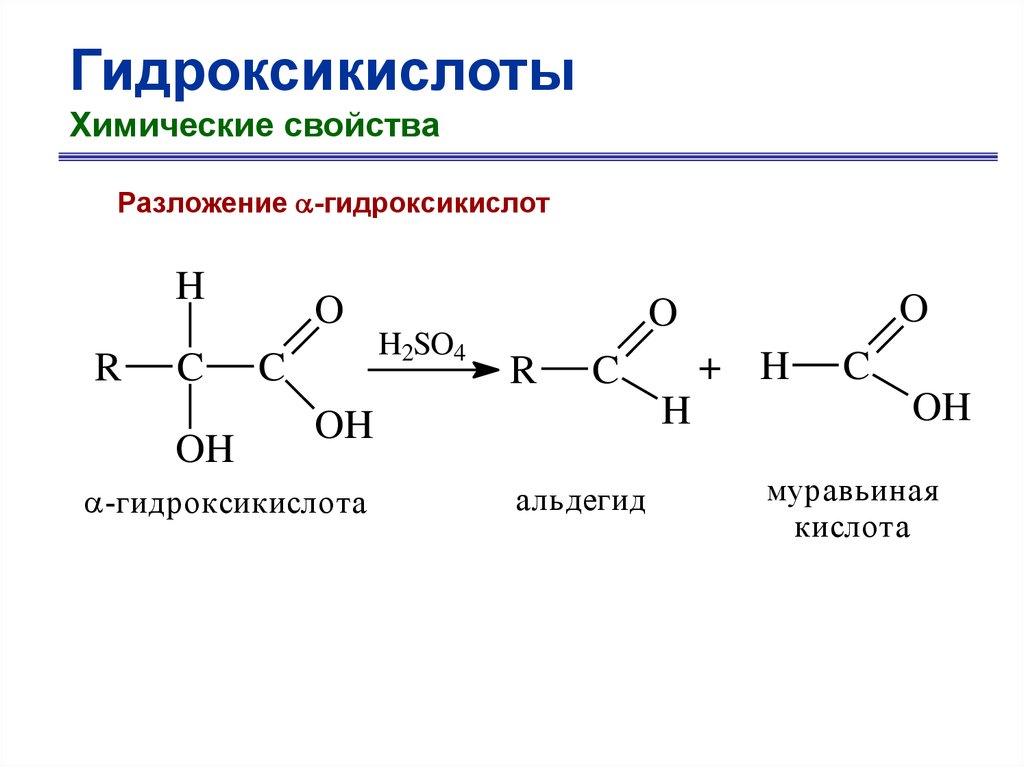
ГидроксикислотыХимические свойства
Разложение -гидроксикислот
H
R
C
OH
O
H2SO4
C
R
+ H
C
H
OH
-гидроксикислота
O
O
альдегид
C
OH
муравьиная
кислота
69.
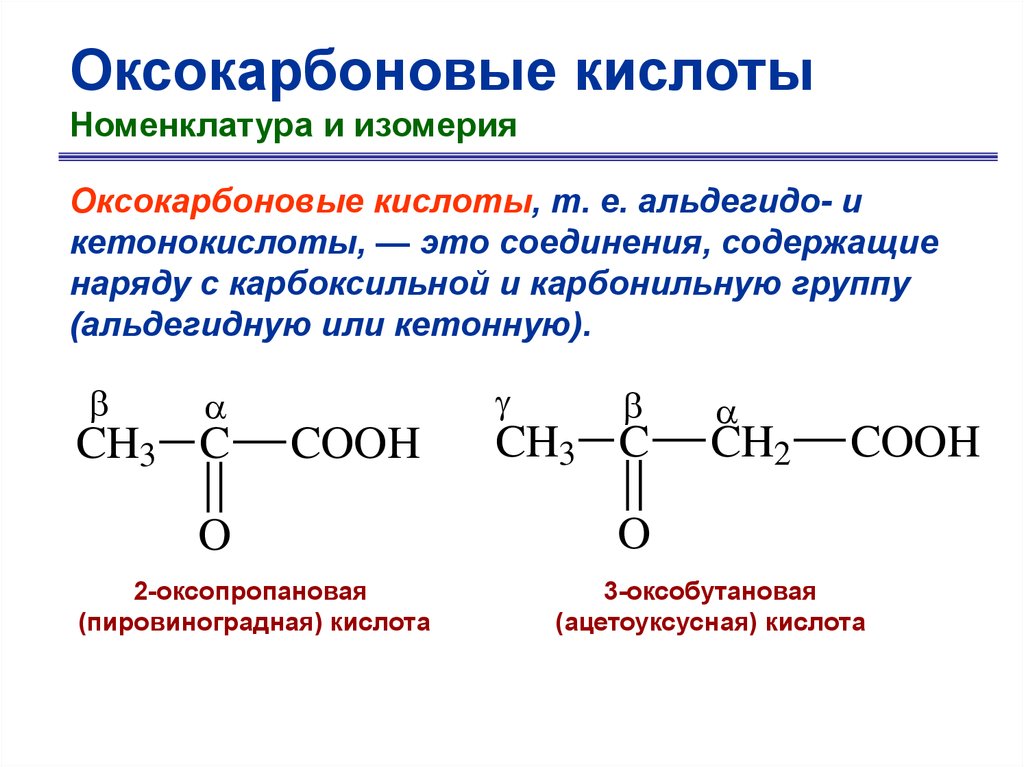
Оксокарбоновые кислотыНоменклатура и изомерия
Оксокарбоновые кислоты, т. е. альдегидо- и
кетонокислоты, — это соединения, содержащие
наряду с карбоксильной и карбонильную группу
(альдегидную или кетонную).
CH3 C
COOH
O
2-оксопропановая
(пировиноградная) кислота
CH3 C
CH2
COOH
O
3-оксобутановая
(ацетоуксусная) кислота
70.
Оксокарбоновые кислотыПолучение и химические свойства
CH3 CH
OH
COOH
молочная кислота
[O]
CH3 C
O
COOH
пировиноградная
кислота
71.
Оксокарбоновые кислотыПолучение и химические свойства
O
NaOH
CH3 C
O
CH3 C
O
C
C
ONa
+ H2O
O
пируват натрия
OH
O
+
C2H5OH, H
CH3 C
O
C
этилпируват
OC2H5
+ H2O
72.
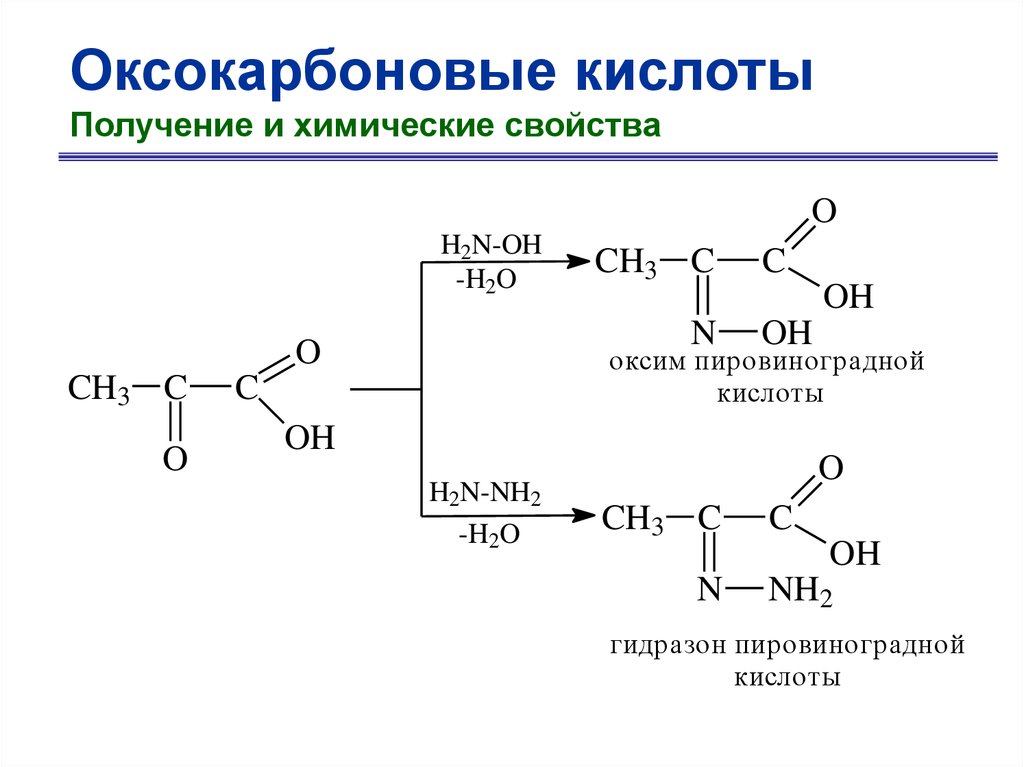
Оксокарбоновые кислотыПолучение и химические свойства
O
H2N-OH
-H2O
N
O
CH3 C
O
CH3 C
C
OH
OH
оксим пировиноградной
кислоты
C
OH
H2N-NH2
-H2O
O
CH3 C
N
C
OH
NH2
гидразон пировиноградной
кислоты
73.
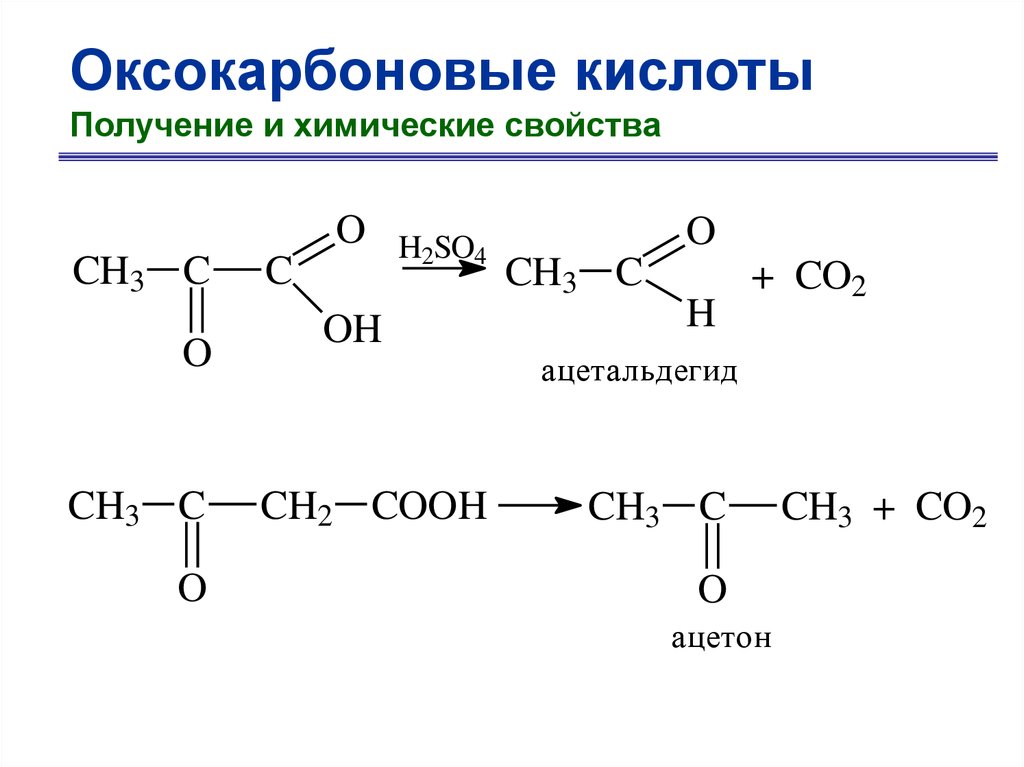
Оксокарбоновые кислотыПолучение и химические свойства
O
CH3 C
O
CH3 C
O
C
H2SO4
OH
O
CH3 C
H
+ CO2
ацетальдегид
CH2 COOH
CH3 C
O
ацетон
CH3 + CO2
74.
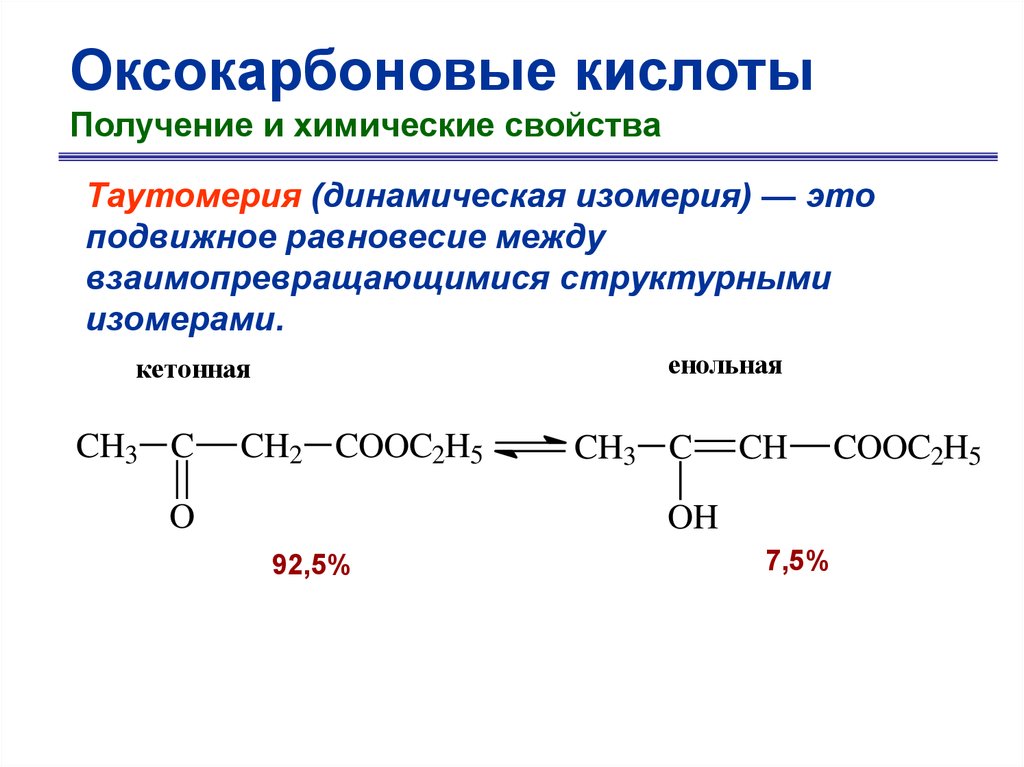
Оксокарбоновые кислотыПолучение и химические свойства
Таутомерия (динамическая изомерия) — это
подвижное равновесие между
взаимопревращающимися структурными
изомерами.
енольная
кетонная
CH3 C
CH2 COOC2H5
O
CH3 C
CH
OH
92,5%
7,5%
COOC2H5
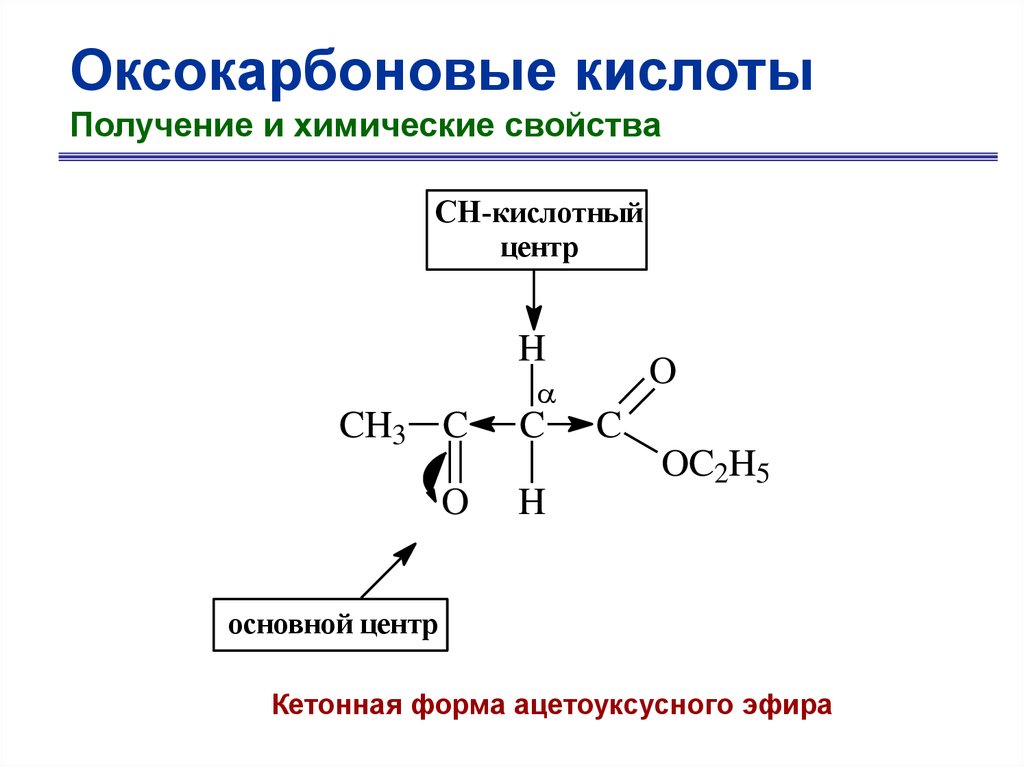
75.
Оксокарбоновые кислотыПолучение и химические свойства
CH-кислотный
центр
H
O
CH3 C
C
O
H
C
OC2H5
основной центр
Кетонная форма ацетоуксусного эфира
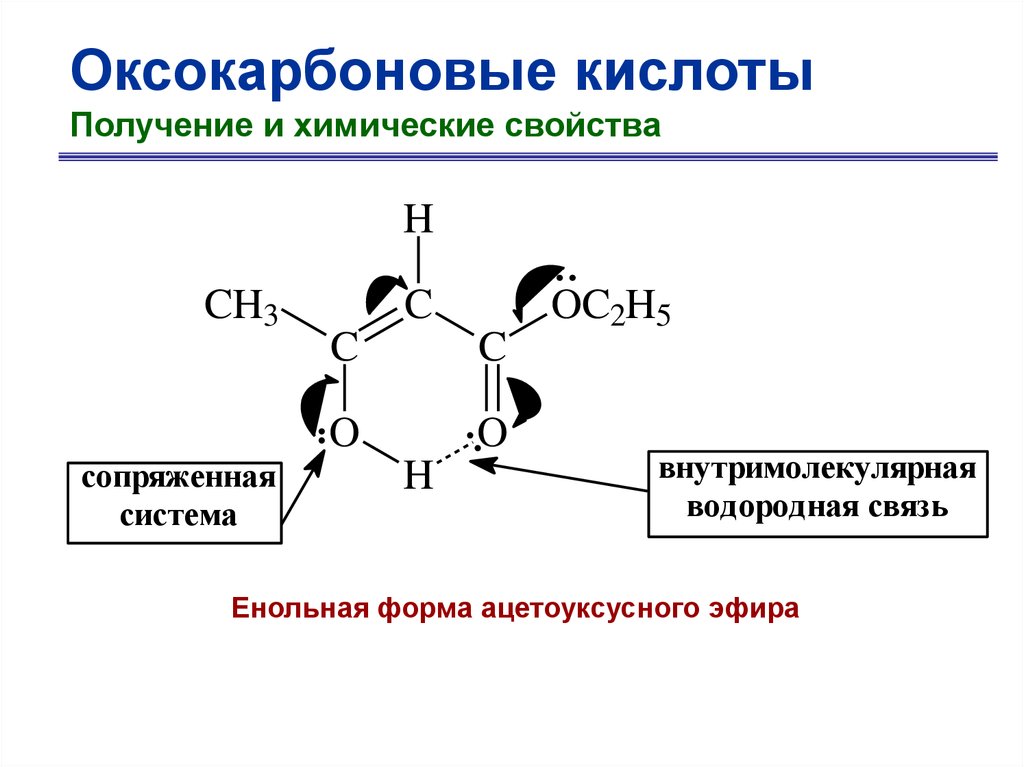
76.
Оксокарбоновые кислотыПолучение и химические свойства
H
CH3
сопряженная
система
C
C
C
O
O
H
OC2H5
внутримолекулярная
водородная связь
Енольная форма ацетоуксусного эфира
77.
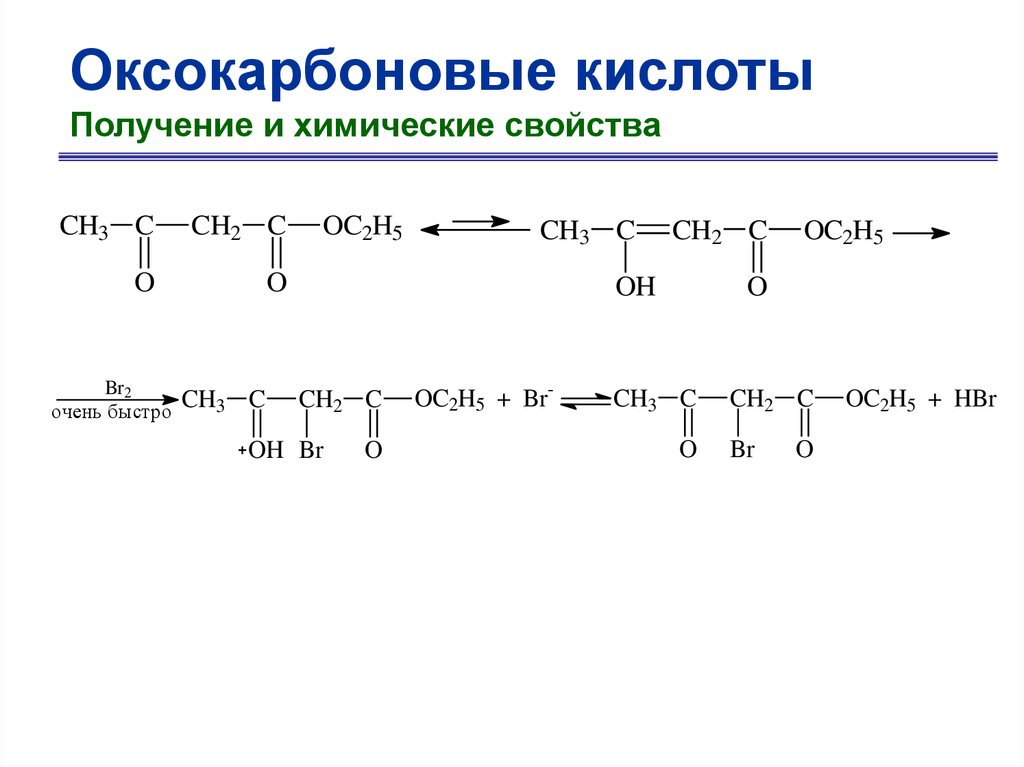
Оксокарбоновые кислотыПолучение и химические свойства
CH3 C
CH2 C
O
O
Br2
очень быстро
CH3 C
OC2H5
CH3 C
CH2 C
OH
CH2 C
OH Br
O
OC2H5 + Br-
OC2H5
O
CH3 C
O
CH2 C
Br
O
OC2H5 + HBr
78.
Оксокарбоновые кислотыПолучение и химические свойства
Реакция Кляйзена
2CH3 COOC2H5
C2H5ONa
CH3 C
CH2 COOC2H5 + C2H5OH
O
этилацетат
ацетоуксусный эфир (75%)
Людвиг Кляйзен (1851-1930)



































 chemistry
chemistry








