Similar presentations:
Общие свойства растворов
1.
ОБЩИЕ СВОЙСТВА РАСТВОРОВ2.
Основные понятияДисперсная система – смесь веществ.
Дисперсные системы
состоят из дисперсной фазы и дисперсионной среды и
классифицируются, например, по размерам частиц
дисперсной фазы.
3.
Классификация дисперсных системДисперсная система
Взвеси
(суспензии, эмульсии)
Коллоидные
системы
Размер частиц ≥1000 нм
Размер частиц от 1 до 200 нм
Истинные
растворы
Размер частиц ˂ 1 нм
4.
Основные понятияРаствором называют гомогенную систему переменного
состава, состоящую из нескольких компонентов
5.
Основные понятияКомпоненты раствора: растворитель и растворяемое вещество
Растворитель – это компонент
раствора, агрегатное состояние
которого не изменяется при
образовании раствора.
6.
Основные понятияРастворимость – это способность вещества растворяться
в том или ином растворителе
Мера растворимости вещества характеризуется
коэффициентом растворимости
7.
Основные понятияКоэффициент растворимости К – это
масса
растворенного вещества (г) в насыщенном растворе,
содержащем 100 г растворителя.
К˂10-3 г/100г воды
«Н» нерастворимое
К=10-3 г/100г воды
«М» малорастворимое
К˃10-3 г/100г воды
«Р» растворимое
Если в таблице растворимости стоит прочерк, то такие
вещества в растворе не существуют.
8.
Растворимость зависит:от природы растворенного вещества и растворителя;
от температуры;
от давления;
от присутствия третьих компонентов.
9.
Влияние природы компонентоврастворимость определяется принципом: подобное растворяется в
подобном.
Влияние температуры
растворимость зависит от теплового эффекта растворения и
определяется принципом Ле Шателье.
Влияние давления
существенно только в том случае, если при растворении происходит
значительное изменение объема системы, что наблюдается при
растворении газов в жидкостях.
10.
Основные понятияРастворение – физико-химический процесс
Физическая составляющая – вещество теряет свою
структуру, разрушается (диффузия, перемешивание).
Химическая составляющая – растворяемое вещество
взаимодействует с растворителем с образованием
сольватированных (гидратированных, если процесс
растворения идет в воде) ионов.
11.
12.
Теплота растворенияТеплотой или энтальпией растворения называется
количество теплоты, которое выделяется или поглощается
при растворении 1 моля вещества.
∆Нраств.;
кДж/моль
13.
Процесс растворения складывается из:1. Разрушения структуры растворяемого
вещества
(разрушение кристаллической решетки)
∆Нфп ˃ 0
тепло затрачивается,
эндотермический процесс
14.
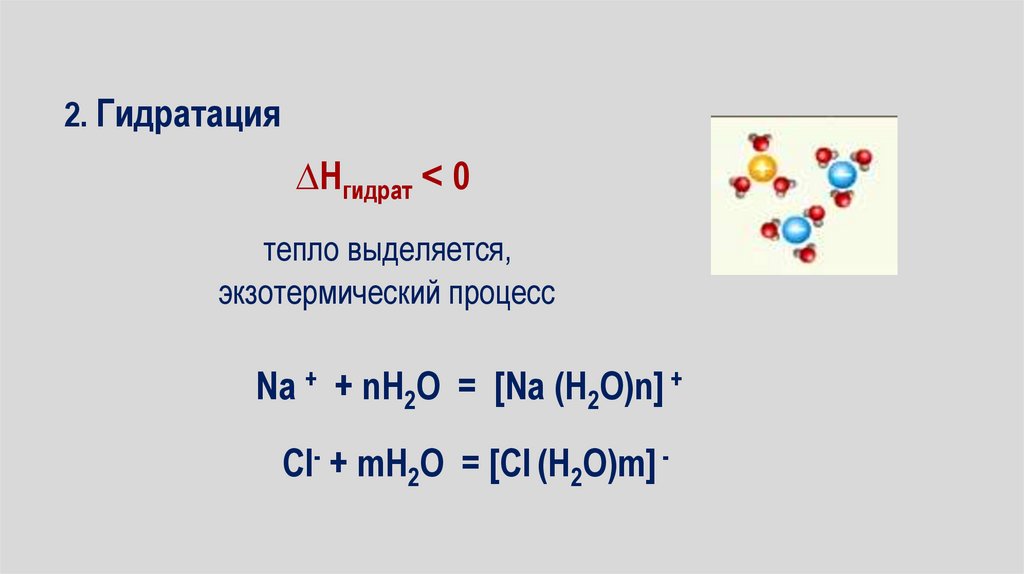
2. Гидратация∆Нгидрат ˂ 0
тепло выделяется,
экзотермический процесс
Na + + nH2O = [Na (H2O)n] +
Cl- + mH2O = [Cl (H2O)m] -
15.
Энтальпия растворения∆Нраств = ∆Нфп + ∆Нгидр
∆Нфп ˃ ∆Нгидр
∆Нфп ˂ ∆Нгидр
Процесс
эндотермический
Процесс
экзотермический
16.
Энтропия растворения∆Sраств
Дж/моль К
Энтропия растворения твердых и жидких
веществ всегда больше нуля ∆S ˃ 0
Энтропия растворения газов ∆S ˂ 0
17.
Энергия Гиббса процесса растворения∆Gраств = ∆ Hраств - T∆Sраств
∆Gраств ˂ 0 - растворение идет самопроизвольно
∆G насыщенного раствора равно нулю
18.
РастворыКонцентрированные – содержат
большое количество растворенного
вещества
по
сравнению
с
растворителем
Разбавленные – содержат небольшое
количество растворенного вещества по
сравнению с растворителем
19.
Основные понятияНасыщенным
называют раствор, который
находится в равновесии с избытком растворяемого
вещества.
Насыщенный
раствор
имеет
максимально возможную в данных условиях
концентрацию.
20.
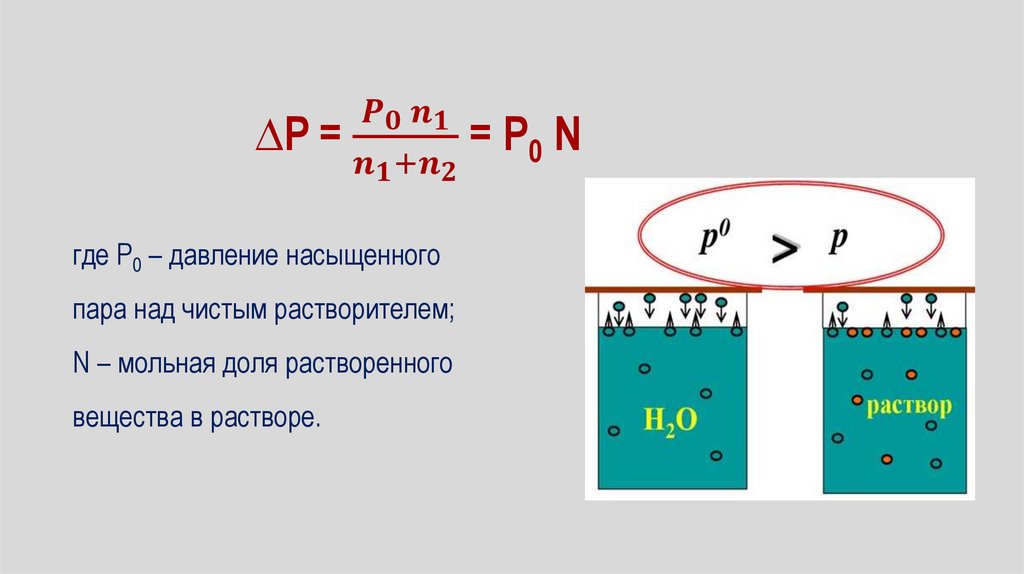
Способы выражения концентрации растворовКонцентрация показывает в каком соотношении взяты
растворитель и растворенное вещество .
21.
Массовая доляЭто число единиц массы вещества, содержащегося в ста
единицах массы раствора
Обозначение - ω
Размерность – мас. доля, %
ω =


































 chemistry
chemistry








