Similar presentations:
7 класс_ПР_Образование осадков
1.
Практическая работа .Признаки химических реакций. Образование
и растворение осадка
2.
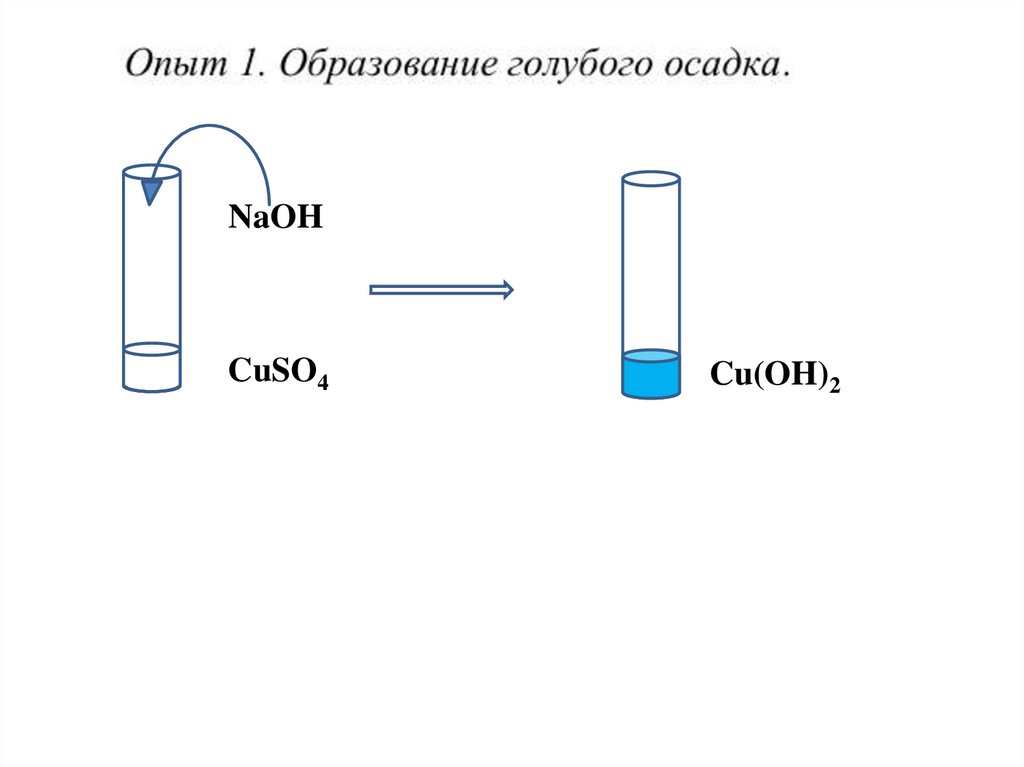
NaOHCuSO4
Cu(OH)2
3.
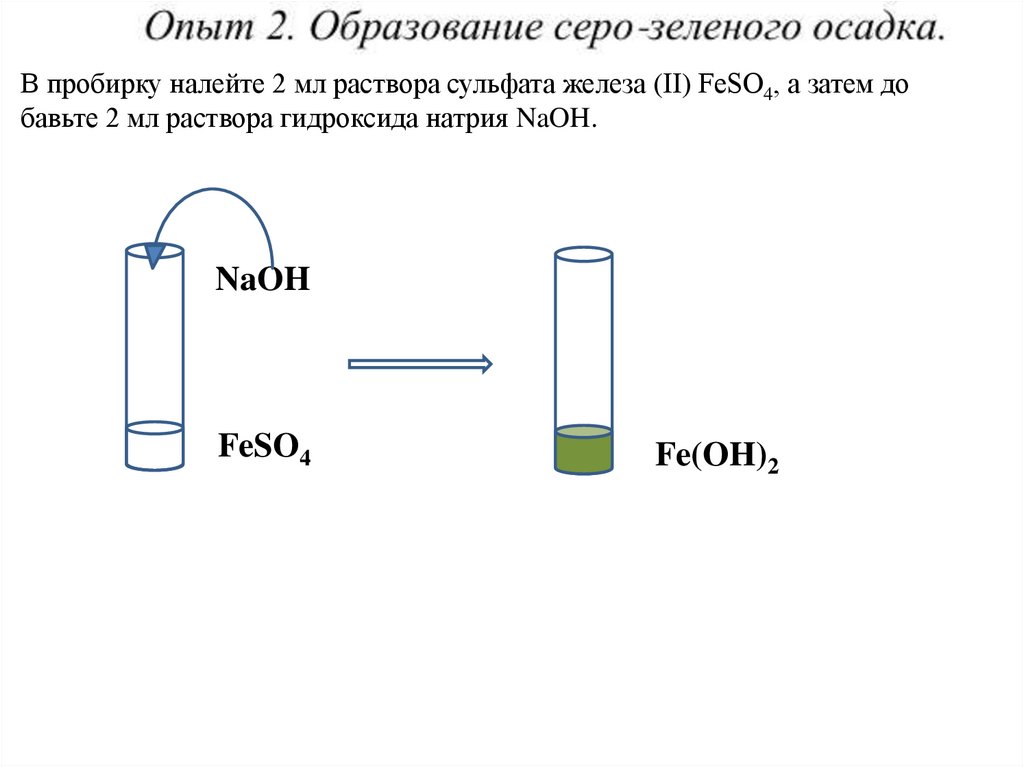
В пробирку налейте 2 мл раствора сульфата железа (II) FeSO4, а затем добавьте 2 мл раствора гидроксида натрия NaOH.
NaOH
FeSO4
Fe(OH)2
4.
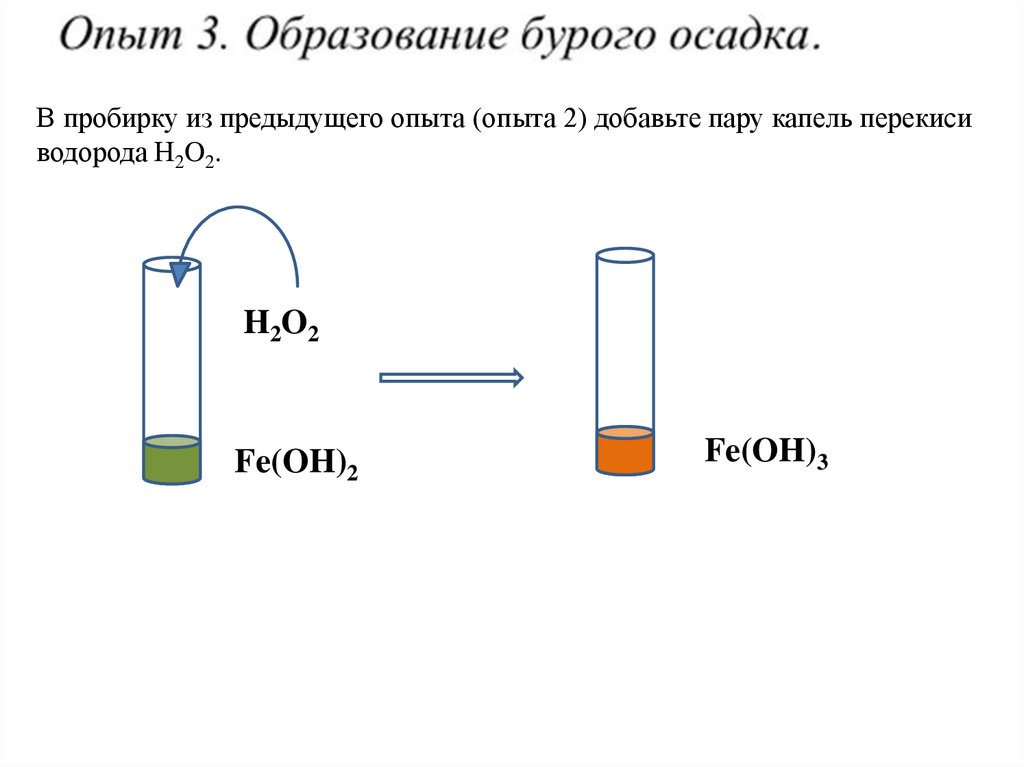
В пробирку из предыдущего опыта (опыта 2) добавьте пару капель перекисиводорода H2O2.
H2O2
Fe(OH)2
Fe(OH)3
5.
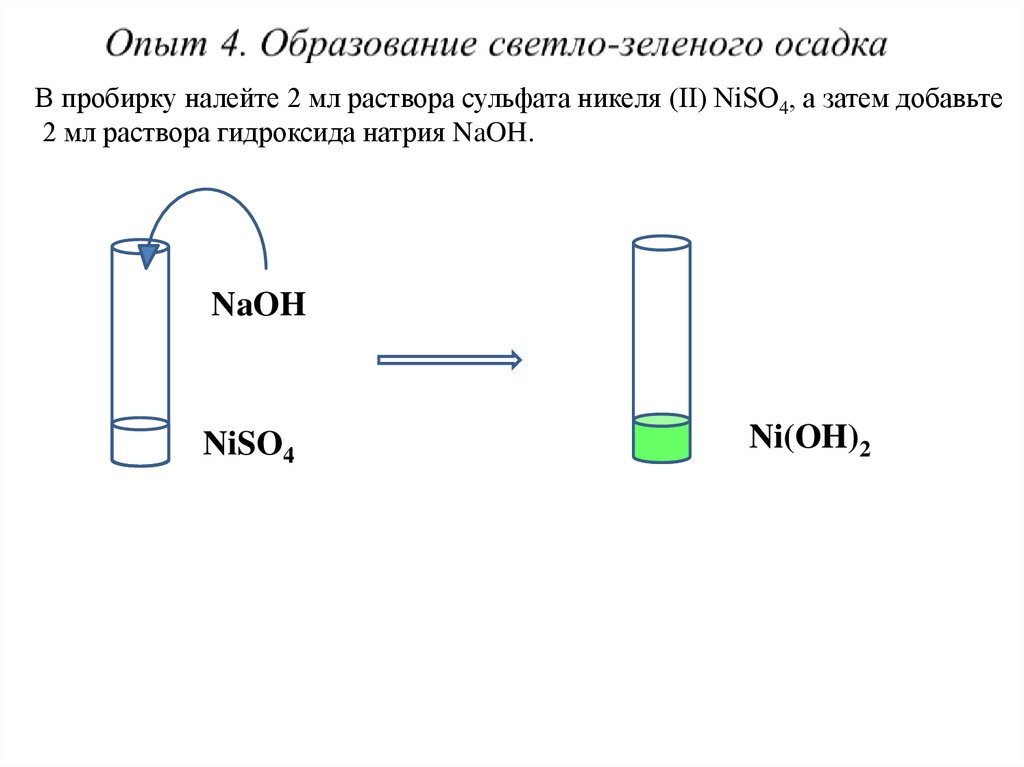
В пробирку налейте 2 мл раствора сульфата никеля (II) NiSO4, а затем добавьте2 мл раствора гидроксида натрия NaOH.
NaOH
NiSO4
Ni(OH)2
6.
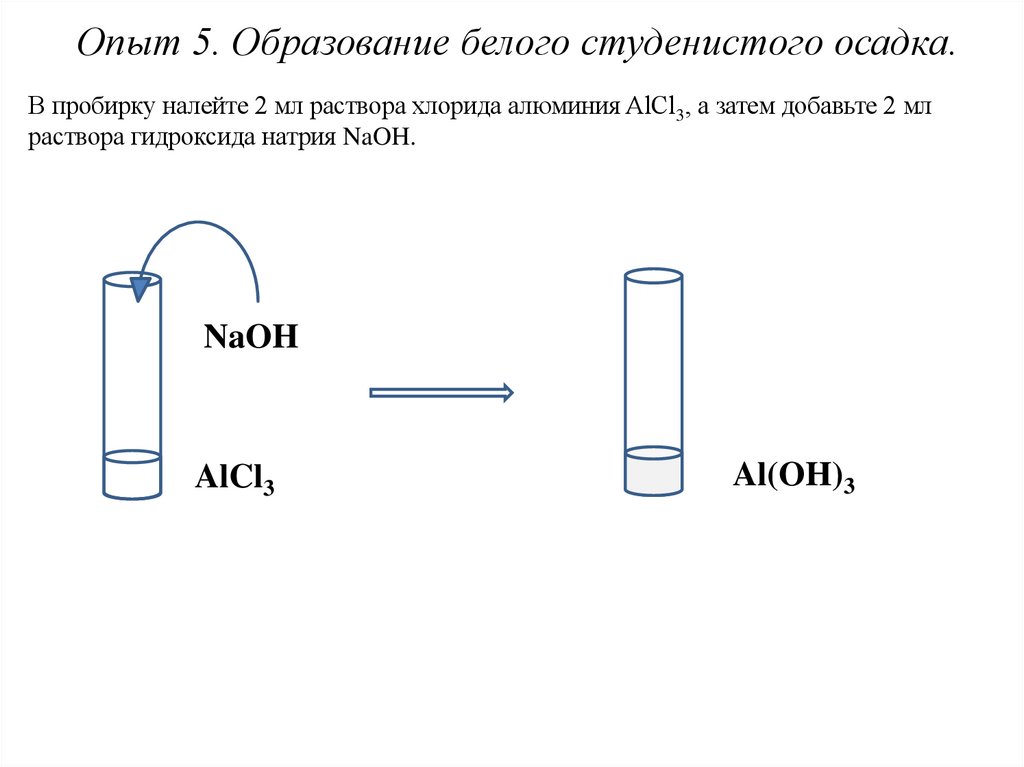
Опыт 5. Образование белого студенистого осадка.В пробирку налейте 2 мл раствора хлорида алюминия AlCl3, а затем добавьте 2 мл
раствора гидроксида натрия NaOH.
NaOH
AlCl3
Al(OH)3
7.
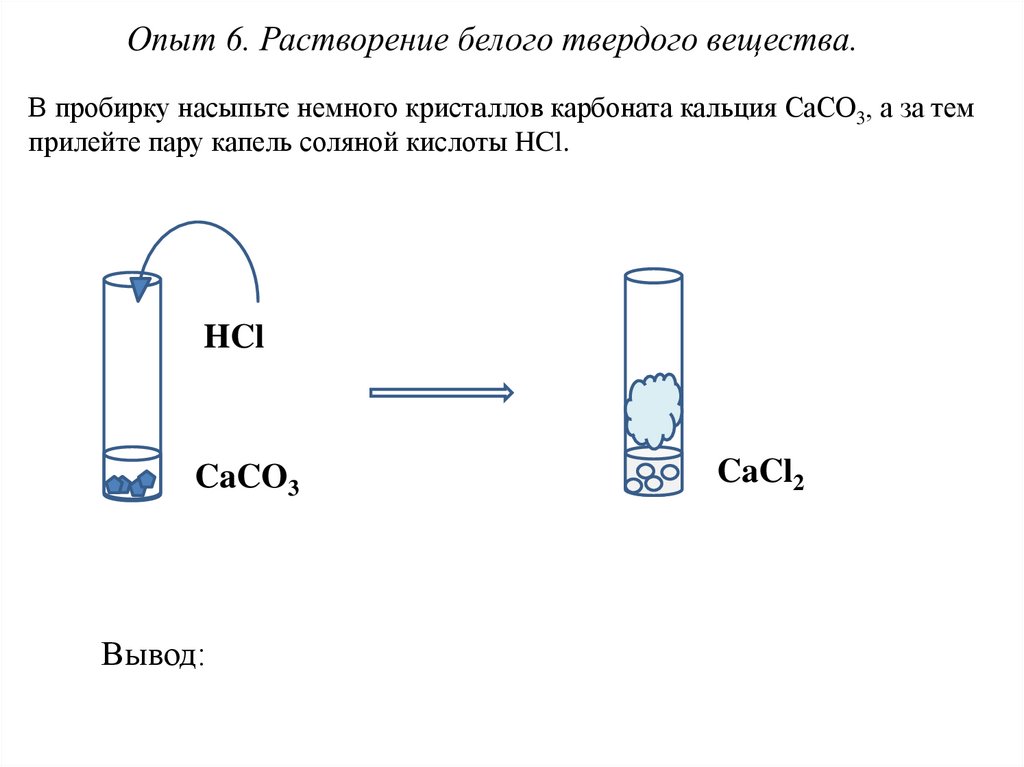
В пробирку насыпьте немного кристаллов карбоната кальция CaCO3, а за темприлейте пару капель соляной кислоты HCl.
HCl
CaCO3
Вывод:
CaCl2

 chemistry
chemistry








