Similar presentations:
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
1. Химия 9 класс
Электролитическая диссоциация кислот, солей и основанийСтепень электролитической диссоциации.
Сильные и слабые электролиты
Преподаватель химии Приходько Альбина Александровна
2. Цели урока:
• Дать определение кислотам, солями основаниям с точки зрения
Теории электролитической диссоциации
• Уметь записывать уравнения ступенчатой
электролитической диссоциации
• понимать понятие степень диссоциации и
определять силу электролитов
3.
ЗАДАНИЕСоставьте возможные уравнения
электролитической диссоциации кислот в
водных растворах.
1) HCl
2) HNO3 3) Н2SiO3
4. Проверим
Возможные уравнения электролитическойдиссоциации кислот в водных растворах.
1) HCl
2) HNO3
3) Н2SiO3
H+ + Cl+
H + NO3
5.
ЗАДАНИЕСоставьте возможные уравнения
электролитической диссоциации
оснований в водных растворах.
1) NaOH 2) KOH 3) Fe(OH)2
6. Проверим
Возможные уравнения электролитическойдиссоциации оснований в водных растворах.
1) NaOH
2) KOH
3) Fe(OH)2
Na+ + OH+
K
+ OH
7.
ЗАДАНИЕСоставьте возможные уравнения
электролитической диссоциации солей в
водных растворах.
1) NaCl 2) KNO3 3) BaSO4
8. Проверим
Возможные уравнения электролитическойдиссоциации солей в водных растворах.
1) NaCl
2) KNO3
3) BaSO4
Na+ + Cl+
K + NO3
9. HBr H+ + Br- H2SO4 2 H+ + SO42-
HBrH2SO4
H+ + Br2 H+ + SO42-
КИСЛОТЫ - электролиты, которые при
диссоциации образуют катионы
водорода и анионы кислотного остатка.
HCl = H+ + ClHNO3 = H+ + NO3-
10.
Лабораторный опыт № 1«Выявление катионов водорода»
В пробирки налейте 1—2 мл раствора
соляной кислоты
В пробирку добавьте несколько капель раствора
лакмуса. По изменению цвета определите
кислотность среды.
https://vk.com/video-62685088_456239097
11.
•Кислотыокрашивают все
индикаторы в
красный цвет
разных оттенков.
Общие характерные
свойства кислот
обусловлены присутствием
катионов водорода Н+
12. Многоосновные кислоты диссоциируют ступенчато
H3PO4 (фосфорная кислота)1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+ + H2PO42) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO423) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
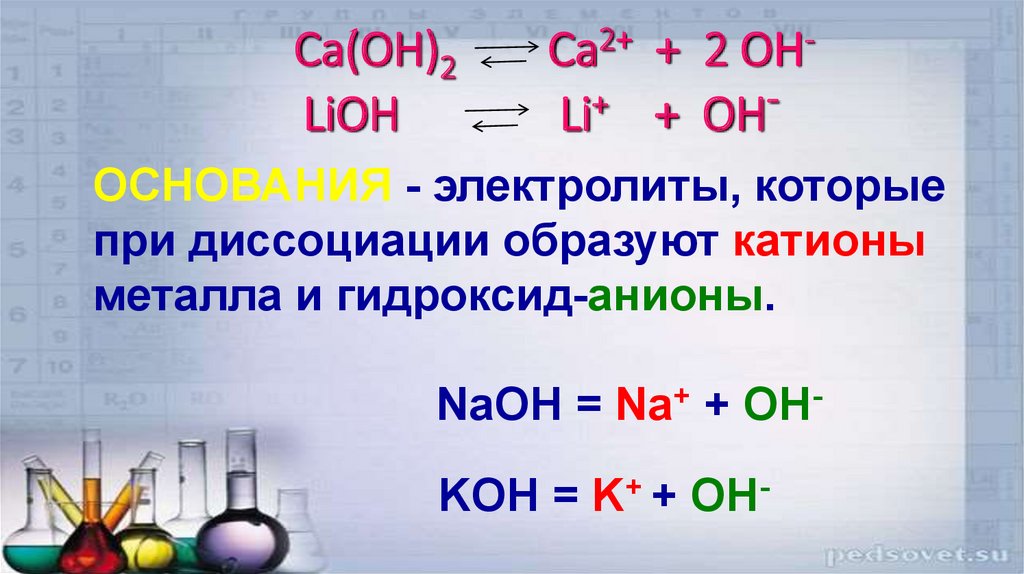
13. Ca(OH)2 Ca2+ + 2 OH- LiOH Li+ + OH-
Ca(OH)2LiOH
Ca2+ + 2 OH+
Li + OH
ОСНОВАНИЯ - электролиты, которые
при диссоциации образуют катионы
металла и гидроксид-анионы.
NaOH = Na+ + OHKOH = K+ + OH-
14.
Лабораторный опыт № 2«Выявление гидроксид анионов»
В пробирки налейте 1—2 мл растворов
гидроксида натрия,
В пробирку добавьте несколько капель раствора
лакмуса. По изменению цвета определите
кислотность среды.
15.
16.
Основания (щёлочи)окрашивают бесцветный
фенолфталеин в
малиновый цвет, а
лакмус и универсальный
индикатор ─ в синий.
Общие свойства
оснований обусловлены
присутствием
гидроксид-ионов ОН
17. Многокислотные основания диссоциируют ступенчато
Многокислотныедиссоциируют
основания
ступенчато
Ba(OH)2 (гидроксид бария)
1) Образование гидроксо-ионов бария
Ba(OH)2 ↔ OH- + BaOH+
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
18. NaCl Na+ + Cl- KNO3 K+ + NO3-
NaClKNO3
Na+ + Cl+
K + NO3
Средние соли - электролиты, которые при
диссоциации образуют катионы металла (или
аммония NH4) и анионы кислотных остатков.
K3PO4 = 3K+ + PO43NH4Cl = NH4+ + Cl-
19.
Лабораторный опыт № 3«Выявление общих свойств у солей»
В пробирки налейте по 1—2 мл растворов
сульфата натрия и хлорида кальция,
В каждую пробирку добавьте несколько капель
раствора лакмуса. Что наблюдаете?
20.
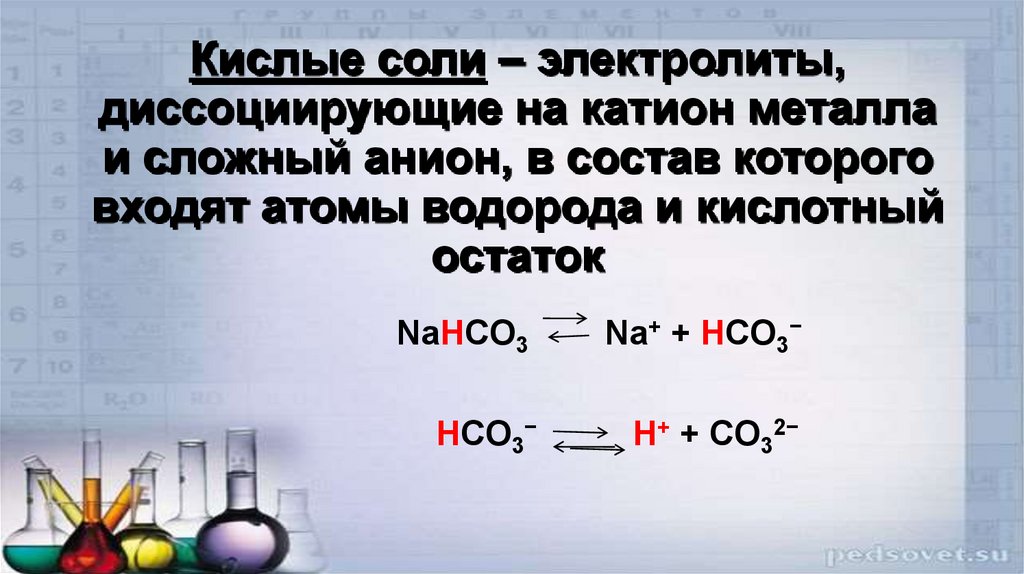
21. Кислые соли – электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и
кислотныйостаток
NaHCO3
Na+ + HCO3−
HCO3−
H+ + CO32−
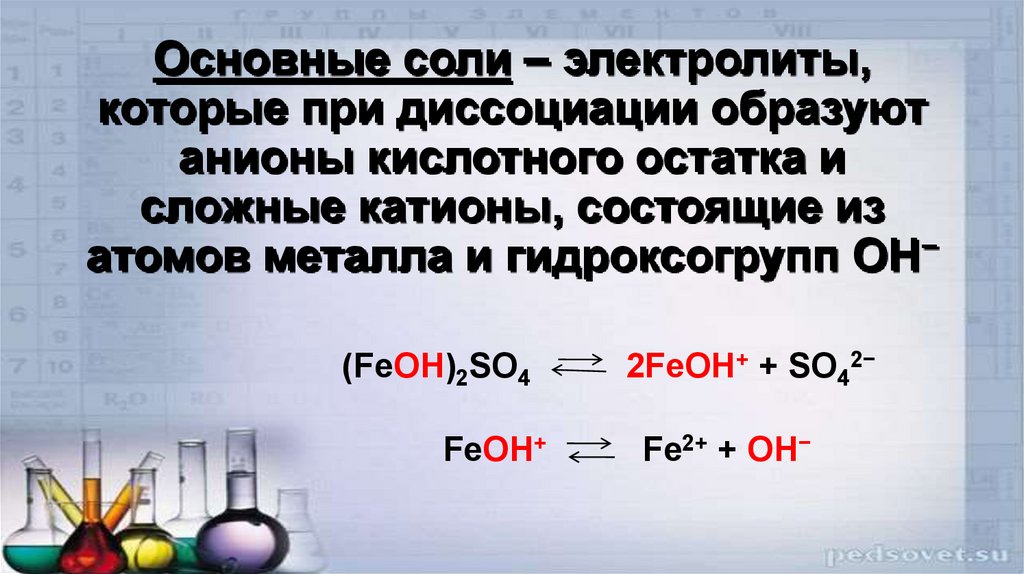
22. Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов
металла и гидроксогрупп ОН−(FeOH)2SO4
FeOH+
2FeOH+ + SO42−
Fe2+ + OH−
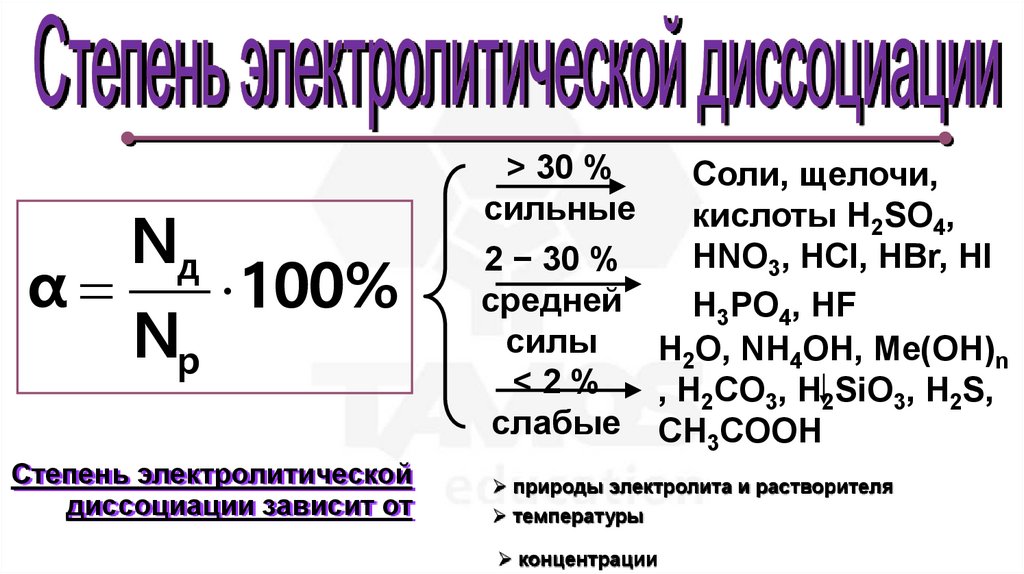
23. Количественная характеристика электролитической диссоциации
24.
Nдα
100%
Nр
Степень электролитической
диссоциации зависит от
> 30 %
Соли, щелочи,
сильные
кислоты H2SO4,
HNO3, HCl, HBr, HI
2 − 30 %
средней
H3PO4, HF
силы
H2O, NH4OH, Me(OH)n
<2%
, H2CO3, H2SiO3, H2S,
слабые CH3COOH
природы электролита и растворителя
температуры
концентрации
25.
ЭлектролитыСильные
электролиты
а=1
Слабые
электролиты
а стремиться к 0
26.
•Сильные электролиты:1) все растворимые соли;
2) сильные кислоты (H2SO4, HCl,
HNO3);
3) все щелочи (NaOH, KOH)
27.
1)
Электролиты средней силы:
кислоты (H3РO4, HNO2);
28.
• Слабые электролиты:1) слабые кислоты (H2S, H2CO3,
H2SO3);
2) водный раствор аммиака
NH3* H2O;
3) вода
29. Проверьте свои знания
1.2.
3.
4.
Электролиты, которые при диссоциации образуют катионы
водорода и анионы кислотного остатка.
Электролиты, которые при диссоциации образуют катионы металла
и анионы гидроксогрупп ОН−.
Электролиты, которые при диссоциации образуют катионы металла
и анионы кислотных остатков.
Количественная характеристика электролитической диссоциации
30. Домашнее задание:
Параграф 3 и 4записать и выучить
№ 4-7 стр. 16,
4,5 и задачи 1-3 стр. 19



























 chemistry
chemistry








