Similar presentations:
Свойства растворов
1.
Общая и неорганическая химияРаздел: Ионные равновесия
Тема: Свойства растворов
2.
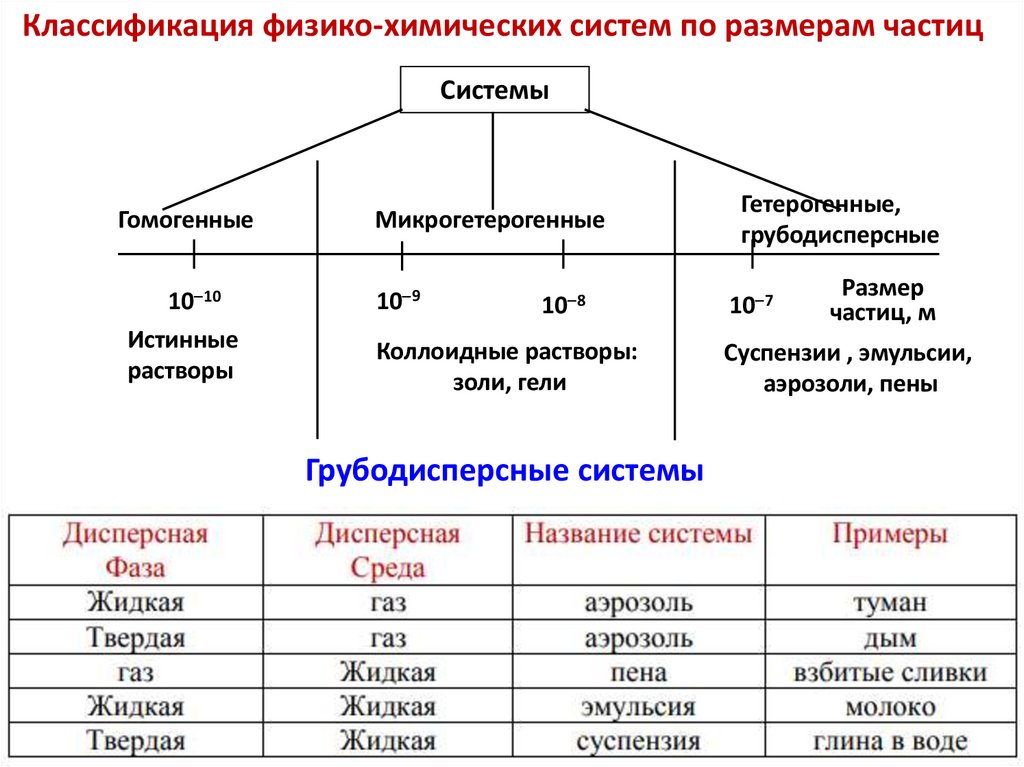
Классификация физико-химических систем по размерам частицСистемы
Гомогенные
10 10
Истинные
растворы
Микрогетерогенные
Гетерогенные,
грубодисперсные
10 9
10 7
10 8
Коллоидные растворы:
золи, гели
Грубодисперсные системы
Размер
частиц, м
Суспензии , эмульсии,
аэрозоли, пены
3.
Истинный раствор — однородная гомогенная система,состоящая из двух и более веществ. В растворе
присутствует несколько типов частиц.
Истинный раствор — молекулярно-дисперсная система,
размеры частиц <10-9 м, частицы не обнаруживаются
оптическими методами. Между частицами вещества нет
границы раздела фаз.
Растворитель — вещество, агрегатное состояние
которого совпадает с агрегатным состоянием раствора.
В случае смеси двух жидкостей растворителем считают
то вещество, которого больше.
4.
Агрегатные состояния растворовПо агрегатному состоянию растворы могут быть
- жидкими (морская вода),
- газообразными (воздух) или
- твёрдыми (сплавы металлов).
- Размеры частиц в истинных растворах - менее 10-9 м.
5.
Растворы - однородны;- характеризуются тепловыми движениями частиц;
- контракцией объема;
- не подчиняются закону постоянства состава;
- растворы могут быть разделены на составные части.
Растворы занимают промежуточное положение между
химическими соединениями постоянного состава и
механическими смесями.
Свойства растворов зависят от
-природы растворенного вещества и природы
растворителя
-количественного состава — концентраций растворов
В объеме раствора не происходит скачкообразного изменения
свойств.
Коллигативные (физико-химические) свойства растворов зависят
от суммарного числа частиц в растворе.
6.
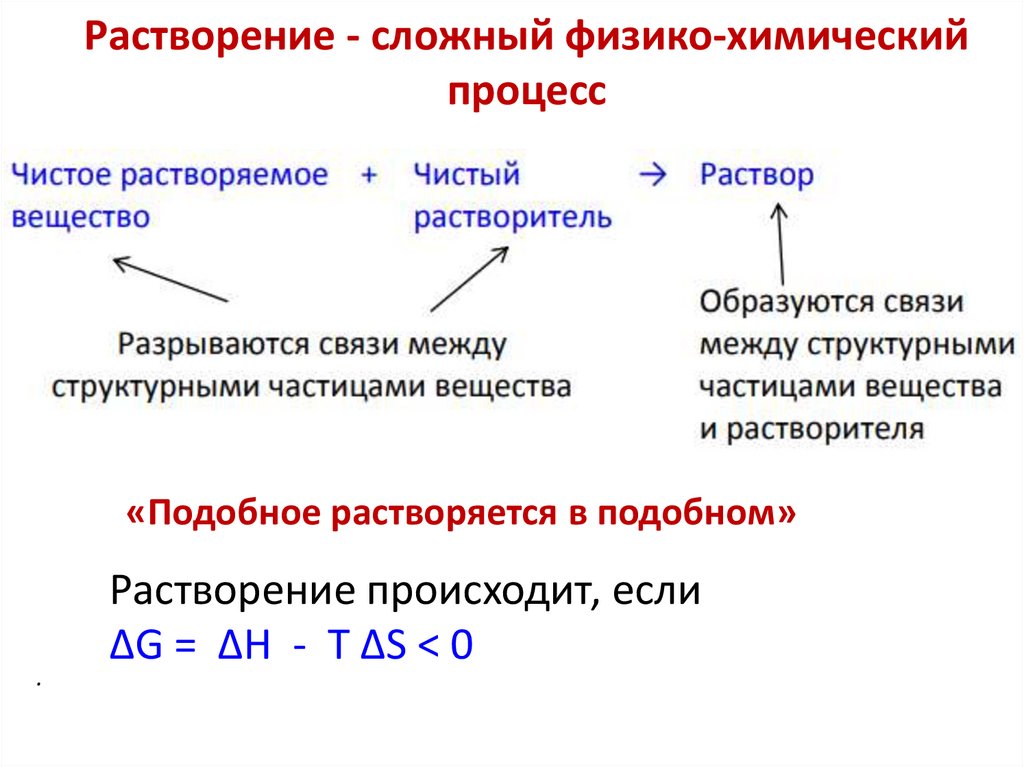
Растворение - сложный физико-химическийпроцесс
«Подобное растворяется в подобном»
.
Растворение происходит, если
∆G = ∆H - T ∆S < 0
7.
Насыщенный раствор – раствор, в котором при данныхусловиях невозможно растворение дополнительного
количества данного растворяемого вещества.
Насыщенный раствор находится в динамическом
равновесии с осадком растворенного вещества.
Растворимость вещества в растворителе
количественно определяется составом образуемого
ими насыщенного раствора.
Растворимость веществ зависит от природы
растворителя и растворимых веществ, от
температуры, давления, от присутствия в
растворах посторонних веществ
8.
Ненасыщенный раствор - раствор, содержащий меньшерастворенного вещества, чем насыщенный. В ненасыщенном
растворе возможно растворение дополнительного количества
растворяемого вещества при данных условиях.
Пересыщенный раствор - раствор, содержащий больше
растворенного вещества, чем насыщенный.
Если перенасыщенный раствор осторожно охладить, то
избыточное количество растворенного вещества не всегда и не
сразу выпадает в осадок. В этом случае получаем
перенасыщенный раствор.
Перенасыщенные растворы неустойчивы. Помешивание,
встряхивание, добавление крупинок соли может вызвать
выпадение вещества в осадок и переход раствора в насыщенное
устойчивое состояние. Из перенасыщенного раствора образуется
отдельная фаза растворяемого вещества
9.
Растворение происходит, если∆G = ∆H - T ∆S < 0
a) Газ + жидкость → раствор
Беспорядок уменьшается, ∆S<0
Процесс осуществляется, если ∆H < 0 (экзотермический
процесс).
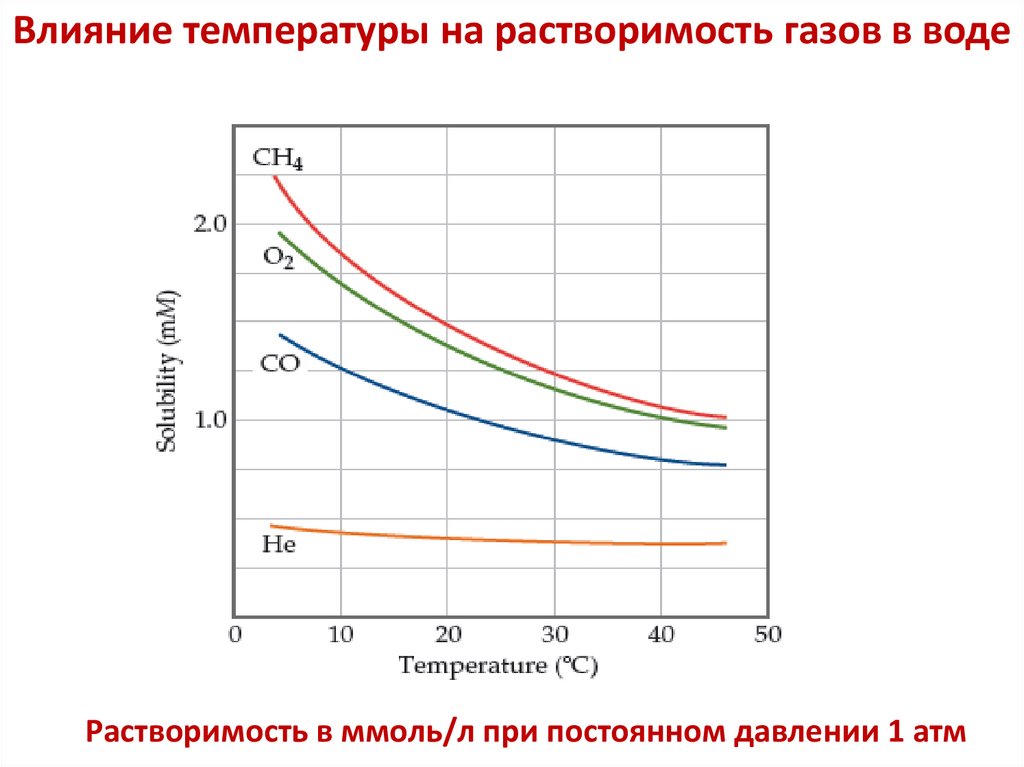
Растворимость газов увеличивается при понижении
температуры.
При изменении давления растворимость газа в жидкости
подчиняется закону Генри:
Растворимость газа прямо пропорциональна его давлению над
жидкостью.
Эту закономерность выражают формулой: m = kP,
где m – масса газа в единице объема растворителя,
P – парциальное давление газа, k – постоянная величина
(константа Генри).
10.
Влияние температуры на растворимость газов в водеРастворимость в ммоль/л при постоянном давлении 1 атм
11.
Растворение происходит, если∆G = ∆H - T ∆S < 0
б) Твердое + жидкость → раствор
Беспорядок увеличивается, ∆S>0
Процесс осуществляется, если
∆G = ∆H - T ∆S < 0,
то есть растворение возможно как с выделением тепла
(∆H < 0, экзотермический процесс), так и с поглощением
тепла (∆H >0, эндотермический процесс).
Чаще растворение твердых веществ —
эндотермические процессы, протекающие с
поглощением тепла.
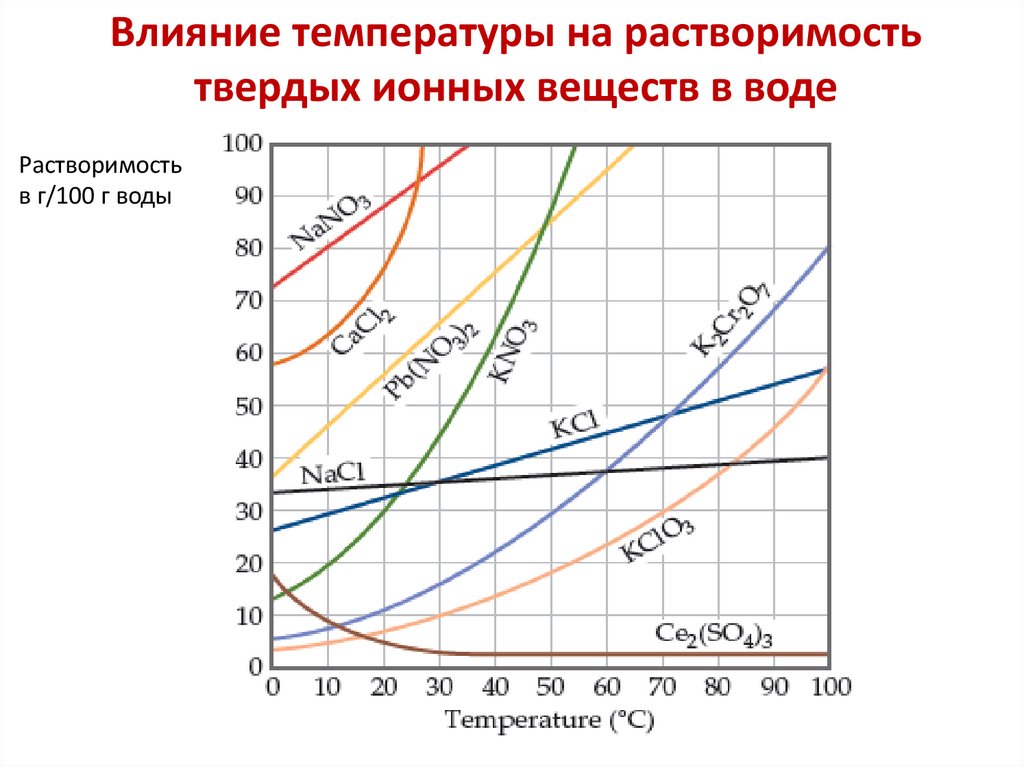
Растворимость твердых веществ в воде, как
правило, увеличивается с повышением температуры
12.
Влияние температуры на растворимостьтвердых ионных веществ в воде
Растворимость
в г/100 г воды
13.
Способы выражения концентраций растворовМассовая доля растворённого вещества (ω) - безразмерная
величина, равная отношению массы растворённого вещества к
общей массе раствора:
mА
А
m р-ра
Процентная концентрация (%) – число граммов растворенного
вещества в 100 г раствора:
mА
А
100%
m р-ра
Молярная концентрация (CM) – число молей растворённого
вещества в 1 литре раствора:
nА
mА
СM M A
, моль/л
Vр-ра M(A)Vр-ра
14.
Нормальная концентрация (CN) (молярная концентрацияэквивалента вещества) – число моль эквивалентов вещества в 1
литре раствора
n экв. A
mA
СN N
, моль - экв/л
Vр-ра M(ЭA )Vр-ра
Эквивалент вещества это целая или часть формульной единицы
вещества, которая в данной реакции химически равноценна 1
атому водорода.
Молярная масса эквивалента вещества рассчитывается в общем
случае по формуле:























 chemistry
chemistry








