Similar presentations:
Растворы и свойства растворов. Лекция 3
1.
Санкт-Петербургский государственныйархитектурно-строительный университет
кафедра строительной физики и химии
Химия
Тема 3
Растворы и свойства
растворов
Поляков Максим Сергеевич
к.х.н., доцент КСФиХ
2.
Атом –сложная частица
3.
Количественнаяхарактеристика растворов,
растворение,
растворимость
4.
РастворыРастворы представляют собой
гомогенные, или однородные, системы
переменного состава, которые содержат
два или несколько компонентов.
Растворы
Жидкие
Газообразные
Твёрдые
5.
РастворыРаствор = Растворитель + Растворённое вещество
Растворы
Водные
Неводные
Водные растворы – это растворы, в которых
растворителем является вода.
Неводные растворы – это растворы, в которых
растворителями являются другие жидкости (бензол,
спирт, эфир).
6.
РастворыФизическая сторона процесса
7.
РастворыФизическая сторона процесса
Химическая сторона процесса
8.
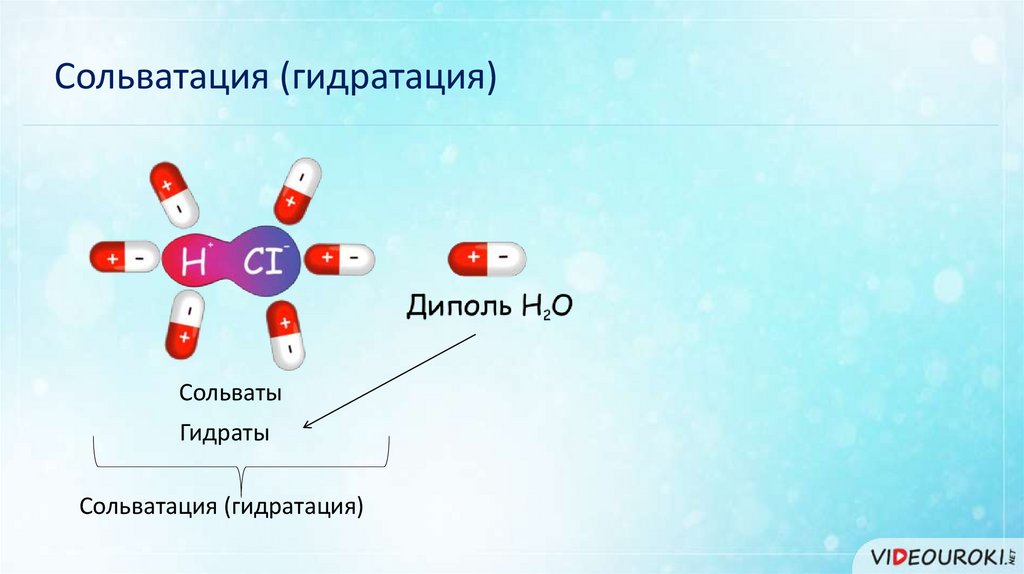
Сольватация (гидратация)Сольваты
Гидраты
Сольватация (гидратация)
9.
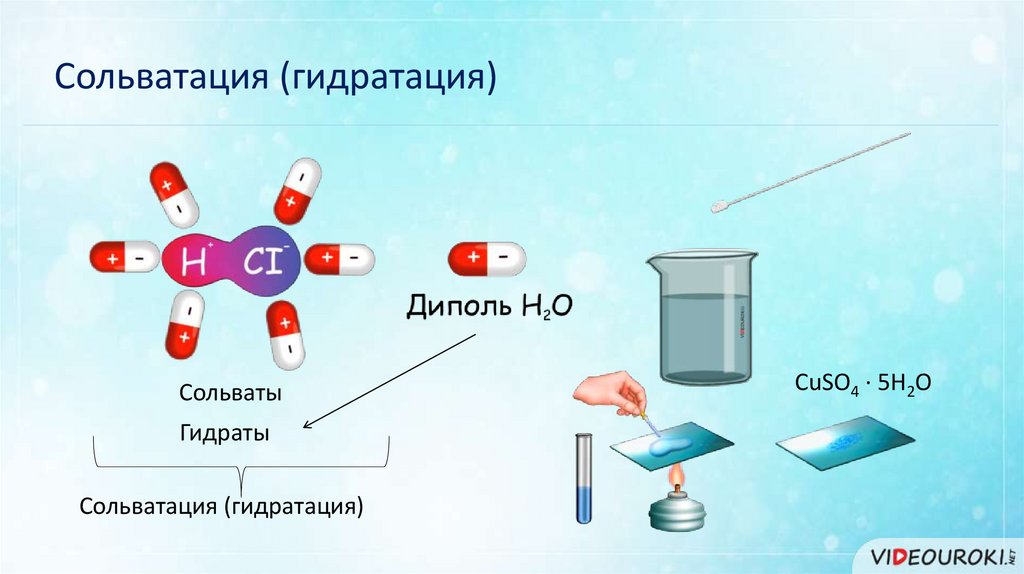
Сольватация (гидратация)Сольваты
Гидраты
Сольватация (гидратация)
CuSO4 · 5H2O
10.
КристаллогидратыКристаллические вещества, содержащие молекулы воды, называются
кристаллогидратами.
CuSO4 · 5H2O
Na2CO3 · 10H2O
Медный купорос
Кристаллическая сода
FeSO4 · 7H2O
Na2SO4 · 10H2O
Железный купорос
Глауберова соль
CaSO4 · 2H2O
Гипс
11.
Гидратная теория (1887 год)«Растворы суть химические соединения,
определяемые силами, действующими между
растворителем и растворённым веществом».
Д. И. Менделеев
(1834–1907)
12.
«Подобное растворяетсяв подобном…»
13.
РастворениеУксусная кислота
+ вода
Масло + вода
14.
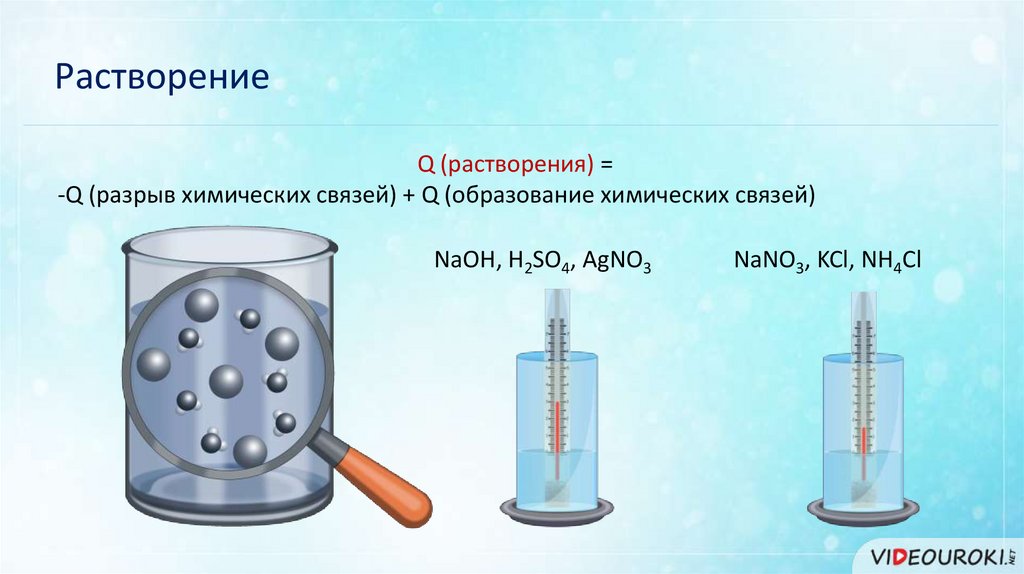
РастворениеQ (растворения) =
-Q (разрыв химических связей) + Q (образование химических связей)
NaOH, H2SO4, AgNO3
NaNO3, KCl, NH4Cl
15.
РастворыНасыщенный
Ненасыщенный
Количественной характеристикой
растворимости является коэффициент
растворимости.
Коэффициент растворимости
показывает, какая максимальная
масса вещества может раствориться в
100 г растворителя при данной
температуре.
16.
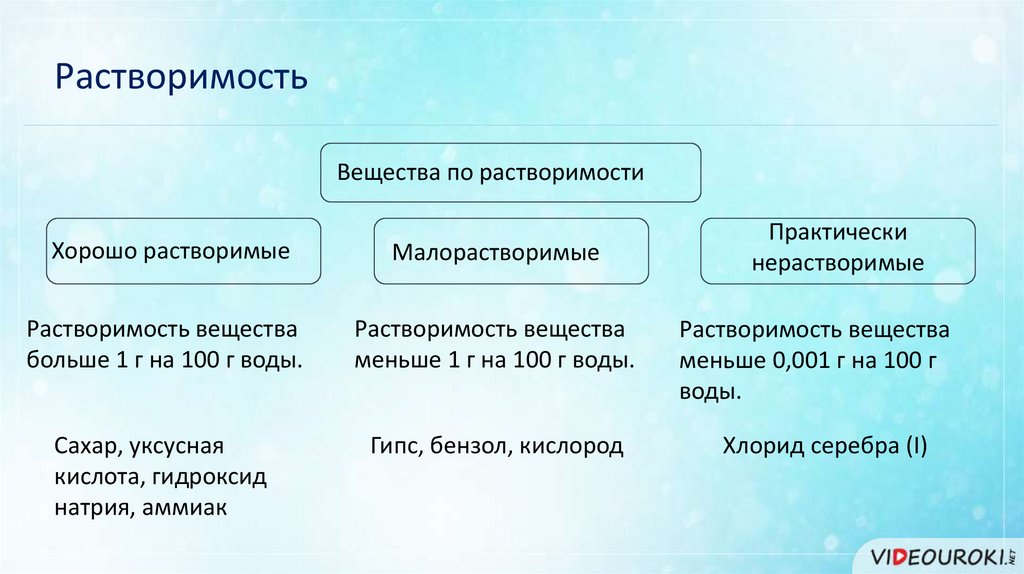
РастворимостьВещества по растворимости
Практически
нерастворимые
Хорошо растворимые
Малорастворимые
Растворимость вещества
больше 1 г на 100 г воды.
Растворимость вещества
меньше 1 г на 100 г воды.
Растворимость вещества
меньше 0,001 г на 100 г
воды.
Сахар, уксусная
кислота, гидроксид
натрия, аммиак
Гипс, бензол, кислород
Хлорид серебра (I)
17.
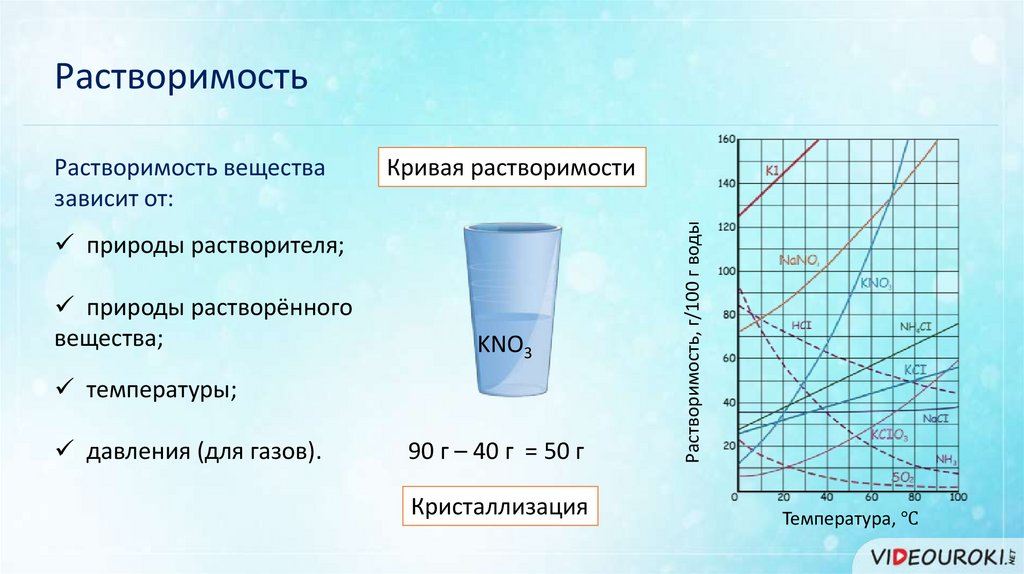
РастворимостьКривая растворимости
природы растворителя;
природы растворённого
вещества;
KNO3
температуры;
давления (для газов).
90 г – 40 г = 50 г
Кристаллизация
Растворимость, г/100 г воды
Растворимость вещества
зависит от:
Температура, ℃
18.
Кристаллизация приводит к образованиюминералов.
19.
Кристаллизация имеет большое значение впроцессах, протекающих в почве.
20.
РастворыРазбавленный
Концентрированный
Массовая доля
растворённого вещества
m (в−ва)
ω (в-ва) =
,
m (р−ра)
где ω – массовая доля растворённого
вещества;
m (в-ва) – масса растворённого
вещества;
m (р-ра) – масса раствора.
21.
Массовая доля растворённого веществаДано:
m (р-ра) = 200 г
m (в-ва) = 40 г
Решение:
m (в−ва)
ω (в-ва) =
m (р−ра)
ω (в-ва) = 40 г / 200 г = 0,20, или 20 %.
ω (в-ва) – ?
Ответ: 0,2, или 20%.
m (р-ра) = V · ρ,
где V – объём раствора, мл;
ρ – плотность раствора, г/мл.
22.
Молярная концентрацияn
С= ,
V
где С – молярная концентрация, моль/л;
n – количество растворённого вещества,
моль;
V – объём раствора, л.
23.
Молярная концентрацияДано:
V (р-ра) = 4 л
m (NaOH) = 1,6 г
C (NaOH) – ?
Решение:
n
С=
V
m
n=
M
M (NaOH) = 40 г/моль;
n (NaOH) = 1,6 г / 40 г/моль = 0,04 моль;
С (NaOH) = 0,04 моль / 4 л = 0,01 моль/л.
Ответ: 0,01 моль/л.
24.
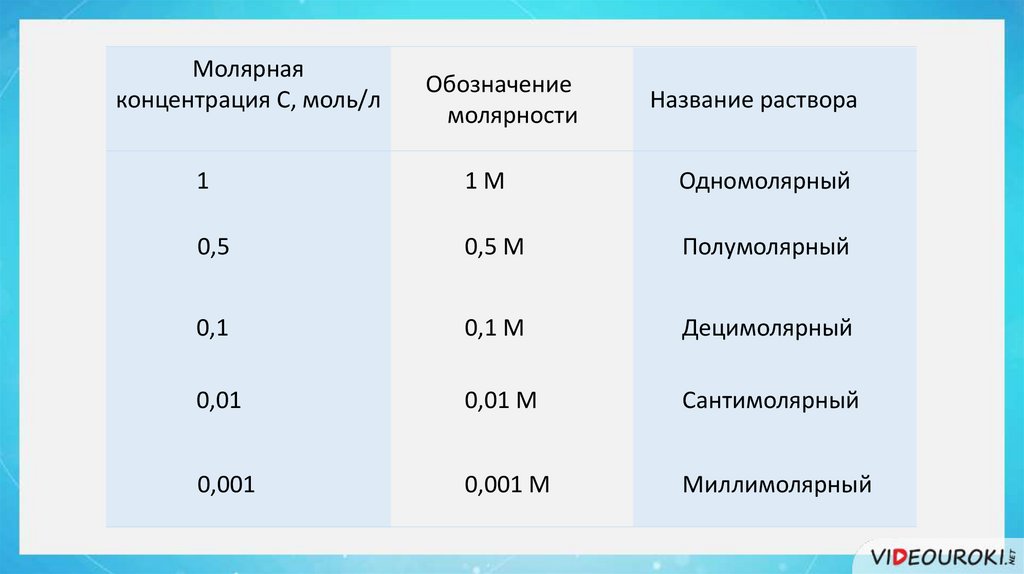
Молярнаяконцентрация С, моль/л
Обозначение
молярности
Название раствора
1
1М
Одномолярный
0,5
0,5 М
Полумолярный
0,1
0,1 М
Децимолярный
0,01
0,01 М
Сантимолярный
0,001
0,001 М
Миллимолярный
25.
Количественный состав растворовДано:
Решение:
ρ (р-ра) = 1,15 г/мл
m (в−ва)
ω (в-ва) =
m (р−ра)
ω (H2SO4) = 20 %
C (H2SO4) – ?
n
С=
V
m
n=
M
m (р-ра) = V · ρ
m (р-ра) = 1000 мл · 1,15 г/мл = 1150 г;
m (H2SO4) = 1150 г · 0,2 = 230 г;
n (H2SO4) = 230 г / 98 г/моль = 2,35 моль;
C (H2SO4) = 2,35 моль / 1 л = 2,35 моль/л.
Ответ: 2,35 моль/л.
26.
Массовая концентрация (титр)Массовая концентрация вещества в растворе (Т) (г/мл) – это величина, численно
равная отношению массы растворённого вещества к объёму раствора.
Дано:
ω (HNO3) = 15 %
ρ (р-ра) = 1,012 г/мл
Т (HNO3) – ?
Ответ: 0,152 г/мл.
Решение:
m (р-ра) = V · ρ
m (в−ва)
T=
V (р−ра)
m (р-ра) = 1000 мл · 1,012 г/мл = 1012 г;
m (HNO3) = 1012 г · 0,15 = 152 г;
Т (HNO3) = 152 г / 1000 мл = 0,152 г/мл.
27.
Состав и свойства растворов.Растворение и
растворимость.
Количественные
характеристики состава
растворов.
28.
Санкт-Петербургский государственныйархитектурно-строительный университет
кафедра строительной физики и химии
Авторы:
Поляков Максим Сергеевич
https://interneturok.ru/
videouroki.net
mpolyakov@lan.spbgasu.ru






















 chemistry
chemistry








