Similar presentations:
Физика. 5 дәріс
1. «ФИЗИКА»
5 дәрісОқытушы: Лесбаев Айдос Бакытжанович,
1
2.
Сабақ жоспары• Идеал газдың молекулакинетикалық теориясы.
• МКТ негізгі теңдеуі.
• Идеал газдың күй теңдеуі.
• Изопроцестер.
2
3.
Идеал газдың молекула-кинетикалық теориясыМолекулалық физика және термодинамика
Молекулалық физика денелердің әртүрлі агрегаттық
күйлердегі физикалық қасиеттерін заттардың микроскопиялық
құрылысы негізінде зерттейтін физика бөлімі. Заттардың
қасиеттері
молекула-кинетикалық
теория
тұрғысынан
статистикалық әдіс арқылы зерттеледі.
Термодинамикада
тепе-теңдіктегі
макроскопиялық
жүйелердің
жалпы
қасиеттері
мен
олардың
бір
термодинамикалық күйден екінші күйге ауысу процестері
зерттеледі. Термодинамика көптеген тәжірибе нәтижелерін
қорытындылау арқылы анықталған, жүйедегі денелер
табиғатына тәуелсіз орындалатын бірнеше бастама негізінде
құрылған. Молекула-кинетикалық теория мен термодинамика
бір-бірін толықтырып, біртұтас ілім құрайды.
3
4.
Идеал газдың молекула-кинетикалық теориясыӨте көп бөлшектерден тұратын жүйелер бірін-бірі
толықтыратын екі әдіс арқылы тағайындалған: статистикалық
және термодинамикалық.
Статистикалық әдісте белгілі бір зерттелетін жүйенің
нұсқауларының
құрылысы
мен
ықтималдық
теориясы
қолданылады. Өте көп бөлшектердің координаттары мен
импульстері кез-келген уақыт мезетінде кездейсоқ шамаларға ие
болады,
бұл
жағдайда
статистикалық
заңдылықтар
тағайындалады.
Физикалық құбылыстарды зерттеуде қолданылатын екінші әдіс
термодинамикалық (жылулық қозғалыс) деп аталады. Бұл әдісте
денелердің ішкі құрылысы және оны құраушы бөлшектердің
қозғалыс сипаттамалары қарастырылмайды.
4
5.
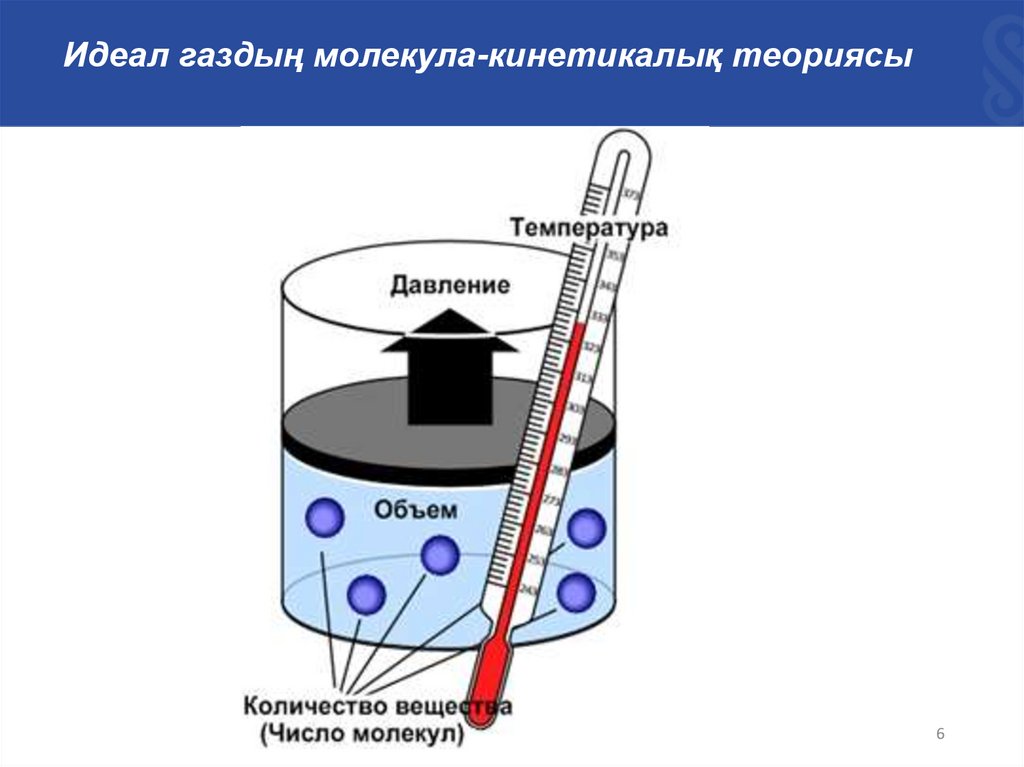
Идеал газдың молекула-кинетикалық теориясыТермодинамикалық жүйелер мен олардың параметрлері
Термодинамикалық жүйе деп бір-бірімен және сыртқы
денелермен
зат
пен
энергия
алмасушы
дараланған
макроскопиялық денелер жүйесін айтады.
Термодинамикалық параметрлер мен процестер
Жүйенің күйін сипаттау үшін жүйенің термодинамикалық
параметрлері (күй параметрлері) деп аталатын физикалық
шамалар енгізілген. Оларға P – қысым V– көлем, Т – темпертура, n
– концентрация және т.б. жатады. Термодинамикалық процесс
деп жүйенің кез-келген параметрінің өзгерісін айтады.
dFn
p
dS
1 Пa
1H
1 м2
Қалыпты күйде
термодинамикалық параметрлер
келесі мәндерге тең болады:
p=1,013· 105 Па, VM=22,4· 10-3 м3 , T=273,15K
T = t + 273,15
5
6.
Идеал газдың молекула-кинетикалық теориясы6
7.
Идеал газдың молекула-кинетикалық теориясыИдеал газ деп бір-бірімен әсерлесу күштері ескерілмейтін,
өзара және ыдыс қабырғасымен соқтығысулары абсолют серпімді
болатын ретсіз қозғалыстағы материалдық нүктелер жүйесін
айтады.
Идеал газдың күй теңдеуі – термодинамикалық параметрлер
арасындағы функционалдық байланыс:
f ( P, V , T ) 0
Көптеген тәжірибе нәтижелерін қорыта отырып, Менделеев
(1874), бір моль идеал газ үшін келесі теңдеуді анықтады:
pVM R T
m
pV
RT
7
M Бұл Менделеев – Клапейрон теңдеуі
8.
Идеал газдың молекула-кинетикалық теориясы8
9.
Идеал газдың молекула-кинетикалық теориясыКлайперон теңдеуін тағы бір түрде жазуға болады:
p
RT
R NA
T k nT
VM N A VM
немесе
p nkT
9
10.
Идеал газ үшін молекула-кинетикалықтеорияның негізгі теңдеуі
Үздіксіз
бейберекет
ретсіз
қозғалыстағы
газ
молекулаларының өзара және ыдыс қабырғасымен соқтығысуы
абсолют серпімді болады. Молекулалардың соқтығысулары
арқылы олардың арасында жылдамдық пен энергия
алмасулары
жүреді.
Молекулалардың
қабырғамен
соқтығысуынан газ қысымы пайда болады.
Идеал газ үшін молекула-кинетикалық теорияның негізгі
теңдеуі жүйенің тәжірибеде өлшенетін р макроскопиялық
параметрі мен бөлшектің микроскопиялық параметрін
байланыстырады
1
p
m0 n
2
3
10
11.
Газ молекулаларының ілгерілемелі қозғалысыныңорташа кинетикалық энергиясы
Идеал газдың молекула-кинетикалық теориясының негізгі теңдеуін
келесі түрде жазуға болады:
2 m0 2 2
p n
n Eк 0
3
2
3
Қысым
бірлік
көлемдегі
молекулалардың
ілгерілемелі
қозғалысының орташа кинетикалық энергиясының 2/3-не тең
болады. Олай болса, қысым күштік сипаттама ғана емес,
энергетикалық сипаттама да болып та табылады.
Жоғарыдағы өрнектерден келесі шамаларды келтіріп шығаруға
болады:
3RT
3kT
кв 2
M
m0
Бұдан идеал газдың бір молекуласының орташа кинетикалық
энергиясы тек Т термодинамикалық температураға ғана тәуелді
екенін көреміз:
Соңғы
өрнек
идеал
газ
молекуласының
m0 2 3
Eк 0
kT
2
2
термодинамикалық орташа кинетикалық энергиясы
температураға
пропорционал
болатынын
11
көрсетеді.
12.
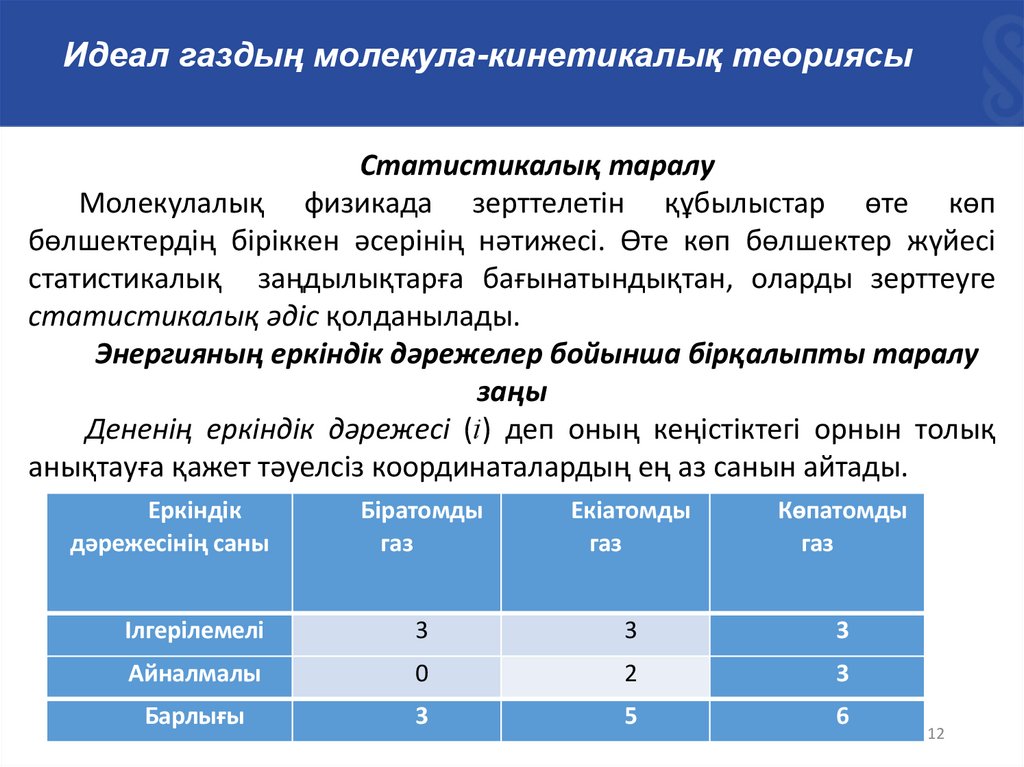
Идеал газдың молекула-кинетикалық теориясыСтатистикалық таралу
Молекулалық физикада зерттелетін құбылыстар өте көп
бөлшектердің біріккен әсерінің нәтижесі. Өте көп бөлшектер жүйесі
статистикалық заңдылықтарға бағынатындықтан, оларды зерттеуге
статистикалық әдіс қолданылады.
Энергияның еркіндік дәрежелер бойынша бірқалыпты таралу
заңы
Дененің еркіндік дәрежесі (і) деп оның кеңістіктегі орнын толық
анықтауға қажет тәуелсіз координаталардың ең аз санын айтады.
Еркіндік
дәрежесінің саны
Біратомды
газ
Екіатомды
газ
Көпатомды
газ
Ілгерілемелі
3
3
3
Айналмалы
0
2
3
Барлығы
3
5
6
12
13.
Идеал газдың молекула-кинетикалық теориясыКестеден молекула үшін ілгерілемелі қозғалыстың еркіндік
дәрежесі әрқашан үшке тең болатынын көреміз. Ілгерілемелі
қозғалыстың әр еркіндік дәрежесіне бір атомды молекуланың
орташа кинетикалық энергиясының үштен біріне (1/3) сәйкес
келеді:
Eko 3kT
1
kT
3
2 3 2
Сондықтан, молекуланың еркіндік дәрежесі і болса, онда оның
орташа кинетикалық энергиясы мына шамаға тең болады:
i
Ek 0 kT
2
Мөлшері 1 моль және массасы т кез-келген газдың ішкі
энергиясы келесі өрнектермен анықталады:
i
i
U M Ek 0 N A kTN A RT
2
2
және
U
m i
RT
M 2
13
14.
Идеал газдың молекула-кинетикалық теориясыСыртқы күш өрісіндегі бөлшектер үшін Больцман таралуы
Сыртқы күш өрісі әсер етпейтін идеал газда молекулалар жылулық
қозғалыс әсерінен бүкіл көлемге бірдей таралады. Сыртқы күш өрісіндегі газ
молекулаларының көлем бойынша таралуы біртекті болмайды.
Біртекті ауырлық күші өрісіндегі идеал газ қысымының биіктікке
байланысты өзгеруі барометрлік формуламен анықталады: p p0 exp( Mgh )
RT
14
15.
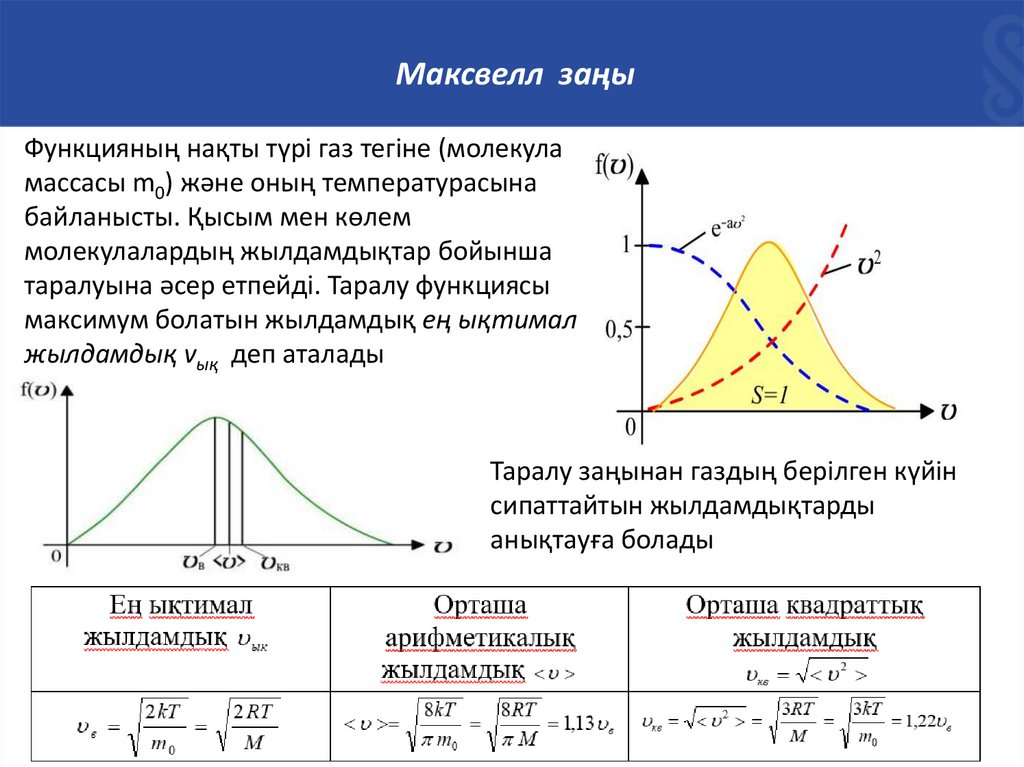
Максвелл заңыГаз молекулаларының жылдамдықтар бойынша таралу заңы
(Максвелл заңы)
Газ молекулалары ретсіз қозғалып, бір-бірімен үздіксіз соқтығыста
болатындықтан, молекулалардың жылдамдықтары да әртүрлі болып, олар
жылдамдық бойынша қандай да бір заңдылық бойынша таралады.
Молекулалардың қозғалысына ретсіздік, ал олардың соқтығысуларына
ықтималдылық тән болатынына қарамастан, теория мен тәжірибе олардың
жылдамдықтар бойынша таралуы бір ғана мүмкін заңдылық бойынша
бірмәнді анықталатынын көрсетті. Ықтималдылық теориясын қолдана
отырып, 1860 жылы Максвелл идеал газ молекулаларының
жылдамдықтар бойынша таралу заңын анықтады:
2
m0 3 2 2
m
f ( ) 4 (
) exp( 0 )
2 kT
2kT
15
16.
Максвелл заңыФункцияның нақты түрі газ тегіне (молекула
массасы m0) және оның температурасына
байланысты. Қысым мен көлем
молекулалардың жылдамдықтар бойынша
таралуына әсер етпейді. Таралу функциясы
максимум болатын жылдамдық ең ықтимал
жылдамдық vық деп аталады
Таралу заңынан газдың берілген күйін
сипаттайтын жылдамдықтарды
анықтауға болады
16
17.
Термодинамикалық тепе-теңдіксіз жүйелердегітасымалдау құбылыстары
Газдың қандай-да бір көлемінде біртектілік бұзылған
жағдайда (газ тығыздығы, температурасы немесе оның жеке
қабаттарының реттелген қозғалысының жылдамдығы) сол
физикалық шаманың кеңістіктегі таралуын теңестіруге
бағытталған заттың, энергияның немесе бөлшектердің
реттелген қозғалысының импульсінің ағындары пайда болады.
Бұл құбылыстарды тасымалдау құбылыстары деп атайды.
Тасымалдау құбылыстарына диффузия, жылуөткізгіштік және
ішкі кедергі жатады.
17
18.
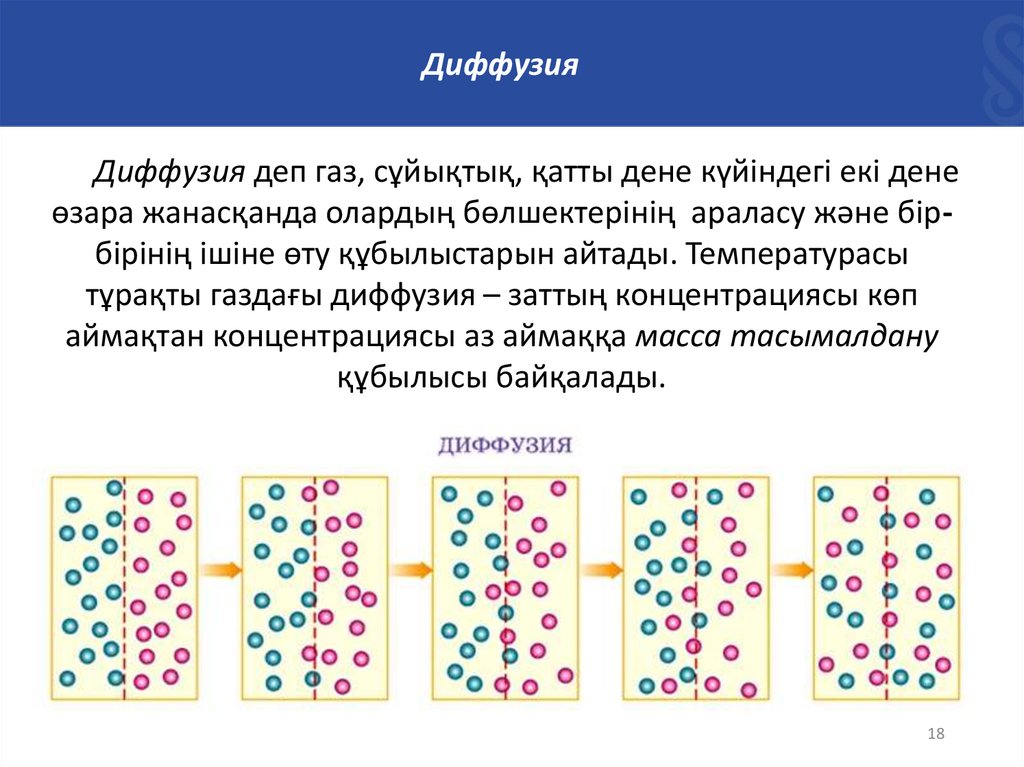
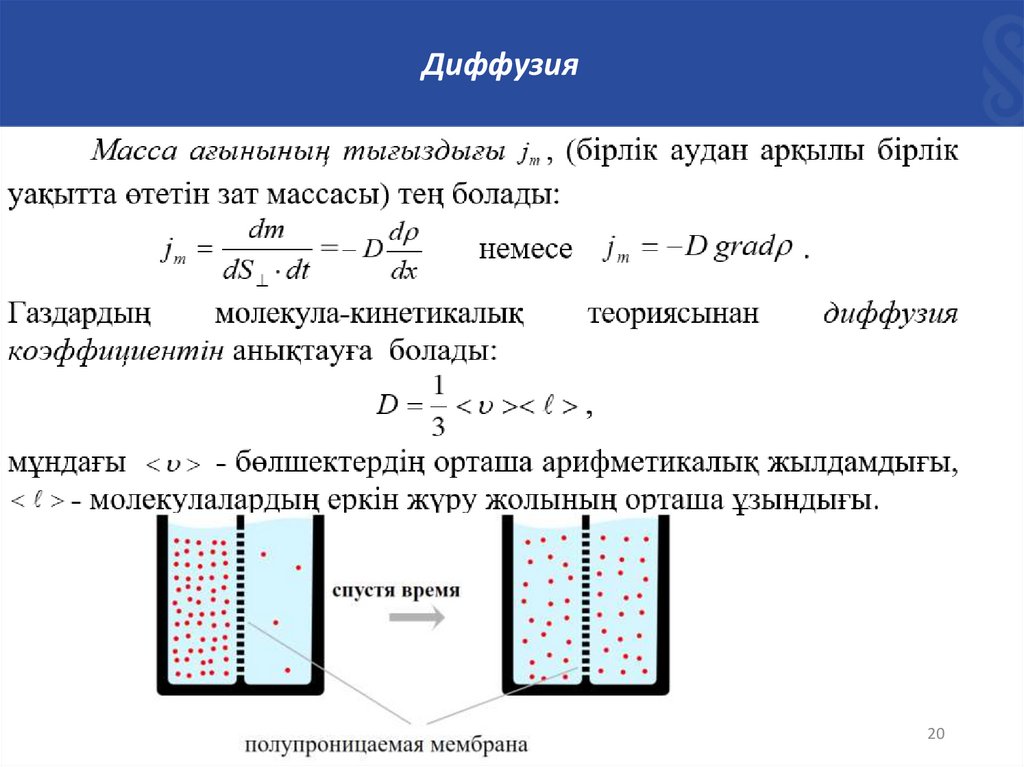
ДиффузияДиффузия деп газ, сұйықтық, қатты дене күйіндегі екі дене
өзара жанасқанда олардың бөлшектерінің араласу және бірбірінің ішіне өту құбылыстарын айтады. Температурасы
тұрақты газдағы диффузия – заттың концентрациясы көп
аймақтан концентрациясы аз аймаққа масса тасымалдану
құбылысы байқалады.
18
19.
ДиффузияЕгер концентрациясы n химиялық біртекті газ (немесе
тығыздығы ) х осьі бойынша өзгерсе, онда зат тасымалдау
құбылысы Фик заңымен сипатталады:
d
dm D
dS dt ,
dx
19
20.
Диффузия20
21.
Ішкі кедергі21
22.
Ішкі кедергі22
23.
Жылуөткізгіштік23
24.
Жылуөткізгіштік24
25.
Жылуөткізгіштік25
26.
ИзопроцестерИзопроцестер деп үш параметрдің (Р - қысым, V - көлем, Т - температура)
біреуі тұрақты болғандағы басқа екі параметр өзгеретін процесті айтады.
Изопроцестер үшеу: изотермалық, изобаралық, изохоралық.
Тұрақты температурада термодинамикалық жүйе күйінің өзгеру процесі
Изотермалық процесс деп атайды.
Тұрақты қысымда термодинамикалық жүйе күйінің өзгеру процесі
Изобаралық процесс деп аталады.
Көлем тұрақты болғанда, температураның өзгеруінен туындайтын газ
қысымының өзгеру процесін Изохоралық процесс деп атайды.
27.
2728.
Бақылау сұрақтары:1. Макроскопиялық зерттеулердің термодинамикалық және
статистикалық
(молекула-кинетикалық)
әдістерінің
ерекшеліктері қандай және олар бір-бірін қалай
толықтырады?
2. Қысым мен температураның молекула-кинетикалық мәні
неде?
3. Тасымалдау құбылысының мағынасын түсіндіріңіз.
4. Изопроцестерді сипаттап графигін салыңыз
28
29.
Әдебиеттер тізімі1. Савельев И.В. Жалпы физика курсы. Механика және
молекулалық физика. 1том. Алматы: Мектеп, 1977г.
2. Қойшыбаев Н. Жалпы физика курсы.
3. Абдуллаев Ж. Жалпы физика курсы.
4. Трофимова Т.И. Краткий курс физики: Учебное пособие
для вузов Изд. 2-е, испр. - 352 с, М: Высшая Школа, 2002 г.
5. Детлаф А.А., Яворский Б.М. Курс физики: Учебное
пособие для втузов. Изд. 4-е, испр. - 718 с. М: Высшая
Школа, 2002 г.
6. Сивухин Л.В. Общий курс физики. - М.: Наука, 1977-1986,
т. 1-5.
7. «Физика I» пәні бойынша дәрістер:
(http://edu.kaznitu.kz – студент беті)
29
























 physics
physics








