Similar presentations:
Законы химической термодинамики. Энергетика химических процессов
1. Законы химической термодинамики. Энергетика химических процессов
1. Термодинамические законы – первый, второй,третий.
2. Внутренняя энергия, энтальпия, энтропия.
3. Стандартные характеристические функции.
4. Термохимические законы Гесса и их следствия.
5. Изменение энтальпии системы в различных
процессах.
6. Изменение энтропии при химических
процессах и фазовых переходах.
7. Свободная энергия Гиббса.
2. Второе и третье начало термодинамики.
1. Энтропия.2. Энергия Гиббса и направление
самопроизвольного протекания
химического процесса.
3. Стандартные термодинамические
величины и термодинамические
расчеты.
3.
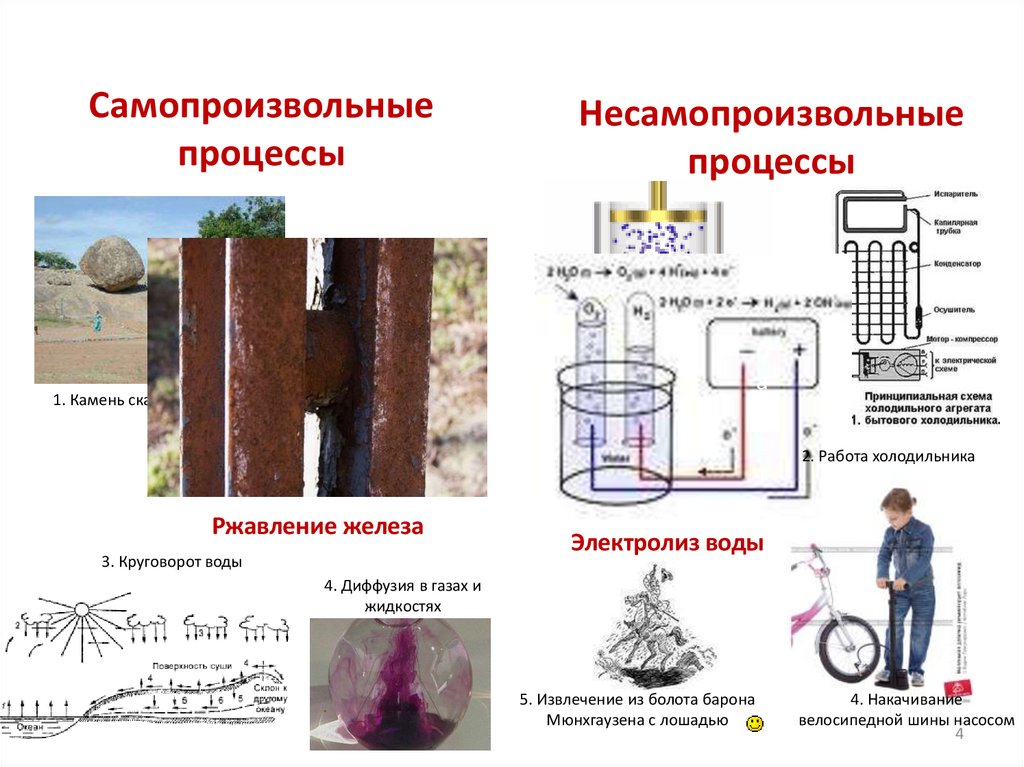
Самопроизвольные инесамопроизвольные процессы
• Существуют явления, которые происходят сами по
себе, и явления, которые сами по себе
происходить не могут.
• Самопроизвольные процессы – это процессы,
которые совершаются без внешнего воздействия.
• Несамопроизвольные процессы – это процессы,
которые происходят под воздействием какихлибо усилий (затраты внешней энергии).
3
4.
Самопроизвольныепроцессы
Несамопроизвольные
процессы
1. Сжатие газа
1. Камень скатывается с горы
Ржавление железа
3. Круговорот воды
р
а
б
о
т
2. Работа холодильника
Электролиз воды
4. Диффузия в газах и
жидкостях
5. Извлечение из болота барона
Мюнхгаузена с лошадью
4. Накачивание
велосипедной шины насосом
4
5.
Как определить, будет ли процесс протекать самопроизвольно или нет?• Принцип Бертло-Томсена (середина 19 века):
из числа возможных реакций происходит та, которая
сопровождается наибольшим выделением тепла.
• Согласно этому принципу самопроизвольно могут протекать
только экзотермические реакции:
А + В → АВ
при ΔΗ < 0
А+В→С+D
при ΔΗ < 0
• Установлено, что для 95% всех необратимых реакций принцип
соблюдается, однако для 5% реакций существует обратная зависимость:
_
+
NH4NO3 → NH4 + NO3
ΔΗ > 0
N2O4 → 2NO2
ΔΗ > 0
• Следовательно, самопроизвольно могут происходить и
эндотермические процессы, если в результате их система
переходит в более безпорядоченное состояние.
• Итак, выделение или поглощение системой теплоты
(энтальпийный фактор) не позволяет судить о возможности
5
процесса.
6.
• Первый закон термодинамики не может отличитьобратимые процессы от необратимых. Он просто требует от
термодинамического процесса (в том числе и химических
реакций) определенного энергетического баланса и ничего
не говорит о том, возможен такой процесс или нет.
• Направление самопроизвольно протекающих
процессов устанавливает второй закон термодинамики.
Так же он дает ответы на вопросы:
1. При каком соотношении концентраций установится
состояние равновесия химической реакции
2. Как температура и давление влияют на состояние
равновесия реакции
6
7.
Формулировки второго закона термодинамики:Формулировка Клаузиуса: (1850): теплота сама по себе не может
перейти от более холодного тела к более теплому, тогда как
передача теплоты от теплого тела к холодному может быть
единственным результатом процессов
Формулировка Томсона: (1851): никакая совокупность процессов не
может сводиться только к превращению теплоты в работу, тогда как
превращение работы в теплоту может быть единственным
результатом процесса.
Формулировка Оствальда: невозможно создание вечного
двигателя второго рода, т.е. такой машины, которая
производила бы работу только за счет поглощения теплоты
из окружающей среды без передачи части теплоты
холодильнику (невозможно всю внутреннюю энергию системы
превратить в работу).
Формулировка Больцмана: изолированная система эволюционирует
преимущественно в направлении большей термодинамической
7
вероятности.
8. Энтропия
- функция состояния система, изменение которой (ΔS)равно минимальной теплоте (Qmin), поступившей в
систему в обратимом изотермическом процессе,
делённой на абсолютную температуру (Т), при которой
совершается этот процесс.
ΔS = Qmin / T, [Дж · моль-1 · К-1].
• это параметр характеризующий хаотичность движения
частиц, является мерой молекулярного, атомного и
ионного беспорядка. Она определяет критерий
самопроизвольного протекания процесса в
изолированных системах
9. Основные положения
• Энтропия - это мера термодинамическойвероятности состояния веществ и систем.
• Любая изолированная система
предоставленная самой себе, изменяется в
направлении состояния обладающего
максимальной вероятностью.
• Все процессы в изолированной системе
происходят в направлении увеличения
энтропии, т.е. увеличения беспорядка.
10.
Чем выше энтропия, тем большенеупорядоченность системы.
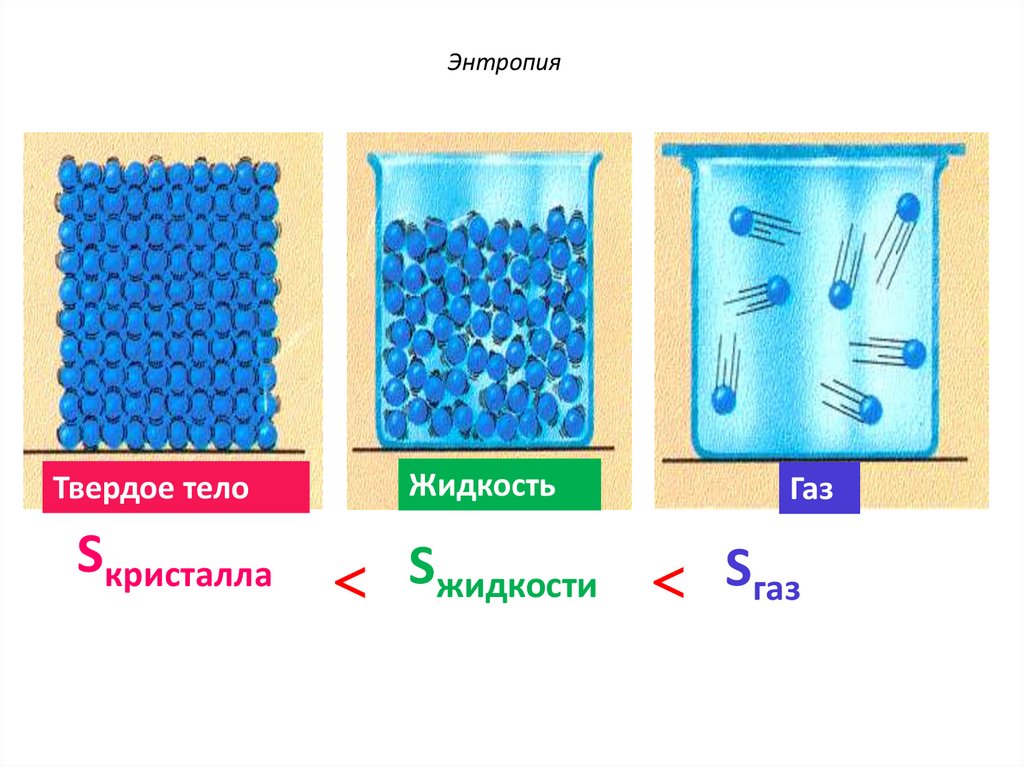
11. Пример. В каком состоянии энтропия 1моль вещества больше: в кристаллическом или в парообразном при той же температуре?
• Решение. Энтропия есть мера неупорядоченности состояниявещества. В кристалле частицы (атомы, ионы) расположены
упорядочение и могут находиться лишь в определенных
точках пространства, а для газа таких ограничений нет.
Объем 1 моль газа гораздо больше, чем объем 1 моль
кристаллического вещества; возможность хаотичного
движения молекул газа больше. А так как энтропию можно
рассматривать как количественную меру атомномолекулярной структуры вещества, то энтропия 1моль паров
вещества больше энтропии 1 моль его кристаллов при
одинаковой температуре.
12.
ЭнтропияТвердое тело
Sкристалла
Жидкость
Газ
Sжидкости Sгаз
13. 2 закон термодинамики (“закон об энтропии”)
• В изолированных системах самопроизвольномогут совершаться только такие необратимые
процессы, при которых энтропия системы
возрастает, т.е. ∆S>0.
ΔS = S2– S1
• если ΔS > 0, то процесс протекает в прямом
направлении,
• если ΔS < 0, то процесс протекает в обратном
направлении.
13
14. Энтропия химической реакции
S0
хим. р .
(nпрод. S
0
f , прод
) (nисх. S
0
f ,исх
0 • стандартная энтропия
S f
образования вещества
• количество вещества
n
• значения стандартных энтропий приведены в
таблице;
• значение энтропий зависит от агрегатного
состояния веществ.
)
15. Пример:
ДжS
44,2
моль К
Дж
0
S H O 70
моль К
Дж
0
S H O 189
моль К
0
H 2Oтв
2
ж
2
г
16. Пример
Ств. + СО2 =1моль
2СОгаз
2 моль
твердые и жидкие вещества не
учитываются, в данной реакции
объем увеличивается, беспорядок
системы возрастает ΔS>0.
17. Пример
2Н2(г) + О2(г) = 2Н2О(г)2моль
1моль
2моль
в данной реакции объем уменьшается,
беспорядок системы уменьшается
ΔS<0
18.
Третий закон термодинамикиЭнтропия любой термодинамической
системы стремится к нулю при стремлении
к нулю абсолютной температуры системы:
lim S 0
T 0
Энтропия системы становится равной нулю для однозначно
упорядоченной системы
Абсолютный ноль температуры не может быть достигнут
9
Т 10 K
Физика сверхнизких температур
- криогенная физика.
18
19. Движущие силы химической реакции
- ЭНТАЛЬПИЙНЫЙ ФАКТОР - стремлениесистему перейти в состояние в наименьшей
внутренней энергией ( H<0);
- ЭНТРОПИЙНЫЙ ФАКТОР - стремление системы
приобрести наиболее вероятностное состояние с
максимально возможным молекулярным
беспорядком ( S>0)
20. Энтальпийные и энтропийные факторы, обуславливающие самопроизвольность протекания физико-химических процессов – стремление к
уменьшению энтальпии(ΔH < 0) и стремление к увеличению энтропии (ΔS > 0)
1. H<0 и S>0 - самопроизвольная:
C(тв.) +O2(г)=2CO(г)
2. H>0 и S<0 - НЕсамопроизвольная:
3O2(г)=2O3(г) (эл.разр.)
3. H>0 и S>0 - при высоких T:
Cu2O(тв.) =4Cu(тв.)+O2(г)
4. H<0 и S<0 - при низких T:
2NO2 (г)=N2O4 (г)
21. Энергия Гиббса
• Энтропийный и энтальпийный факторыобычно действуют в противоположных
направлениях и общее направление реакции
определяется влиянием преобладающего
фактора.
• В неизолированных системах критерием
является ΔG –энергия Гиббса, ее рассчитывают
при разных температурах.
Д.У.Гиббс (1839—1903) – американский физик,
который вывел эту функцию, а затем
использовал в термодинамических работах.
22. Энергия Гиббса химической реакции
Энергия Гиббса реакции равна алгебраическойсумме энергий Гиббса образования
стехиометриеского количества продуктов за
вычетом алгебраической суммы энергий Гиббса
образования стехиометрического количества
реагентов:
G
0
хим. р .
(nпрод. G
G
0
f , прод
) (nисх. G
0
f ,исх
)
0 • стандартная энергия Гиббса
образования вещества
f
n • количество вещества
23. Стандартная энергия Гиббса образования химического соединения ΔG°
• это энергия Гиббса реакции образованияодного моля этого соединения находящегося в
стандартных условиях, из простых веществ
• ΔG° простых веществ так же как ΔH°, ΔS° равны
нулю
• Единицы измерения ΔG° - кДж/моль
• Стандартная энергия Гиббса образования
химического соединения ΔG° приведена в
справочниках
24. ВАЖНО! Любая реакция при постоянных температуре и давлении протекает самопроизвольно в направлении убыли энергии Гиббса.
Величина и знак ΔG позволяют судить овозможности и направлении процесса.
• ΔG<0 - самопроизвольно протекает в прямом
направлении,
• Δ G>0 - прямая реакция невозможна и протекает в
обратном направлении,
• Δ G=0 - реакция находится в состоянии равновесия,
т.е. скорость прямой реакции равна скорости
обратной.
25. Пример. Прямая или обратная реакция будет протекать при стандартных условиях в системе: СН4(г) + СО2(г) = 2СО(г) + 2Н2(г)
Решение. Для ответа на вопрос следует вычислить Gо298прямой реакции. Значения Gо298 соответствующих
веществ приведены в табл. 6. Зная, что G есть функция
состояния и что G для простых веществ, находящихся в
устойчивых при стандартных условиях агрегатных
состояниях, равны нулю, находим Gо298 процесса:
Gо298 = 2(-137,27) + 2(0) – (-50,79 – 394,38) = +170,63 кДж.
То, что Gо298 > 0, указывает на невозможность
самопроизвольного протекания прямой реакции
при Т = 298 К и равенстве давлений взятых газов
101,3 103 Па (760 мм рт. ст. = 1 атм).
26. Джозайя Уиллард Гиббс 1839-1903 гг.
∆G = ∆H-T∆S• Обобщенная термодинамическая
функция состояния системы,
учитывающая энергетику и
неупорядоченность системы при
изобарно-изотермических
процессах (Р и Т const.)
• ∆H – полное изменение энергии
системы при р,Т – const.
• T∆S – стремление к
неупорядоченности системы
(вследствие роста энтропии)
Джозайя
Уиллард
Гиббс
1839-1903 гг.
26
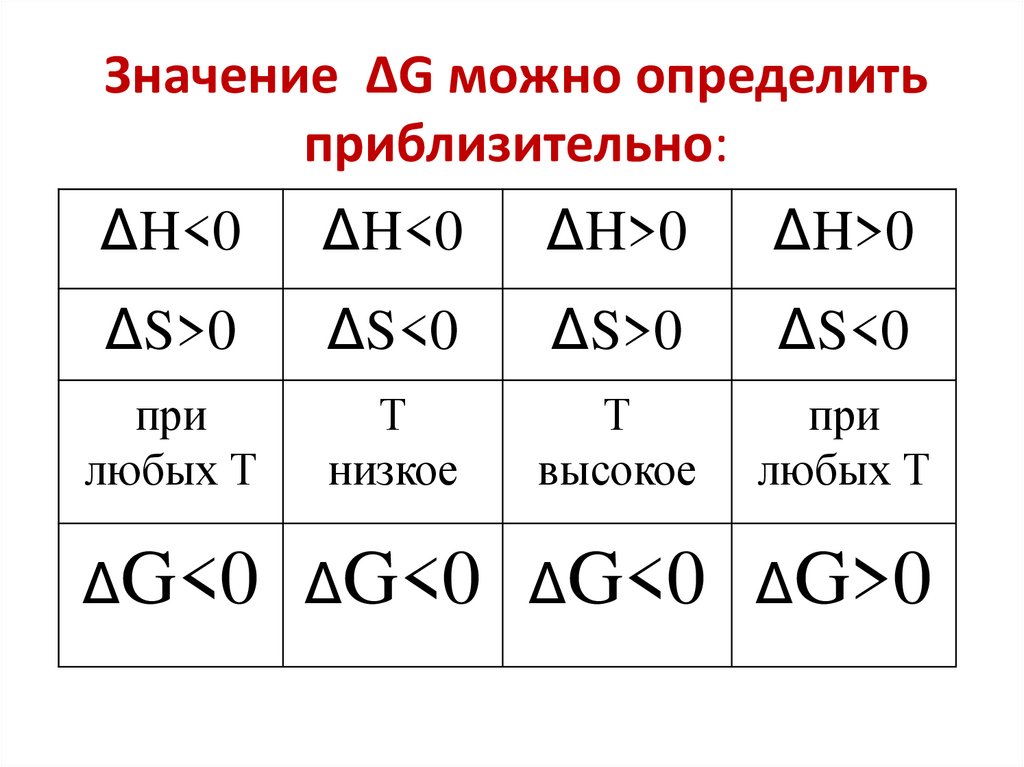
27. Значение ΔG можно определить приблизительно:
ΔH<0ΔH<0
ΔH>0
ΔH>0
ΔS>0
ΔS<0
ΔS>0
ΔS<0
при
любых Т
Т
низкое
Т
высокое
при
любых Т
ΔG<0 ΔG<0 ΔG<0 ΔG>0
28. На основании стандартных теплот образования и абсолютных стандартных энтропий вещества вычислите изменение энергии Гиббса
На основании стандартных теплот образования иабсолютных стандартных энтропий вещества
вычислите изменение энергии Гиббса реакции,
протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г)
Решение.
29. Пример Fe2O3(тв) +3Н2 (г) = 2Fe (тв) +3Н2О(г) ΔН х.р. = 96,61 кДж
Возможна ли данная реакция при стандартныхусловиях, если ΔSх.р. = 138,7 Дж/град?
ΔG = ΔH – TΔS
ΔG = 96,61 - 298×138,7×10–3 = 55,28 кДж,
т.к. ΔG>0 ,то реакция при стандартных
условиях невозможна, в этих условиях
идет обратная реакция.
Решение
30. Практические задания
1. Рассчитайте ∆rH0298 химической реакцииNa2O(т) + H2O(ж) = 2NaOH(т) по значениям стандартных
теплот образования веществ ∆ f Н0298. Укажите тип
реакции (экзо- или эндотермическая).
2. Вычислите тепловой эффект реакции горения
этилена С2Н4(г), учитывая, что ее продуктами являются
СО2 (г) и Н2О(ж).
3. Рассчитайте величину rSo298 для процесса
Na2O(т) + H2O(ж) = 2NaOH(т), используя значения
стандартных энтропий веществ
So298 (NaOH(т)) = 64,16 Дж/(моль×К),
So298 (Na2O(т) ) = 75,5 Дж/(моль×К),
So298 (H2O(ж) ) = 70 Дж/(моль×К).
31. Практические задания
4. Вычислите ∆rG0298 реакции 2N2O(г) + О2 (г) = 4NO(г),исходя из значений ∆ f Н0298 и ∆S°298 веществ. При
какой температуре в системе наступит равновесие?
Возможно ли самопроизвольное протекание
реакции при 456 К?
5. Не производя вычислений, установить
знак ∆S°298 следующих процессов:
а) 2NH3(г) = 3H2(г) + N2(г);
б) CО2(к) = СО2(г);
в) 2NO(г) + O2(г) = 2NO2(г);
г) 2H2S(г) + 3O2(г) = 2H2O(ж) + 2SO2(г);
д) 2СН3ОН(г) + 3О2(г) = 4Н2О(г) + 2СО2(г).




























 chemistry
chemistry








