Similar presentations:
Химическая термодинамика
1.
Химическая термодинамика2. Термодинамика
therme (теплота) + dinamis (сила)наука о силах, связанных с теплотой;
изучает взаимосвязь теплоты, работы и других видов энергии
Химическая термодинамика
изучает превращения энергии при химических реакциях:
энергетические эффекты химических процессов
возможность и направление
самопроизвольного протекания реакций
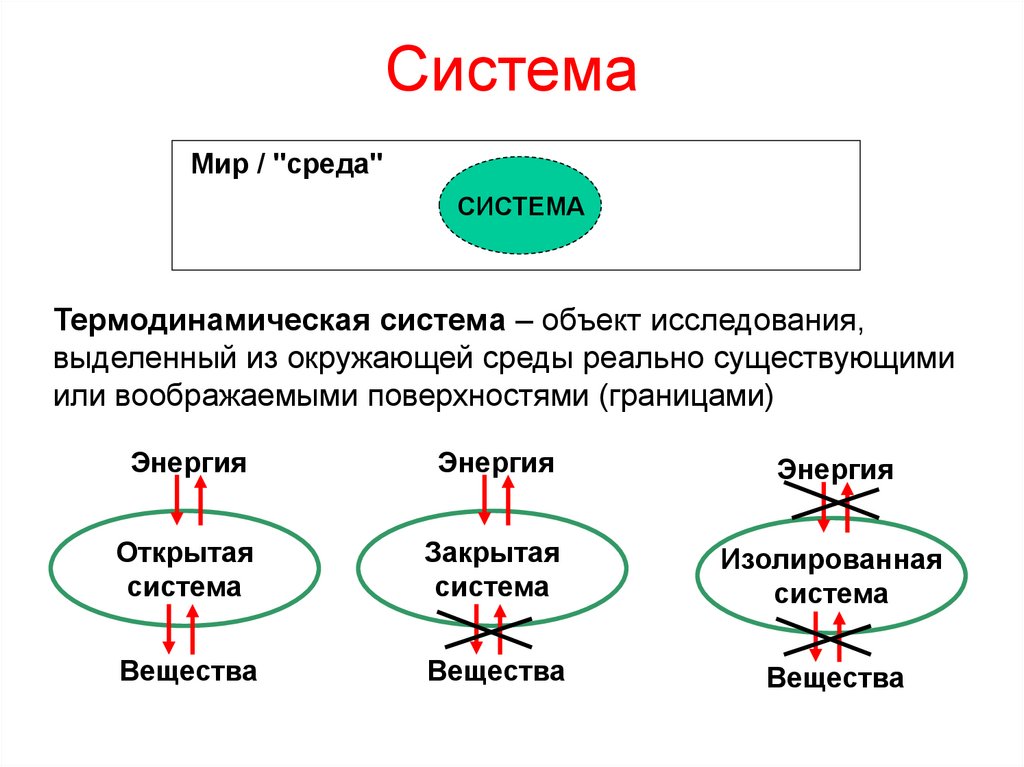
3. Система
Мир / "среда"СИСТЕМА
Термодинамическая система – объект исследования,
выделенный из окружающей среды реально существующими
или воображаемыми поверхностями (границами)
Энергия
Энергия
Энергия
Открытая
система
Закрытая
система
Изолированная
система
Вещества
Вещества
Вещества
4. Свойства системы
Совокупность свойств определяет состояние системыf (p, V, T) = 0 – функция состояния;
описывает свойства системы
(все свойства знать не обязательно)
pV = nRT
– уравнение состояния идеального газа
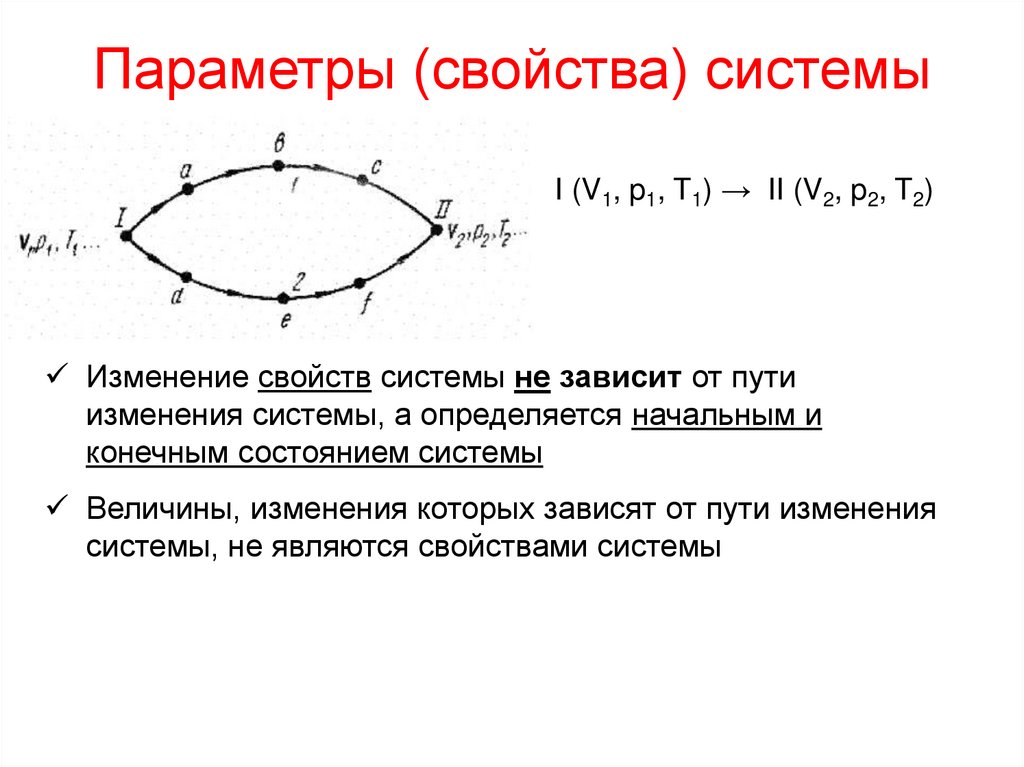
5. Параметры (свойства) системы
I (V1, p1, T1) → II (V2, p2, T2)Изменение свойств системы не зависит от пути
изменения системы, а определяется начальным и
конечным состоянием системы
Величины, изменения которых зависят от пути изменения
системы, не являются свойствами системы
6. Процессы
Процесс – переход системы из одного состояния в другоеизотермический (T = const)
изобарический (p = const)
изохорный (V = const)
изобарно-изотермический (p, T = const)
изохорно-изотермический (V, T = const)
адиабатический (отсутствует теплообмен)
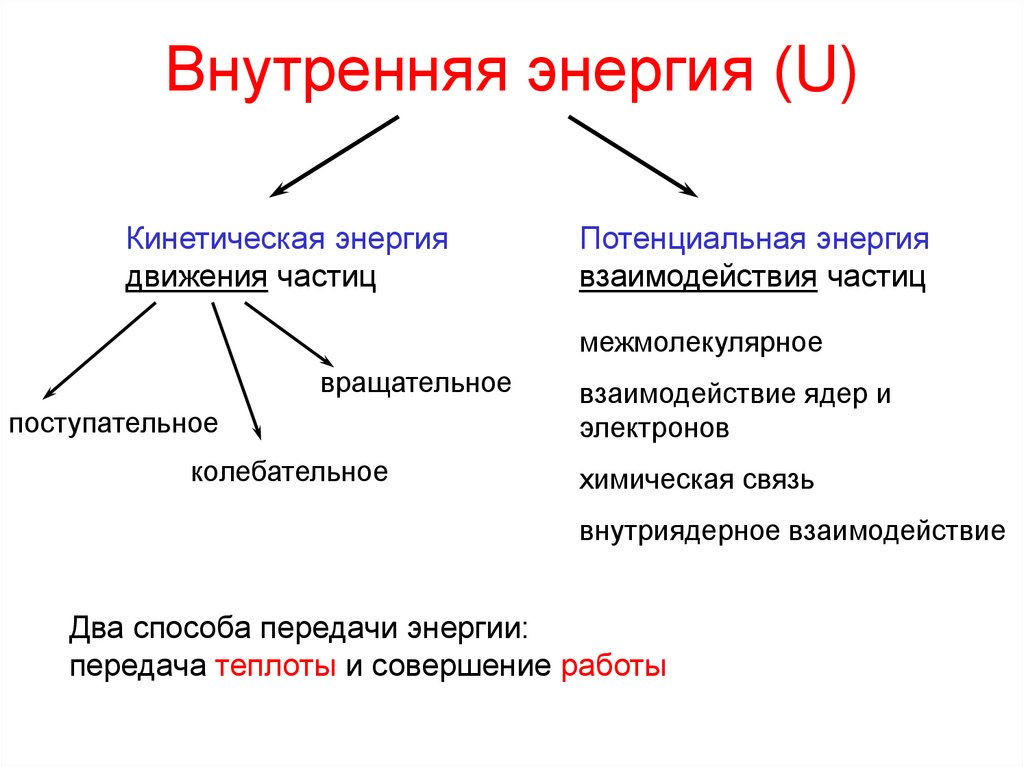
7. Внутренняя энергия (U)
Кинетическая энергиядвижения частиц
Потенциальная энергия
взаимодействия частиц
межмолекулярное
вращательное
поступательное
колебательное
взаимодействие ядер и
электронов
химическая связь
внутриядерное взаимодействие
Два способа передачи энергии:
передача теплоты и совершение работы
8. Теплота (Q)
Передача теплоты – "микрофизический" (на уровне молекул)способ передачи энергии от системы к системе путем
неупорядоченного движения молекул
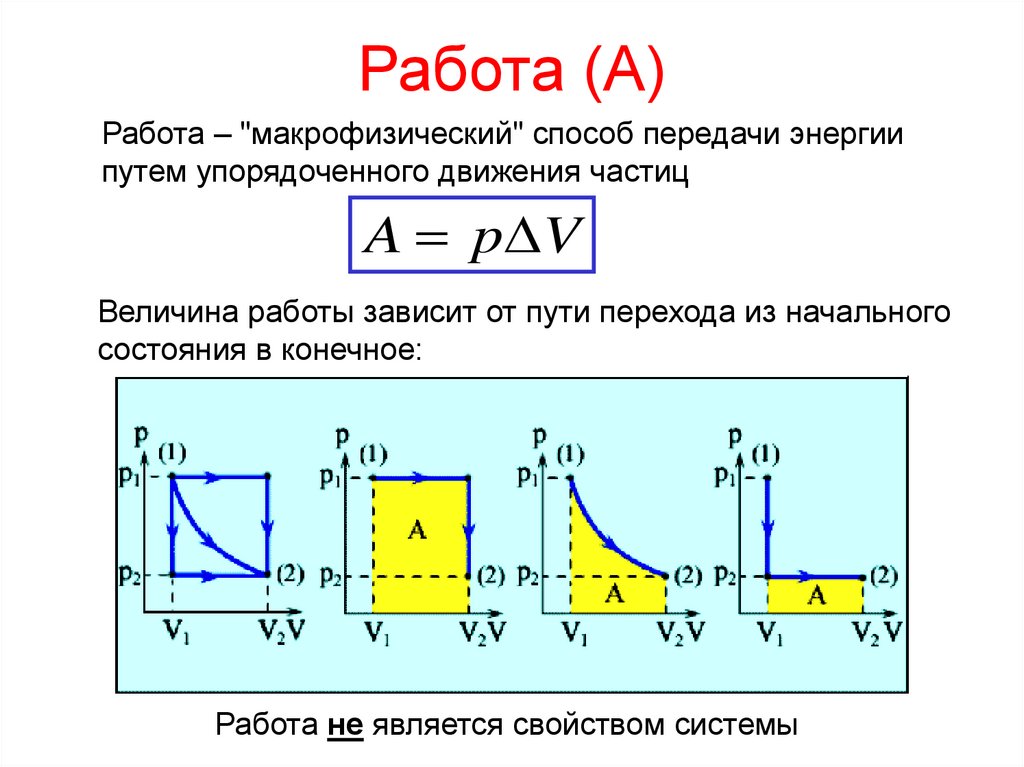
9. Работа (А)
Работа – "макрофизический" способ передачи энергиипутем упорядоченного движения частиц
A p V
Величина работы зависит от пути перехода из начального
состояния в конечное:
Работа не является свойством системы
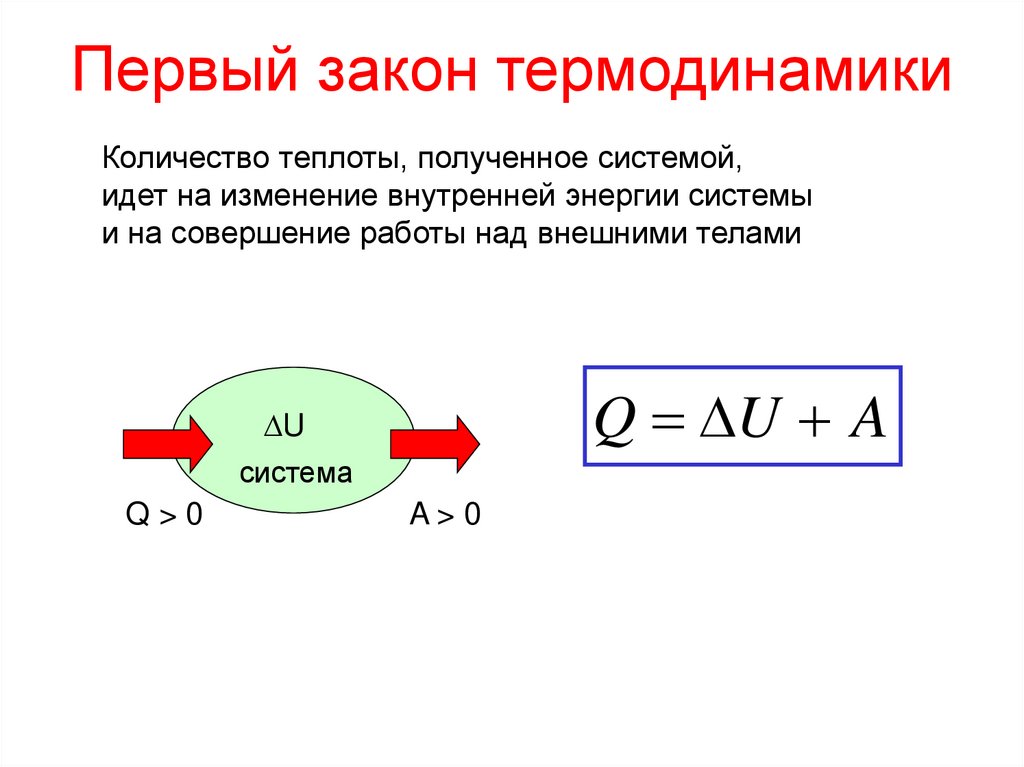
10. Первый закон термодинамики
Количество теплоты, полученное системой,идет на изменение внутренней энергии системы
и на совершение работы над внешними телами
Q U A
U
система
Q>0
A>0
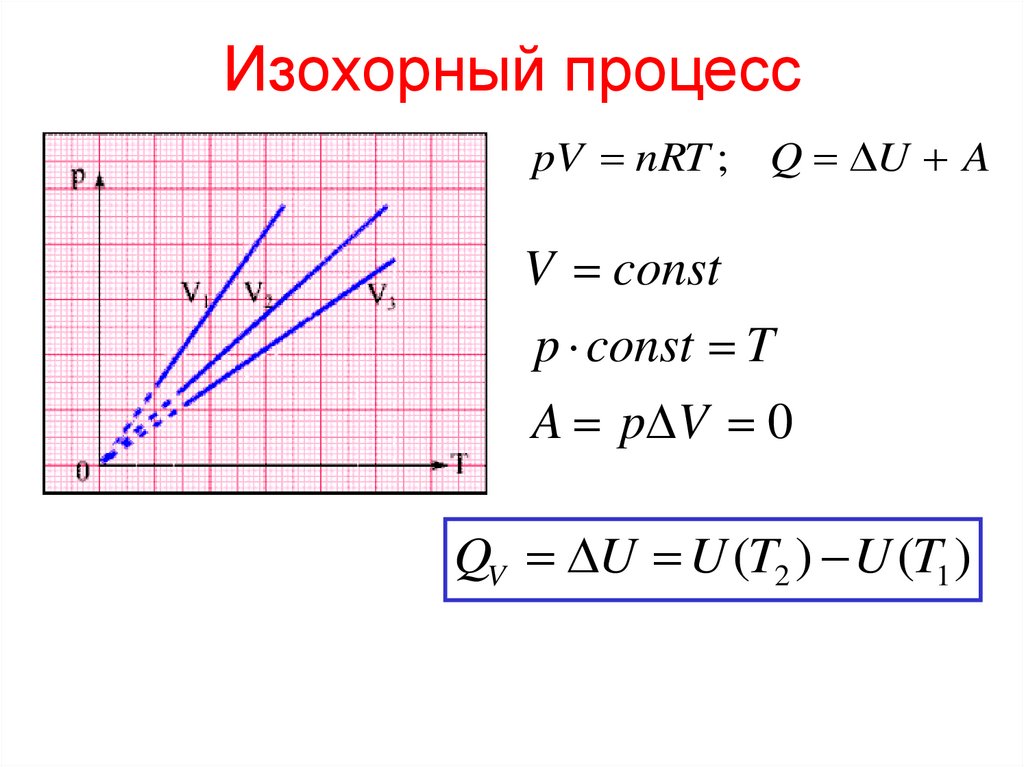
11. Изохорный процесс
pV nRT ; Q U AV const
p const T
A p V 0
QV U U (T2 ) U (T1 )
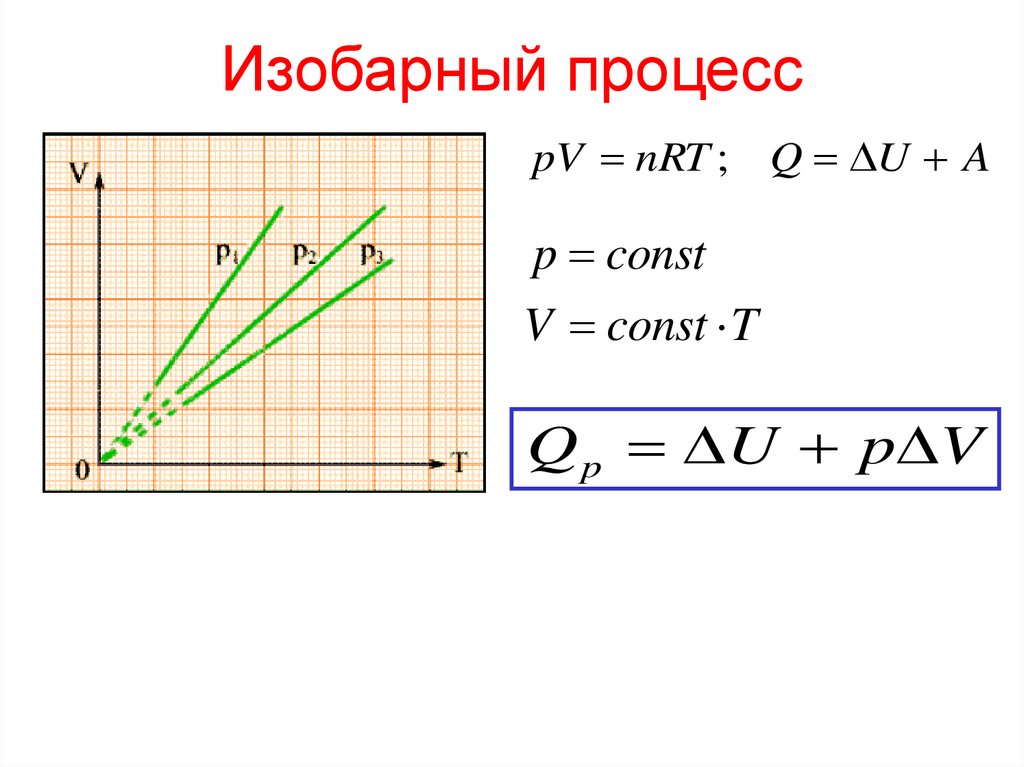
12. Изобарный процесс
pV nRT ; Q U Ap const
V const T
Q p U p V
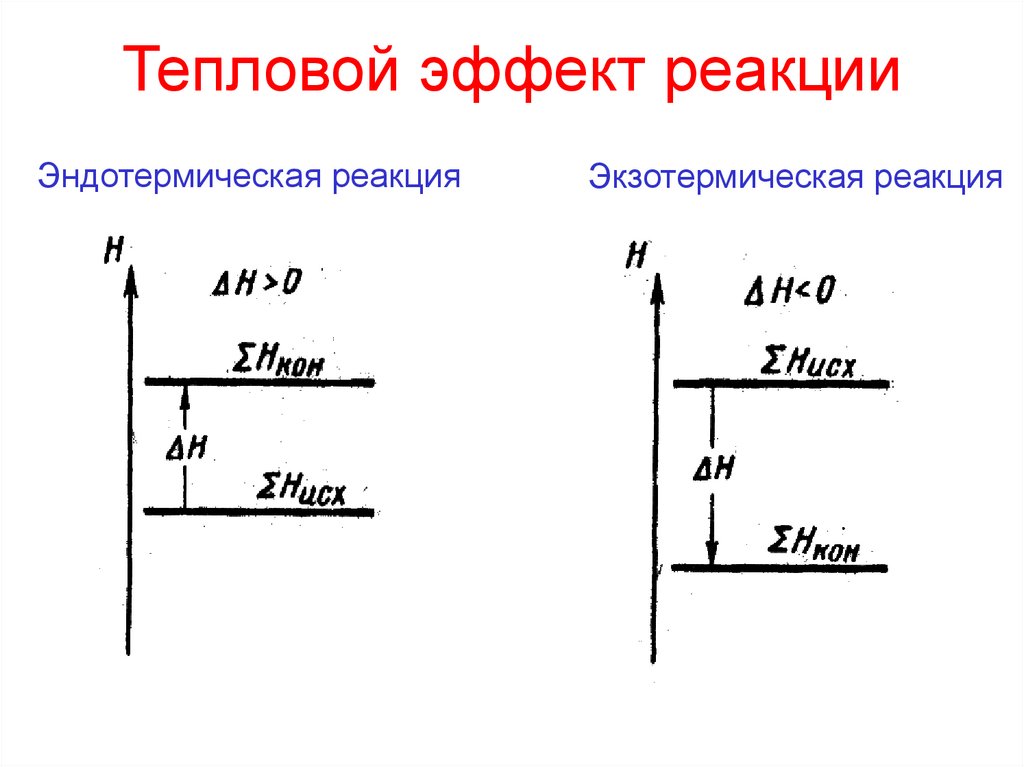
13. Тепловой эффект реакции
теплота, выделяющаяся или поглощающаясяпри химической реакции
V const : QV U
p const :
Q p U p V U 2 U1 p(V2 V1 )
(U 2 pV2 ) (U1 pV1 ) H 2 H1 H
H U pV энтальпия
QV Q p тепловой эффект зависит
от условий реакции
14. Тепловой эффект реакции
Эндотермическая реакцияЭкзотермическая реакция
15. Термохимические уравнения
химические уравнения, в которых указан тепловой эффектреакции
Стандартные условия:
устойчивая модификация вещ-ва
р = 1атм. = 101325 Па
Т любая, обычно 298,15 К (25 С)
H T – дельта аш стандартное при Т (К)
0
1 2 H 2 ( г ) 1 2Cl2 ( г ) HCl ( г ) ; H 298
92 кДж
0
1 2 N 2 ( г ) 1 2O2 ( г ) NO( г ) ; H 298
90,37 кДж
16. Стандартная теплота образования
Теплота образования (formation) – тепловой эффект реакцииобразования 1 моля вещества из простых веществ, устойчивых
в указанных условиях
0
H 2 ( г ) 1 2 O2 ( г ) H 2O( г ); f H 298
241,8 кДж
0
H 2 ( г ) 1 2 O2 ( г ) H 2O( ж); f H 298
285,91 кДж
0
H 2 ( г ) 1 2 O2 ( г ) H 2O(тв); f H 298
291,85 кДж
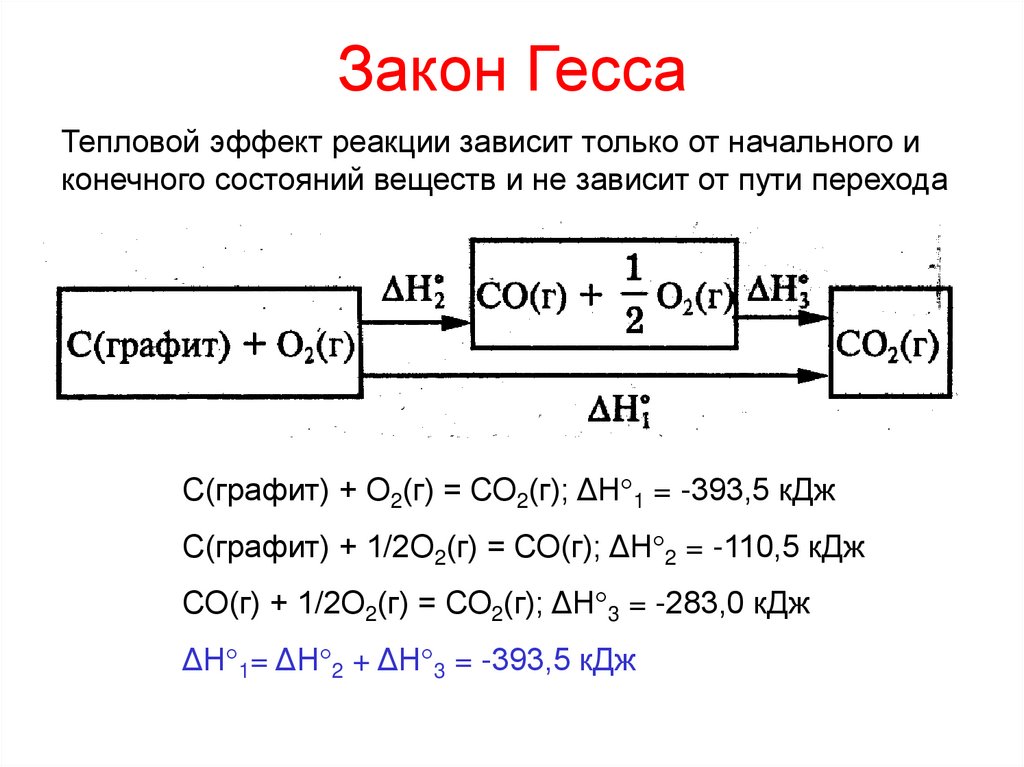
17. Закон Гесса
Тепловой эффект реакции зависит только от начального иконечного состояний веществ и не зависит от пути перехода
С(графит) + О2(г) = СО2(г); ΔН 1 = -393,5 кДж
С(графит) + 1/2О2(г) = СО(г); ΔН 2 = -110,5 кДж
СО(г) + 1/2О2(г) = СО2(г); ΔН 3 = -283,0 кДж
ΔН 1= ΔН 2 + ΔН 3 = -393,5 кДж
18. Следствия из закона Гесса
Закон Лавуазье-Лапласа. Тепловой эффект обратной реакцииравен тепловому эффекту прямой реакции с обратным знаком
A B; H1
B A; H 2
H1 H 2
Тепловой эффект реакции ΔrH равен сумме теплот образования
конечных продуктов реакции за вычетом суммы теплот
образования исходных веществ
r H 0 vпрод f H 0 прод vисх f H 0исх
19. Термохимические расчеты
Примеры1) Используя табличные значения энтальпий образования,
определите стандартную энтальпию реакции:
3Mn3O4(т) + 8Al(т) = 9Mn(т) + 4Al2O3(т)
2) Реакция горения ацетилена выражается
термохимическим уравнением:
C2H2(г) + 2,5O2(г) = 2CO2(г) + H2O(г); Н0298 = - 1256 кДж
Рассчитайте теплоту образования ацетилена.
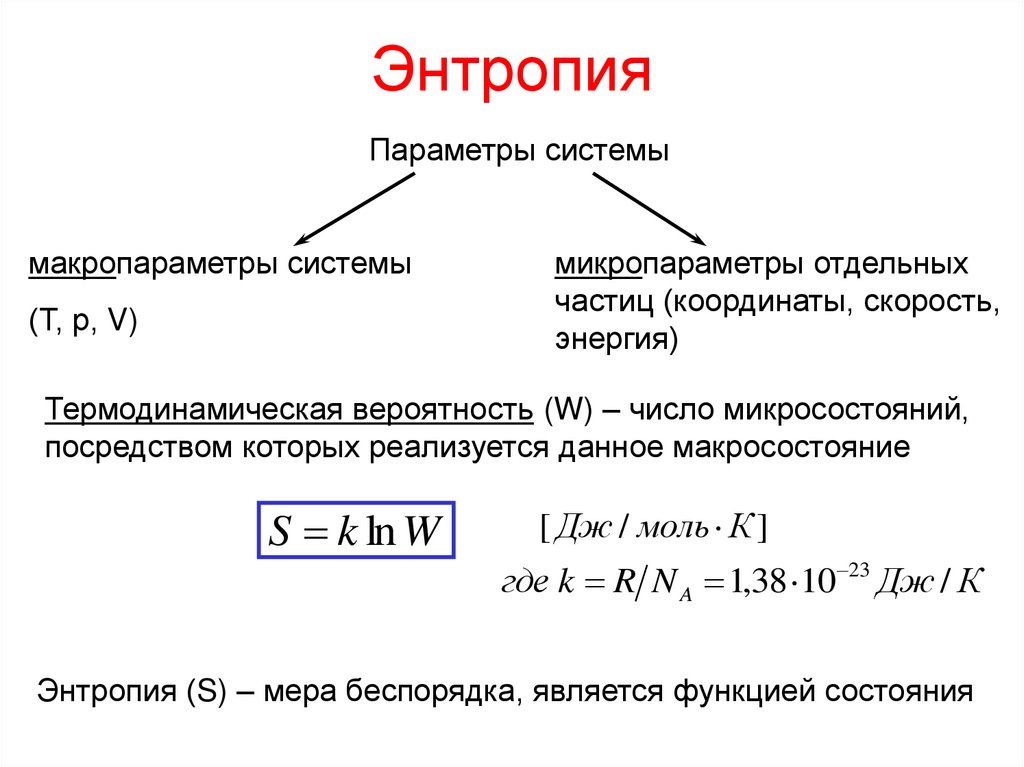
20. Энтропия
Параметры системымакропараметры системы
(Т, р, V)
микропараметры отдельных
частиц (координаты, скорость,
энергия)
Термодинамическая вероятность (W) – число микросостояний,
посредством которых реализуется данное макросостояние
S k ln W
[ Дж / моль К ]
где k R N A 1,38 10 23 Дж / К
Энтропия (S) – мера беспорядка, является функцией состояния
21. Изменение энтропии в химических реакциях
r S 0 vпродS 0 прод vисх S 0исхПример
Определить изменение энтропии в ходе реакции:
2С(тв.) + О2(г) = 2СО(г)
S0298 (C) = 5,74 Дж/моль·К
S0298 (O2) = 205,04 Дж/моль·К
S0298 (CO) = 197,54 Дж/моль·К
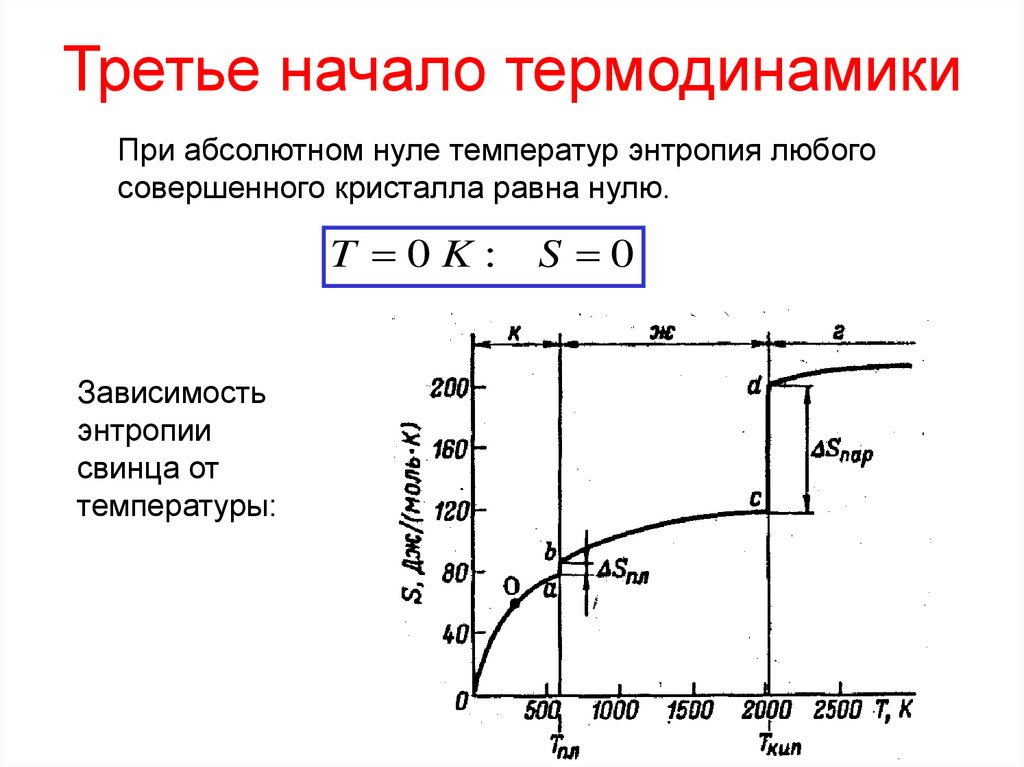
22. Третье начало термодинамики
При абсолютном нуле температур энтропия любогосовершенного кристалла равна нулю.
T 0K:
Зависимость
энтропии
свинца от
температуры:
S 0
23. Самопроизвольные процессы
Экзотермические реакцииПринцип Бертло-Томсена. Самопроизвольный химический
процесс должен сопровождаться выделением тепла. H<0
Эндотермические реакции – ?
NH 4 NO3 NH 4 aq NO3 aq ; H 0
Направление самопроизвольно протекающих процессов
устанавливает второй закон термодинамики
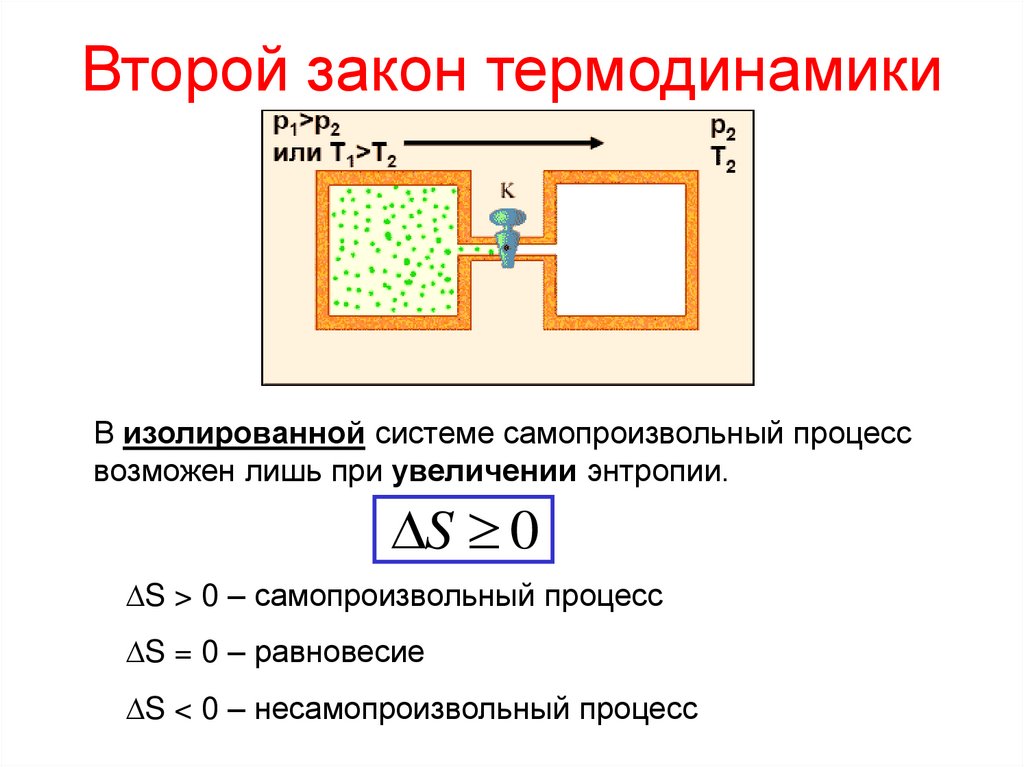
24. Второй закон термодинамики
В изолированной системе самопроизвольный процессвозможен лишь при увеличении энтропии.
S 0
S > 0 – самопроизвольный процесс
S = 0 – равновесие
S < 0 – несамопроизвольный процесс
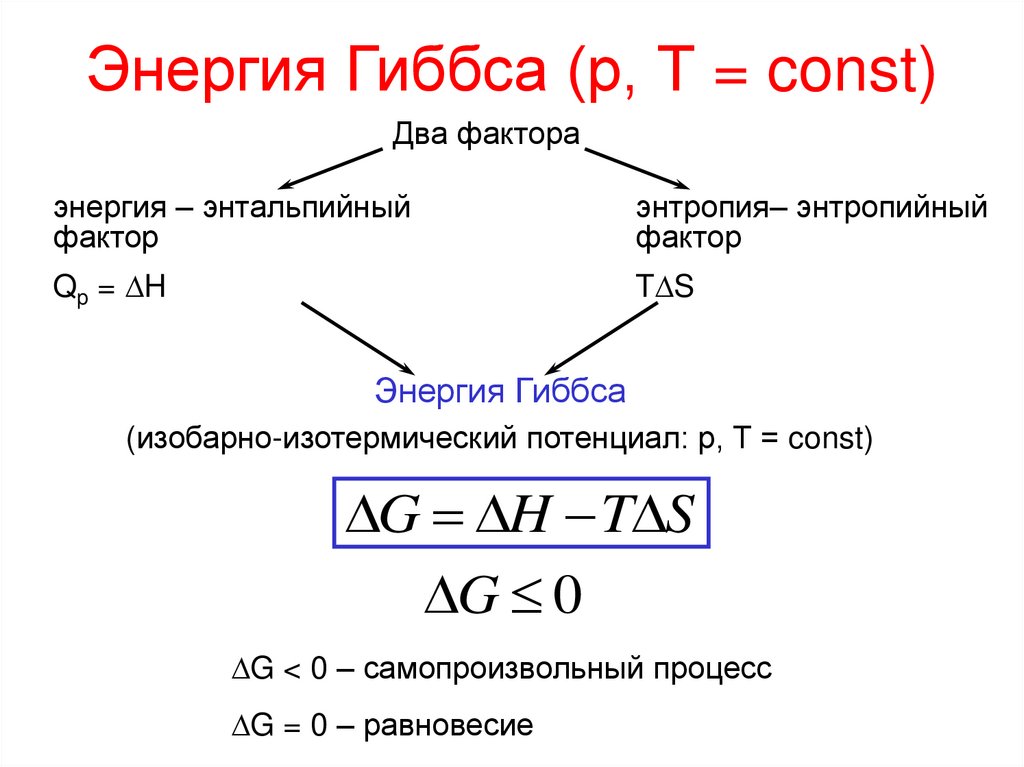
25. Энергия Гиббса (р, Т = const)
Два фактораэнергия – энтальпийный
фактор
энтропия– энтропийный
фактор
Qp = H
T S
Энергия Гиббса
(изобарно-изотермический потенциал: р, Т = const)
G H T S
G 0
G < 0 – самопроизвольный процесс
G = 0 – равновесие
26. II закон т.д. для химических процессов
Химическая реакция протекает самопроизвольно в томнаправлении, при котором происходит уменьшение энергии
Гиббса:
G H T S 0
ΔH < 0, ΔS > 0 – самопроизвольный процесс.
2С(тв.) + О2(г) = 2СО(г)
ΔH > 0, ΔS < 0 – несамопроизвольный процесс.
3О2(г) = 2О3(г) (эл. разряд)
ΔH > 0, ΔS > 0 – процесс протекает при |ΔH| < |TΔS|
2Сu2O(тв.) = 4Cu(тв) + O2(г)
ΔH < 0, ΔS < 0 – процесс протекает при |ΔH| > |TΔS|
2NO2(г) = N2O4(г)
27. Изменение энергии Гиббса
rG0
298
vпрод f G
0
298прод
vисх f G
0
298исх
Пример
Вычислить стандартное изменение энергии Гиббса при 25 С
для термического разложения CaCO3, если ΔH0 = +178
кДж\моль, ΔS0 = +161 Дж\мольК.
Может ли эта реакция протекать самопроизвольно при 25 С?
При какой температуре становится возможным
самопроизвольное протекание реакции?














 chemistry
chemistry








