Similar presentations:
Законы химической термодинамики. Энергетика химических процессов. Термодинамические законы
1. Законы химической термодинамики. Энергетика химических процессов
1. Термодинамические законы – первый, второй,третий.
2. Внутренняя энергия, энтальпия, энтропия.
3. Стандартные характеристические функции.
4. Термохимические законы Гесса и их следствия.
5. Изменение энтальпии системы в различных
процессах.
6. Изменение энтропии при химических
процессах и фазовых переходах.
7. Свободная энергия Гиббса.
2. Химическая система - это совокупность веществ находящихся во взаимодействии, мысленно (или фактически) обособленная от
окружающей среды.Химическая термодинамика – раздел химии, который
изучает превращения энергии в ходе химической реакции и
способность химических систем выполнять полезную работу.
Химическая термодинамика изучает:
1. переходы химической энергии в другие формы - тепловую,
электрическую и. т.д.,
2. энергетические эффекты химических реакций,
3. возможность и направление самопроизвольно
протекающей реакции,
4. состояние химического равновесия и условия его смещения.
3.
С точки зрения химической термодинамикиэнергетическое состояние системы
характеризуют следующие параметры:
P – давление
T – температура
V – объем
U – внутренняя энергия
H – энтальпия вещества
S – энтропия
G – энергия Гиббса
4.
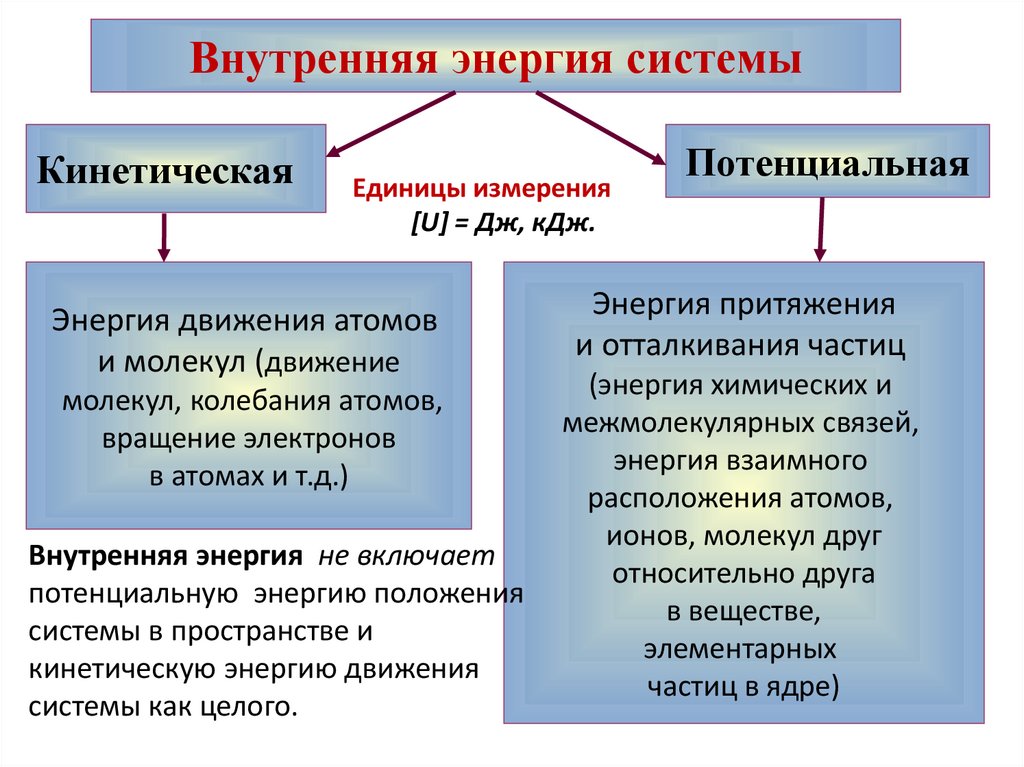
Внутренняя энергия системыКинетическая
Единицы измерения
[U] = Дж, кДж.
Энергия движения атомов
и молекул (движение
молекул, колебания атомов,
вращение электронов
в атомах и т.д.)
Внутренняя энергия не включает
потенциальную энергию положения
системы в пространстве и
кинетическую энергию движения
системы как целого.
Потенциальная
Энергия притяжения
и отталкивания частиц
(энергия химических и
межмолекулярных связей,
энергия взаимного
расположения атомов,
ионов, молекул друг
относительно друга
в веществе,
элементарных
частиц в ядре)
5.
Абсолютное значение внутренней энергииопределить невозможно, однако можно измерить
ее изменение ΔU при переходе из одного состояния
в другое.
Оно не зависит от пути и способа перехода
системы из одного состояния в другое.
ΔU = U2 – U1
U2 и U1 - внутренняя энергия системы в конечном и
начальном состояниях соответственно.
• Если система поглотила количество теплоты и
совершила работу, то
ΔU = Q - A
6. Первый закон термодинамики
Выражает количественное соотношение междуизменением внутренней энергии, теплотой и
работой
:
Q = ΔU + A
Теплота Q, подведенная к системе,
расходуется на увеличение ее
внутренней энергии ΔU и на
совершение системой работы А.
Если А – это работа расширения, то
A = PΔV
7. Термодинамический процесс
- это изменение состояния системы,сопровождающийся изменением хотя бы
одного из параметров системы во времени.
В зависимости от условий перехода системы
из одного состояния в другое в термодинамике различают следующие процессы:
• изотермические Т- const,
• изобарные Р-const,
• изохорные V-const.
8. Изобарный процесс
Для изобарного процесса Р = const.Первый закон ТД:
Qр = ΔU+P×ΔV = (U2-U1) + P(V2-V1) =
= (U2+PV2)-(U1+PV1)
обозначим через
Н = U+PV
Тогда
Qр = H2 - H1 = ΔН.
В изобарных процессах тепловой эффект
химической реакции равен изменению
энтальпии (Н).
9. Функции состояния системы
Энтальпия - это функция состояния системы,изменение которой равно теплоте, поступившей в
систему в изобарном процессе.
Энтальпию часто называют «тепловой
функцией» или «теплосодержанием» системы.
• Абсолютное значение энтальпии измерить
невозможно, поэтому измеряют ее приращение:
Hсистемы = Hкон - Hнач
10.
Раздел химической термодинамики,изучающий тепловые эффекты
химических реакций и процессов,
называется термохимией.
Из 1 начала термодинамики следует, что
теплота поглощенная или
выделившаяся в процессе, т.е. тепловой
эффект (при P=const), равна изменению
энтальпии системы.
11. Закон сохранения энергии
- энергия не исчезает и не возникает, онапереходит из одной формы в другую в
строго определенных, всегда в
эквивалентных количествах.
Отличительной чертой хим. реакций
является глубокое изменение системы
взаимодействующих веществ,
сопровождающееся выделением или
поглощением энергии.
12. Тепловой эффект реакции
- это количество теплоты, котороевыделяется или поглощается системой
после протекания химической реакции
В
термохимии
приняты
знаки,
противоположные
используемым
в
термодинамике (ТД).
Теплота, выделенная системой, считается
положительной. При этом, с точки зрения ТД,
система теряет энергию т.е.
Q > 0 , ∆H < 0 - реакция экзотермическая.
Полученная
системой
теплота
считается
отрицательной:
Q < 0 , ∆H > 0 - реакция эндотермическая
13. Термохимическое уравнение
это уравнение химической реакции в котором указан
тепловой эффект химической реакции и агрегатные
состояния.
• В термохимических уравнениях, указываются значения
тепловых эффектов при постоянном давлении Qp,
равные изменению энтальпии системы H.
• Значение Н приводят обычно в правой части
уравнения, отделяя его запятой или точкой с запятой.
C2H6(г) + 3½O2 = 2 CO2(г) + 3H2O (ж);
Hх.р = -1559,87кДж
14. Виды агрегатного состояния вещества
т – твердоек – кристаллическое,
ам. – аморфное,
ж – жидкое,
г – газообразное,
р – растворимое
Эти символы опускаются, если агрегатное
состояние веществ очевидно.
CaCO3( к ) CaO( к ) СО2( г )
15. Пример. При взаимодействии 1 моль кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС13 и хлористый водород.
Реакциясопровождается выделением 111,4кДж теплоты.
Напишите термохимическое уравнение этой реакции.
• Решение
Если в результате реакции выделяется теплота,
то H < 0. Учитывая сказанное, составляем
термохимическое уравнение данной в
примере реакции:
РС15(к) + Н2О(г) = РОСl3(ж) + 2НС1(г);
∆Нхр = -111,4 кДж
16.
Энтальпия образованияданного соединения называют тепловой эффект
реакции образования 1 моль этого соединения из
простых веществ, взятых в их устойчивом состоянии
при данных условиях.
• Для сравнения энтальпий образования различных соединений
их определяют при стандартных условиях:
Т=298 К Р=101,3 КПа, 1 атм., 760 мм.рт.ст.
• Энтальпия образования определенная при стандартных
условиях называется стандартной энтальпией
образования вещества и обозначается
Н
0
Так как тепловой эффект с температурой
обр изменяется незначительно, то индексы
опускаются, и тепловой эффект обозначается
через
Н.
17. Единицы измерения энтальпии образования
Единицы измерениякДж
0
энтальпии образования [ Н обр ]
моль
Значения стандартных энтальпий
образования приведены в таблицах,
необходимо обращать внимание на
агрегатные состояния веществ
Энтальпии образования устойчивых простых
веществ равны нулю. Например, для твердого
йода энтальпия образования равна Н 0 0;
О
нулю, а для газообразного йода
кДж
0
не равна нулю.
Н 142
;
2
О3
моль
кДж
0
Н О 246
.
моль
18. Закон Гесса (1836г)
• Тепловой эффектхимической реакции
определяется лишь
начальным и
конечным состояниями
системы реагирующих
веществ и не зависит
от пути ее протекания.
Герман Иванович Гесс
(1802-1850)- русский
химик, академик
Петербургский АН,
врач по образованию,
основоположник
термохимии.
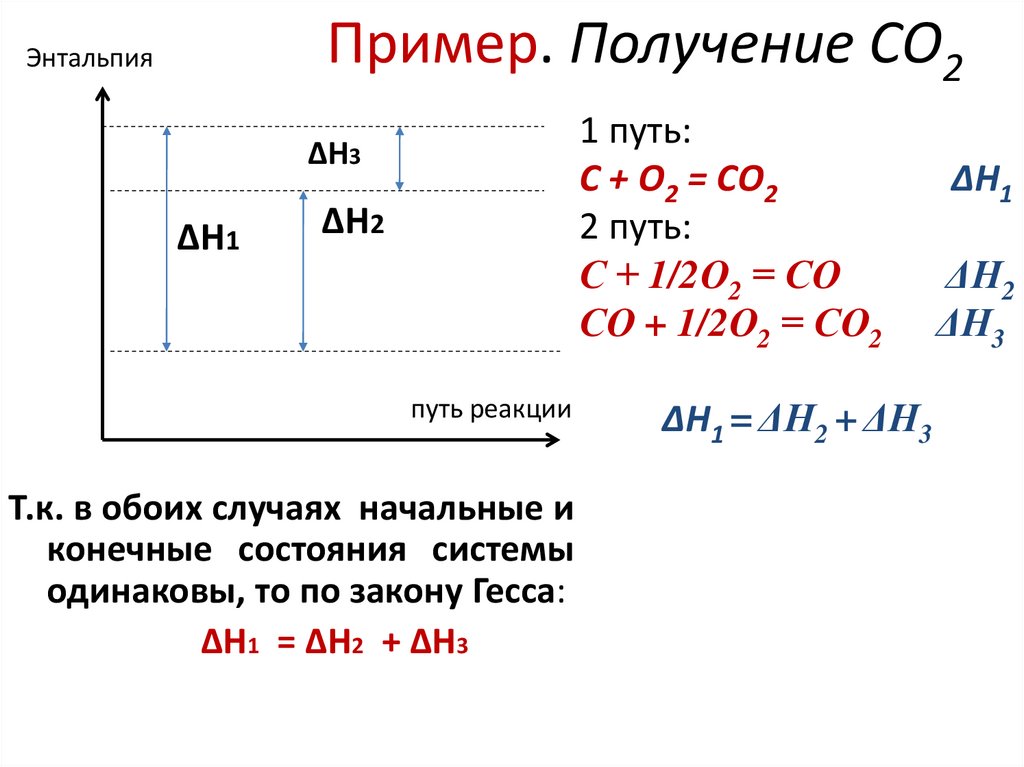
19. Пример. Получение СО2
Энтальпия1 путь:
С + О2 = СО2
2 путь:
С + 1/2О2 = СО
СО + 1/2О2 = СО2
∆H3
∆H1
∆H2
путь реакции
Т.к. в обоих случаях начальные и
конечные состояния системы
одинаковы, то по закону Гесса:
∆H1 = ∆H2 + ∆H3
ΔН1 = ΔН2 + ΔН3
ΔН1
ΔН2
ΔН3
20. Следствие из закона Гесса
• Теплота химической реакции равна разностимежду суммой энтальпий образования продуктов
реакции и суммой энтальпий образования
исходных веществ.
• Необходимо учитывать стехиометрические
коэффициенты.
Н
0
хим. р .
(nпрод. Н
0
f , прод
) (nисх. Н
0
f ,исх
)
21. Пример. Рассчитать ΔН0 химической реакции
2 Mg CO2 2 MgO CкДж
H
611
моль
кДж
0
H СO 393,5
моль
0
0
0
H хим
2
*
H
H
. р.
MgO
СO
0
MgO
2
2
0
H хим
. р . 2 * ( 611) ( 393,5) 828,5кДж
22. Пример: Рассчитайте тепловой эффект реакции:
Ответ: - 1034, 0 кДжРеакция экзотермическая
23. Закон Гесса
Задача. Рассчитать тепловой эффектреакции спиртового брожения глюкозы,
исходя из стандартных энтальпий сгорания:
С6Н12О6 (к) = 2С2Н5ОН(ж) + 2СО2 (г).
ΔН0сгор(С6Н12О6 (к)) = - 2815,78 кДж · моль-1
ΔН0сгор(С2Н5ОН(ж)) = - 1366,9 кДж · моль-1
Решение: по второму следствию закона Гесса:
ΔН0х.р. = ΔН0сгор(С6Н12О6 (к)) - 2ΔН0сгор(С2Н5ОН(ж)) =
= - 82 кДж · моль-1.
Реакция экзотермическая.
24. Пример. Рассчитать ΔН0 MgO
SiO2 2 Mg 2MgO Si 350 .7 кДжкДж
Н 827 .2
моль
Решение :
0
SiO2
0
0
0
Н хим
2
Н
Н
. р.
MgO
SiO
2
0
Н MgO
0
0
Н хим
Н
. р.
SiO
2
2
0
Q Н Н хим
350 .7кДж
. р.
Н
0
MgO
( 350 .7) ( 827 .2)
кДж
588 .95
2
моль
25. Задача
Вычислите ΔН0 для SO3 если при сгорании 64гсеры выделилось 790 кДж тепла.
Решение:
S + 3/2 O2 = SO3
64 г S – 790 кДж
32 г S – Х кДж
Х = 395 кДж тепла
ΔН0(SO3) = - 395кДж/моль
26. Задача
Сколько тепла выделится привзаимодействии 4,48 литров N2 (н.у.) с Н2 ,
если ΔН0 (NH3)= –46 кДж/моль.
Решение:
½N2 +3/2H2 =NH3
11,2 л
N2 –
– 46 кДж
4,48 л
N2 –
Х
кДж
Х=18,4кДж тепла.
27. Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г
железа.Решение:
Уравнение реакции:
Значения стандартных теплот образования веществ приведены в
специальных таблицах. Теплоты образования простых веществ
условно приняты равными нулю. Рассчитаем тепловой эффект
реакции, используя следствие из закона Гесса, получим:
=
(Al2O3) (Fe2O3) = -1669,8 -(-822,1) = - 847,7 кДж
Вычисление количества теплоты, которое выделяется при
получении 335,1 г железа, производим из пропорции:
(2 . 55,85) : -847,7 = 335,1 : х;
х = (0847,7 . 335,1)/ (2 . 55,85) = 2543,1 кДж,
где 55,85 атомная масс железа.
Ответ: 2543,1 кДж.

























 chemistry
chemistry








