Similar presentations:
Разнообразие ферментов. Уравнение Хилла. Ингибирование ферментов
1. РАЗНООБРАЗИЕ ФЕРМЕНТОВ. УРАВНЕНИЕ ХИЛЛА. ИНГИБИРОВАНИЕ ФЕРМЕНТОВ.
2.
1. Аллостерические эффекторы.2. Особенности аллостерических ферментов.
3. Кинетика реакций с участием аллостерических
ферментов. Уравнение Хилла. Принцип
кооперативности.
4. Модели аллостерических ферментов.
5. Влияние рН и температуры на скорость
ферментативных реакций (для
самостоятельного изучения).
6. Ингибирование ферментов.
3.
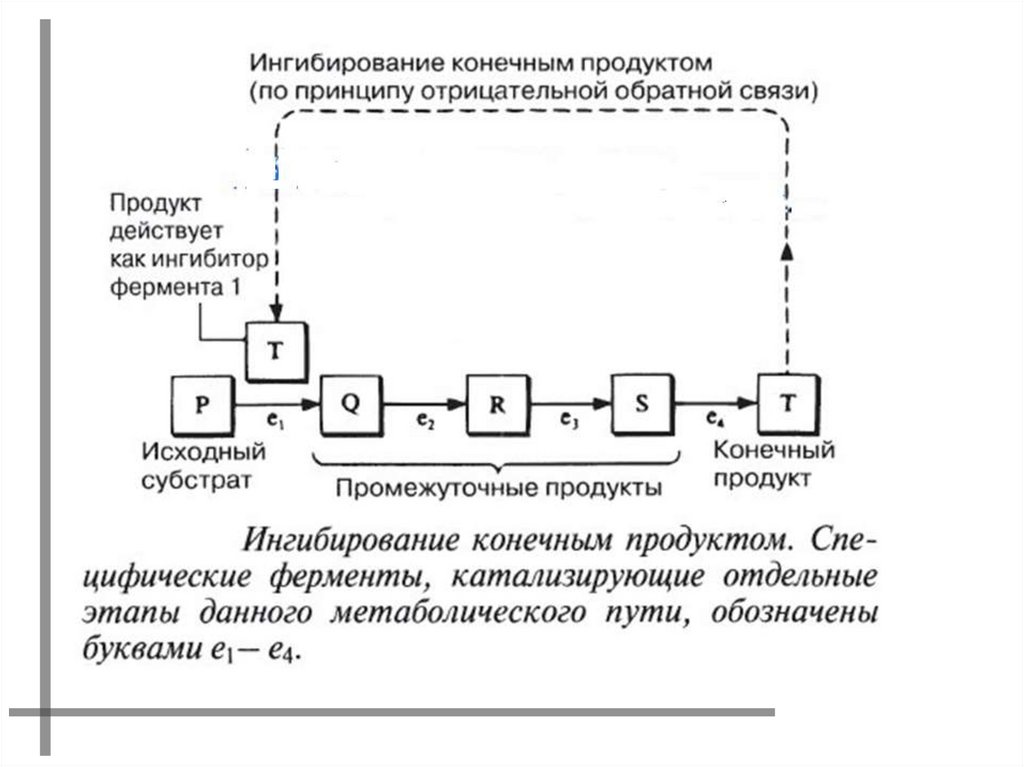
ДЛЯ МНОГИХ ФЕРМЕНТОВ, КАТАЛИЗИРУЮЩИХКЛЮЧЕВЫЕ СТАДИИ МЕТАБОЛИЗМА, ХАРАКТЕРНА
ЧУВСТВИТЕЛЬНОСТЬ К МЕТАБОЛИТАМ, КОТОРЫЕ
ОТЛИЧАЮТСЯ ПО ХИМИЧЕСКОЙ СТРУКТУРЕ ОТ
СУБСТРАТОВ ЭТИХ ФЕРМЕНТОВ.
ПРИМЕР: ИНГИБИРОВАНИЕ ПЕРВОГО ФЕРМЕНТА
БИОСИНТЕТИЧЕСКОГО ПУТИ КОНЕЧНЫМ ПРОДУКТОМ
РЕАКЦИИ
4.
5.
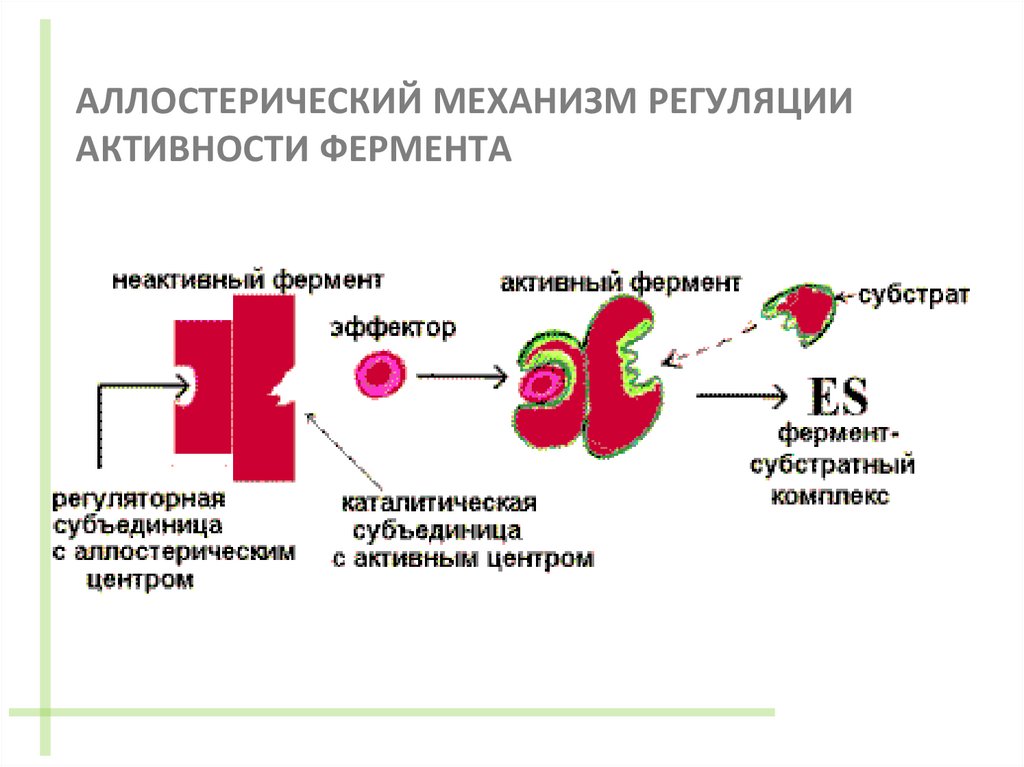
Термин «аллостерический» (ОТ ГРЕЧЕСКОГО «АЛЛОС» - ДРУГОЙ И«СТЕРЕО» - ПРОСТРАНСТВЕННЫЙ)
был предложен Ж. Мано и Ф. Жакобом в 1961 г.
Они предположили, что взаимодействие эффектора с
аллостерическим центром вызывает в молекуле
фермента конформационные изменения,
затрагивающие активный центр, в результате чего
активность фермента изменяется.
6. АЛЛОСТЕРИЧЕСКИЙ МЕХАНИЗМ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТА
7.
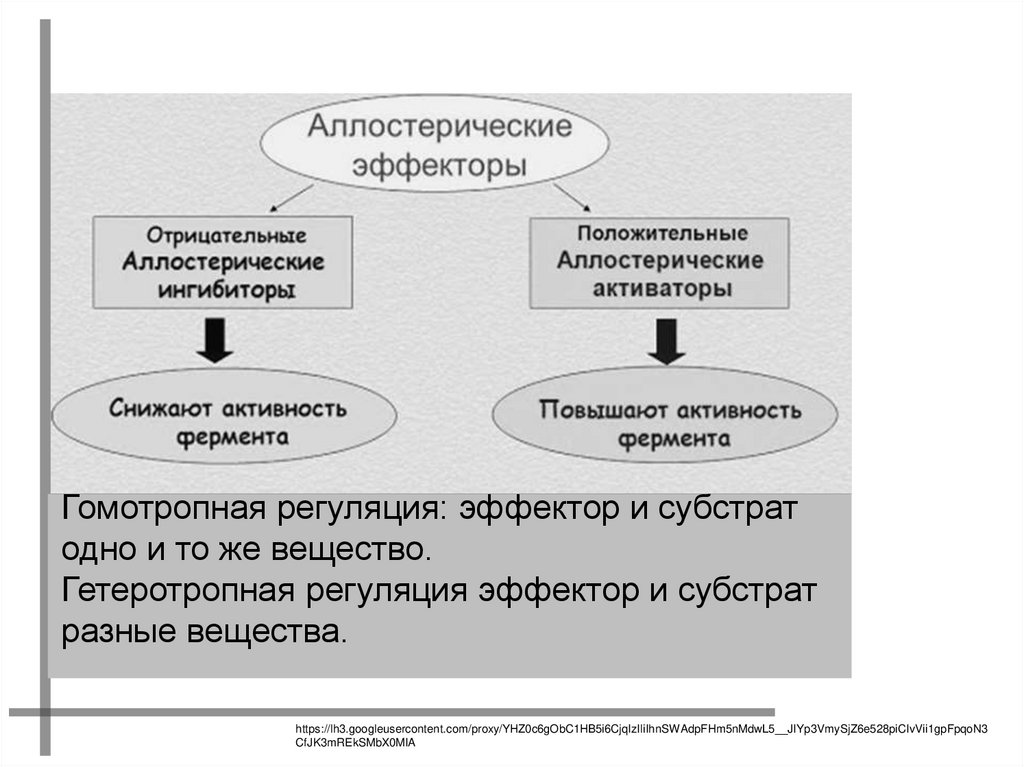
ОСОБЕННОСТИ АЛЛОСТЕРИЧЕСКИХ ЭФФЕКТОРОВРЕГУЛИРУЮТ АКТИВНОСТЬ ФЕРМЕНТОВ, НЕ ЗАТРАГИВАЯ
АКТИВНЫЙ ЦЕНТР.
ПРИСОЕДИНЯЮТСЯ К МОЛЕКУЛЕ ФЕРМЕНТА ВНЕ
АКТИВНОГО ЦЕНТРА.
ПРИСОЕДИНЕНИЕ СУБСТРАТА
ЛИБО ОБЛЕГЧАЕТСЯ (АКТИВАТОРЫ),
ЛИБО СТАНОВИТСЯ НЕВОЗМОЖНЫМ (ИНГИБИТОРЫ)
8.
Гомотропная регуляция: эффектор и субстратодно и то же вещество.
Гетеротропная регуляция эффектор и субстрат
разные вещества.
https://lh3.googleusercontent.com/proxy/YHZ0c6gObC1HB5i6CjqIzIliIhnSWAdpFHm5nMdwL5__JIYp3VmySjZ6e528piCIvVii1gpFpqoN3
CfJK3mREkSMbX0MIA
9.
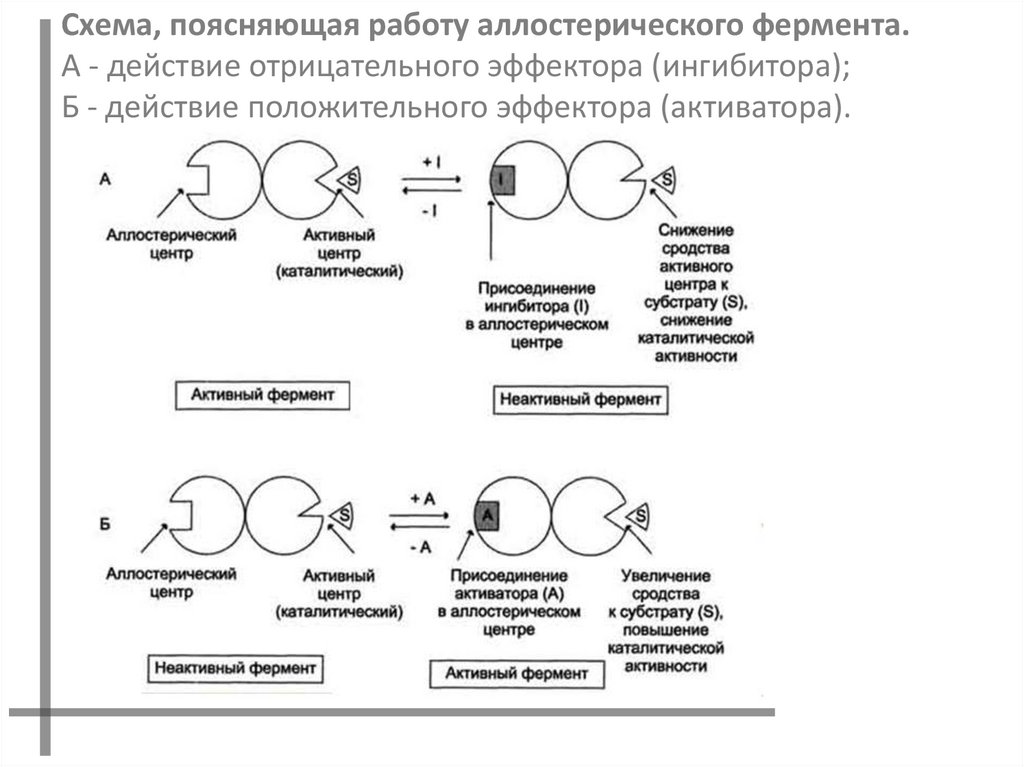
Схема, поясняющая работу аллостерического фермента.А - действие отрицательного эффектора (ингибитора);
Б - действие положительного эффектора (активатора).
10.
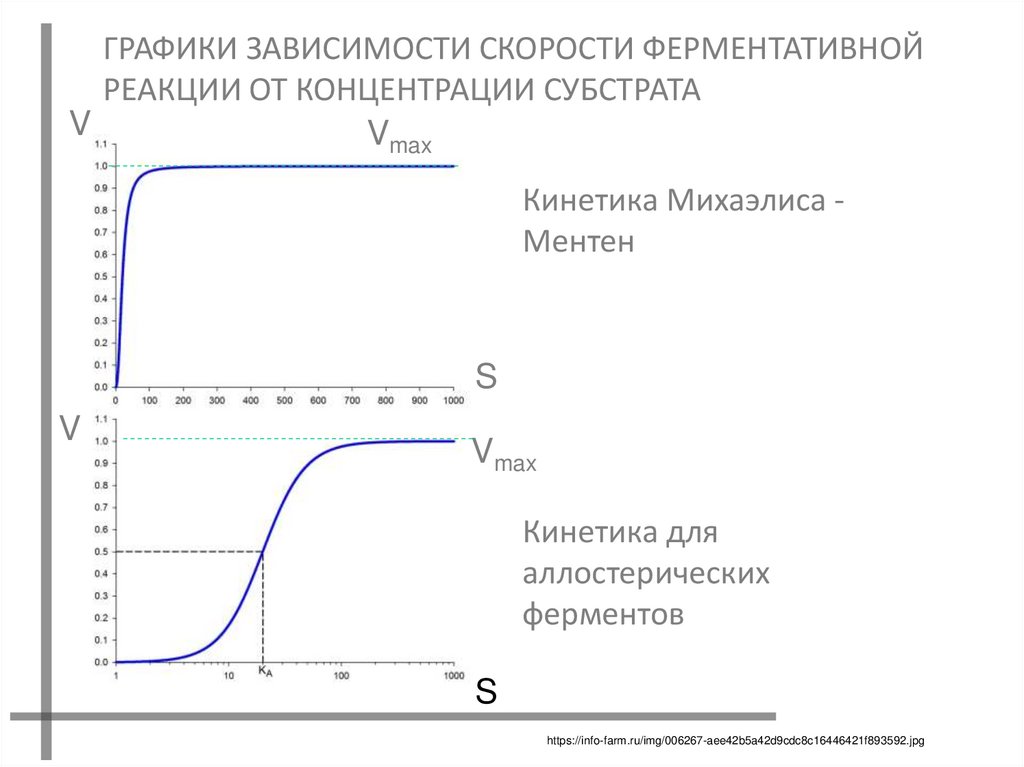
ГРАФИКИ ЗАВИСИМОСТИ СКОРОСТИ ФЕРМЕНТАТИВНОЙРЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА
V
Vmax
Кинетика Михаэлиса Ментен
S
V
Vmax
Кинетика для
аллостерических
ферментов
S
https://info-farm.ru/img/006267-aee42b5a42d9cdc8c16446421f893592.jpg
11. ОСОБЕННОСТИ АЛЛОСТЕРИЧЕСКИХ ФЕРМЕНТОВ
1. НАЛИЧИЕ СПЕЦИФИЧЕСКИХ ЦЕНТРОВ СВЯЗЫВАНИЯ,ПРОСТРАНСТВЕННО УДАЛЕННЫХ ОТ КАТАЛИТИЧЕСКОГО
(АКТИВНОГО) ЦЕНТРА
2. СОСТОЯТ ИЗ НЕСКОЛЬКИХ СУБЪЕДИНИЦ
3. ГРАФИК ЗАВИСИМОСТИ СКОРОСТИ ФЕРМЕНТАТИВНОЙ
РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА ИМЕЕТ SОБРАЗНУЮ ФОРМУ, ЧТО СВИДЕТЕЛЬСТВУЕТ О
КООПЕРАТИВНОСТИ ПРОЦЕССА
12. УРАВНЕНИЕ ХИЛЛА
13.
Арчибальд Хилл1886-1977
В 1909 ГОДУ А. ХИЛЛ ПРЕДЛОЖИЛ
МОДЕЛЬ СВЯЗЫВАНИЯ КИСЛОРОДА С
ГЕМОГЛОБИНОМ, КОТОРАЯ
СООТВЕТСТВОВАЛА
ЭКСПЕРИМЕНТАЛЬНЫМ ДАННЫМ.
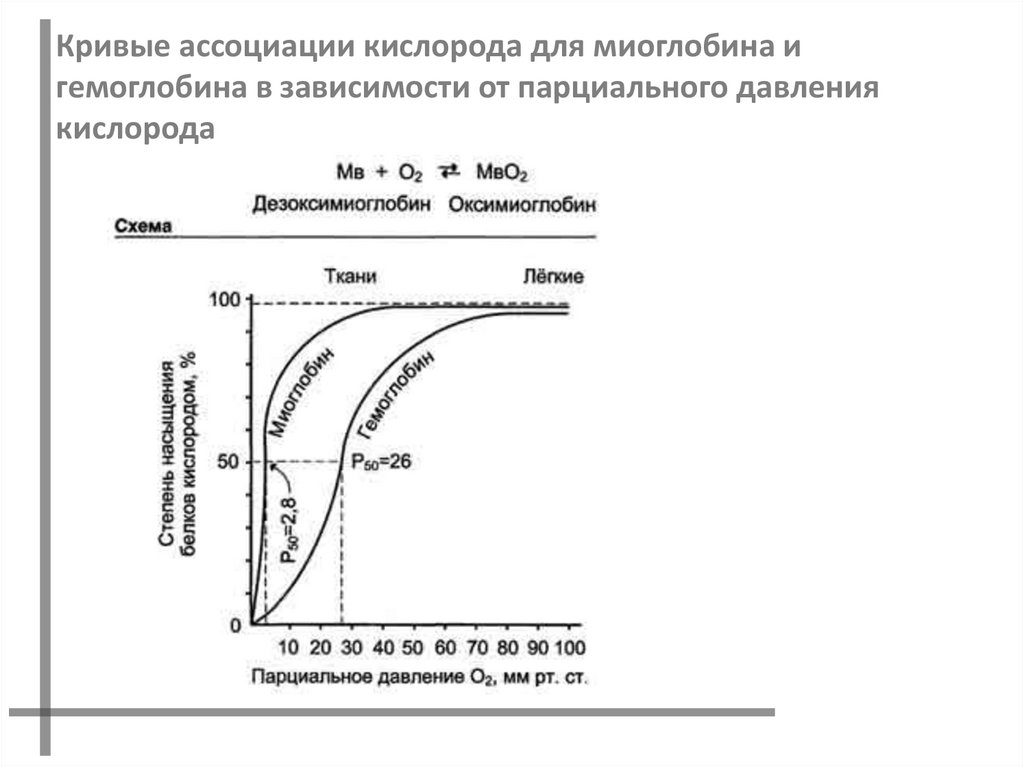
14.
Кривые ассоциации кислорода для миоглобина игемоглобина в зависимости от парциального давления
кислорода
15.
миоглобингемоглобин
16.
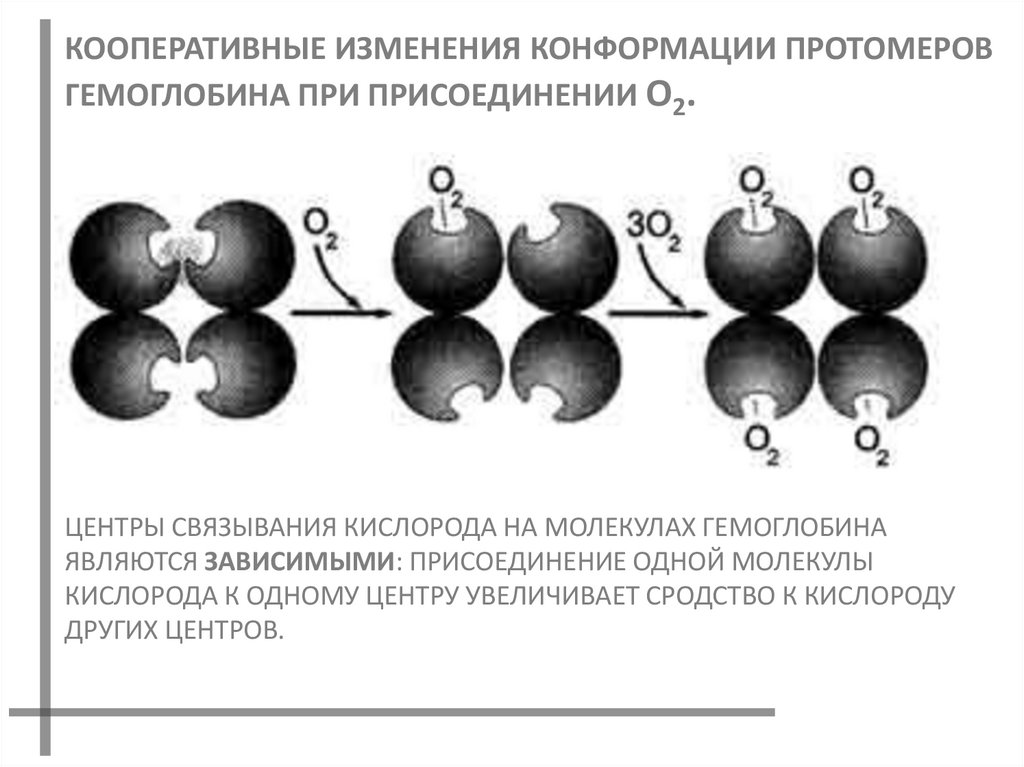
КООПЕРАТИВНЫЕ ИЗМЕНЕНИЯ КОНФОРМАЦИИ ПРОТОМЕРОВГЕМОГЛОБИНА ПРИ ПРИСОЕДИНЕНИИ О2.
ЦЕНТРЫ СВЯЗЫВАНИЯ КИСЛОРОДА НА МОЛЕКУЛАХ ГЕМОГЛОБИНА
ЯВЛЯЮТСЯ ЗАВИСИМЫМИ: ПРИСОЕДИНЕНИЕ ОДНОЙ МОЛЕКУЛЫ
КИСЛОРОДА К ОДНОМУ ЦЕНТРУ УВЕЛИЧИВАЕТ СРОДСТВО К КИСЛОРОДУ
ДРУГИХ ЦЕНТРОВ.
17.
КООПЕРАТИВНОЕ СВЯЗЫВАНИЕКОНСТАНТЫ СВЯЗЫВАНИЯ ИДЕНТИЧНЫХ ЦЕНТРОВ
ИЗМЕНЯЮТСЯ ПО МЕРЕ ИХ ЗАПОЛНЕНИЯ
А. ХИЛЛ РАССМОТРЕЛ МОДЕЛЬ МАКСИМАЛЬНОЙ
КООПЕРАТИВНОСТИ
В РАВНОВЕСНОМ РАСТВОРЕ ЛИГАНДА Х И МАКРОМОЛЕКУЛ
ПРИСУТСТВУЮТ
ЛИБО МАКРОМОЛЕКУЛЫ С НЕЗАНЯТЫМИ ЦЕНТРАМИ,
ЛИБО КОМПЛЕКСЫ ЛИГАНДА С МАКРОМОЛЕКУЛАМИ, У
КОТОРЫХ ВСЕ ЦЕНТРЫ ЗАНЯТЫ.
18.
ОБРАЗОВАНИЕ КОМПЛЕКСА ЕХ МОЖНОРАССМАТРИВАТЬ КАК КИНЕТИЧЕСКУЮ РЕАКЦИЮ,
КОНСТАНТА КОТОРОЙ РАВНА К
K
E + X EX
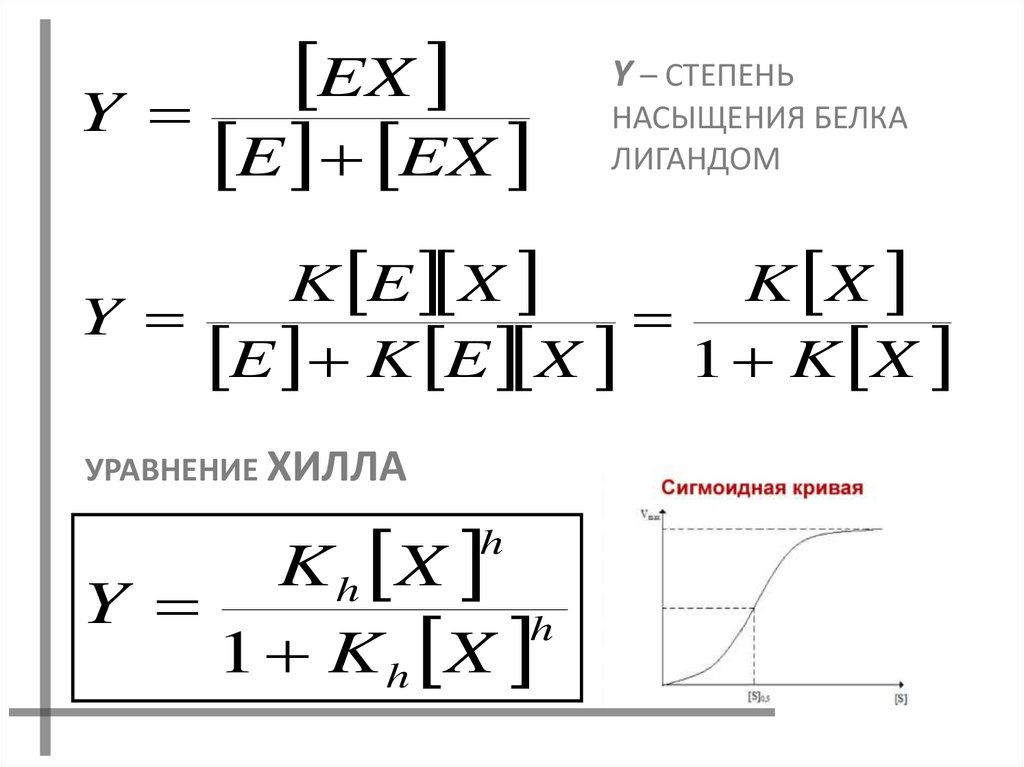
19.
EXY
E EX
Y – СТЕПЕНЬ
НАСЫЩЕНИЯ БЕЛКА
ЛИГАНДОМ
K E X
K X
Y
E K E X 1 K X
УРАВНЕНИЕ ХИЛЛА
K h X
Y
h
1 K h X
h
20.
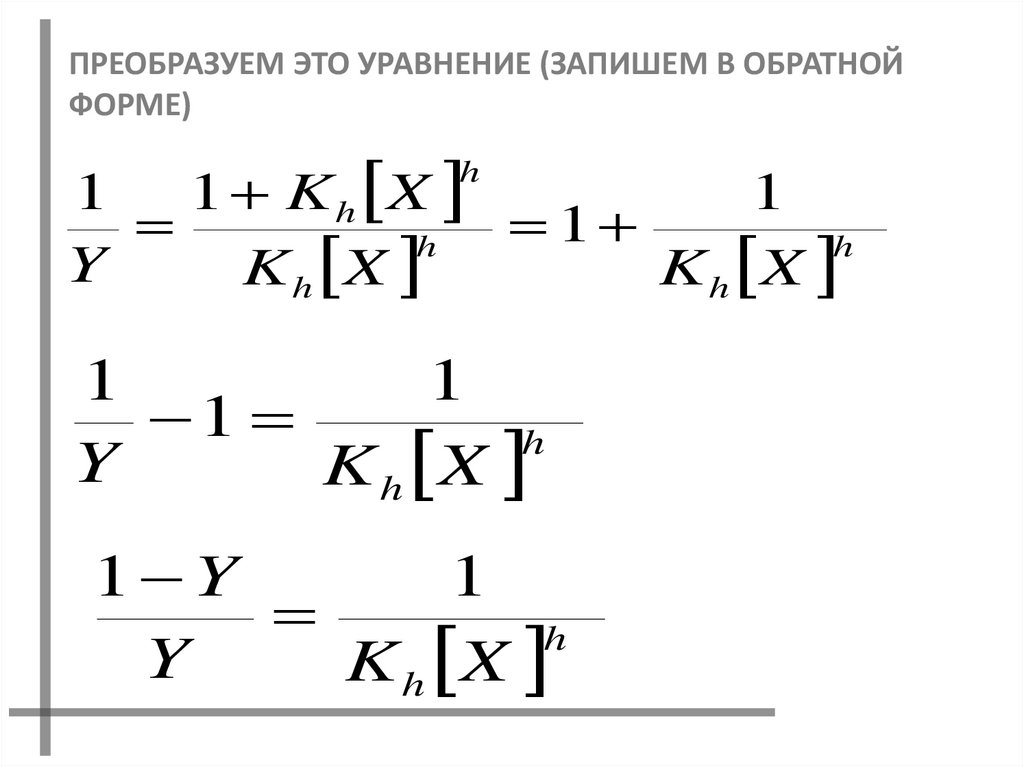
ПРЕОБРАЗУЕМ ЭТО УРАВНЕНИЕ (ЗАПИШЕМ В ОБРАТНОЙФОРМЕ)
1
1 K h X
1
1
h
h
Y
K h X
K h X
h
1
1
1
h
Y
K h X
1 Y
1
h
Y
K h X
21.
ПЕРЕПИШЕМ ЭТО УРАВНЕНИЕ ЕЩЕ РАЗ В ОБРАТНОЙФОРМЕ И ЗАТЕМ ПРОЛОГАРИФМИРУЕМ
Y
h
K h X
1 Y
Y
lg
lg
K
h
lg
X
h
1
Y
НА ОСНОВАНИИ ЭТОГО УРАВНЕНИЯ СТРОИМ ГРАФИК
ХИЛЛА
22.
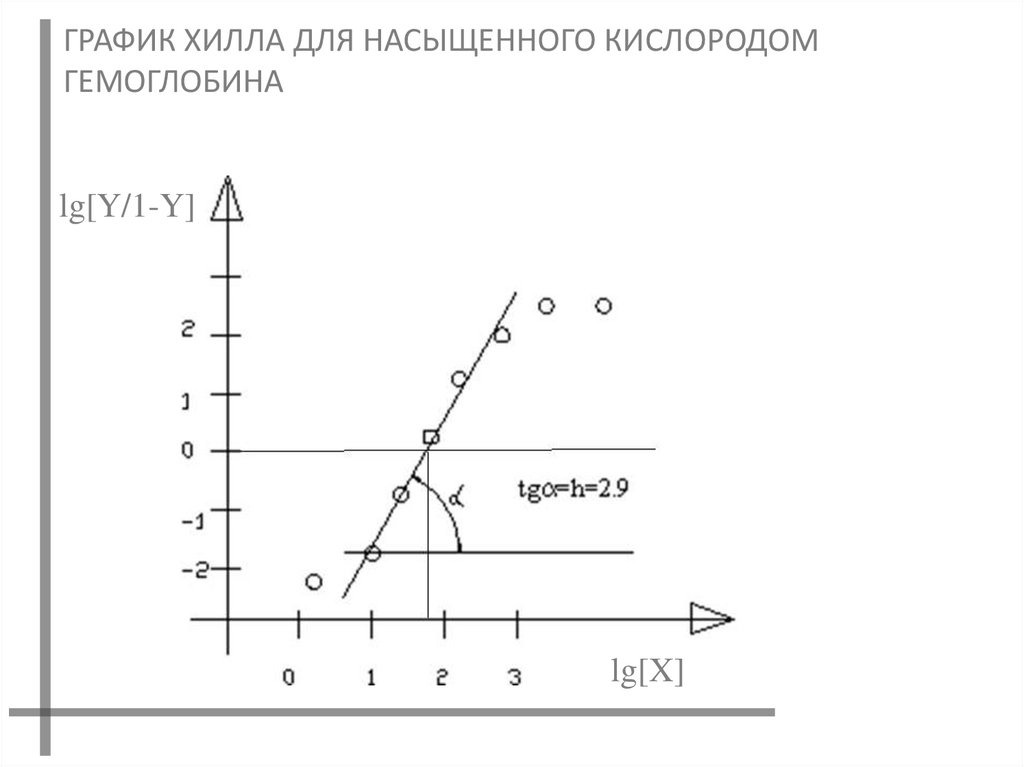
ГРАФИК ХИЛЛА ДЛЯ НАСЫЩЕННОГО КИСЛОРОДОМГЕМОГЛОБИНА
lg[Y/1-Y]
lg[X]
23.
Уравнение Хилла удовлетворительно описываетсвязывание лигандов аллостерическими белками в
интервале от 10 до 90% насыщения.
За пределами этого интервала экспериментальная
кривая отклоняется от прямой.
24.
НА ЭТОМ ГРАФИКЕ МОЖНО НАЙТИ КОНСТАНТУ СВЯЗЫВАНИЯКh и КОЭФФИЦИЕНТ ХИЛЛА h (tg ), КОТОРЫЙ
ХАРАКТЕРИЗУЕТ СТЕПЕНЬ КООПЕРАТИВНОСТИ
ЕСЛИ h=1, ТО КООПЕРАТИВНОСТЬ ОТСУТСТВУЕТ
МАКСИМАЛЬНОЕ ЗНАЧЕНИЕ h РАВНО ЧИСЛУ ЦЕНТРОВ
СВЯЗЫВАНИЯ.
25.
ЕСЛИ h>1, ТО ИМЕЕТ МЕСТО ПОЛОЖИТЕЛЬНАЯКООПЕРАТИВНОСТЬ.
Присоединение одной молекулы лиганда к активному центру
фермента увеличивает сродство к лиганду остальных активных
центров
ЕСЛИ h<1, ТО ИМЕЕТ МЕСТО ОТРИЦАТЕЛЬНАЯ
КООПЕРАТИВНОСТЬ.
Присоединение одной молекулы лиганда к активному центру
фермента уменьшает сродство к лиганду остальных активных
центров.
26.
Физиологическое значение кооперативногосвязывания:
положительная кооперативность обеспечивает
резкое изменение степени сродства в очень узком
диапазоне концентраций лиганда.
27.
Здесь: v – наблюдаемая скорость ферментативной реакции;VMAX – максимальная скорость реакции при концентрации субстрата,
стремящейся к бесконечности;
К′– концентрация субстрата, при которой скорость равна половине от
максимальной.
К′ не соответствует величине Км в данном случае вместо символа Км
используют символы ([S]0,5, К0,5);
h – коэффициент Хилла (суммарное число связывающих центров в
олигомерной молекуле фермента, коэффициент кооперативных
взаимодействий)
28.
29. МОДЕЛИ АЛЛОСТЕРИЧЕСКИХ ФЕРМЕНТОВ
30.
СУБЪЕДИНИЦЫ ФЕРМЕНТА МОГУТ НАХОДИТЬСЯ В ДВУХКОНФОРМАЦИЯХ:
R (relaxed – расслабленное состояние)
T (tense – напряженное состояние).
КОНФОРМАЦИЯ R ИМЕЕТ ВЫСОКОЕ СРОДСТВО К СУБСТРАТУ
КОНФОРМАЦИЯ T ИМЕЕТ НИЗКОЕ СРОДСТВО К СУБСТРАТУ
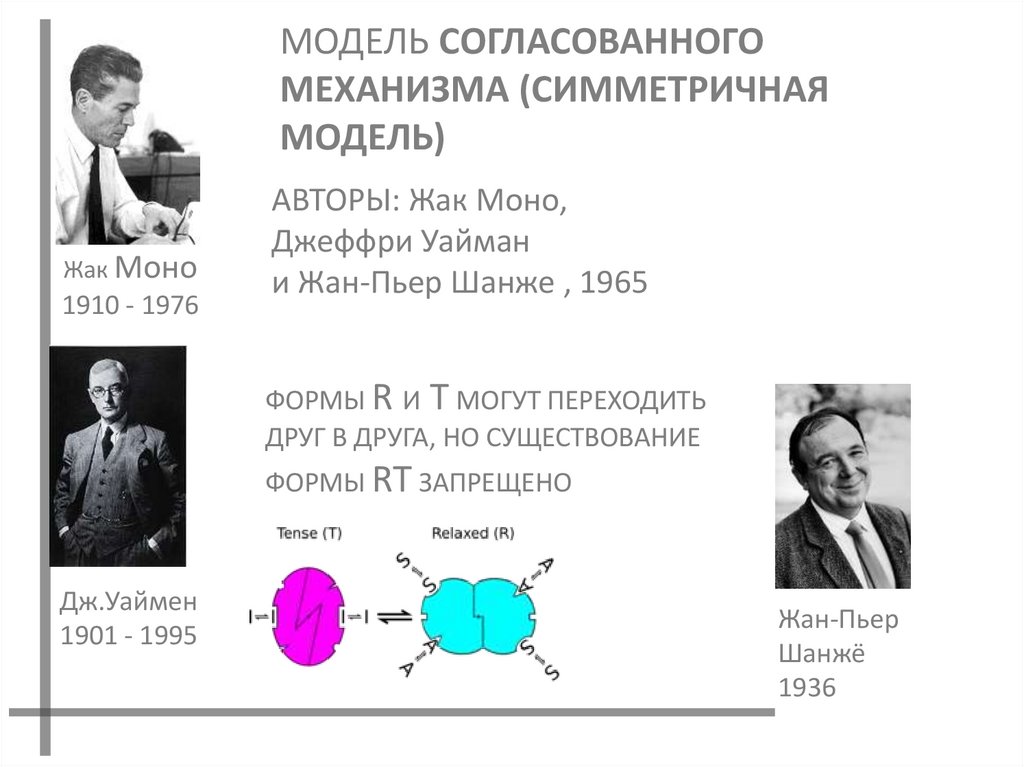
31.
МОДЕЛЬ СОГЛАСОВАННОГОМЕХАНИЗМА (СИММЕТРИЧНАЯ
МОДЕЛЬ)
Жак Моно
1910 - 1976
АВТОРЫ: Жак Моно,
Джеффри Уайман
и Жан-Пьер Шанже , 1965
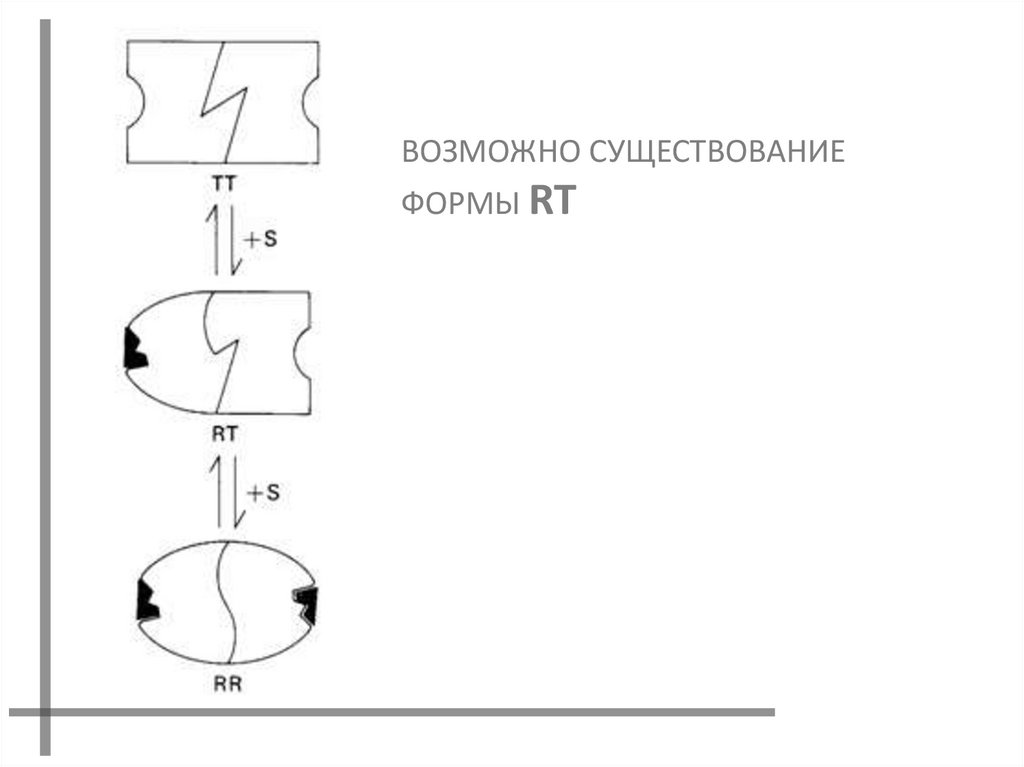
ФОРМЫ R И T МОГУТ ПЕРЕХОДИТЬ
ДРУГ В ДРУГА, НО СУЩЕСТВОВАНИЕ
ФОРМЫ RT ЗАПРЕЩЕНО
Дж.Уаймен
1901 - 1995
Жан-Пьер
Шанжё
1936
32.
В растворе и в отсутствии любых лигандов (субстрата илиаллостерического эффектора) равновесие сдвинуто в сторону Tформы.
Конформация активных центров такова, что R-состояние имеет
более высокое сродство к лиганду. Это не обязательно означает, что
T форма неспособна к связыванию лиганда, просто у нее более
низкое сродство.
Если добавляется небольшое количество лиганда к этому раствору,
более вероятно, что он свяжется с R белком, поскольку тот имеет
более высокое сродство. Это приведет к образованию комплекса,
в котором белок R со связанной молекулой лиганда, утратит
способность переходить в Т форму, что сместит сложившееся
равновесие вправо, увеличив число R белков с высоким сродством
к лиганду и увеличив тем самым общее сродство к лиганду в
системе. Результат - положительная кооперативность - связывание
одной молекулы лиганда а увеличивает способность белка,
связывать другие молекулы лигандов.
33.
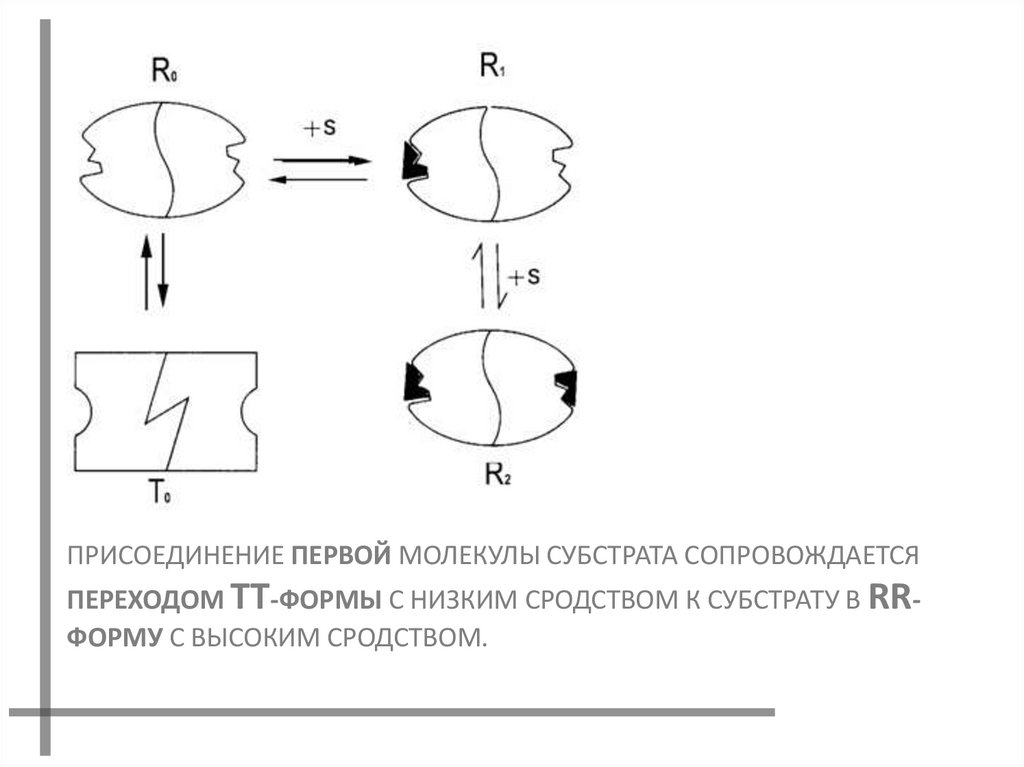
ПРИСОЕДИНЕНИЕ ПЕРВОЙ МОЛЕКУЛЫ СУБСТРАТА СОПРОВОЖДАЕТСЯПЕРЕХОДОМ ТТ-ФОРМЫ С НИЗКИМ СРОДСТВОМ К СУБСТРАТУ В RRФОРМУ С ВЫСОКИМ СРОДСТВОМ.
34.
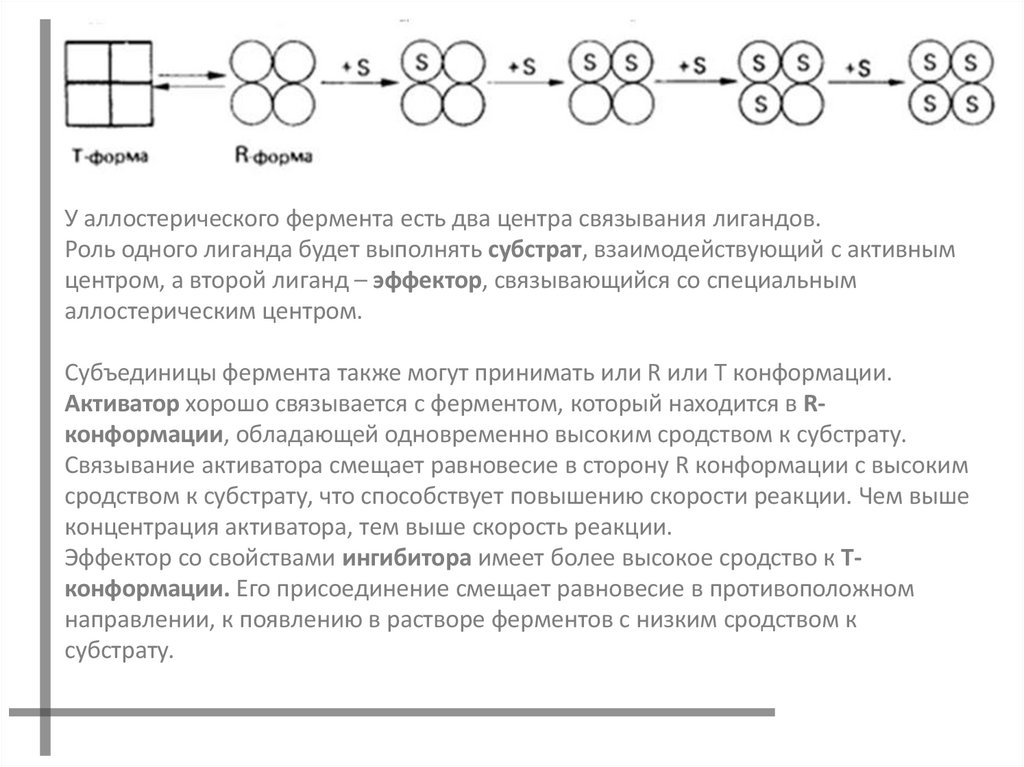
У аллостерического фермента есть два центра связывания лигандов.Роль одного лиганда будет выполнять субстрат, взаимодействующий с активным
центром, а второй лиганд – эффектор, связывающийся со специальным
аллостерическим центром.
Субъединицы фермента также могут принимать или R или T конформации.
Активатор хорошо связывается с ферментом, который находится в Rконформации, обладающей одновременно высоким сродством к субстрату.
Связывание активатора смещает равновесие в сторону R конформации с высоким
сродством к субстрату, что способствует повышению скорости реакции. Чем выше
концентрация активатора, тем выше скорость реакции.
Эффектор со свойствами ингибитора имеет более высокое сродство к Tконформации. Его присоединение смещает равновесие в противоположном
направлении, к появлению в растворе ферментов с низким сродством к
субстрату.
35.
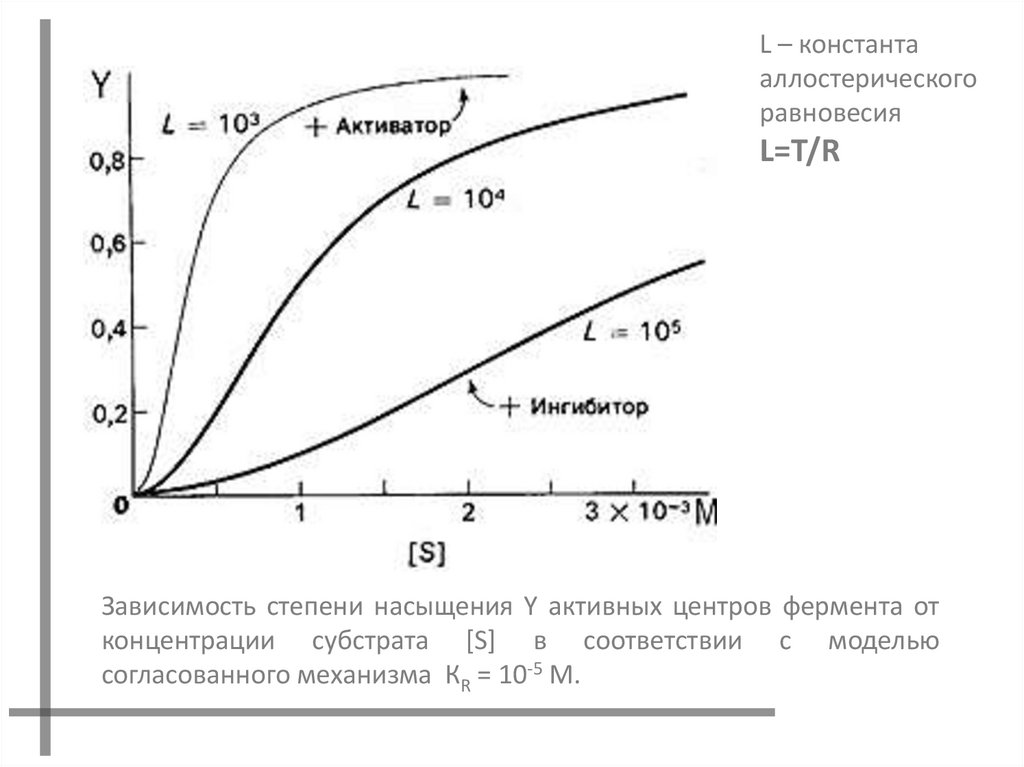
L – константааллостерического
равновесия
L=T/R
Зависимость степени насыщения Y активных центров фермента от
концентрации субстрата [S] в соответствии с моделью
согласованного механизма КR = 10-5 M.
36.
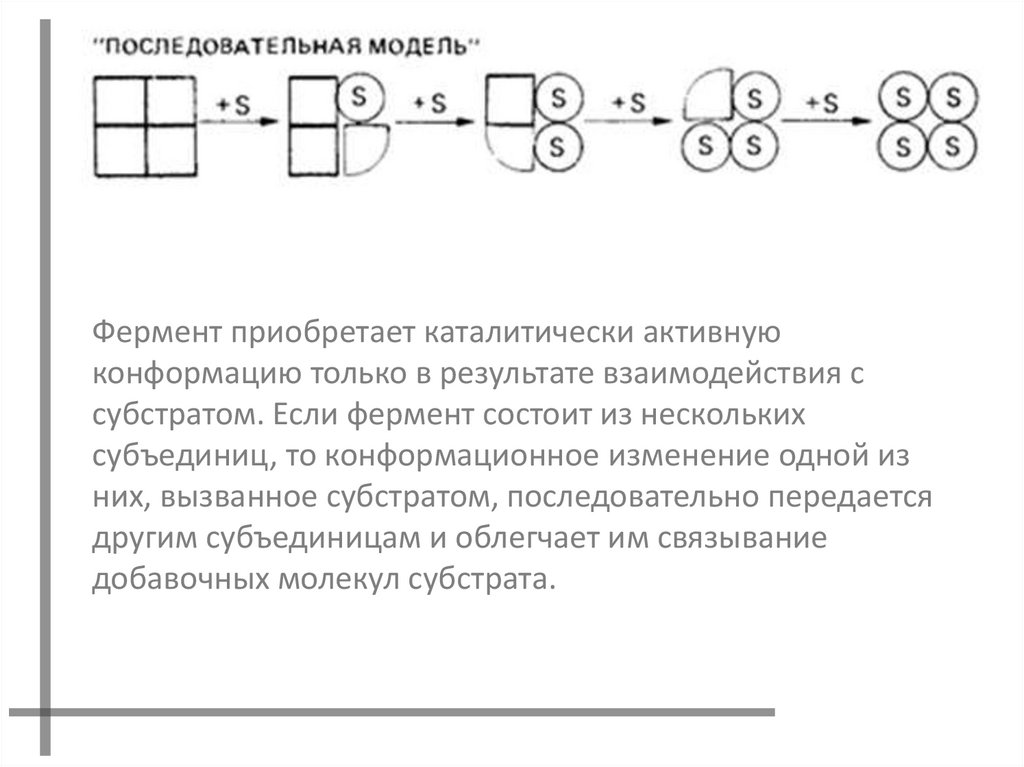
МОДЕЛЬ ПОСЛЕДОВАТЕЛЬНОГОМЕХАНИЗМА
Дэниел Кошланд
(1920–2007)
Автор: Даниэль Кошланд
Последовательная гипотеза
постулирует существование смешанных
ферментов , содержащих оба типа
субъединиц. Равновесие лишь
достигается в растворе, в котором
законченные R и T структуры просто
представляют экстремальные значения.
37.
ВОЗМОЖНО СУЩЕСТВОВАНИЕФОРМЫ RT
38.
1. Каждая субъединица может существовать в одном издвух возможных конформационных состояний (R или Т).
2. Связывание субстрата изменяет форму той субъединицы,
к которой он присоединяется. Конформация другой
субъединицы при этом существенно не меняется.
3 Конформационные изменения, вызванные связыванием
субстрата на одной субъединице, могут увеличивать
или уменьшать сродство к субстрату другой
субъединицы той же молекулы фермента.
39.
Фермент приобретает каталитически активнуюконформацию только в результате взаимодействия с
субстратом. Если фермент состоит из нескольких
субъединиц, то конформационное изменение одной из
них, вызванное субстратом, последовательно передается
другим субъединицам и облегчает им связывание
добавочных молекул субстрата.
40.
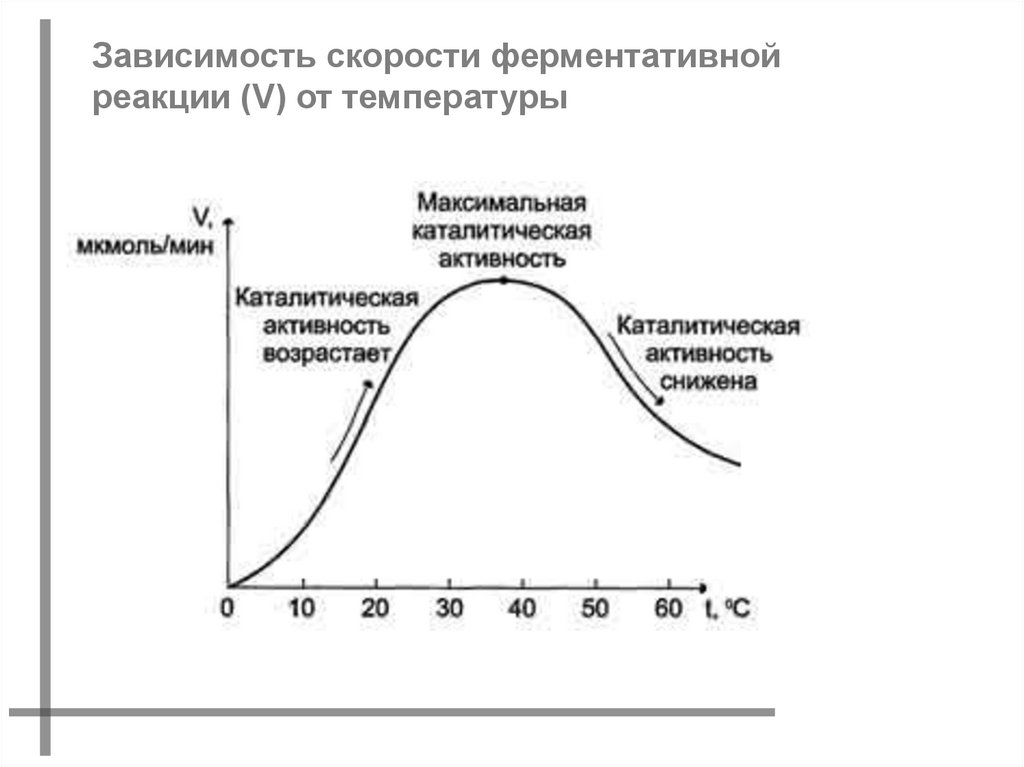
Зависимость скорости ферментативнойреакции (V) от температуры
41.
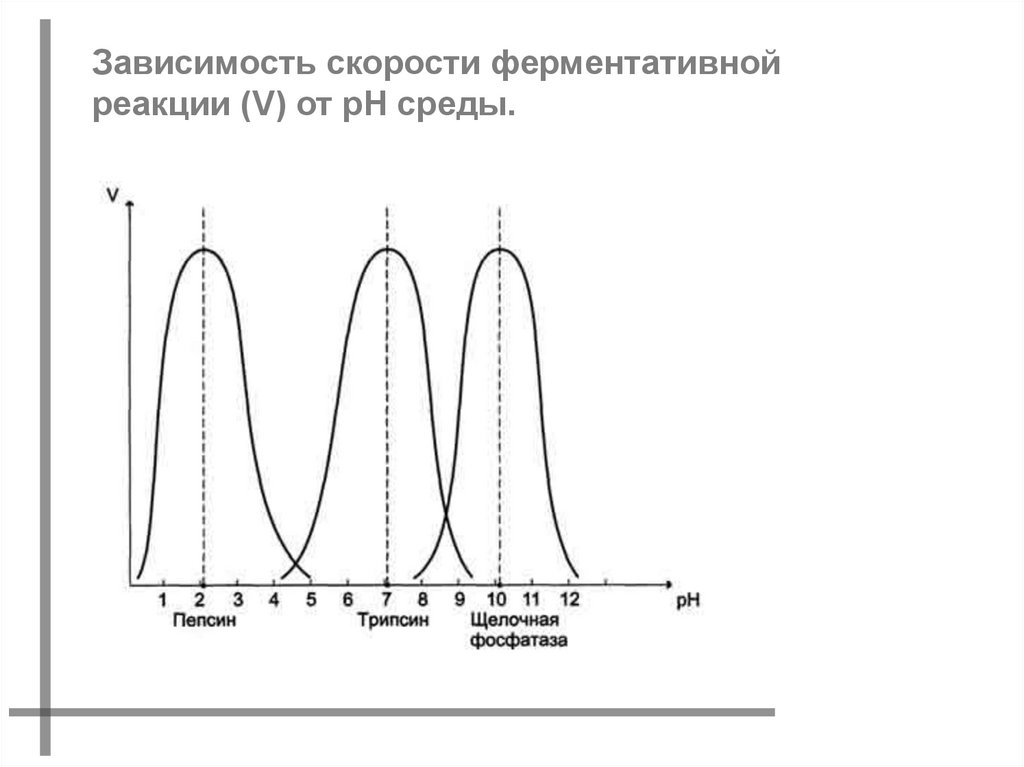
Зависимость скорости ферментативнойреакции (V) от рН среды.
42.
Оптимальные значения рН для некоторыхферментов
Фермент
Оптимальное значение рН
Пепсин
1,5-2
Пируват-карбоксилаза
4,8
Каталаза
6,8-7
Фумараза
6,5
Уреаза
6,8-7,2
Кабоксипептидаза
7,5
Трипсин
6,5-7,5
Аргиназа
9,5-9,9
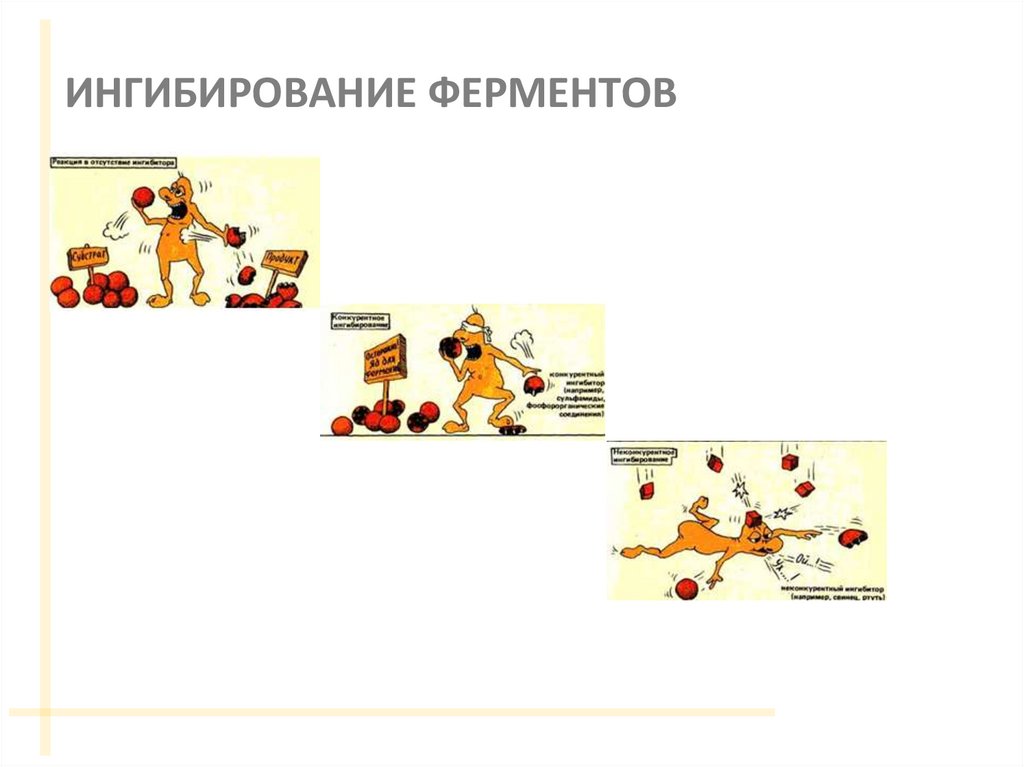
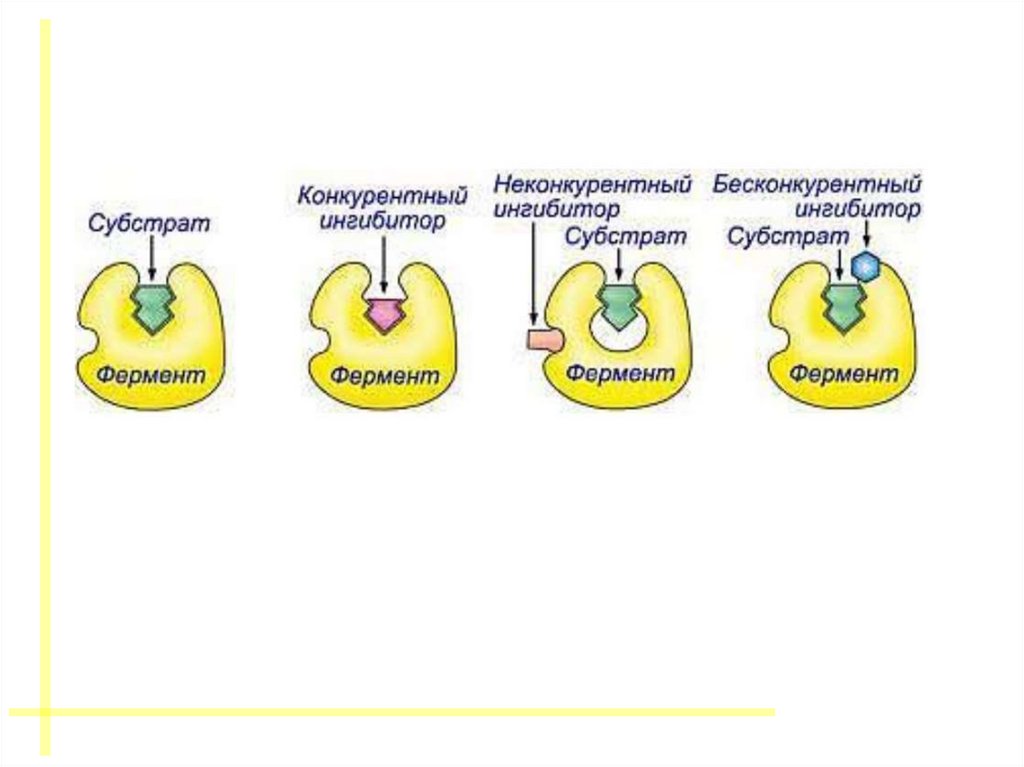
43. ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
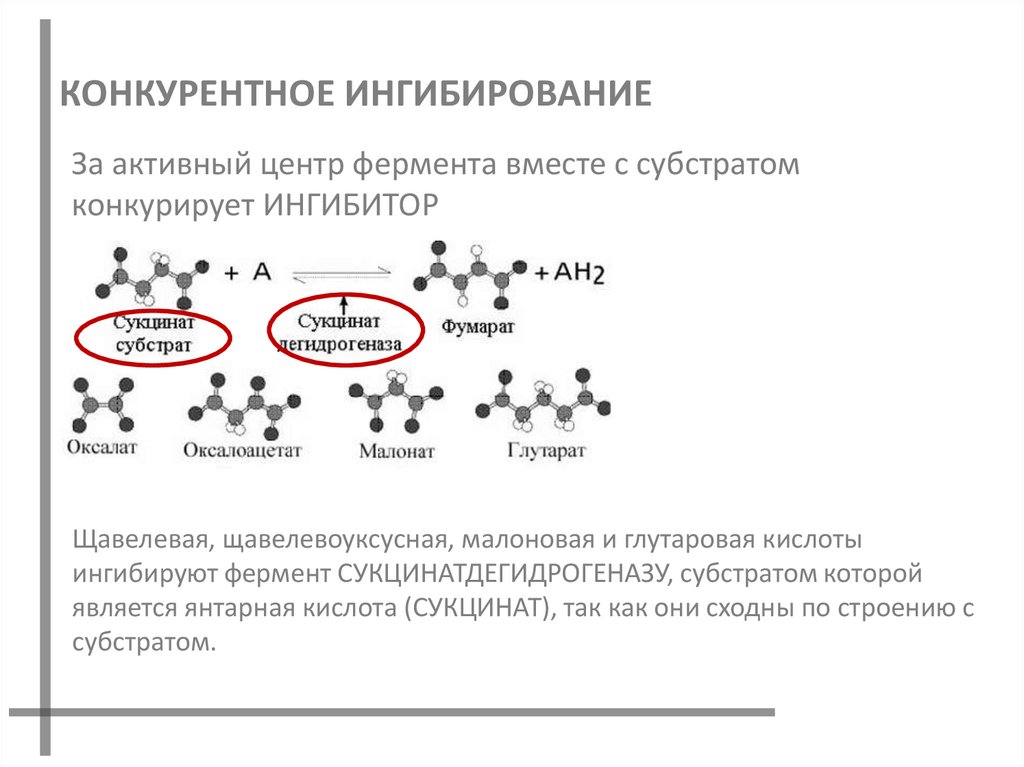
44. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
За активный центр фермента вместе с субстратомконкурирует ИНГИБИТОР
Щавелевая, щавелевоуксусная, малоновая и глутаровая кислоты
ингибируют фермент СУКЦИНАТДЕГИДРОГЕНАЗУ, субстратом которой
является янтарная кислота (СУКЦИНАТ), так как они сходны по строению с
субстратом.
45.
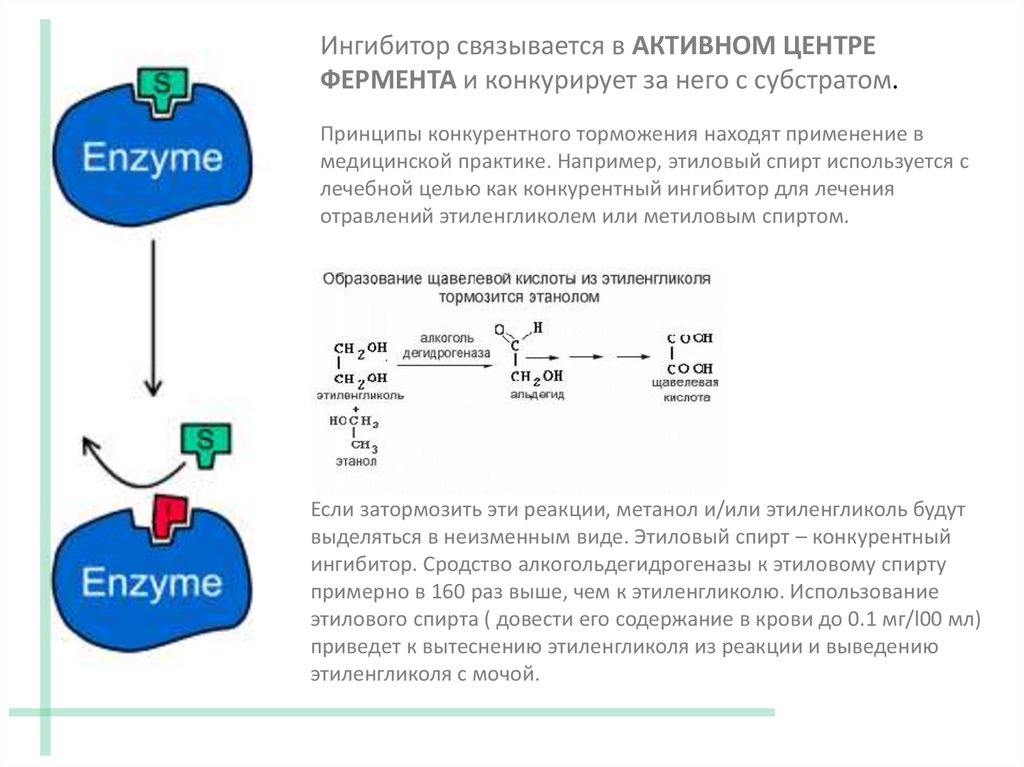
Ингибитор связывается в АКТИВНОМ ЦЕНТРЕФЕРМЕНТА и конкурирует за него с субстратом.
Принципы конкурентного торможения находят применение в
медицинской практике. Например, этиловый спирт используется с
лечебной целью как конкурентный ингибитор для лечения
отравлений этиленгликолем или метиловым спиртом.
Если затормозить эти реакции, метанол и/или этиленгликоль будут
выделяться в неизменным виде. Этиловый спирт – конкурентный
ингибитор. Сродство алкогольдегидрогеназы к этиловому спирту
примерно в 160 раз выше, чем к этиленгликолю. Использование
этилового спирта ( довести его содержание в крови до 0.1 мг/l00 мл)
приведет к вытеснению этиленгликоля из реакции и выведению
этиленгликоля с мочой.
46.
k1E S ES
E
P
k
k-1
2
ki
E I EI- НЕАКТИВНЫЙ КОМПЛЕКС
k-i
УРАВНЕНИЕ ЛАЙНУИВЕРА – БЕРКА ДЛЯ КОНКУРЕНТНОГО
ИНГИБИРОВАНИЯ
1
KM
I 1
1
1
V
Vmax
Ki S Vmax
47.
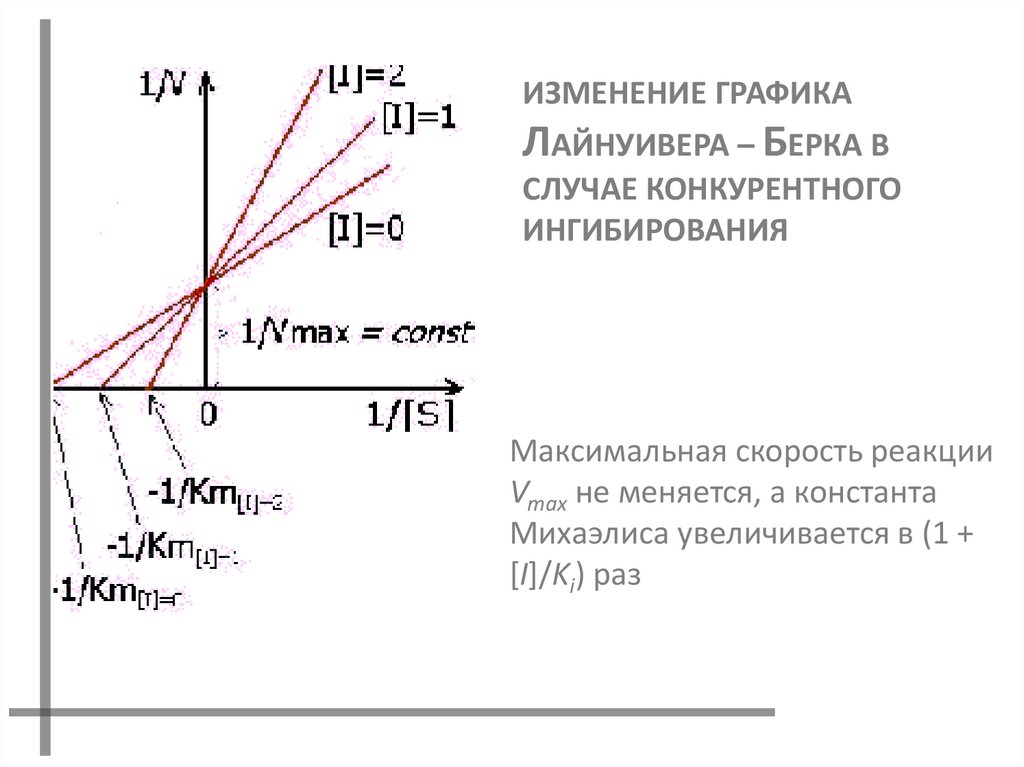
ИЗМЕНЕНИЕ ГРАФИКАЛАЙНУИВЕРА – БЕРКА В
СЛУЧАЕ КОНКУРЕНТНОГО
ИНГИБИРОВАНИЯ
Максимальная скорость реакции
Vmax не меняется, а константа
Михаэлиса увеличивается в (1 +
[I]/Ki) раз
48. НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
ИНГИБИТОР связывается с ФЕРМЕНТОМ ВНЕ АКТИВНОГО ЦЕНТРА, но приэтом меняется структура активного центра и связь с субстратом
становится невозможной
ОБРАЗУЕТСЯ НЕАКТИВНЫЙ КОМПЛЕКС ESI
УРАВНЕНИЕ ЛАЙНУИВЕРА – БЕРКА ДЛЯ НЕКОНКУРЕНТНОГО
ИНГИБИРОВАНИЯ
1
I K M 1
1
1
V
V
K
S
V
i
max
max
49.
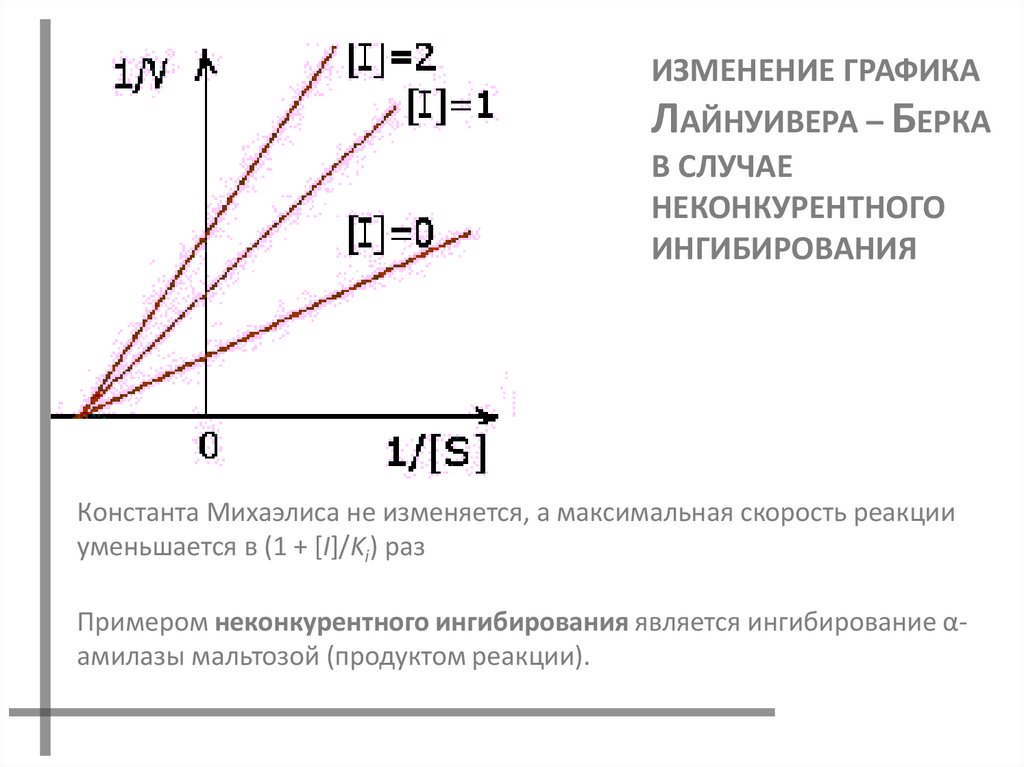
ИЗМЕНЕНИЕ ГРАФИКАЛАЙНУИВЕРА – БЕРКА
В СЛУЧАЕ
НЕКОНКУРЕНТНОГО
ИНГИБИРОВАНИЯ
Константа Михаэлиса не изменяется, а максимальная скорость реакции
уменьшается в (1 + [I]/Ki) раз
Примером неконкурентного ингибирования является ингибирование αамилазы мальтозой (продуктом реакции).
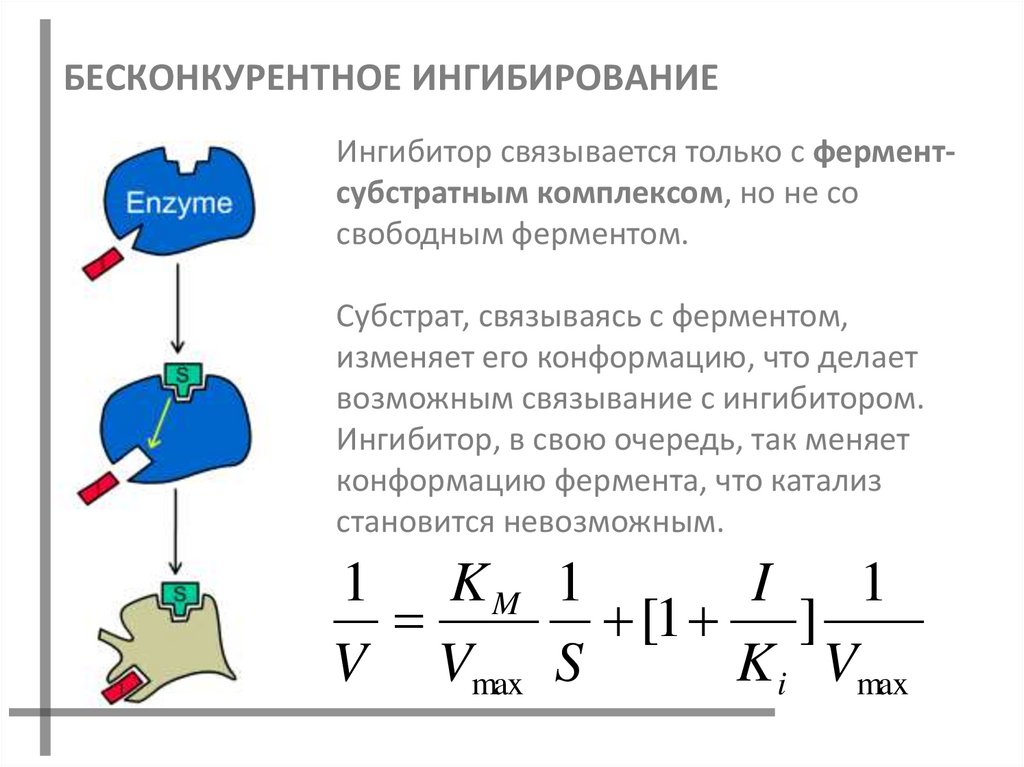
50. БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
Ингибитор связывается только с ферментсубстратным комплексом, но не сосвободным ферментом.
Субстрат, связываясь с ферментом,
изменяет его конформацию, что делает
возможным связывание с ингибитором.
Ингибитор, в свою очередь, так меняет
конформацию фермента, что катализ
становится невозможным.
1 KM 1
I
1
[1 ]
V Vmax S
K i Vmax
51.
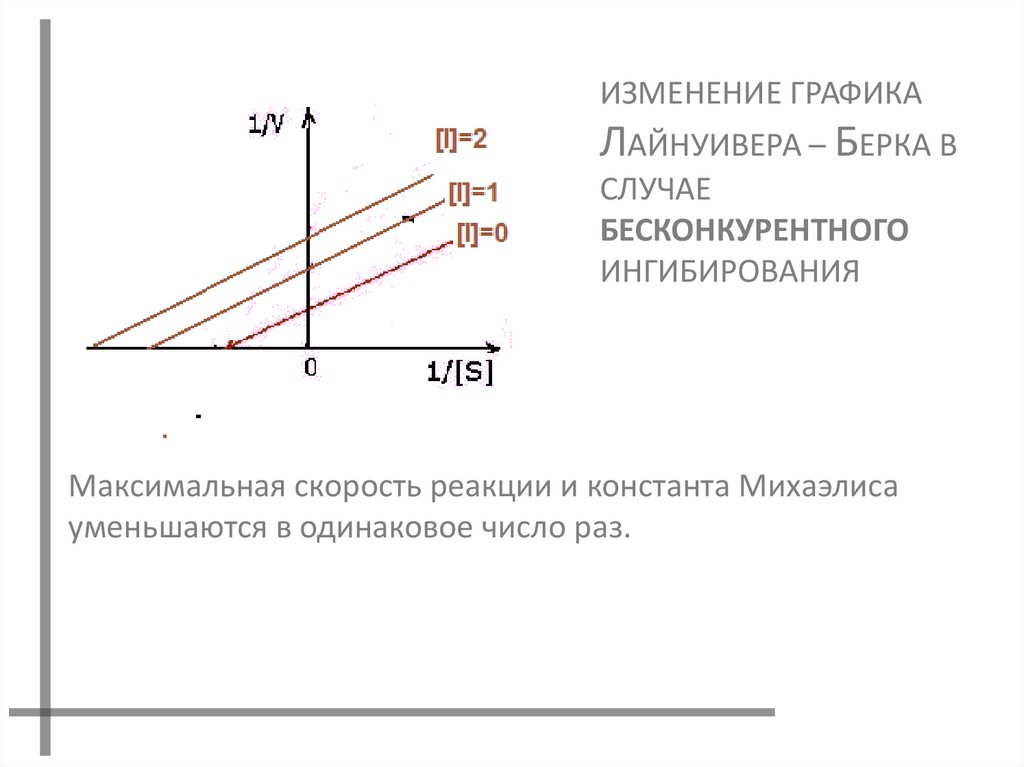
ИЗМЕНЕНИЕ ГРАФИКАЛАЙНУИВЕРА – БЕРКА В
СЛУЧАЕ
БЕСКОНКУРЕНТНОГО
ИНГИБИРОВАНИЯ
Максимальная скорость реакции и константа Михаэлиса
уменьшаются в одинаковое число раз.


























 biology
biology








