Similar presentations:
Основные понятия химической термодинамики
1.
Основные понятия химической термодинамикиХимическая термодинамика изучает законы взаимного превращения различных
видов энергии, состояние равновесия, а также возможность, направление и
предел протекания самопроизвольных процессов.
Термодинамическая система – это совокупность материальных объектов,
выбранных нами произвольно для изучения, которая отделена от всего
окружающего (называемого внешней средой) некоторой границей (условной или
реальной).
Изолированная система – это система, которая не может обмениваться с
окружающей средой ни веществом, ни энергией и имеет постоянный объем.
Закрытая система – это система, которая не может обмениваться с
окружающей средой веществом (т.е. имеет постоянную массу), но может
обмениваться энергией (в форме теплоты или работы).
Открытая система – это система, которая может обмениваться с окружающей
средой и веществом, и энергией.
Кроме того, системы могут быть гомогенными (однородными), которые состоят
из одной фазы, и гетерогенными (неоднородными), состоящими из двух или
более фаз.
2.
Термодинамические параметры состояния системы – (температура, объем,давление и т.д.) – это определенные измеряемые свойства системы,
характеризующие ее состояние.
Состояние системы – это совокупность термодинамических параметров
системы.
Различают: экстенсивные и интенсивные свойства
Экстенсивные свойства, зависят от массы системы (V, m, U, H и т. д.) и
обладают аддитивностью: свойство системы равно сумме свойств ее частей.
Интенсивные свойства, не зависят от массы системы (T, p, , и т. д.). Эти
свойства не суммируются, а выравниваются.
1) Равновесные и неравновесные процессы.
Равновесные процессы- это процессы, проходящие через непрерывный ряд
равновесных состояний.
Равновесное состояние системы – состояние, не изменяющееся во времени
и не требующее для своего поддержания воздействия каких-либо внешних
факторов.
Неравновесные процессы — это процессы, после протекания которых
систему нельзя вернуть в исходное состояние без того, чтобы в ней не
осталось каких-либо изменений..
3.
2). Обратимые и необратимые процессы.
Обратимые процессы –это процессы при протекании которых система
возвращается в исходное состояние без того, чтобы в окружающей
среде остались какие-либо изменения. В противном случае процессы
будут необратимыми.
В дальнейшем часто можно считать понятия обратимого и
равновесного процесса совпадающими
3). Самопроизвольные и несамопроизвольные процессы.
Самопроизвольные – процессы, происходящие сами собой не
требующие затраты энергии извне и приближающие систему к
равновесию.
Несамопроизвольные – процессы, требующие затраты энергии извне.
Химическая реакция – это разновидность процесса, при котором
наблюдается изменение химического состава системы.
Энергия – мера способности системы совершать работу.
Внутренней энергией системы называется сумма всех видов энергии,
за исключением кинетической энергии системы в целом и ее
потенциальной энергии положения.
Полная энергия системы равна сумме ее внутренней энергии,
кинетической и потенциальной энергии системы как целого.
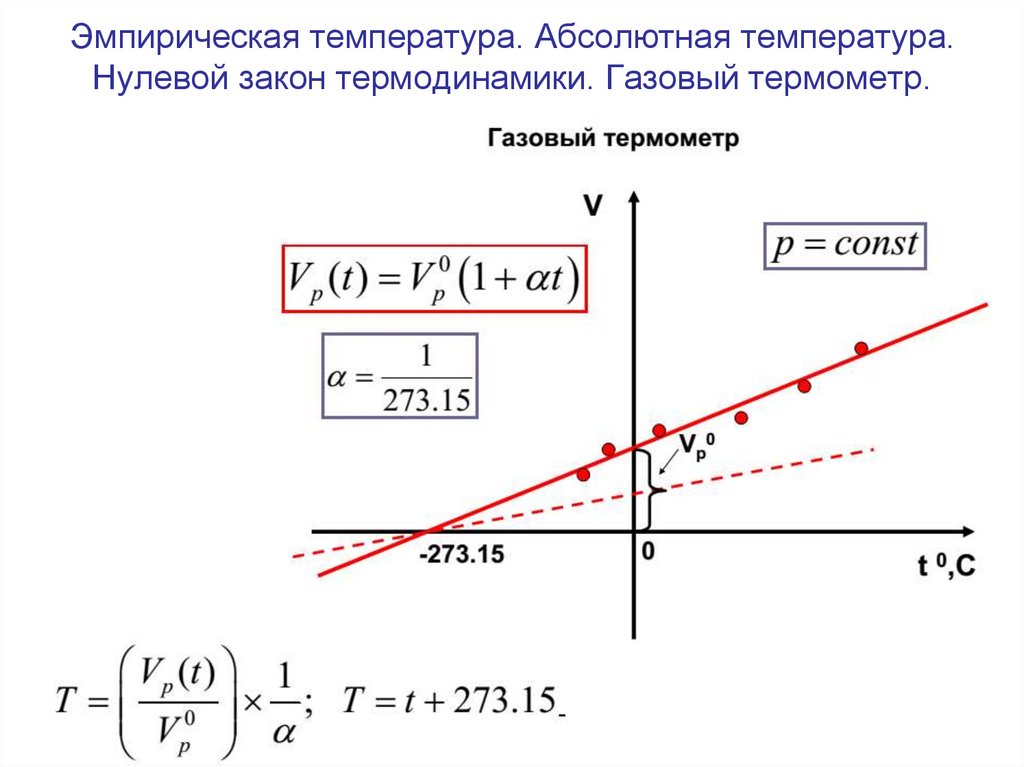
4. Эмпирическая температура. Абсолютная температура. Нулевой закон термодинамики. Газовый термометр.
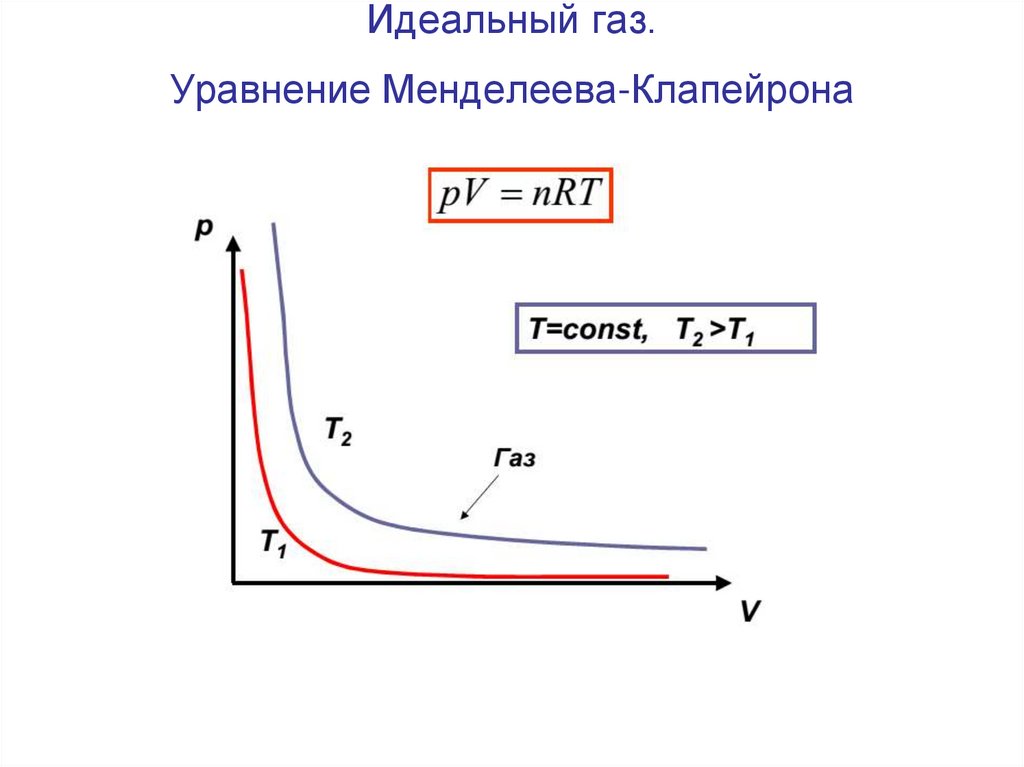
5. Идеальный газ. Уравнение Менделеева-Клапейрона
6.
Уравнение Ван-дер-ВаальсаПервая поправка – это учет
собственного объема молекул газа.
С учетом собственного объема
молекулы уравнение запишется так:
b – поправка на собственный объем молекул,
рассчитанная на 1 моль газа.
Вторая поправка – это учет сил
взаимодействия между молекулами
реального газа.
В результате сил притяжения между молекулами газ как
бы «сжимается» так, как если бы газ находился под
бо’льшим давлением P’, чем то внешнее давление P,
которое на него оказывают стенки сосуда.
Величина P i называется внутренним давлением газа.
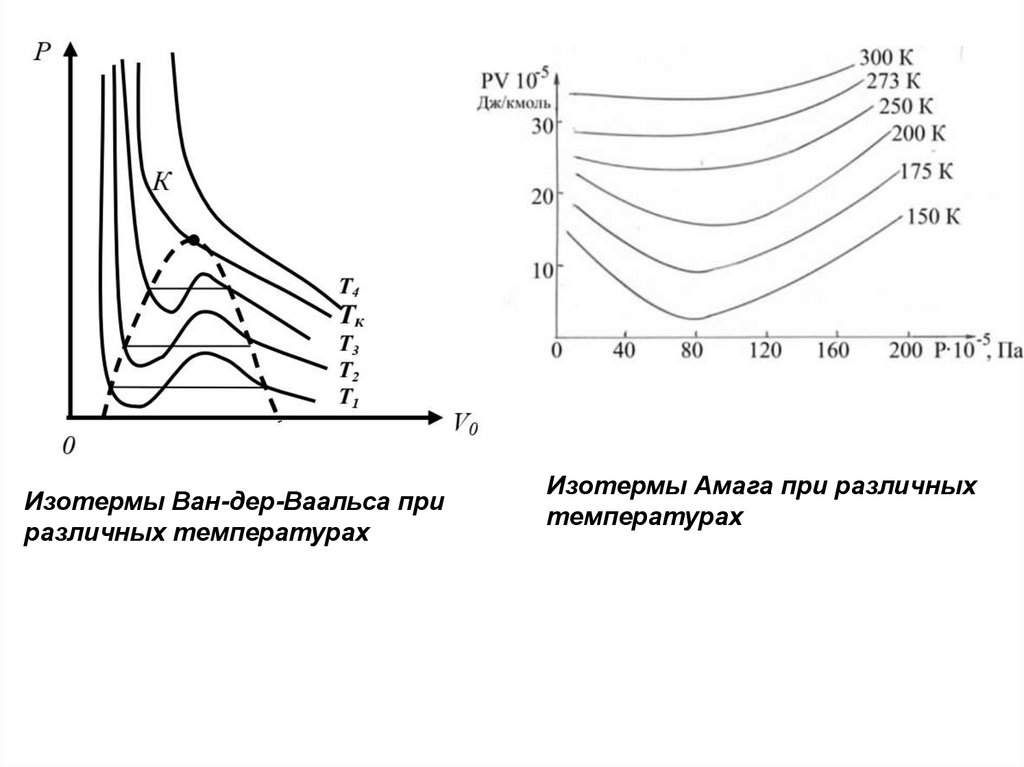
7.
Изотермы Ван-дер-Ваальса приразличных температурах
Изотермы Амага при различных
температурах
8.
Первый закон термодинамикиQ = dU + A
Формулировки первого закона термодинамики:
1. Теплота, подводимая к системе, идет на изменение внутренней энергии
(функция состояния системы) и на совершение системой работы.
2. Энергия системы постоянна.
3.Энергия не исчезает бесследно и не возникает из ничего, переход её из
одного вида в другой происходит в строго эквивалентных количествах.
4. Вечный двигатель 1 первого рода невозможен.
Для изолированной системы справедливо условие:
U = const, dU = 0.
Формулировка первого начала термодинамики для изолированной системы:
«Запас внутренней энергии в изолированной системе постоянен».
9.
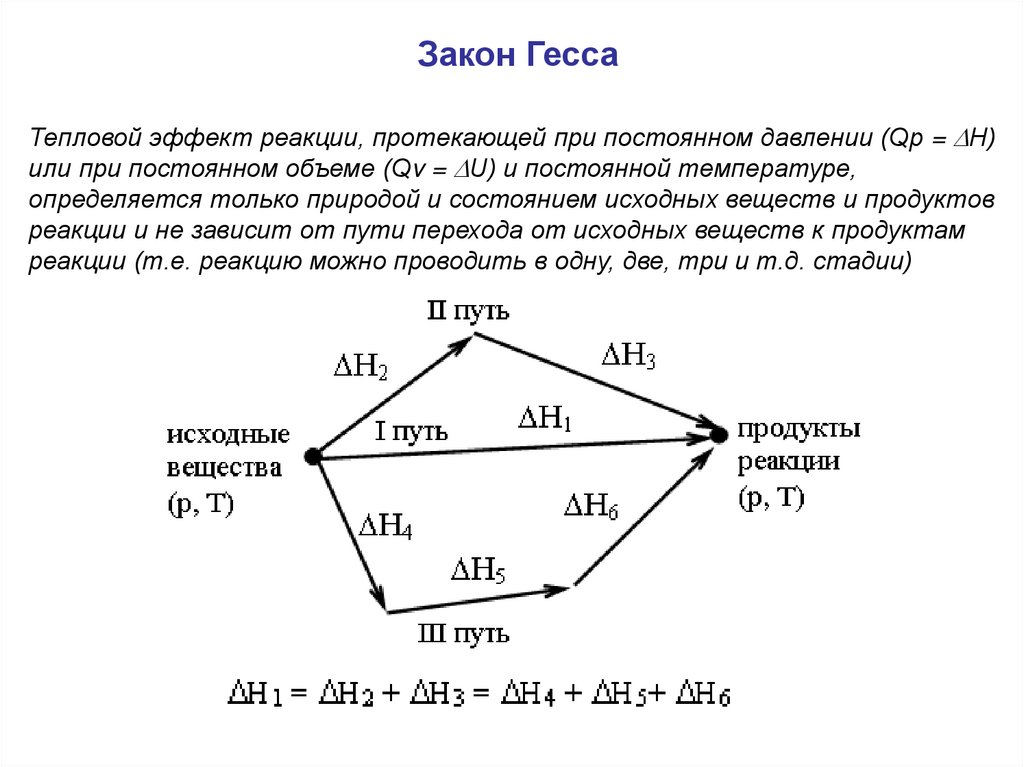
Закон ГессаТепловой эффект реакции, протекающей при постоянном давлении (Qp = Н)
или при постоянном объеме (Qv = U) и постоянной температуре,
определяется только природой и состоянием исходных веществ и продуктов
реакции и не зависит от пути перехода от исходных веществ к продуктам
реакции (т.е. реакцию можно проводить в одну, две, три и т.д. стадии)
10.
Следствия из закона ГессаH
реакции
H реакции
H i f H i f
продукты
i
исходные
вещества
j
сг
сг
i H i продукты
j H i
исходные
вещества
11.
Теплоемкость веществаQ V U
dU
СV
dT T V dT
Q p
H dH
CР
dT T p dT
C Р С V A расш.
Для идеальных газов справедливо уравнение Майера:
CP CV R
12.
Теплоемкость газовкинет.
потенц.
U U пост. U вращ. U колеб
U
.
колеб.
dU i
СV
R
dT 2
Для одноатомных идеальных газов
3
CV R
2
5
CP R
2
Для двухатомных идеальных газов
и линейных многоатомных
5
CV R
2
7
CP R
2
6
CV R 3R
2
CP 4R
Для многоатомных
13.
Теплоемкость твердых телправило Дюлонга - Пти
C = 3R
правило Неймана - Коппа
С = nС1 + nС2 + …
Эмпирические данные для вычисления теплоемкости
элемент
С
Н
В
C
7,6
9,6 11,3 15,9 16,8 21,0 22,6 22,6
Si
O
F
P
S
14.
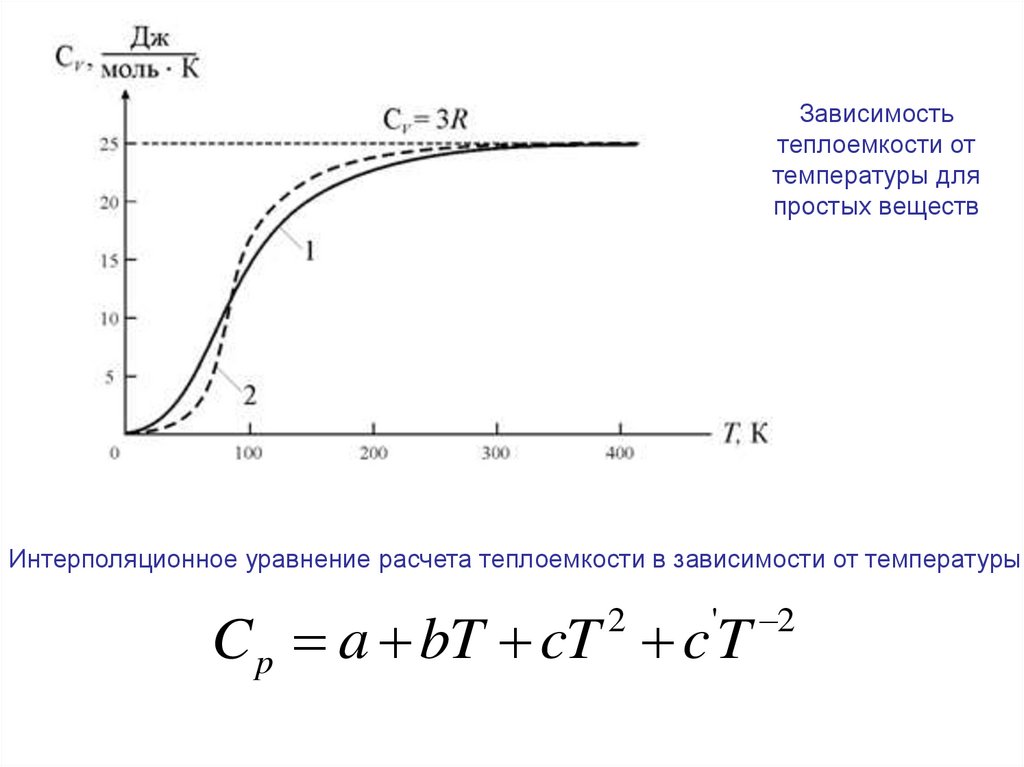
Зависимостьтеплоемкости от
температуры для
простых веществ
Интерполяционное уравнение расчета теплоемкости в зависимости от температуры
C p a bT cT c T
2
'
2
15.
Расчет работы расширения идеального газа и теплоты вразличных процессах
16.
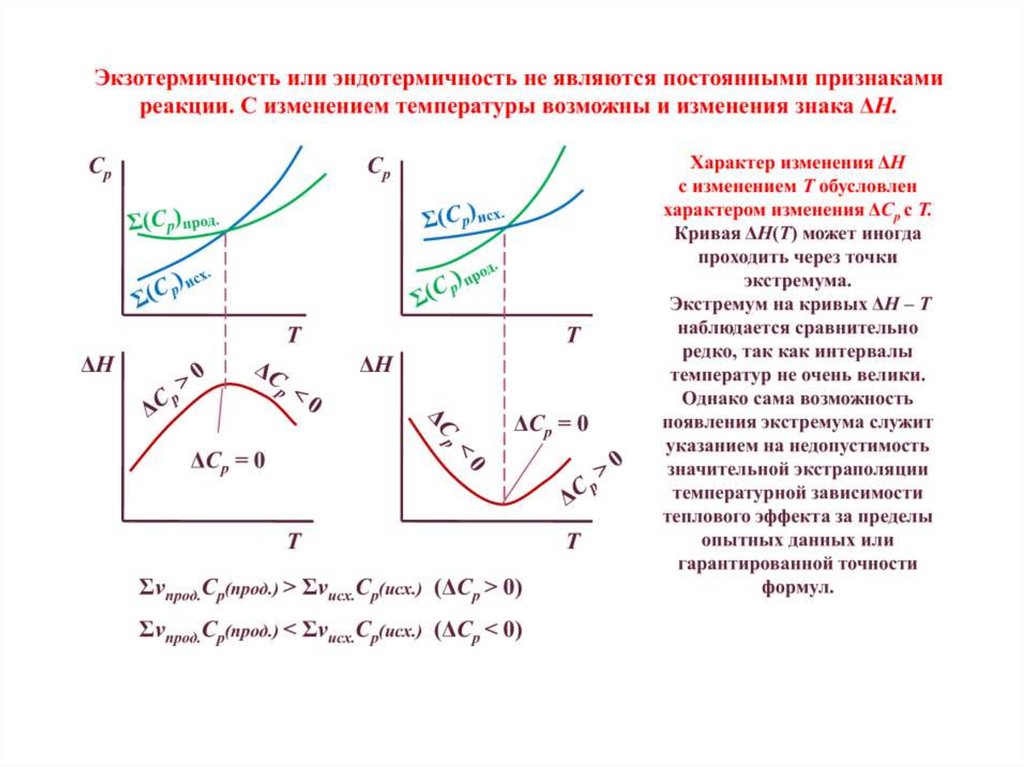
Зависимость теплового эффекта химической реакцииот температуры. Уравнение Кирхгофа
H
i C p,i C p
T p
уравнение Кирхгофа
C p i C p ,i j C p , j
прод
исх
17.
0 0298 C 0р d298
H 0T H 0298 C0p, 298 (T 298)
2) С р f (T )
в 2
с 3
1
2
3
l 1
H 2 Н 1 а(Т 2 Т 1 )
(Т 2 Т 1 )
(Т 2 Т 1 ) с
2
3
Т 2 Т1











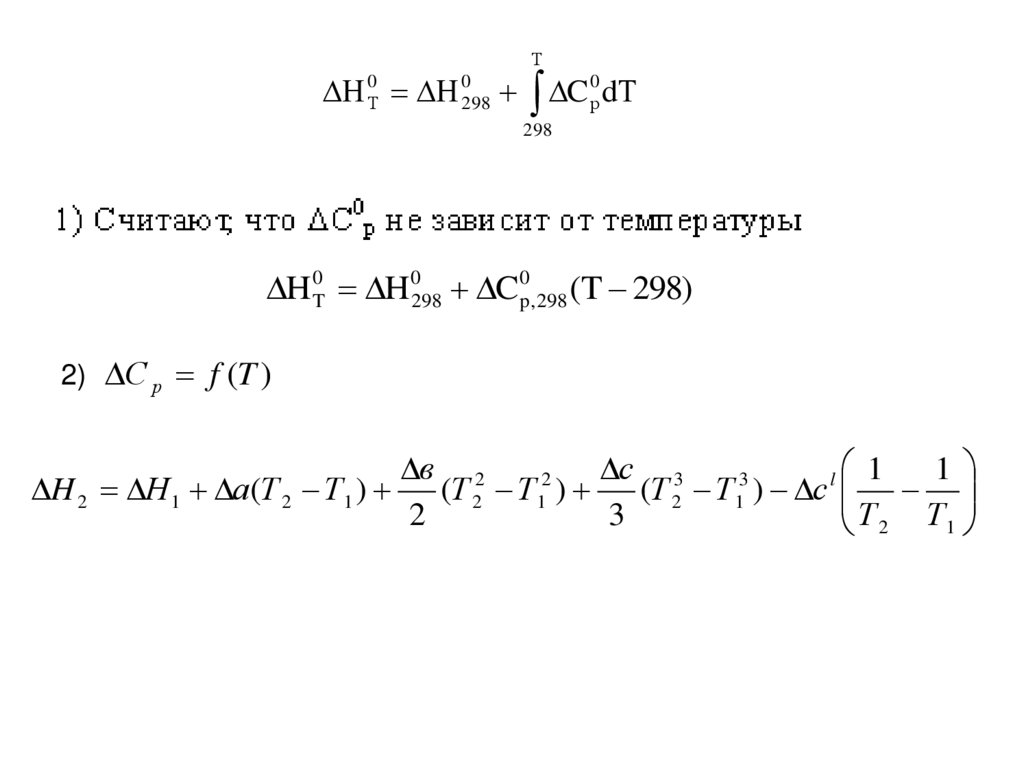
 physics
physics








