Similar presentations:
Лекция 1 Теория отталкивания электронных пар валентной оболочки
1.
Курс «Строение вещества»Лекция 1
Теория отталкивания электронных пар
валентной оболочки
2.
Литература1.Квантовая химия. Молекулы, молекулярные системы и твердые
тела [Электронный ресурс] : учебное пособие для вузов / В. Г.
Цирельсон.-3-е изд., испр. (эл.). - Электрон. текстовые дан. (1 файл
pdf : 522 с.). -М. : БИНОМ. Лаборатория знаний, 2014. - (Учебник
для высшей школы).-Систем. требования: Adobe Reader XI ; экран
10". http://www.studentlibrary.ru/book/ISBN9785996323623.html
2.Калашников, Н.П. Практикум по решению задач по общему
курсу физики. Основы квантовой физики. Строение вещества.
Атомная и ядерная физика [Электронный ресурс] : учебное
пособие / Н.П. Калашников, Н.М. Кожевников, Т.В. Котырло [и
др.]. — Электрон. дан. — СПб. : Лань, 2014. — 238 с.
http://e.lanbook.com/books/element.php?pl1_id=49468
02.10.2025
Межмолекулярные взаимодействия
2
3.
3. Капустина, А.А. Строение вещества с основами квантовой химии(модуль "Строение вещества"): учебно-методическое пособие к
семинарским занятиям / А. А. Капустина; Дальневосточный
федеральный университет, Школа естественных наук. Владивосток
: Изд-во Дальневосточного федерального университета, 2017.- 75 с.
http://lib.dvfu.ru:8080/lib/item?id=chamo:830024&theme=FEFU
4. Капустина, А.А. Строение вещества: краткий курс лекций
[Электронный ресурс] / А. А. Капустина, Дальневосточный
федеральный университет, Школа естественных наук. Владивосток:
Изд-во Дальневосточного федерального университета, 2015, 1
электрон. опт. диск (CD-ROM).
http://elib.dvfu.ru/vital/access/manager/Repository/fefu:2233
02.10.2025
Межмолекулярные взаимодействия
3
4. Сиджвиг и Пауэл (1940 г.)
Общая формула АХnПример молекул
Пример молекул
АХ2
BeH2 - линейная
H2O - угловая
АХ3
BF3- треугольная
NF3 - пирамидальная
AX4
CH4 - тетраэдрическая
SF4- пирамидальная
02.10.2025
Межмолекулярные взаимодействия
4
5.
02.10.2025Межмолекулярные взаимодействия
5
6. Основные положения теории Гиллеспи:
• 1. Пространственное расположение связеймноговалентного
атома
(или
иона)
обусловливается
исключительно
числом -пар (q) в его валентной оболочке.
• 2. Ориентация облаков -пар валентных
орбиталей определяется максимальным
отталкиванием
заполняющих
их
электронов.
6
7.
• В число q входят -пары как на связывающих МО, таки несвязывающих, то есть поделенные и
неподеленные электронные пары.
• Гиллеспи ввел для поделенных -пар обозначение X, а
для неподеленных - Е. Тогда формулу молекулы,
образованной многовалентным атомом, можно
записать как A XnEm, где А - центральный
многовалентный атом, n - число поделенных -пар, а
m - число неподеленных -пар в валентной оболочке
атома. Сумма (n + m) = q определяет геометрическое
строение молекулы.
02.10.2025
7
8.
• Электронные пары испытывают не толькоэлектростатическое отталкивание, но и
отталкивание в силу действия принципа Паули,
поэтому выражение для сил отталкивания имеет
вид:
(1).
• где r - расстояние между "центрами тяжести"
облаков электронных пар, n .
02.10.2025
Межмолекулярные взаимодействия
8
9.
Задача поиска расположения центров облаковпар, расталкивающихся в соответствии с законом
(I), при равных для всех пар величинах r
эквивалента задаче размещения нескольких частиц
на поверхности сферы при их максимальном
удалении друг от друга. Эта задача решается
строго для числа частиц (q) от 2 до 12 и дает
следующий результат:
02.10.2025
Межмолекулярные взаимодействия
9
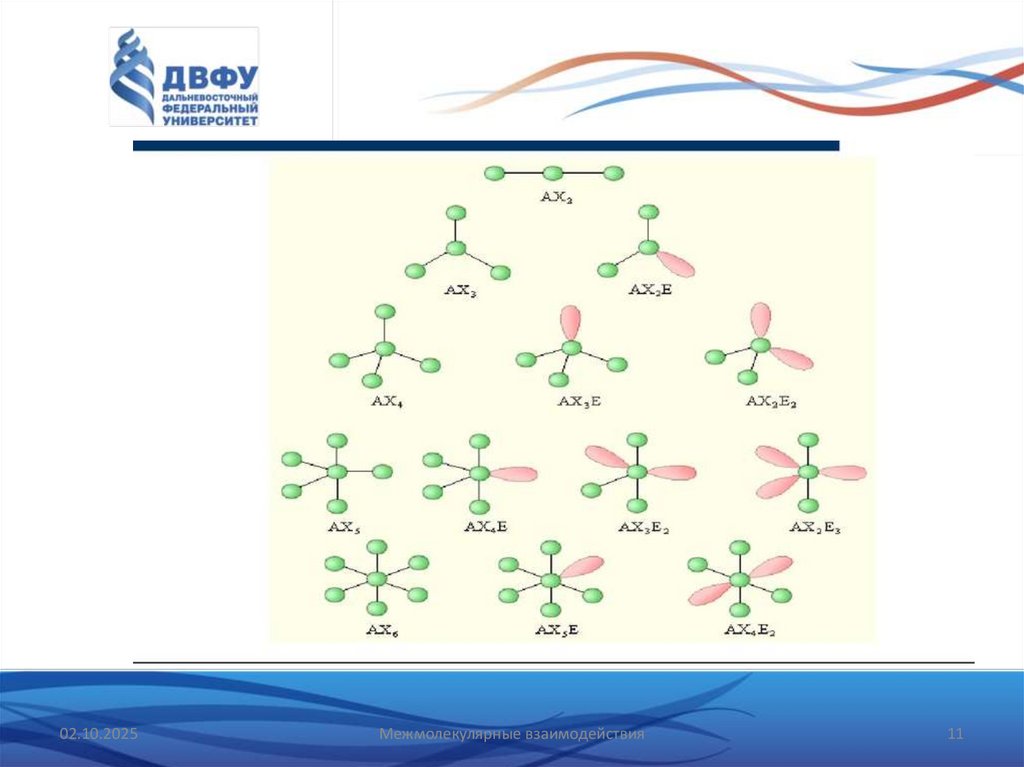
10.
Конфигурацияn+m= 2 линейная
n+m= 3 равносторонний треугольник
n+m= 4 тетраэдр
n+m= 5 тригональная бипирамида
n+m= 6 октаэдр
n+m= 7 октаэдр с дополнительной вершиной
n+m= 8 квадратная антипризма
n+m= 9 тригональная призма с тремя дополнительными вершин
n+m=10 квадратная актипризма с двумя дополнительными
вершинами
n+m= 11 икосаэдр без одной вершины
n+m= 12 икосаэдр
02.10.2025
10
11.
02.10.2025Межмолекулярные взаимодействия
11
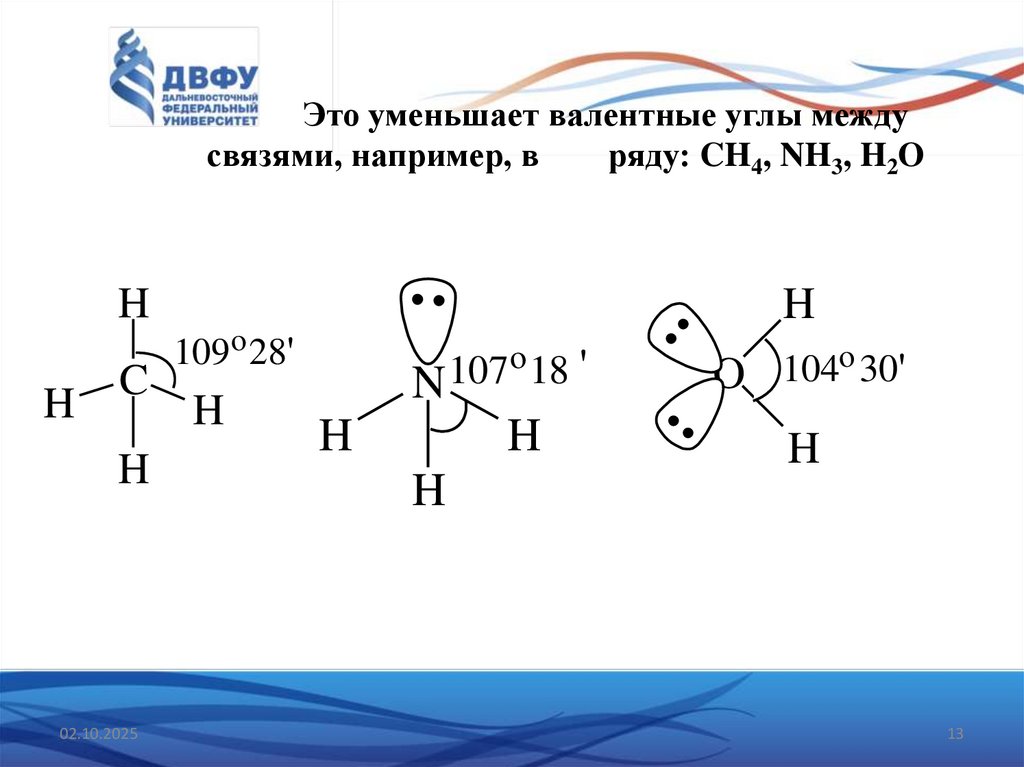
12. 3.Неподеленная пара занимает больший объем, чем пара, участвующая в образовании ординарной связи
Это допущение вытекает из таких простых аргументов,как то, что неподеленная пара находится в поле только
одного положительного атомного остова и, следовательно,
более диффузна, чем связывающая пара, испытывающая
сжатие полем зарядов двух атомных остовов. Отсюда
следует вывод, что в серии однотипных молекул (то есть
содержащих равное число пар в валентной оболочке
центрального атома) неподеленная пара, заменяя связывающую электронную пару, стремится занять большее
пространство вокруг атома.
02.10.2025
Межмолекулярные взаимодействия
12
13. Это уменьшает валентные углы между связями, например, в ряду: CH4, NH3, H2O
HH
H
C
H
02.10.2025
109 o 28'
H
o 18 '
107
N
H
H
o 30
104
'
O
H
H
13
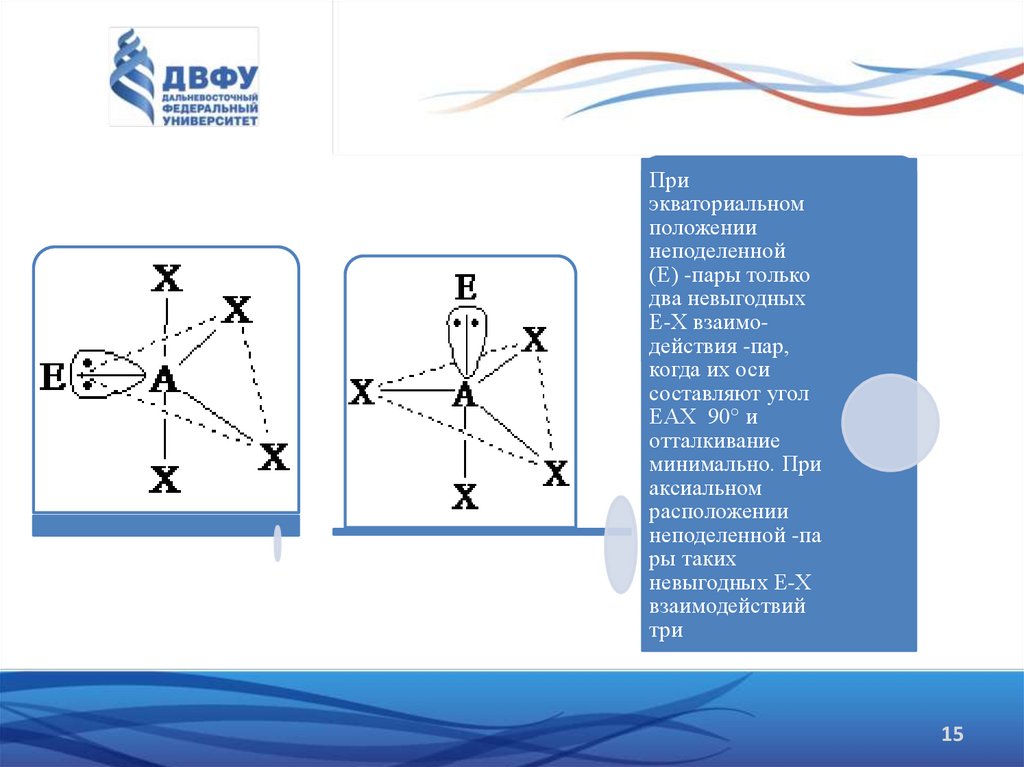
14.
Важное следствие, что в молекулах, геометрическая форма которыхпроизводится от структуры тригональной бипирамиды, неподеленные
электронные пары всегда занимают экваториальное положение . При
экваториальном положении неподеленной (Е) e -пары только два невыгодных
Е-Х взаимодействия e -пар, когда их оси составляют угол ЕАX
90° и
отталкивание минимально.
При аксиальном расположении неподеленной e -пары таких невыгодных
Е-Х взаимодействий три.
02.10.2025
Межмолекулярные взаимодействия
14
15.
Приэкваториальном
положении
неподеленной
(Е) -пары только
два невыгодных
Е-Х взаимодействия -пар,
когда их оси
составляют угол
ЕАX 90° и
отталкивание
минимально. При
аксиальном
расположении
неподеленной -па
ры таких
невыгодных Е-Х
взаимодействий
три
15
16. 4.Объем e‑пары, участвующей в образовании связи, уменьшается с увеличением электроотрицательности лиганда.
4.Объем e-пары, участвующей в образованиисвязи, уменьшается с увеличением
электроотрицательности лиганда.
Более электроотрицательный лиганд сильнее притягивает общее e -облако
связывающей пары, что можно представить как дополнительное сжатие этого
облака. Данная электронная пара более удалена от центрального атома.
02.10.2025
Межмолекулярные взаимодействия
16
17. 4.Объем e‑пары, участвующей в образовании связи, уменьшается с увеличением электроотрицательности лиганда.
4.Объем e-пары, участвующей в образовании связи,уменьшается с увеличением электроотрицательности
лиганда.
Следствие:
В
молекулах
с
неподеленными
электронными парами валентные углы, составляемые
связями
центрального
атома
с
наиболее
электроотрицательными лигандами, имеют наименьшее
значение. Например, в молекуле NH3 угол HNH равен
107°, а в молекуле NF3 угол FNF равен 102°.
17
18.
5. Электронные пары кратных связей эквивалентны ординарной связи, нозанимают в пространстве больший объем.
То есть электроны -связей при определения геометрия молекул не учитываются. Обычно размер e -облака двойной связи принимают равным размеру
орбитали неподеленной электронной пары.
02.10.2025
Межмолекулярные взаимодействия
18
19. 5.Электронные пары кратных связей эквивалентны ординарной связи, но занимают в пространстве больший объем.
Из-за большого объема e-пар кратных связей валентные углыв таких молекулах отличаются от валентных углов в
молекулах с ординарными связями. Например, из-за
большого размера электронного облака кратной связи
угол XСX в молекулах типа X2C=CH2 всегда меньше 120°, и
тем меньше, чем больше электроотрицательность атома X.
Угол XСС, наоборот, больше 120°.
Угол HCH в молекуле H2C=CH2 равен 116.8°, а угол HCC 122°.
Угол ClCCl в молекуле Cl2C=CH2 равен 114.0°,
19
20. Достоинства теории ОЭПВО
• 1.Теория Гиллеспи проста, позволяет предсказатьпространственное строение молекул, образованных s- и p .
• 2. Полезна для описания относительной ориентации групп
в метастабильных комплексах и переходных состояниях:
• FCH3 + F- ↔[CH3F2]-
02.10.2025
Межмолекулярные взаимодействия
20
21. Недостатки теории ОЭПВО
не применима к описанию строения d-элементов, таккак наличие d-электронов приводит к отклонению от
сферической симметрии расположения электронов остова.
Эти отклонения особенно заметны, когда число
d-электронов от 6 до 9.
• 2) не учитывает природу лиганда. Поэтому не может
объяснить некоторые отклонения. Например, [TiCl6]2является октаэдром, а n+m=7.
• 3) не учитывает тип орбиталей электронных пар.
• Последние два недостатка не позволяют учесть отдельные
тонкие различия в однотипных молекулах.
• 1)
02.10.2025
Межмолекулярные взаимодействия
21
22. n+m=2
ClF
Be
линейная (SP)
линейная (SP)
Mg
линейная (SP)
Угловая (Sd)
Ca
линейная (SP)
Угловая (Sd)
Sr
Угловая (Sd)
Угловая (Sd)
Ba
Угловая (Sd)
Угловая (Sd)
02.10.2025
Межмолекулярные взаимодействия
22
23. Примеры
Пример 1.
Установите геометрическое строение молекулы SCl4
А) Определяем сумму электронов в валентной оболочке атома серы:
электронная конфигурация атома серы 1s22s22p63s23p4, на внешнем уровне
6 электронов. Каждый из атомов хлора поставляет в валентную оболочку
атома серы по одному электрону. Отсюда:
e = 6 e + 4 e = 10 e .
02.10.2025
Межмолекулярные взаимодействия
23
24.
Б) Определяем сумму поделенных (n) и неподеленных (m) e -пар (она равнасуммарному числу электронов, деленному на два):
n m
10
5.
2
В) Определяем расположение e -пар в пространстве.
n+m=5 - тригональная бипирамида; n = 4, m = 1 (число n равно числу
-связей в молекуле).
02.10.2025
Межмолекулярные взаимодействия
24
25.
Неподеленная e -пара занимает в пространстве больше места, поэтому будетрасполагаться в том направлении, которое энергетически более выгодно. В
случае тригональной бипирамиды – это экваториальное направление. То
есть молекулу SCl4 можно изобразить так:
Cl
Cl
S
E
Cl
Cl
Угол < 180 , так как одно из направлений занято неподеленной e -парой,
а это приводит к искажению бипирамиды.
02.10.2025
Межмолекулярные взаимодействия
25
26.
• Пример 2. Установите геометрическое строение молекулы POCl3.А) Находим сумму электронов в валентной оболочке атома фосфора. На
внешнем уровне в атоме фосфора 5 e (P 3s23p3). Атом кислорода, как 2валентный, поставляет в валентную оболочку атома фосфора два
электрона, а каждый атом хлора - по одному электрону. Отсюда:
e = 5 e + 2 e + 3 e = 10 e .
02.10.2025
Межмолекулярные взаимодействия
26
27.
Б) Определяем сумму поделенных (n) и неподеленных (m) e -пар, учитывая,что кратная связь равноценна одинарной (то есть исключаем -связи):
n m
10
1 4 .
2
В рассматриваемой молекуле одна -связь, поэтому вычитаем из
получившегося при делении числа единицу.
02.10.2025
Межмолекулярные взаимодействия
27
28.
В) Определяем геометрическое строение молекулы.n+m=4 - тетраэдр, n = 4, m = 0. Таким образом, строение следующее:
O
Cl
P
Cl
Cl
Из-за большого размера e -облака двойной связи угол ClPCl меньше угла в
правильном тетраэдре.
02.10.2025
Межмолекулярные взаимодействия
28
29.
• Пример 3. В какой из молекул H2O или Cl2O угол между связями 0-Хбудет меньше? Почему?
Общая формула рассматриваемых молекул OX2E2, так как
e = 6 e + 2 e = 8 e , где 6 e от атомов O, а 2 e от атомов X.
8
n m 4,
2
n = 2, m = 2.
Электронные пары располагаются в форме тетраэдра:
E
O
E
02.10.2025
X
X
Межмолекулярные взаимодействия
29
30.
Неподеленные e -пары, занимая в пространстве больший объем, приводятк уменьшению угла по сравнению с углом в правильном тетраэдре. Угол
будет тем меньше, чем больше электроотрицательность атома X.
Электроотрицательность атома хлора больше электроотрицательности
атома водорода.
Таким образом, угол между связями O Cl в молекуле Cl2O меньше, чем
угол между связями O H в молекуле H2O.
02.10.2025
Межмолекулярные взаимодействия
30
31. Пример 4. Сравните углы XАX в молекулах SF6 и BrF5.
Пример 4.Сравните углы XАX в молекулах SF6 и BrF5.
Общее число электронов в валентных оболочках центрального атома в
этих молекулах одинаковое и равно 12, n + m = 6. Однако соотношение
между m и n разное:
SF6: n = 6, m = 0, то есть формула AF6E0 - неподеленных электронных пар
нет, геометрическое строение - правильный октаэдр.
BrF5: n = 5, m = 1, то есть формула AF5E. Наличие неподеленной
электронной пары приводит к уменьшению аксиально-экваториального
угла FBrF в молекуле BrF5 по сравнению с аналогичным углом FSF в
молекуле SF6.
F
F
F
F
S
F
F
o
02.10.2025
F F F
Br
F
F
E
o
Межмолекулярные взаимодействия
31
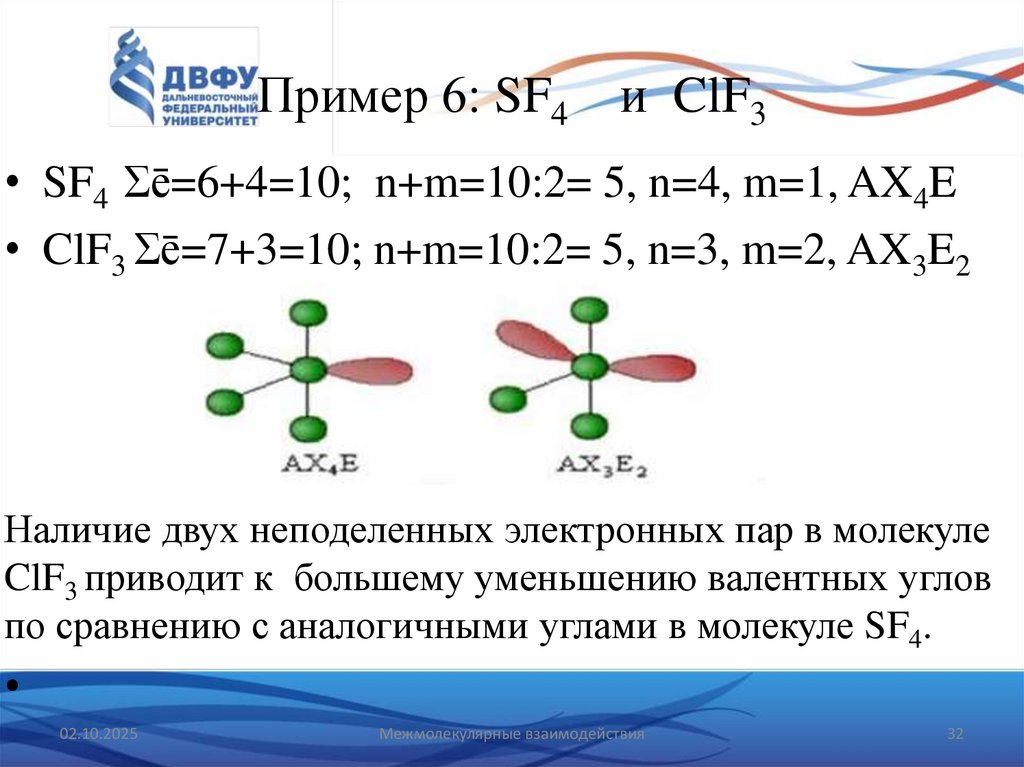
32. Пример 6: SF4 и ClF3
• SF4 Σē=6+4=10; n+m=10:2= 5, n=4, m=1, AX4E• ClF3 Σē=7+3=10; n+m=10:2= 5, n=3, m=2, AX3E2
Наличие двух неподеленных электронных пар в молекуле
ClF3 приводит к большему уменьшению валентных углов
по сравнению с аналогичными углами в молекуле SF4.
02.10.2025
Межмолекулярные взаимодействия
32
33.
• Теория ОЭПВО легко экстраполируется ина более сложные молекулы. В каждом
случае необходимо выделить центральный
атом и окружающие его атомы или
радикалы и определить число и тип
окружающих данный атом электронных
пар.
02.10.2025
Межмолекулярные взаимодействия
33
34.
• Например, H2SO4. Центральный атом – сера.• Σē=6+4 +2=12, n+m=12:2 – 2 =4 – тетраэдр.
• Чтобы определить под каким углом расположен атом
водорода, надо в качестве центрального атома взять
кислород. Σē=6+1 +1=8, n+m=8:2 =4 – тетраэдр.
02.10.2025
Межмолекулярные взаимодействия
34
35.
• Спасибо за внимание!02.10.2025
Межмолекулярные взаимодействия
35































 chemistry
chemistry








