Similar presentations:
Строение молекул
1.
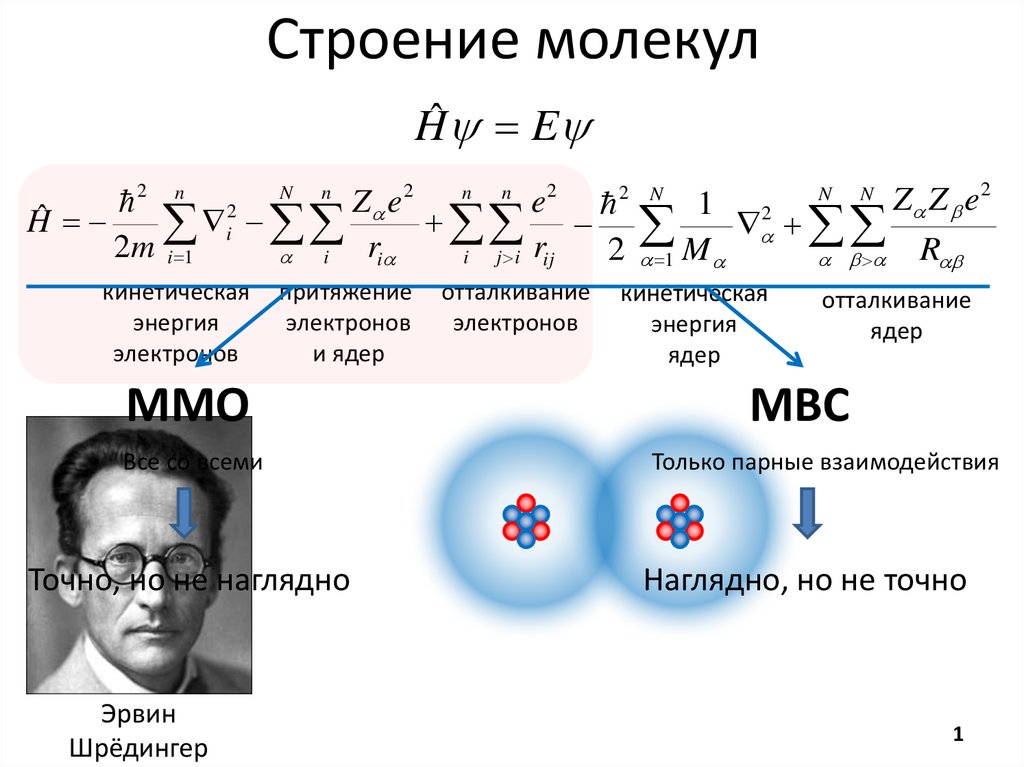
Строение молекулHˆ E
2
2 n
2
N n
n
n
2 N
N N Z Z e
Z
e
e
1
2
2
Hˆ
i
2m i 1
r
r
2
M
R
i
i j i ij
i
1
кинетическая
энергия
электронов
притяжение
электронов
и ядер
ММО
Все со всеми
Точно, но не наглядно
Эрвин
Шрёдингер
отталкивание
электронов
кинетическая
энергия
ядер
2
отталкивание
ядер
МВС
Только парные взаимодействия
Наглядно, но не точно
1
2.
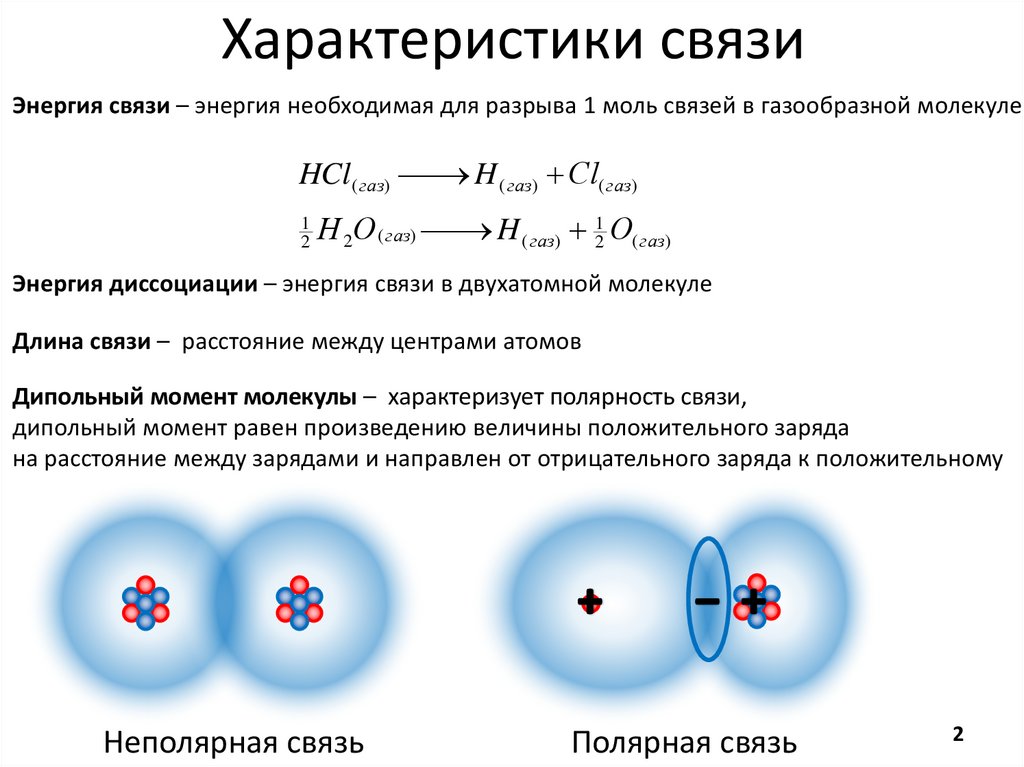
Характеристики связиЭнергия связи – энергия необходимая для разрыва 1 моль связей в газообразной молекуле
HCl( газ)
H ( газ) Сl( газ)
1
2
Н 2О ( газ)
H ( газ) 12 О( газ)
Энергия диссоциации – энергия связи в двухатомной молекуле
Длина связи – расстояние между центрами атомов
Дипольный момент молекулы – характеризует полярность связи,
дипольный момент равен произведению величины положительного заряда
на расстояние между зарядами и направлен от отрицательного заряда к положительному
Неполярная связь
Полярная связь
2
3.
Свойства атомаЭлектроотрицательность
Полинг
Малликен
Аллен
А В Еd АВ 12 Еd АА 12 Еd ВВ Ed энергия диссоциации
А 0.187( I A AA ) 0.17,
I A потенциал ионизации , AA сродство к электрону
А 0.169
ns E s n p E p
ns n p
, ns , p число e, Es , p энергия e
Олред-Рохов
(A-R)
3
4.
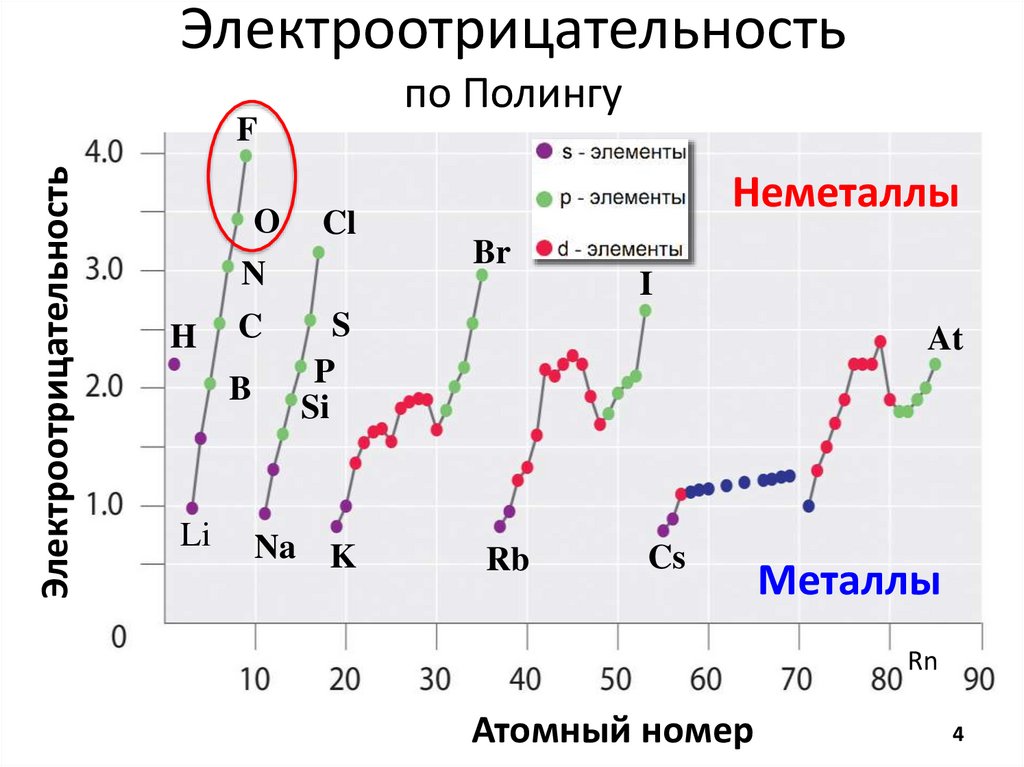
Электроотрицательностьпо Полингу
Электроотрицательность
F
O
Cl
N
H
C
B
Li
Неметаллы
Br
I
S
P
Si
Na K
At
Rb
Cs
Металлы
Rn
Атомный номер
4
5.
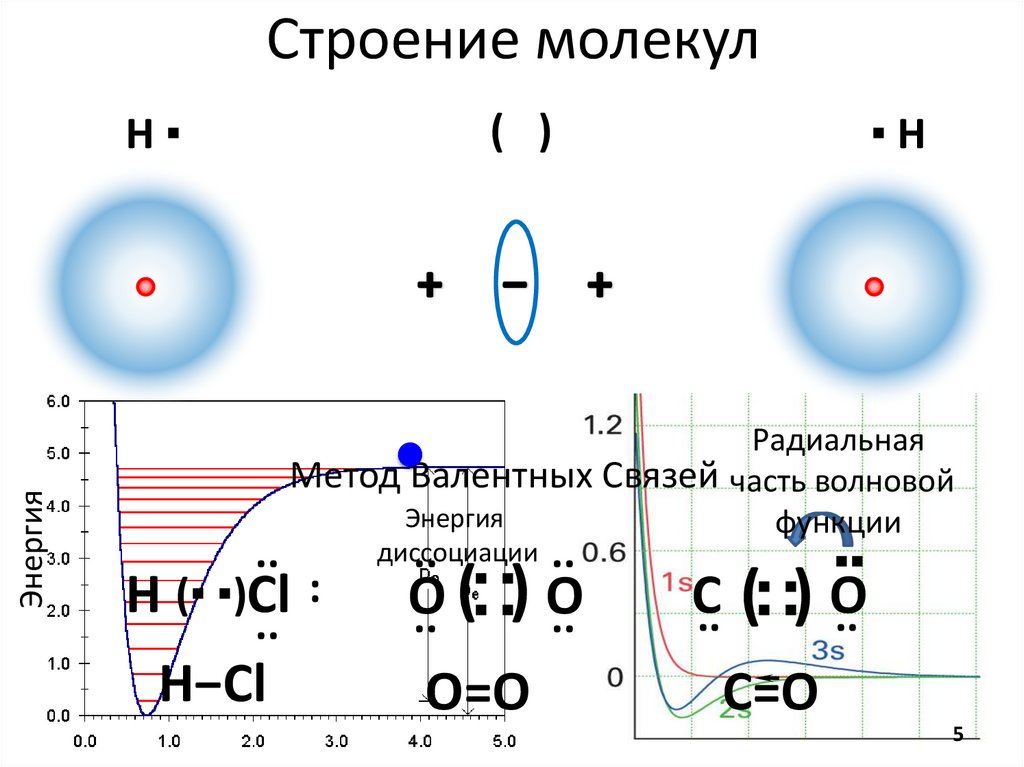
Строение молекул( )
Энергия
H▪
▪H
Радиальная
Метод Валентных Связей часть волновой
Энергия
функции
··
H (▪ ▪)Cl :
··
H−Cl
диссоциации
·· ▪ ▪ ··
(
)
O
O
▪
▪
··
··
▪▪
C·· (▪▪ ▪▪) O
··
O=O
C=O
5
6.
Описание ковалентной связиопределения:
1 направленность
2 насыщаемость
3 поляризуемость
2 приближения:
Метод Валентных Связей
Метод молекулярных орбиталей
6
7.
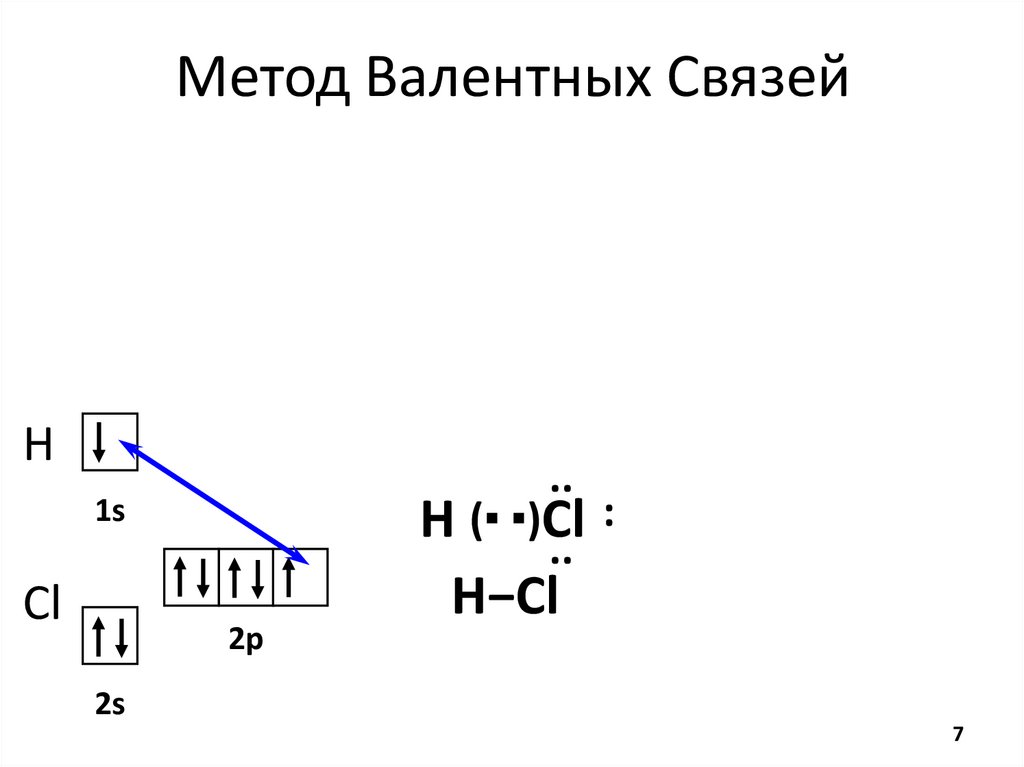
Метод Валентных СвязейH
··
1s
Cl
2p
H (▪ ▪)Cl :
··
H−Cl
2s
7
8.
Метод Валентных СвязейC=O
С
2p
2s
O
2p
2s
▪▪
C·· (▪▪ ▪▪) O
··
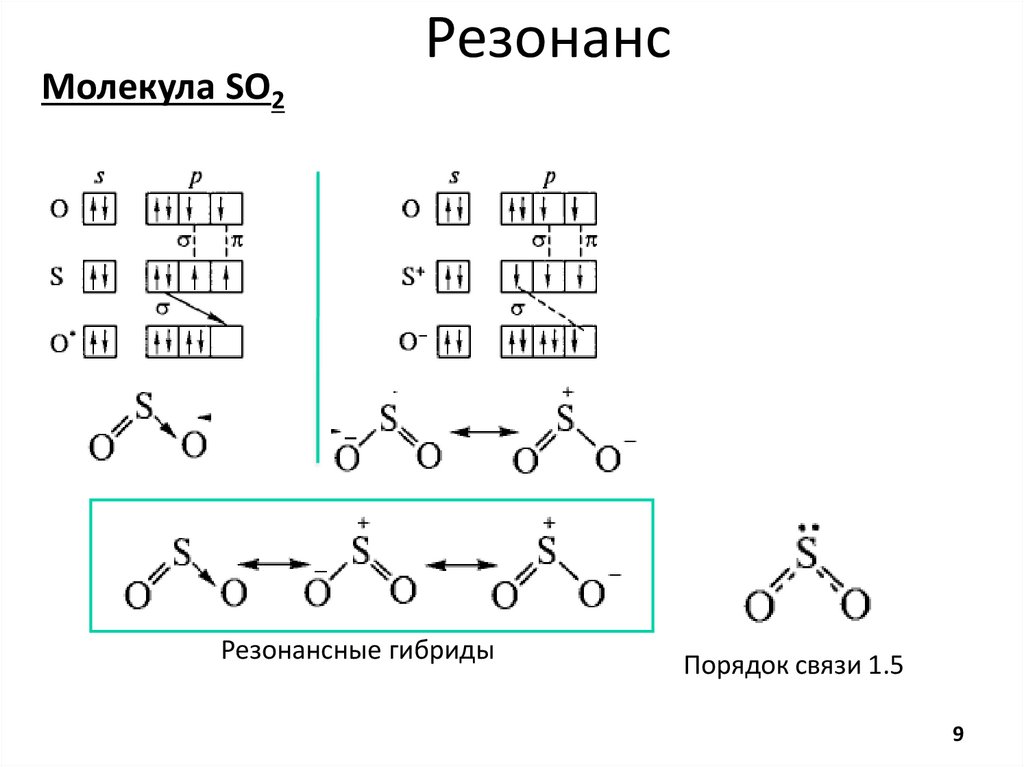
9.
Молекула SO2Резонанс
Резонансные гибриды
Порядок связи 1.5
9
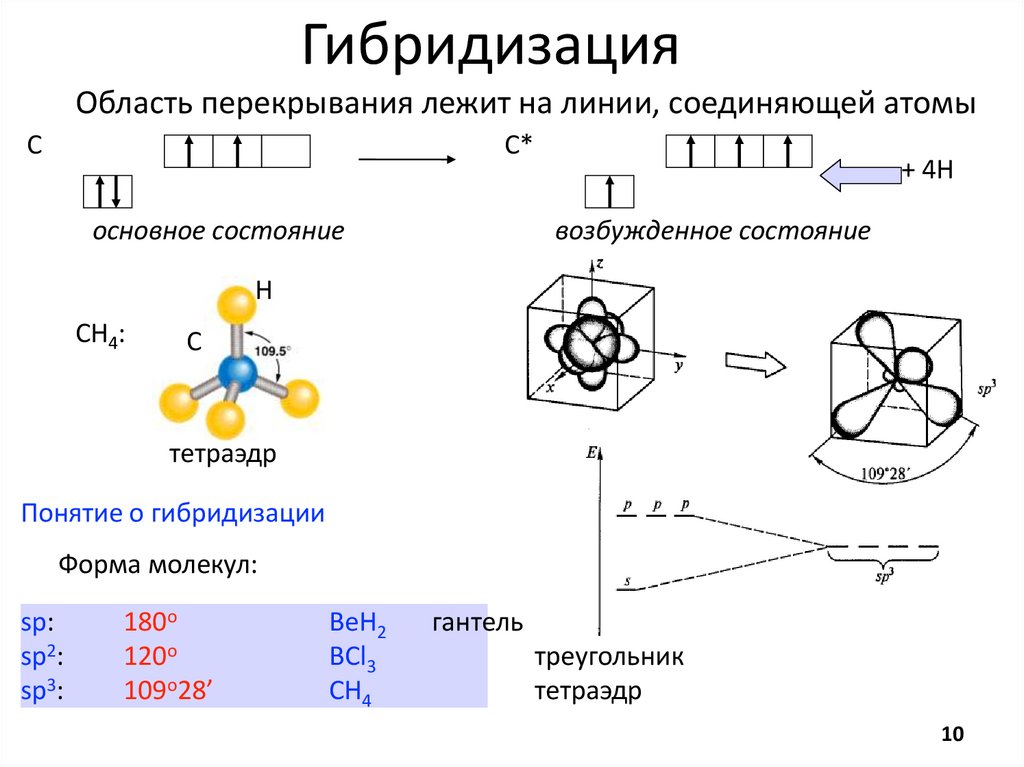
10.
ГибридизацияОбласть перекрывания лежит на линии, соединяющей атомы
C
C*
основное состояние
+ 4Н
возбужденное состояние
H
CH4:
C
тетраэдр
Понятие о гибридизации
Форма молекул:
sp:
sp2:
sp3:
180o
120o
109o28’
BeH2
BCl3
CH4
гантель
треугольник
тетраэдр
10
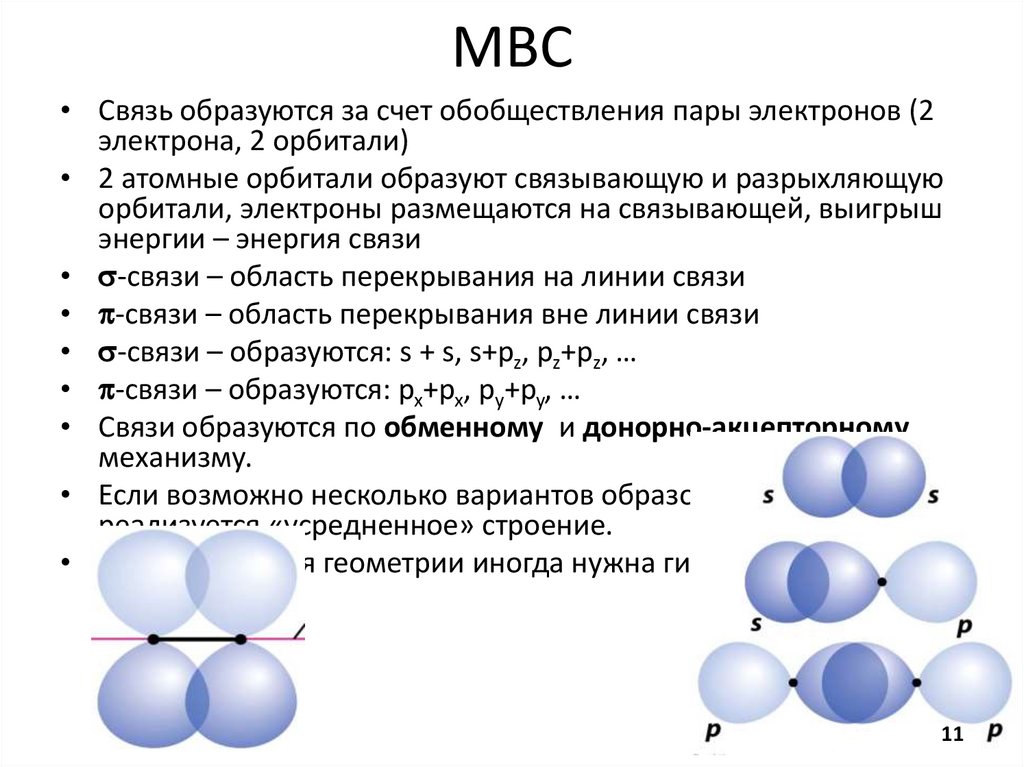
11.
МВС• Связь образуются за счет обобществления пары электронов (2
электрона, 2 орбитали)
• 2 атомные орбитали образуют связывающую и разрыхляющую
орбитали, электроны размещаются на связывающей, выигрыш
энергии – энергия связи
• s-связи – область перекрывания на линии связи
• p-связи – область перекрывания вне линии связи
• s-связи – образуются: s + s, s+pz, pz+pz, …
• p-связи – образуются: px+px, py+py, …
• Связи образуются по обменному и донорно-акцепторному
механизму.
• Если возможно несколько вариантов образования связей , то
реализуется «усредненное» строение.
• Для объяснения геометрии иногда нужна гибридизация
11
12.
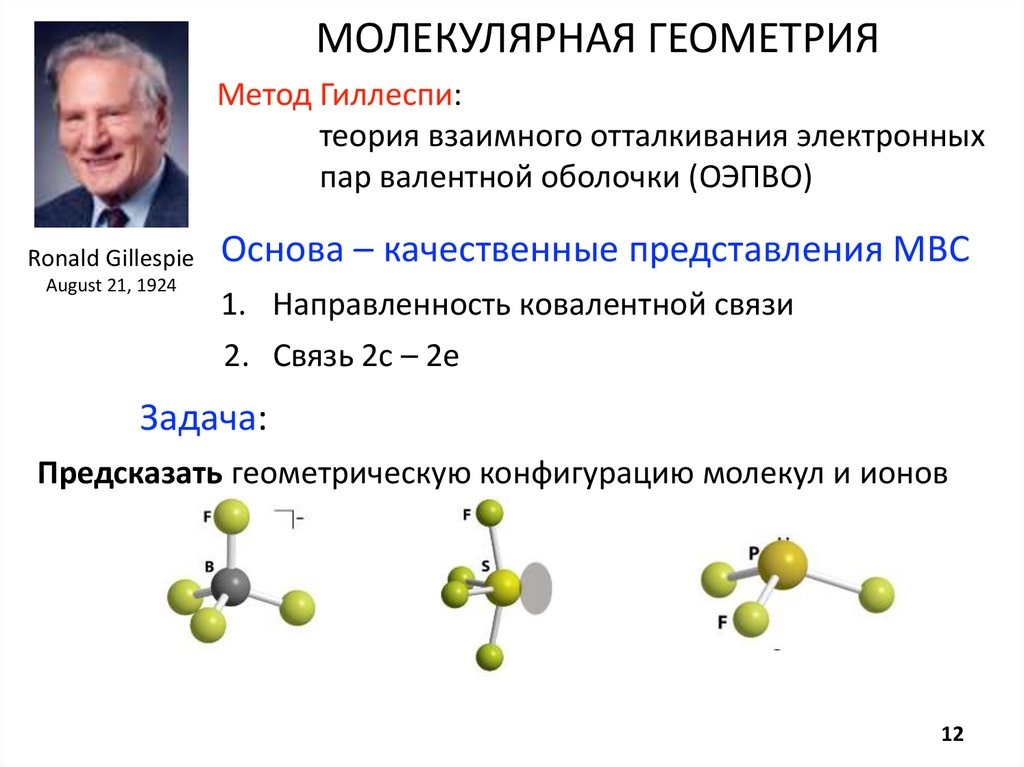
МОЛЕКУЛЯРНАЯ ГЕОМЕТРИЯМетод Гиллеспи:
теория взаимного отталкивания электронных
пар валентной оболочки (ОЭПВО)
Ronald Gillespie
August 21, 1924
Основа – качественные представления МВС
1. Направленность ковалентной связи
2. Связь 2с – 2е
Задача:
Предсказать геометрическую конфигурацию молекул и ионов
12
13.
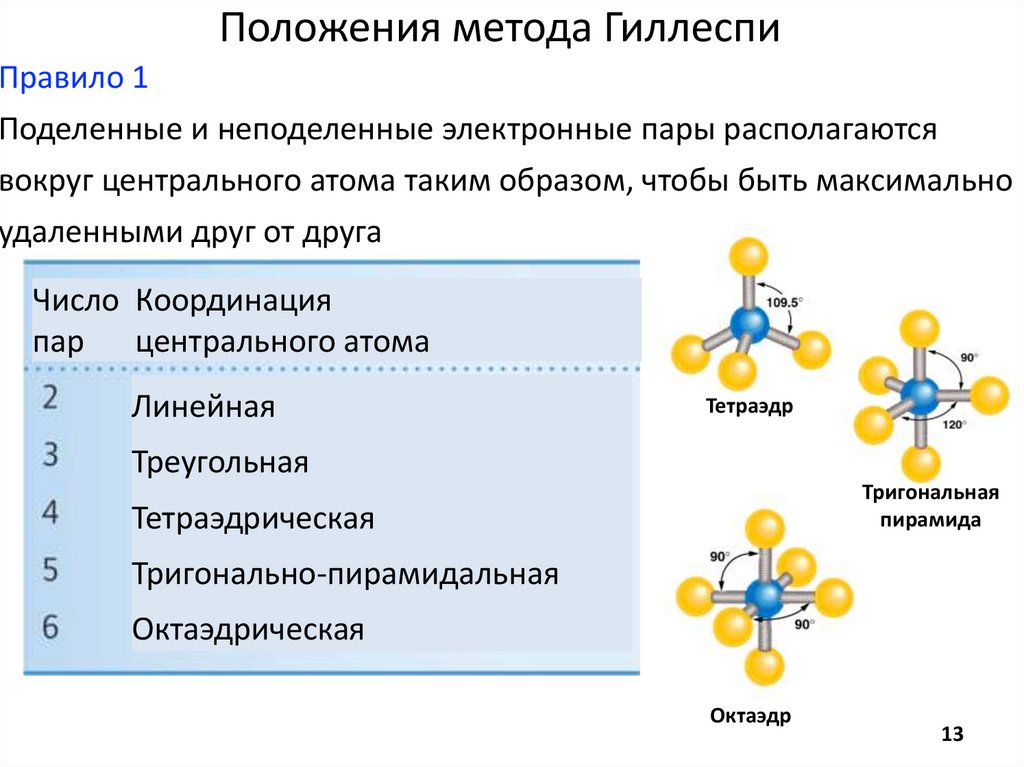
Положения метода ГиллеспиПравило 1
Поделенные и неподеленные электронные пары располагаются
вокруг центрального атома таким образом, чтобы быть максимально
удаленными друг от друга
Число Координация
пар центрального атома
Линейная
Тетраэдр
Треугольная
Тригональная
пирамида
Тетраэдрическая
Тригонально-пирамидальная
Октаэдрическая
Октаэдр
13
14.
Правило 2Электронные пары могут быть связывающие и несвязыывающие.
Несвязывающая электронная пара занимает больший объем чем
связывающая
14
15.
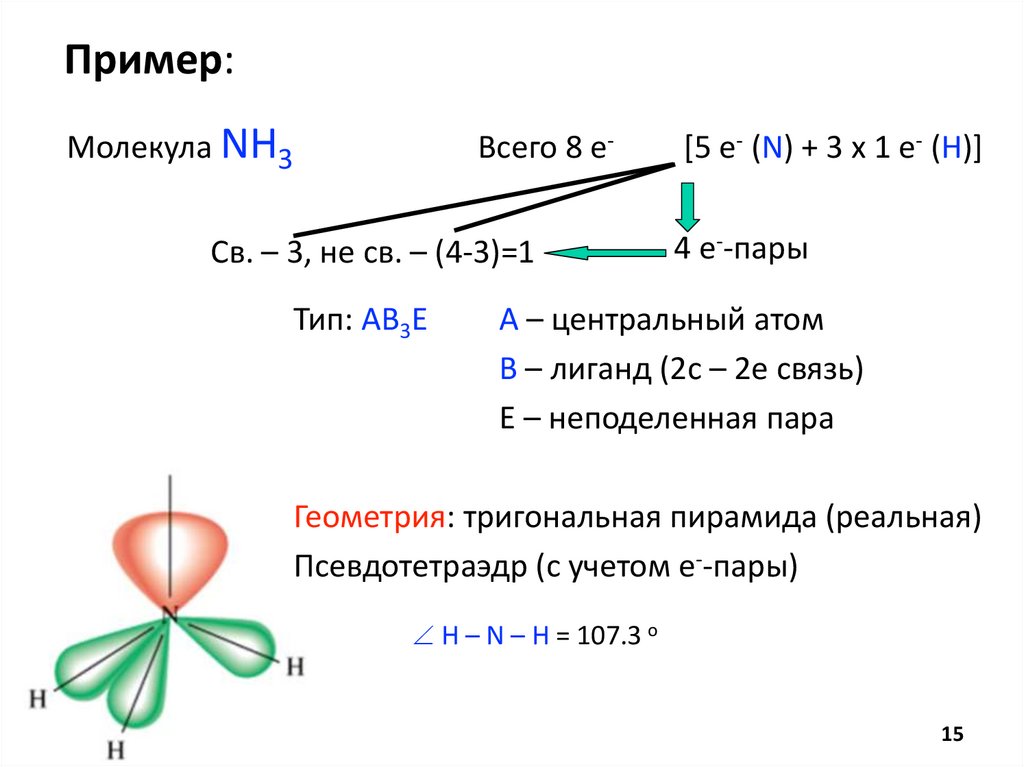
Пример:Молекула NH3
Всего 8 е-
Св. – 3, не св. – (4-3)=1
Тип: АВ3Е
[5 e- (N) + 3 x 1 e- (H)]
4 е--пары
А – центральный атом
В – лиганд (2с – 2е связь)
Е – неподеленная пара
Геометрия: тригональная пирамида (реальная)
Псевдотетраэдр (с учетом е--пары)
H – N – H = 107.3 o
15
16.
Пример:Молекула IOF3
Всего 12 е-
= [7e- (I) + 2e- (O)] + 3 x 1e- (F)]
6е--пар
Тип: АВ4Е
Св. – 5, не св. – (6-5)=1
А – центральный атом
В – лиганд
Е – неподеленная пара
с учетом е— пары — тригональная бипирамида
Геометрия: дисфеноид (реальная)
F
F
O
F
16
17.
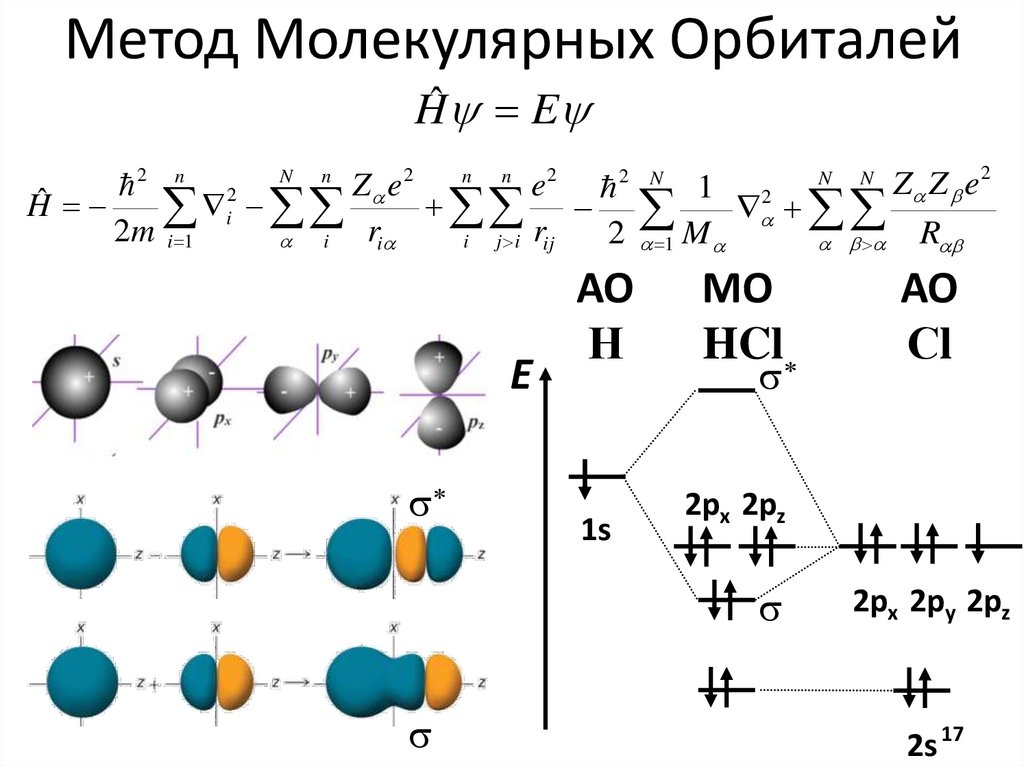
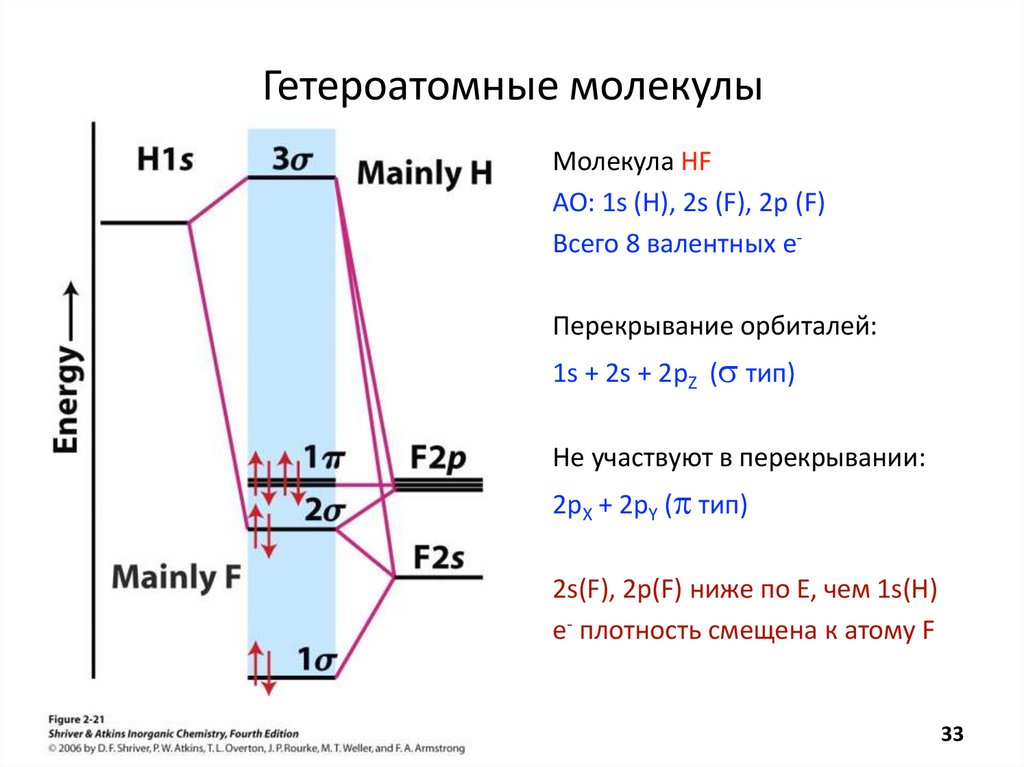
Метод Молекулярных ОрбиталейHˆ E
2
2 n
2
N n
n
n
2 N
N N Z Z e
Z
e
e
1
2
2
Hˆ
i
2m i 1
r
r
2 1 M
R
i
i j i ij
i
E
s*
АО
Н
1s
МО
HCl*
s
АО
Сl
2px 2pz
s
s
2
2px 2py 2pz
2s 17
18.
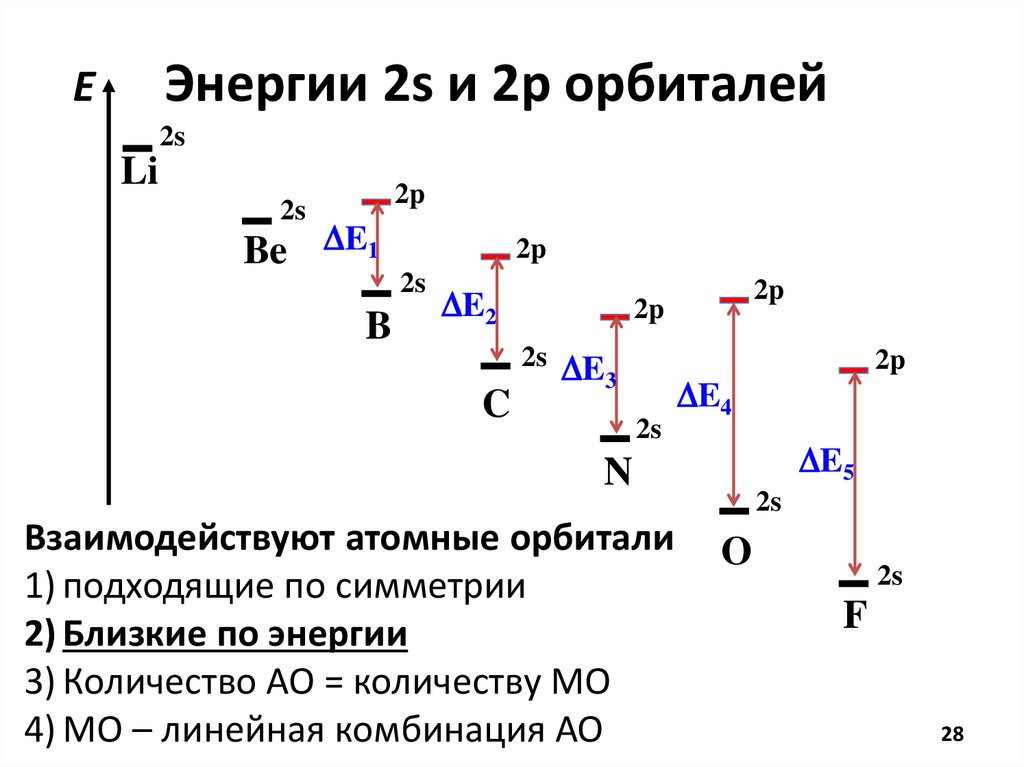
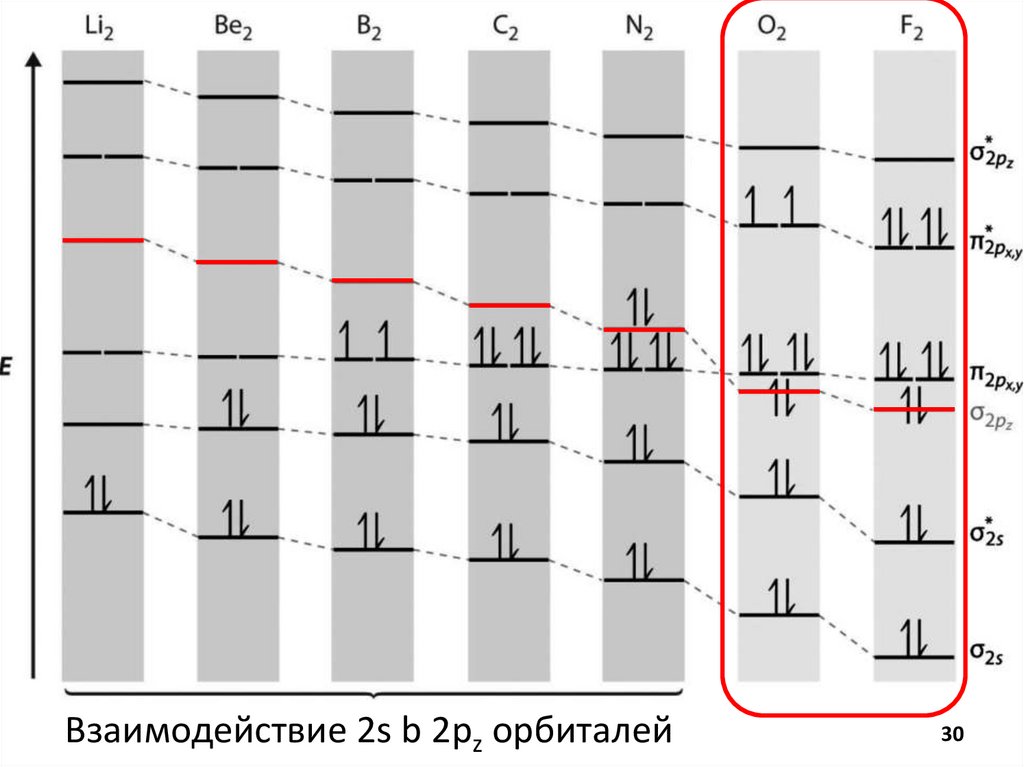
Метод Молекулярных ОрбиталейВзаимодействуют атомные орбитали
1) подходящие по симметрии
2) Близкие по энергии
3) Количество АО = количеству МО
4) MO – линейная комбинация АО
E
p*
АО
1s
МО *
s
2px 2pz
s
p
АО
2px 2py 2pz
2s 18
19.
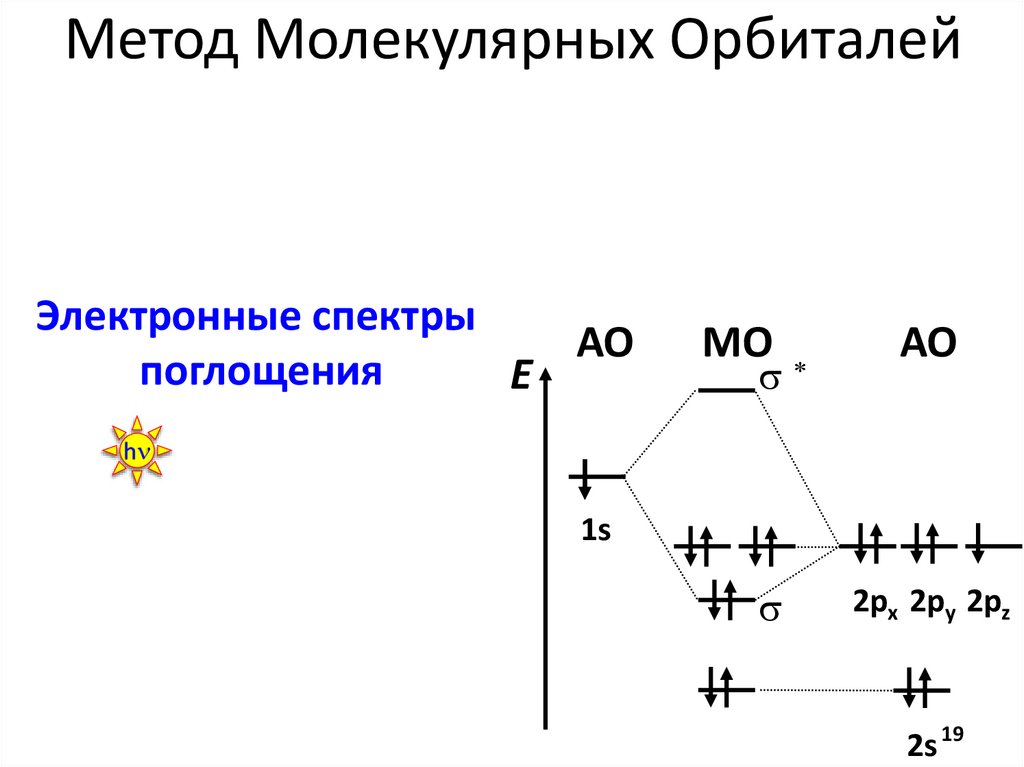
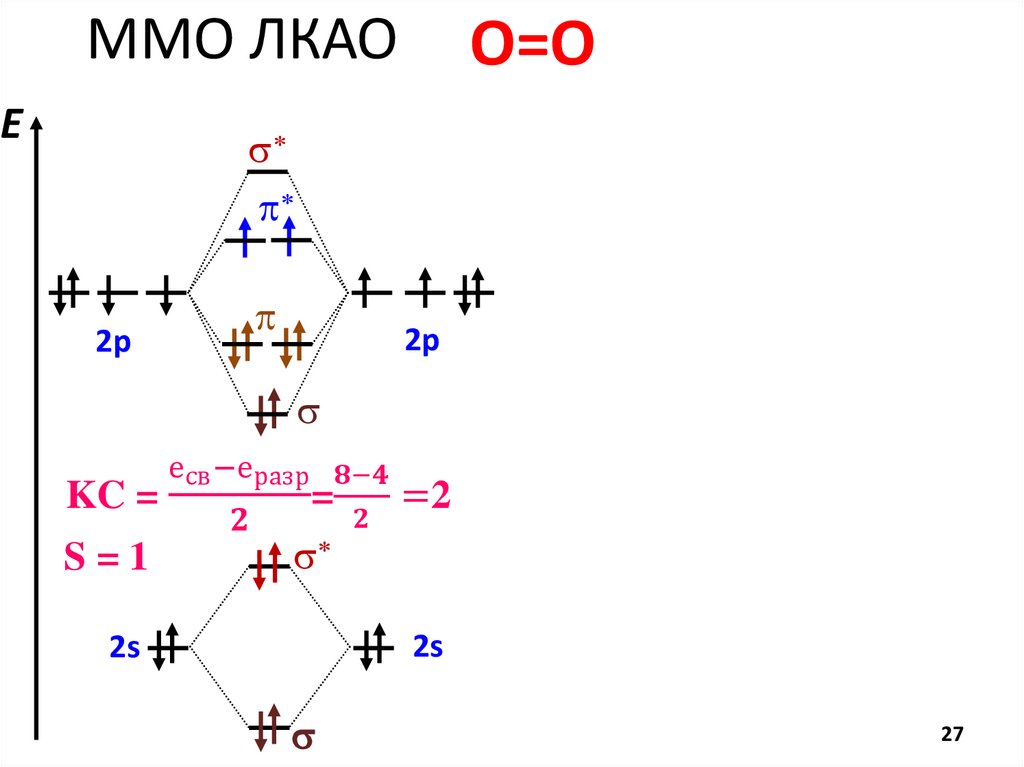
Метод Молекулярных ОрбиталейЭлектронные спектры
АО
поглощения
E
МО *
АО
s
2px 2py 2pz
s
hn
1s
2s 19
20.
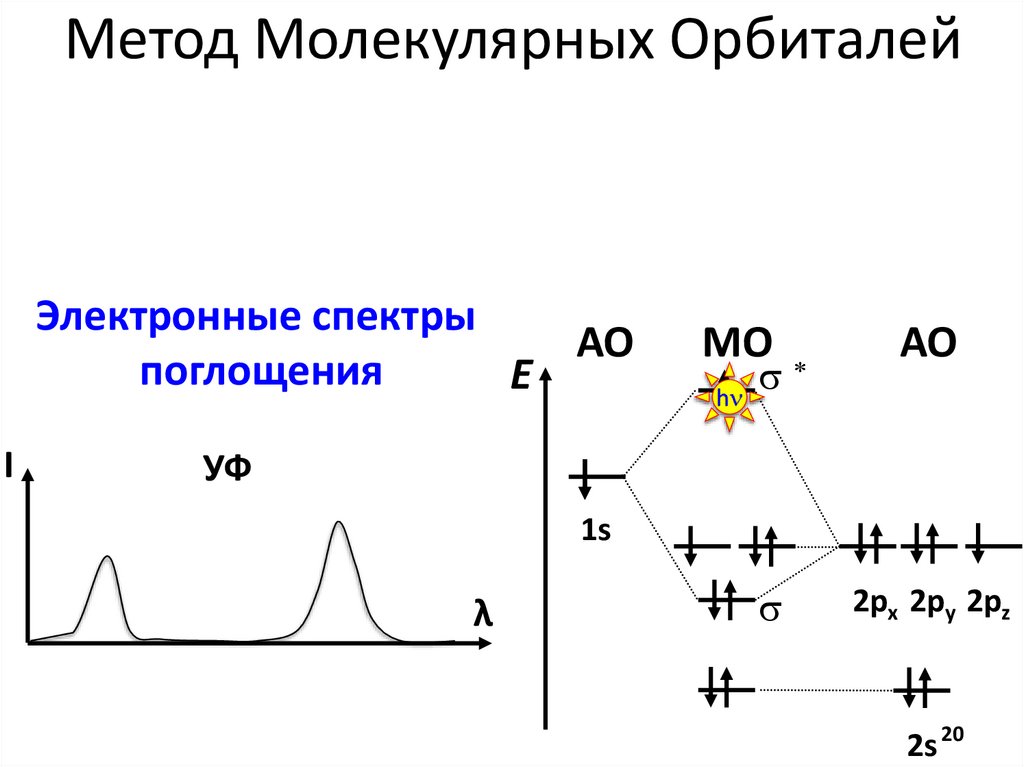
Метод Молекулярных ОрбиталейЭлектронные спектры
АО
поглощения
E
I
МО *
hn
s
АО
УФ
1s
λ
s
2px 2py 2pz
2s 20
21.
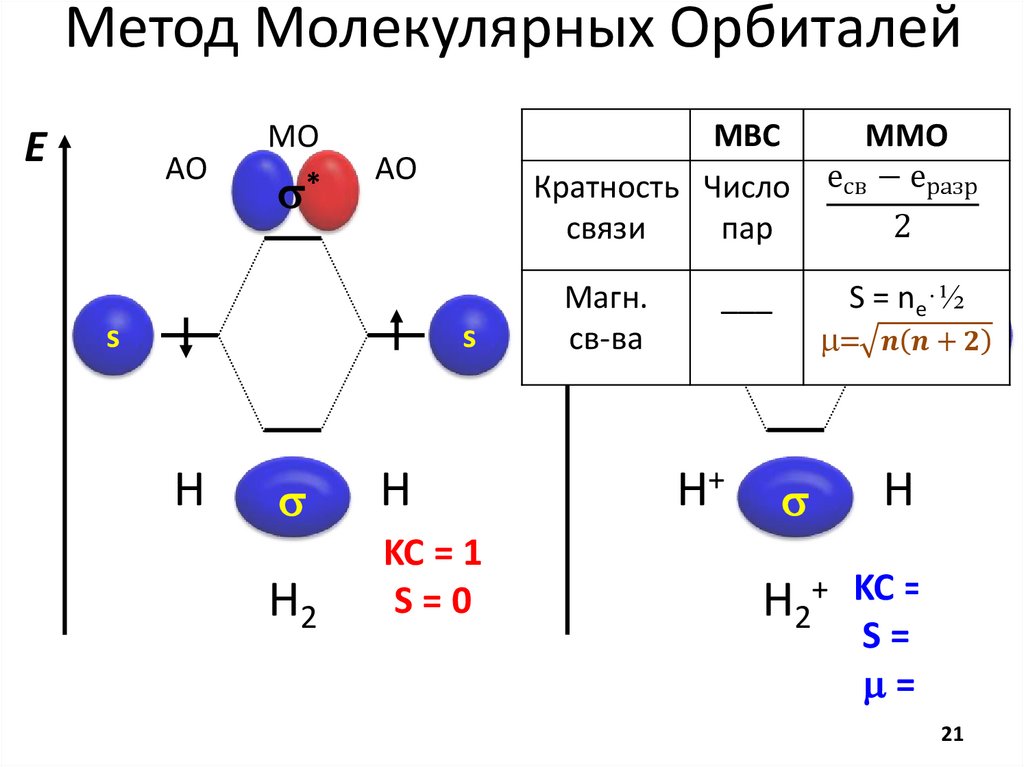
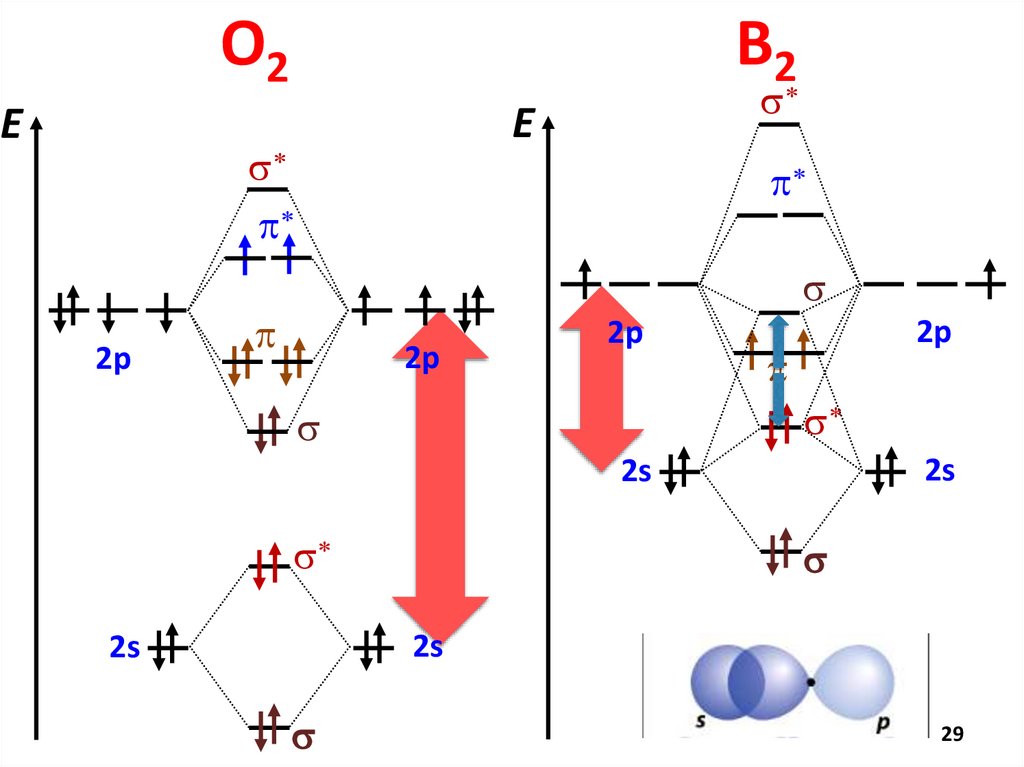
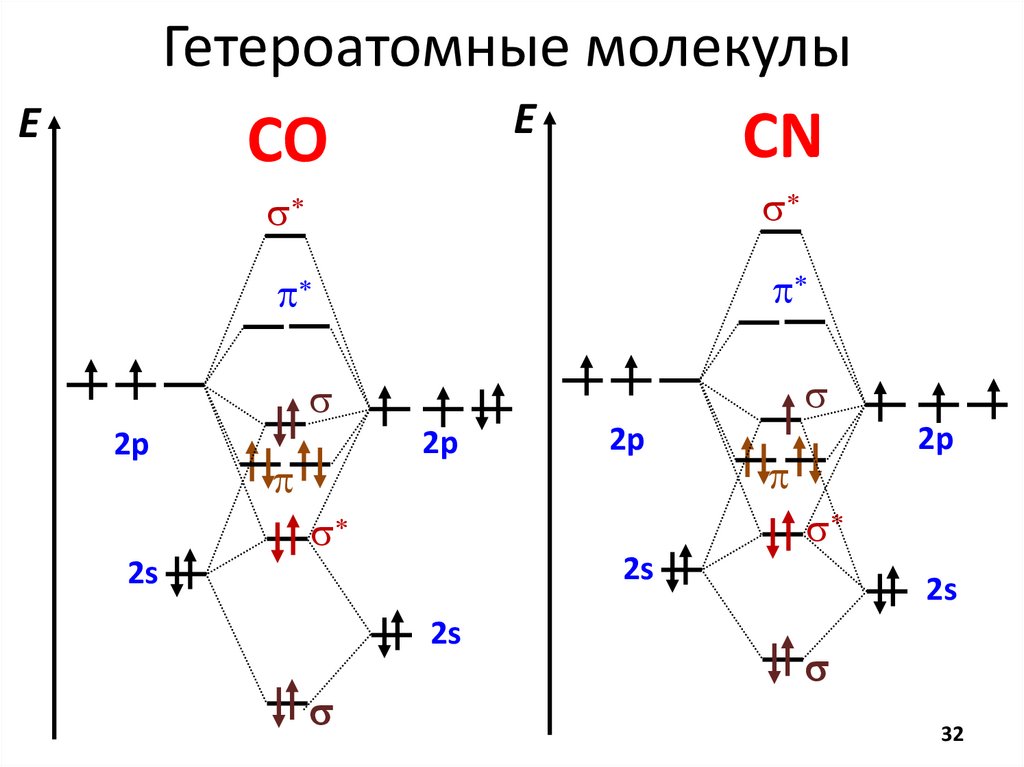
Метод Молекулярных ОрбиталейE
AO
MO
s*
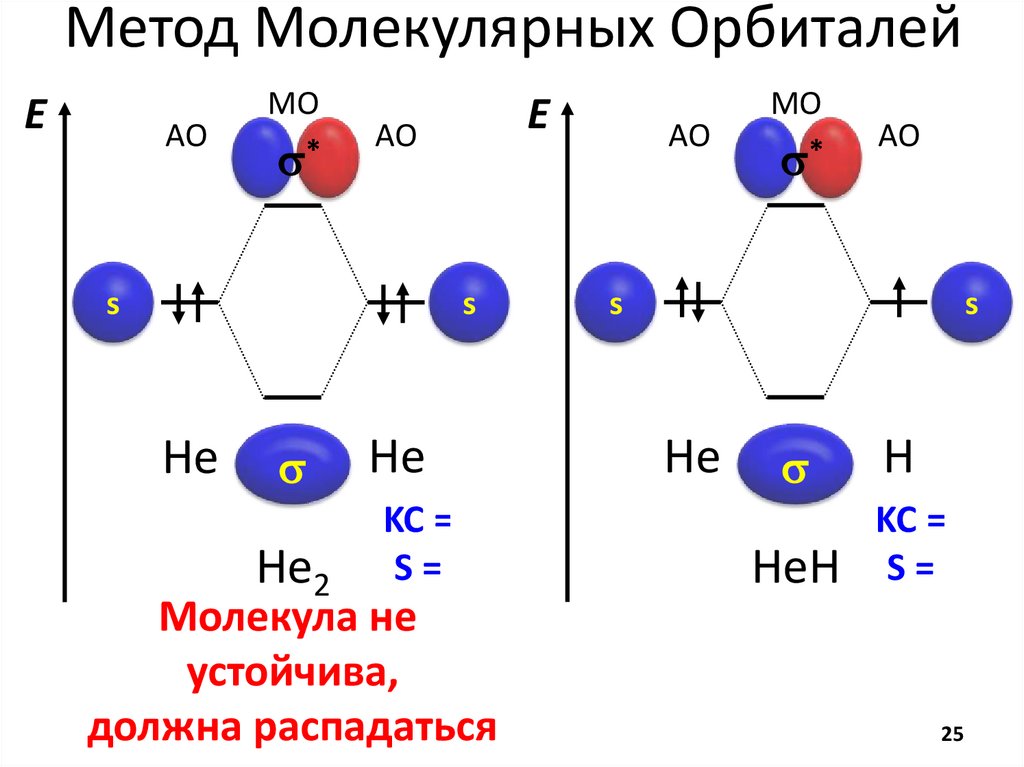
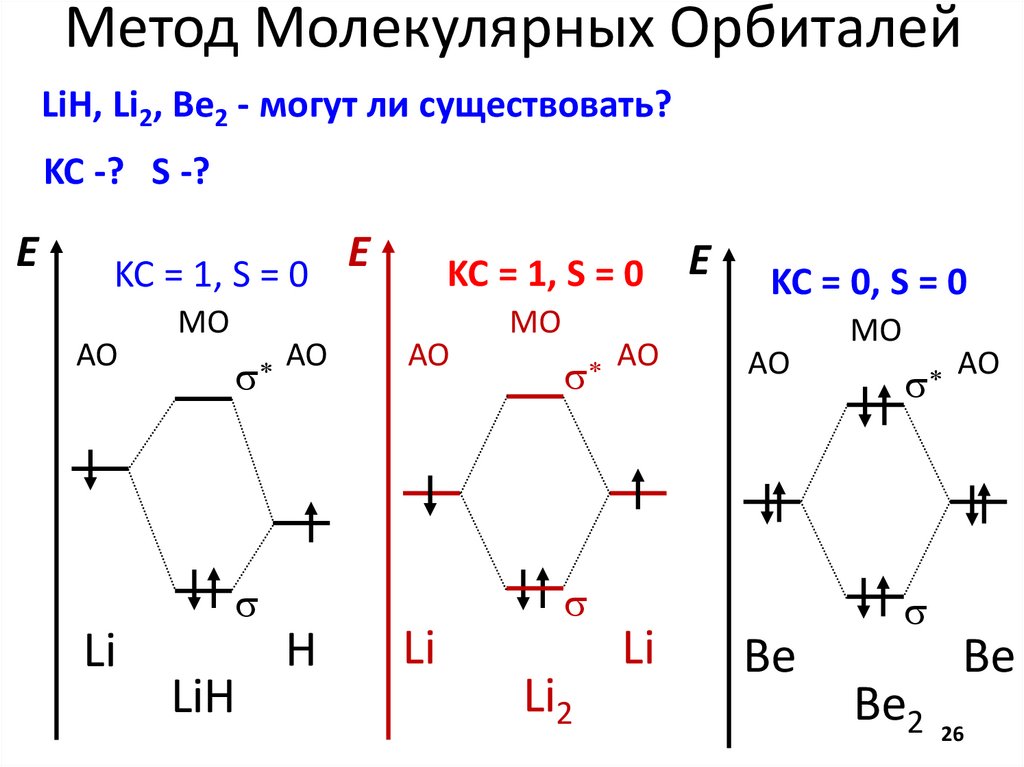
МВСMO ММО
AO
AO
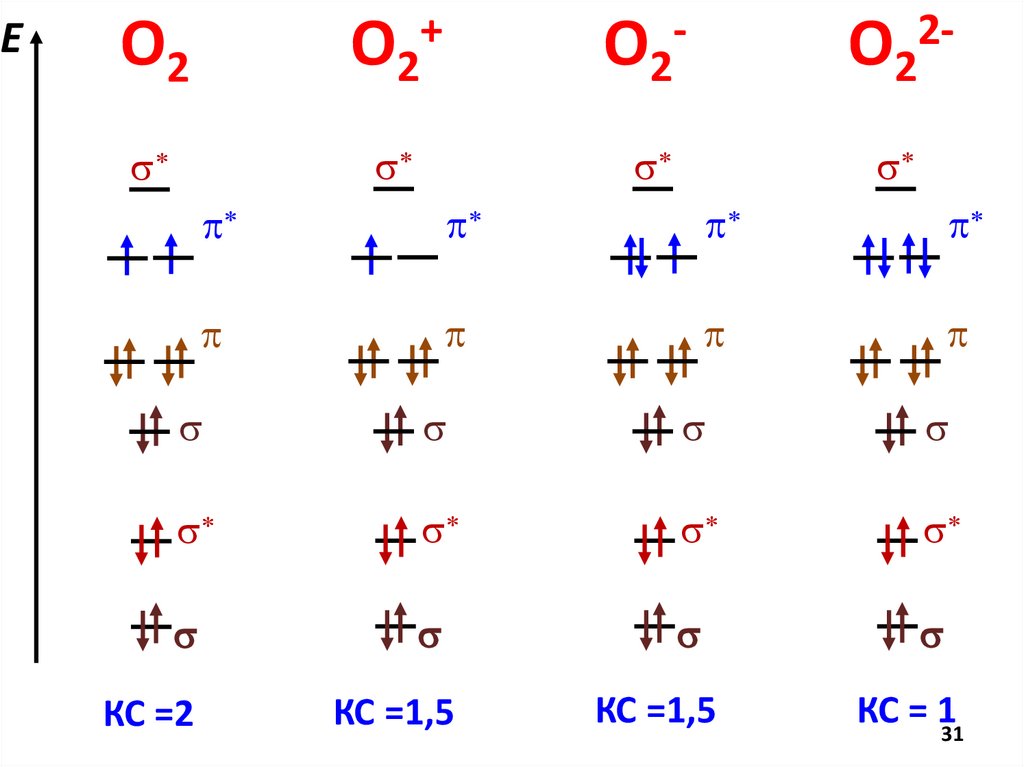
Кратность Числоs* есв − еразр
2
связи
пар
E
AO
s
s
H
s
H
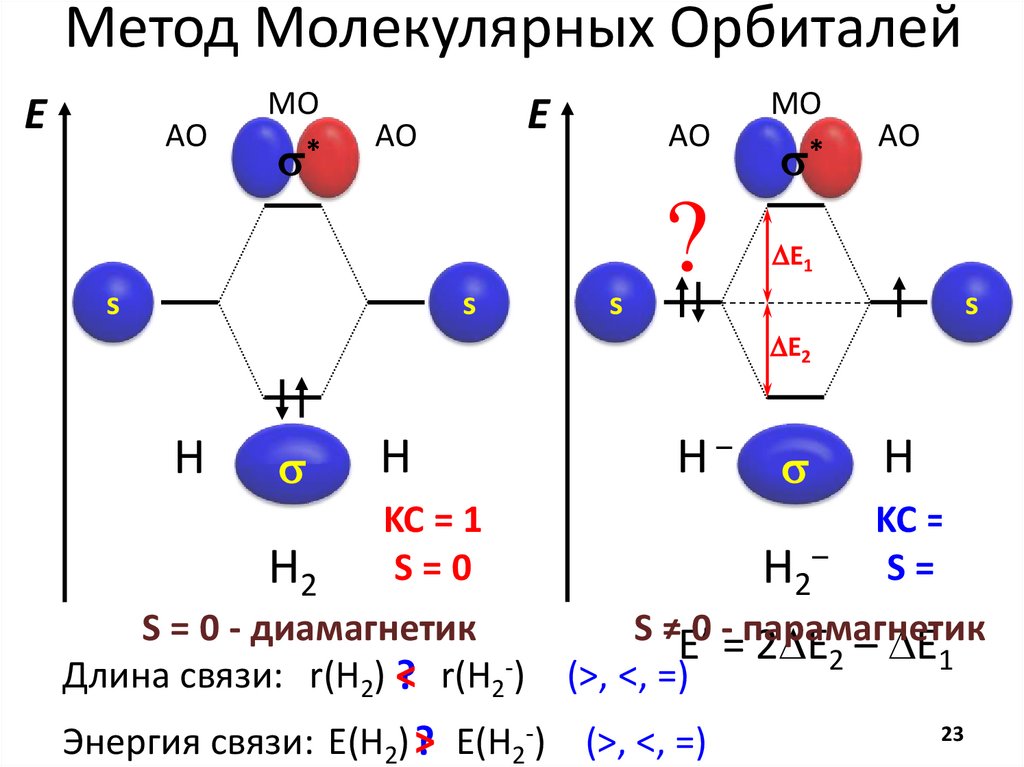
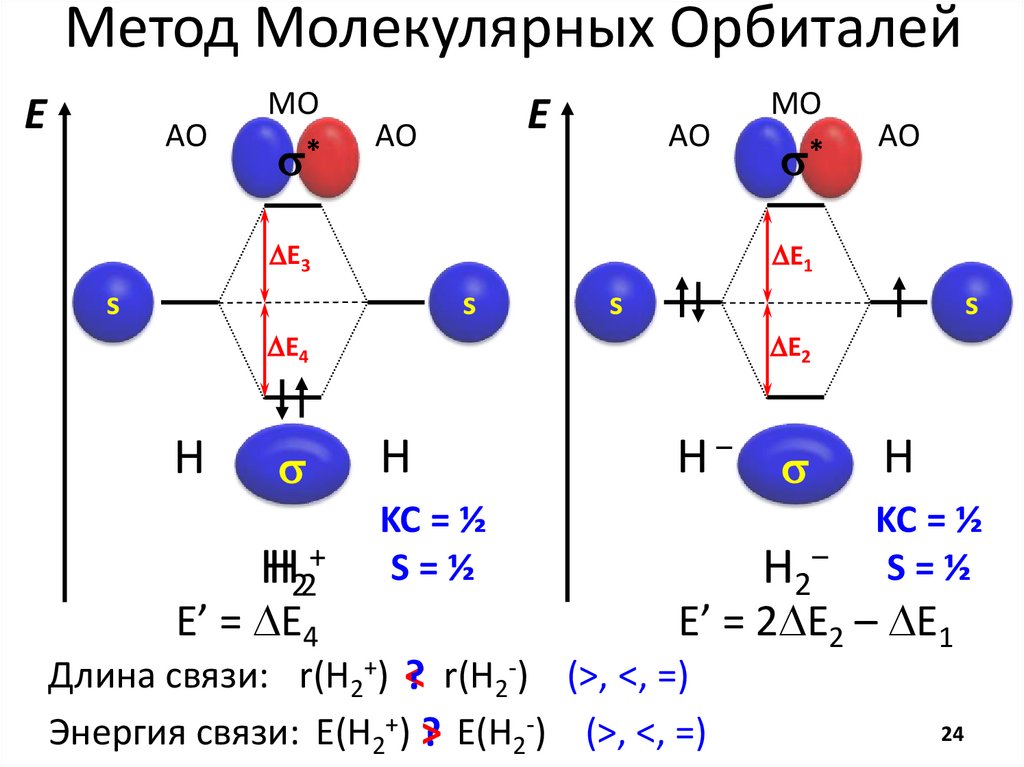
H2
KC = 1
S=0
Магн.
s
св-ва
S = ne·½
m=
















 chemistry
chemistry








