Similar presentations:
Строение атома и периодическая система Д.И. Менделеева
1. Лекция9. Строение атома и периодическая система Д.И.Менделеева
к. х.н., доцент Асланукова М.М.2.
ВАЖНЕЙШИЕ ПОНЯТИЯ1. Строение атома. Протоны, нейтроны и электроны. Атомная
единица массы, порядковый (атомный) номер и массовое
число. Элементы и их символы.
2. Изотопы. Атомные массы и естественная усредненная
атомная масса. Энергия связи.
3. Металлы и неметаллы. Основа периодической
систематизации элементов. Периодический закон,
периодическая система.
4. Современные формы периодической таблицы. Периоды и
группы. Семейства элементов.
5. Периодичность изменения химических свойств элементов
на примере бинарных соединений с водородом и
оксидов. Кислотные, основные и амфотерные свойства.
3.
ОСНОВНЫЕ ОПРЕДЕЛЕНИЯАтом — мельчайшая химически неделимая частица вещества,
состоящая из положительно заряженного ядра, окруженного электронами
Ядро состоит из протонов и нейтронов. Заряд протона равен заряду
электрона, но противоположен ему по знаку
Атомный номер элемента (номер в периодической таблице) равен числу протонов в
атоме этого элемента
Атомная единица массы (а.е.м.) —1/12 абсолютной массы атома изотопа
углерода 12C (1.66.10–24 г)
Относительная атомная масса (Ar) — отношение массы атома к атомной единице
массы
Относительная молекулярная масса (Mr) — отношение массы молекулы к атомной
единице массы
Изотопы— это атомы одного и того же элемента, но с различным числом
нейтронов в ядре
4.
Химический элемен т — вид атомов с од инак ов ым числ омпротон ов в яд ре (т. е. с од и н ак ов ы м з аряд ом яд ра). Кажд ы й
эл емен т и меет свое н аз ван и е и свой символ .
Массовое число
A
Символ элемента
Атомный номер
Z
59
E
Co
27
Атомный номер Z =Число протонов = Число
электронов
Массовое число А = Число протонов + Число
нейтронов
Пример 1.1
Каков символ и порядковый номер брома? Почему в качестве
символа брома не используется только первая буква его названия?
Какой другой элемент имеет символ В?
Решение
80
Br
35
11
4
B
5.
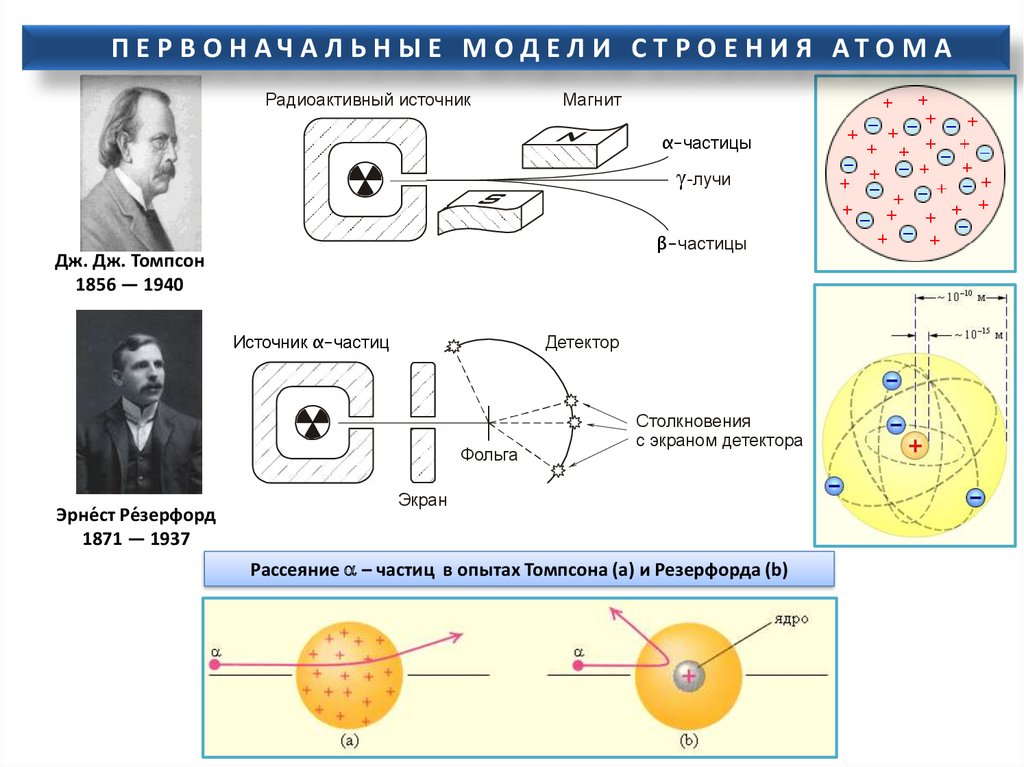
П Е Р В О Н АЧ А Л Ь Н Ы Е М ОД ЕЛ И С Т Р О Е Н И Я АТО М АРадиоактивный источник
Магнит
α-частицы
γ-лучи
β-частицы
Дж. Дж. Томпсон
1856 — 1940
Источник α-частиц
Детектор
Фольга
Эрне́ст Ре́зерфорд
1871 — 1937
Столкновения
с экраном детектора
Экран
Рассеяние a – частиц в опытах Томпсона (а) и Резерфорда (b)
6.
КЛАССИЧЕСКАЯ МОДЕЛЬ СТРОЕНИЯ АТОМА – КВАНТОВАЯ МОДЕЛЬ БОРАЭлектрон в атоме может находиться не в любых, а лишь в
некоторых устойчивых (стационарных) состояниях,
каждому из которых соответствуют определенное
значение энергии En (n = 1, 2, 3, …)
Нильс Бор
1885 – 1962
Макс Планк
1858 – 1947
Находясь в стационарном состоянии, электрон
не излучает и не поглощает энергии
Состояние атома, способного к самопроизвольному переходу в
состояние с меньшей энергией путем самопроизвольного
излучения фотонов, называется возбужденным
Переход электрона из одного стационарного состояния в другое
сопровождается излучением или поглощением кванта
электромагнитного излучения (фотона, Е), частота (u) которого
определяется соотношением:
|E2 – E1| = hu (h = 6.625•10–34)
7. Современная модель строения атома
Основные положения:1. Электрон имеет двойственную (корпускулярно-волновую) природу: он
может себя вести и как частица и как волна
2. Для электрона невозможно одновременно точно определить
координату и скорость - принцип неопределенности Гейзенберга.
3. Электрон в атоме не движется по определенным траекториям, а может
находиться в любой части околоядерного пространства. Вероятность
нахождения электрона в разных частях пространства неодинакова.
Совокупность различных положений электрона образует
электронное облако. Часть электронного облака, где наиболее
вероятно нахождение электрона (90%), называется атомной
орбиталью.
4. Так как электроны имеют волновую природу, то состояние электрона в
атоме описывается при помощи волновых уравнений. Параметрами
решения волнового уравнения являются некие числа, называемые
квантовыми. Они описывают состояние электрона в атоме.
8.
КВАНТОВЫЕ ЧИСЛАГлавное квантовое число (n) — характеризует состояние электрона на уровне, т. е.
общий запас энергии электрона и размеры электронного облака.
Принимает значения: n 1, 2, 3, 4, ….
Орбитальное квантовое число (l) характеризует состояние электрона в пределах
данного подуровня и форму орбитали. Число энергетических п/у данного уровня = n
Принимает значения от 0 до n-1:
l 0, 1, 2, 3, … n-1
s p d f
Магнитное квантовое число (m l) характеризует ориентацию орбиталей в атоме и
число одинаковых орбиталей на одном п/у.
Принимает значения от - l …0…. до + l
Спиновое квантовое число (ms) характеризует собственный момент импульса
электрона. Для электрона в атоме величина ms может принимать только два
значения: +½ и –½. Два электрона с одинаковыми значениями главного, побочного и
магнитного квантовых чисел (т. е. занимающие одну и ту же орбиталь), но с
противоположными (антипараллельными) значениями спинового квантового числа
называют спаренными, или электронной парой
9.
Символn
Название
Главное квантовое
число
Значения
1, 2, 3, ...
Характеризует
Энергетический
уровень электрона или
«оболочку»
l
Орбитальное квантовое
число
Магнитное квантовое
число
Магнитное спиновое
квантовое число
0 ... n–1
(s, p, d, f, ...)
–l ..о.. l
Форма орбитали
ml
ms
+1/2 или –1/2
Пространственную
ориентацию орбиталей
Собственный момент
движения электрона
Квантовые числа n, l, ml и ms характеризуют состояние электрона в
атоме
n/у
s
p
d
f
l
0
1
2
3
число значений
0
1
–1,0,1
3
-2,-1,0,1,2
5
-3,-2,-1,0,1,2,3
7
ml
изображение
10.
ФОРМЫ ОРБИТАЛЕЙ1s
2pz
(1s)
n=1
l=0
ml = 0
(2s)
n=2
l=0
ml = 0
(2pz)
n=2
l=1
ml = 0
(2px)
n=2
l=1
ml = 1
11.
Ф О Р М Ы s - , p - О Р Б И ТА Л Е Й1s
2py
2px
2pz
12.
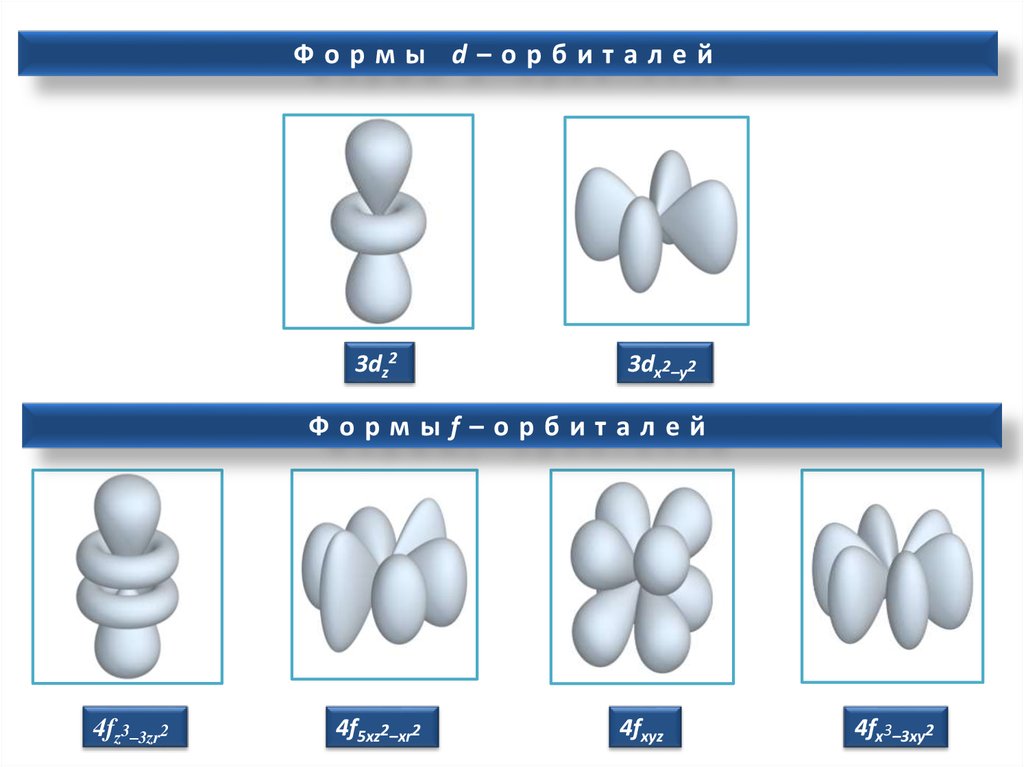
Формы d–орбиталей3dz2
3dx2–y2
Формыf–орбиталей
4fz3–3zr2
4f5xz2–xr2
4fxyz
4fx3–3xy2
13.
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ В АТОМАХПОДЧИНЯЕТСЯ:
1. Принцип запрета (В. Паули, 1925)
В атоме не может быть двух электронов в
одинаковом квантовом состоянии, т. е. любые два
электрона должны различаться значениями хотя
бы одного из квантовых чисел
Вольфганг Паули
1900 - 1958
X
1s
Электрон 1
n=1
l=0
ml = 0
1
ms = + 2
Электрон 2
n=1
l=0
ml = 0
1
ms = + 2
1s
Электрон 1
n=1
l=0
ml = 0
1
ms = + 2
Электрон 2
n=1
l=0
ml = 0
1
ms = – 2
2. Принцип наименьшей энергии - наиболее устойчивому распределению
электронов по уровням и подуровням атома соответствует минимально
возможное значение энергии
14.
Правила Клечковского1. По мере увеличения заряда ядра атома электроны в первую
очередь заполняют подуровень с наименьшим значением суммы
главного и орбитального квантовых чисел (n + l).
Всеволод
Маврикиевич
Клечковский
1900 - 1958
2. Если сумма (n + l) оказывается одинаковой для двух или более
подуровней, то электроны в первую очередь поступают на
подуровень с меньшим значением главного квантового числа
Правило Хунда
В пределах данного подуровня электроны стремятся
занять максимальное число свободных орбиталей, при
этом неспаренные электроны имеют одинаковые
(параллельные) спины.
Фридрих Хунд
1896 - 1997
Пример 1.3
Определите неверную запись электронных орбиталей:
15.
Изменение энергии орбиталей - графическиеэлектронные диаграммы
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d ≈ 4f ≈ 5d < 6p < 7s…
E
6f
7p
6d
5f
7s
6p
5d
4f
6s
5p
4d
5s
4p
3d
4s
3p
3s
2p
2s
1s
2p
Li
2p
2s
O
2s
1s
1s2
2s1
1s
1s2 2s2 2p4
16.
Правило октетовГилберт Льюис
1875 - 1946
Атом удовлетворяет правилу октетов,
когда он, путем присоединения, потери
или обобществления электронов с
другими атомами, принимает
конфигурацию ns2np6.
Уровень является завершенным, если на
нем 8 электронов (октет)или 2 электрона
(для первого периода). Такой
завершенный уровень обладает
минимумом энергии и отвечает
наиболее устойчивому состоянию
атома (инертные элементы).
17.
О С Н О В Н Ы Е Э Л Е М Е Н Т Ы , В Х О Д Я Щ И Е В С О С ТА В О Р ГА Н И З М АЭлемент
масс. доля
Элемент масс. доля
Кислород*
63.0
Калий
0.25
Углерод*
20.0
Натрий
0.15
Водород*
10.0
Сера*
0.10
Азот*
3.0
Хлор
0.15
Кальций
1.5
Магний
0.04
Фосфор*
1.0
Железо
0.004
*Элементы – органогены: Участвуют в образовании органических веществ.
«Металлы жизни» – Ca, K, Na, Mg, Fe, Mn, Co, Cu, Zn, Mo
Биогенные элементы – элементы, необходимые для построения и
обеспечения жизнедеятельности различных клеток и организмов
Макроэлементы (содержание > 10–3 %): O, C, H, N, P, S, Ca, K, Na, Mg, Cl, Fe
Микроэлементы (содержание 10–6 – 10–3 %): Cu, Co, Zn, Mn, Mo, V, Sr, Ba, I, F,
Br, As
18.
П Е Р И О Д И Ч Е С К И Й З А К О Н ( 1 8 6 9 Г. )Современная формулировка периодического закона:
Свойства элементов находятся в периодической зависимости
от их атомных номеров
19.
П Е Р И О Д И Ч Е С К А Я ТА Б Л И Ц А Д . И . М Е Н Д Е Л Е Е В АI
1
2
3
Дмитрий Иванович
Менделеев
1834 – 1907
4
H
водород
II
3
Li
6.94 Be
литий
берилий
медь
6
VII
VIII
III
IV
V
2
4.00
VI
галлий
мышьяк
в 1869 году
41
40
44
46
38
39
42
43
45
91.22
92.91
101.07
106.42
87.62
88.91
95.94
[98]
102.91
рутений
стронций
цирконий
ниобий
родий
палладий
иттрий
молибден
технеций
Ru
Rh
Pd
54
131.29 Xe
I
иод
ксенон
кадмий
индий
серебро
56
57
72
73
76
77
55
75
78
74
*
Cs
132.91 Ba 137.33 La 138.91 Hf 178.49 Ta 180.95 W 183.84 Re 186.21 Os 190.23 Ir 192.22 Pt 195.08
осмий
иридий
барий
лантан
тантал
вольфрам
рений
платина
цезий
гафний
80
81
84
85
86
79
82
83
Названия элементов
At
196.97 Au 200.59 Hg 204.38 Tl 207.2 Pb 208.98 Bi [209] Po [210]
[222] Rn
и атомные массы
золото
астат
радон
таллий
свинец
висмут
полоний
ртуть
7
атомный номер
символ элемента
цинк
Sr
Y
Zr
Nb
Rb
Mo Tc
рубидий
47
52
48
49
50
51
53
107.87 Ag 112.41 Cd 114.82 In 118.71 Sn 121.76 Sb 127.60 Te 126.90
олово
сурьма
теллур
37
85.47
5
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Д. И. МЕНДЕЛЕЕВА
(H)
He
гелий
19
K
8
9
10
4 5
6
7
39.10
B 12.01 углерод
O 19.00 фтор
F 20.18 Ne
C 14.01 азот
N 16.00кислород
9.01 10.81
калий
бор
неон
относительная
18
11
12 13
15
14
16
17
атомная масса
Na
P
S
22.99 Mg 24.31 26.98 Al 28.09
30.97
32.07
35.45 Cl 39.95 Ar
Si
название
элемента
аргон
фосфор
натрий
алюминий
кремний
сера
хлор
магний
25
21
22
26
28
19
20
23
24
27
58.69
K
39.10 Ca 40.08 Sc 44.96 Ti 47.87 V
50.94 Cr 52.00 Mn 54.94 Fe 55.85 Co 58.93 Ni
скандий
калий
кальций
титан
ванадий
хром
марганец
железо
кобальт
никель
33
30
31
32
34
35
29
36
Периодический закон
63.55 Cu 65.41 Zn 69.72 Ga 72.64 Ge 74.92 As 78.96 Se 79.90 Br 83.80 Kr открыт Д. И. Менделеевым
бром
германий
селен
криптон
1
1.01
Fr
франций
87
[223]
Ra
радий
88
[226]
Ac**[227]89
актиний
Rf
Db
Sg
Bh
106
104
105
[266]
[261]
[262]
резерфордий дубний
сиборгий
борий
107
[264]
*лантаниды
... 115
приведены по данным
IUPAC 2003 года.
В квадратных скобках
приведены массовые числа
наиболее устойчивых изотопов.
Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Ce Pr
69
62
63
67
58
59
60
61
64
65
66
70
71
68
140.12
167.26
168.93
140.91
[145]
150.36
151.96
157.25
158.93
164.93
173.04
174.97
162.50
144.24
тулий
церий
празеодим неодим
прометий самарий
европий гадолиний тербий
иттербий лютеций
диспрозий гольмий эрбий
Th Pa U
90
232.04
торий
**актиниды
Np Pu Am Cm Bk Cf
Es
Fm Md No Lr
100
96
95
101
92
93
94
97
98
99
103
102
[262]
[251]
[252]
[237]
238.03
[244]
[243]
[247]
[257]
[258]
231.04
[247]
[259]
протактиний уран
берклий калифорний эйнштейний фермий
менделевий нобелий лоуренсий
нептуний плутоний америций кюрий
91
20.
С ТА Н Д А Р Т Н А Я П Е Р И О Д И Ч Е С К А Я ТА Б Л И Ц А И Ю П А Кs-элементы
p-элементы
1
18
1
H
2
13
14
15
16
17
He
2
Li
Be
B
C
N
O
F
Ne
3
Na
Mg
3
4
5
6
7
8
9
10
11
12
Al
Si
P
S
Cl
Ar
4
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
5
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
6
Cs
Ba
*
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
7
Fr
Ra
**
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
d-элементы
f-элементы
* лантаноиды
La
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
** актиноиды
Ac
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
21.
HНеметалл
Неметаллы He
Металлоиды
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
Se Br
Cr Mn Fe Co Ni Cu Zn Ga Ge As
Kr
Li Be
М е т а л л ы
Na Mg
K Ca Sc Ti
Rb Sr
Y
V
Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te
Cs Ba La Hf Ta W Re Os Ir
Pt Au Hg Tl Pb Bi
I
Po At
Xe
Rn
Благородные газы
РА С П О Л О Ж Е Н И Е Э Л Е М Е Н Т О В В П Е Р И О Д И Ч Е С К О Й ТА Б Л И Ц Е
Металлы — группа элементов, обладающая характерными металлическими
свойствами (высокая тепло- и электропроводность, положительный температурный
коэффициент и др.)
Неметаллы — химические элементы с типично неметаллическими свойствами,
которые занимают правый верхний угол Периодической таблицы
Металлоиды — химические элементы, расположенные на границе между
металлами и неметаллами. Для них характерно образование ковалентной
кристаллической решётки и наличие металлической проводимости
22.
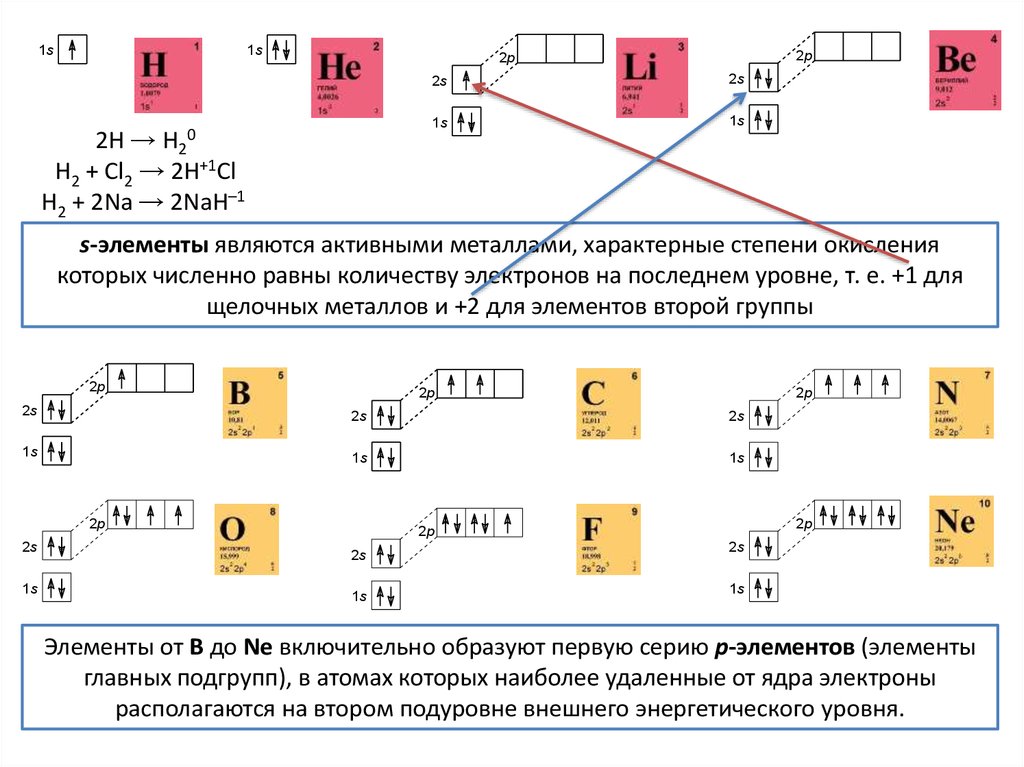
1s1s
2p
2p
2H → H2
H2 + Cl2 → 2H+1Cl
H2 + 2Na → 2NaH–1
0
2s
2s
1s
1s
s-элементы являются активными металлами, характерные степени окисления
которых численно равны количеству электронов на последнем уровне, т. е. +1 для
щелочных металлов и +2 для элементов второй группы
2p
2p
2p
2s
2s
2s
1s
1s
1s
2p
2s
1s
2p
2p
2s
1s
2s
1s
Элементы от В до Ne включительно образуют первую серию p-элементов (элементы
главных подгрупп), в атомах которых наиболее удаленные от ядра электроны
располагаются на втором подуровне внешнего энергетического уровня.
23.
П Е Р И О Д И Ч Е С К А Я З А В И С И М О С Т Ь О Р Б И ТА Л Ь Н О Г О Р А Д И У С ААТ О М А О Т П О Р Я Д К О В О Г О Н О М Е РА
H
0,053
Li
0,164
Na
0,179
K
0,230
Rb
0,249
Cs
0,282
rорб, нм
Be
0,109
Mg
0,137
Ca
0,183
Sr
0,205
Ba
0,235
B
0,084
Al
0,142
Ga
0,140
In
0,158
Tl
0,166
C
0,064
Si
0,115
Ge
0,120
Sn
0,140
Pb
0,148
N
0,054
P
0,098
As
0,107
Sb
0,127
Bi
0,136
0.30
F
0,041
Cl
0,076
Br
0,089
I
0,109
At
0,119
Fr
Cs
Rb
0.25
K
0.20
Li
Na
Tl
In
Ga
Al
0.15
0.10
Rn
Xe
Kr
Ar
0.05
0.00
O
0,046
S
0,086
Se
0,097
Te
0,117
Po
0,127
He
0,030
Ne
0,036
Ar
0,069
Kr
0,083
Xe
0,103
Rn
0,113
He
0
Ne
10
20
30
40
50
60
70
80
90
Z
24.
ЭНЕРГИЯ ИОНИЗАЦИИ, СРОДСТВО К ЭЛЕКТРОНУПериодическая зависимость энергии ионизации атома от порядкового номера
X0 → X+ + e– – Ei1
X+ → X2+ + e– – Ei2
Ei1 < Ei2 < Ei3 и т. д.
Ei1
He
кДж/моль
Ne
2000
Первая энергия ионизации
атома (Ei, кДж/моль,
эВ/моль)— количество энергии,
необходимое для отрыва
электрона от невозбужденного
атома
Ar
N
1500
Kr
Xe
O
P
1000
Zn
Hg Rn
Cd
Gd
B
500
Li
Na
Al
Ga
K
In
Rb
Lu
Cs
Tl
Fr
0
0
10
20
30
40
50
60
70
80
Зависимость энергий ионизации атома Na от числа удаленных электронов
lg Ei
5.0
4.0
3.0
0
1
2
3
4
5
6
7
8
9
10
11
Ne
90
Z
25.
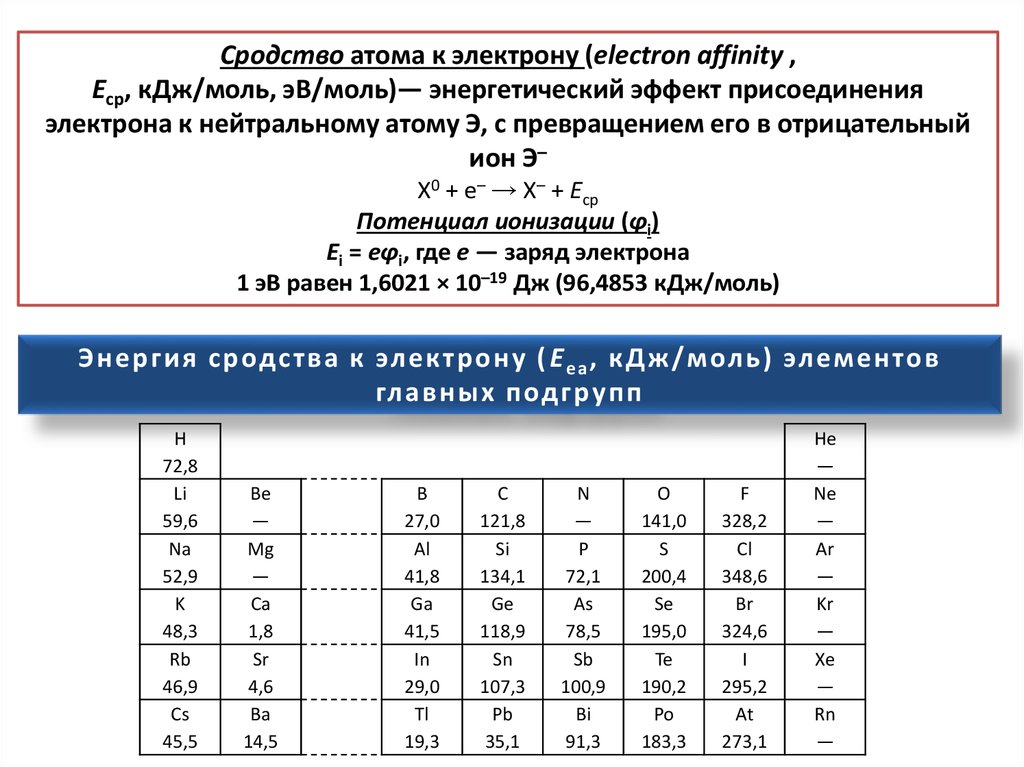
Сродство атома к электрону (electron affinity ,Eср, кДж/моль, эВ/моль)— энергетический эффект присоединения
электрона к нейтральному атому Э, с превращением его в отрицательный
ион Э–
X0 + e– → X– + Eср
Потенциал ионизации (φi)
Ei = eφi, где e — заряд электрона
1 эВ равен 1,6021 × 10–19 Дж (96,4853 кДж/моль)
Э н е р ги я с р одс тва к эл е к т ро ну ( E e a , к Дж / м оль) эл ем е н то в
гл ав н ы х п од гру п п
H
72,8
Li
59,6
Na
52,9
K
48,3
Rb
46,9
Cs
45,5
Be
—
Mg
—
Ca
1,8
Sr
4,6
Ba
14,5
B
27,0
Al
41,8
Ga
41,5
In
29,0
Tl
19,3
C
121,8
Si
134,1
Ge
118,9
Sn
107,3
Pb
35,1
N
—
P
72,1
As
78,5
Sb
100,9
Bi
91,3
O
141,0
S
200,4
Se
195,0
Te
190,2
Po
183,3
F
328,2
Cl
348,6
Br
324,6
I
295,2
At
273,1
He
—
Ne
—
Ar
—
Kr
—
Xe
—
Rn
—
26.
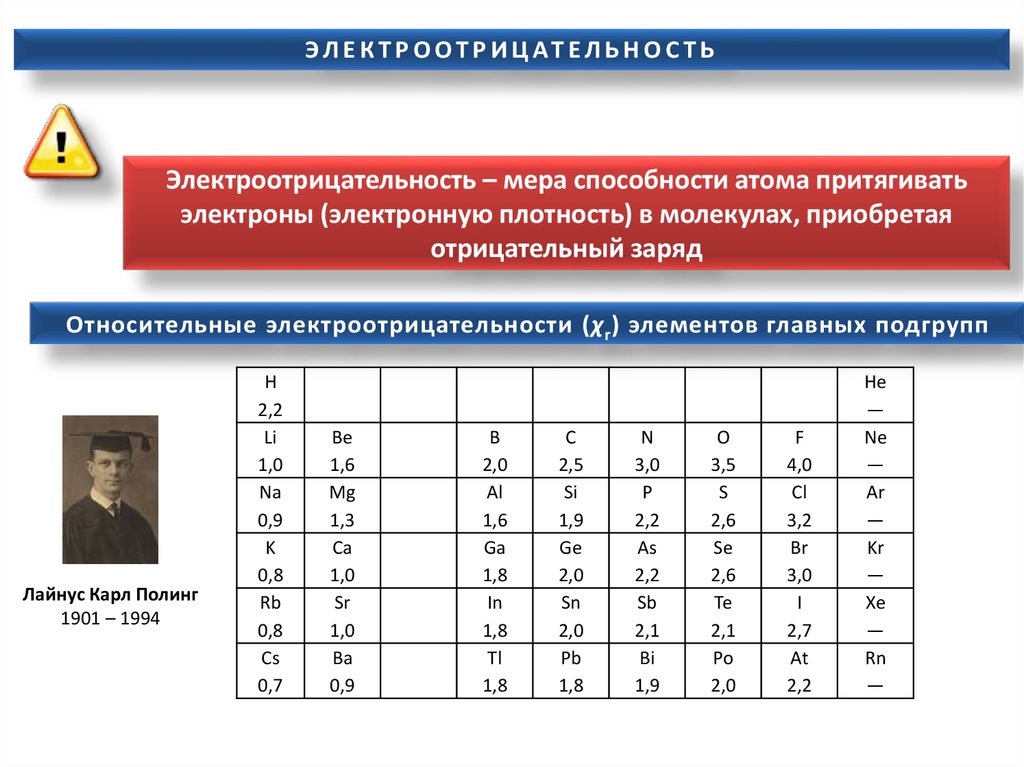
Э Л Е К Т Р О О Т Р И Ц АТ Е Л Ь Н О С Т ЬЭлектроотрицательность – мера способности атома притягивать
электроны (электронную плотность) в молекулах, приобретая
отрицательный заряд
Относительные электроотрицательности (χ r ) элементов главных подгрупп
Лайнус Карл Полинг
1901 – 1994
H
2,2
Li
1,0
Na
0,9
K
0,8
Rb
0,8
Cs
0,7
Be
1,6
Mg
1,3
Ca
1,0
Sr
1,0
Ba
0,9
B
2,0
Al
1,6
Ga
1,8
In
1,8
Tl
1,8
C
2,5
Si
1,9
Ge
2,0
Sn
2,0
Pb
1,8
N
3,0
P
2,2
As
2,2
Sb
2,1
Bi
1,9
O
3,5
S
2,6
Se
2,6
Te
2,1
Po
2,0
F
4,0
Cl
3,2
Br
3,0
I
2,7
At
2,2
He
—
Ne
—
Ar
—
Kr
—
Xe
—
Rn
—
27.
ПЕРИОДИЧНОСТЬ ХИМИЧЕСКИХ И ФИЗИЧЕСКИХ СВОЙСТВ ЭЛЕМЕНТОВМеталлич
ность основные
свойства
высших
оксидов и
гидроксид
ов
Энергия ионизации
He
Li Be
Na Mg
K Ca
Rb Sr
Cs Ba
B C N O F
ону
р
т
к
Al еSi P S Cl
к эл
о
в
т
дс
сро
и
ь
Sc Ti V Cr Mn Fe нCo
остNi Cu Zn Ga Ge As Se Br
ль
е
т
а
триц
о
о
тр Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I
кNb
Y Zr
Эле
La Hf Ta W Re Os Ir Pt Au Hg
Tl Pb Bi Po At
Ne
Ar
Kr
Xe
Энергия ионизации
H
Атомный радиус
Неметалл
ичность –
кислотные
свойства
высших
оксидов и
гидроксид
ов
Rn
Атомный радиус
Металличность основные свойства
высших оксидов и
гидроксидов
Неметалличность –
кислотные свойства
высших оксидов и
гидроксидов























 chemistry
chemistry








